Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Разрушая, созидать
Дальше: От олигомеров к каркасам
Можно обойтись без разрушений
По существу, металлорганосилоксаны представляют собой неорганические соединения, укрытые «шубой» из органических групп, что придает им органорастворимость и позволяет вводить их гомогенно в реакционную среду. При этом открываются новые области применения, в которых обычные силикаты не используют. Например, железосилоксан катализирует окисление метана – это один из способов получения метанола. Такой катализатор благодаря высокой стабильности неорганического каркаса может быть использован десятки раз при сохранении каталитической активности (рис. 6.17).

Другое применение металлосилоксанов – галогенирование органических соединений. Это целая группа промышленных процессов, дающих продукты, широко используемые для дальнейших превращений. Галогенирование непосредственным действием галогенов – экологически неблагоприятный процесс, кроме того, в результате образуется большое количество разных продуктов. Но недавно ученые нашли более деликатные и селективные (то есть избирательные) способы галогенирования, где в качестве реагента, поставляющего галоген, используют CCl4 или CBr4. При их взаимодействии с олефинами двойная связь сама «указывает» то место, к которому должен направиться галоген (рис. 6.18).
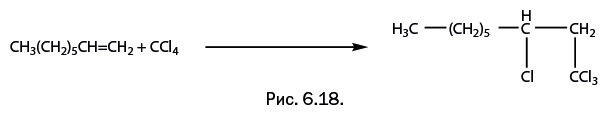
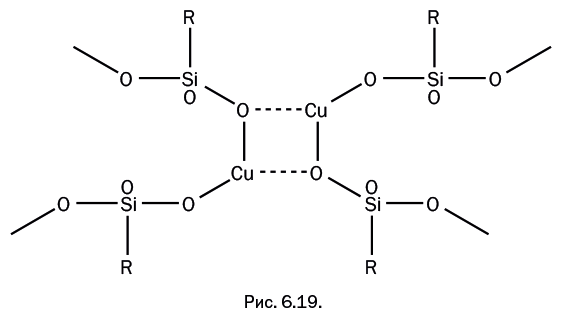
При галогенировании октена по схеме, показанной на рис. 6.18, в качестве традиционных катализаторов используют комплексы галогенидов меди. Оказалось, что медьфенилсилоксан успешно катализирует эту реакцию и, в отличие от традиционных катализаторов, может быть многократно использован в процессе без заметного снижения каталитической активности. Существенный недостаток такого катализатора в сравнении с обычными – низкая каталитическая активность в расчете на один каталитический центр, иными словами, задействованными оказываются не все центры. Причина в том, что некоторые атомы меди, находящиеся в соседних цепях олигомерного металлосилоксана, связаны координационными связями через атомы кислорода (показаны пунктиром на рис. 6.19). Поскольку первичный акт катализа – координация реагента у каталитического центра, в результате межцепной координации часть атомов меди оказывается выключенной из каталитического процесса. На первый взгляд для решения проблемы достаточно присоединить к атому металла какую-либо координирующую молекулу – например, легко присоединяющийся амин. Он, «укрывая» атом меди, естественно, затруднит межцепное координационное взаимодействие. К сожалению, такое решение не подходит, поскольку присутствие лиганда в то же время мешает реагирующим молекулам приблизиться к каталитическому центру, то есть не увеличивает, как хотелось бы, а снижает каталитическую активность.
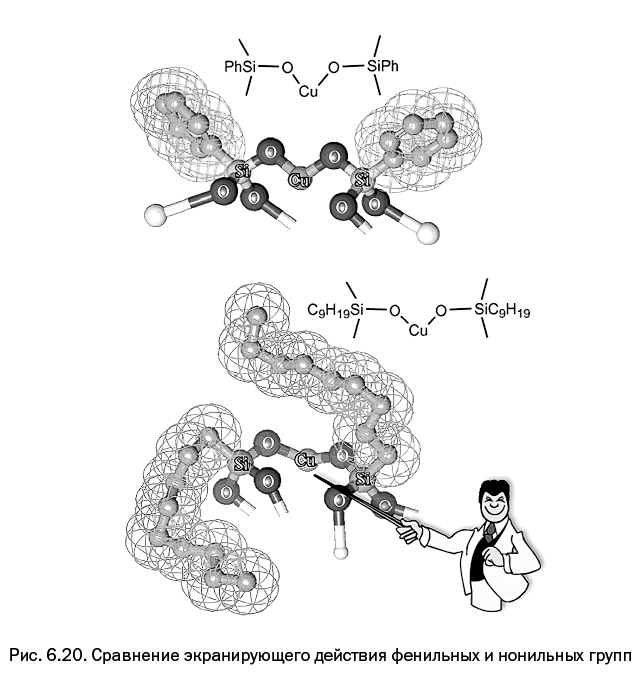
Проблему удалось решить с помощью органического окружения кремния. На рис. 6.20 сетчатая поверхность условно обозначает вандерваальсовы радиусы, то есть реально занимаемый в пространстве объем, который ограничивает сближение молекул.
На рисунке видно, что фенильные группы у атома кремния (достаточно жесткие и "неповоротливые") не экранируют металлосилоксановую связь и не препятствуют взаимосближению атомов меди, расположенных в соседних молекулах. Картина станет иной, если заменить фенильные группы алифатическими нонильными группами. Эти крупные группы заметно затрудняют межцепную координацию атомов меди и в то же время не препятствуют приближению органического реагента к каталитическому центру. Нонильные группы органофильны (не отталкивают органические реагенты) и достаточно подвижны, поскольку обладают гибкостью полимерного сегмента, природу которой мы рассмотрели ранее в разделе "Вращение, переходящее в гибкость". Органический реагент может "отодвинуть" такую группу, но этого не может сделать находящийся поблизости атом меди. В результате каталитическая активность повышается более чем в четыре раза.
Назад: Разрушая, созидать
Дальше: От олигомеров к каркасам

