Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Первая подсказка природы
Дальше: Отвердитель, ожидавший появления силоксанов
Вращение, переходящее в гибкость
Упомянутая выше гибкость – исключительно важное свойство силоксановой связи. Однако не следует понимать это буквально, представляя себе деформируемую металлическую проволоку. Химическая связь, которую мы изображаем валентной чертой, – достаточно жесткое образование. Гибкость, о которой идет речь, когда рассматривают структуры в форме цепочек, имеет совсем иную природу. Дело в том, что валентный угол, образованный двумя связями (объединяющими, естественно, три атома), в результате теплового движения имеет определенную свободу вращения вокруг связи – если этому не препятствуют различные пространственные затруднения. При вращении величина валентного угла α не меняется, и атом имеет возможность перемещаться по основанию мысленного конуса (рис. 6.7). Два диаметральных положения атома показаны в виде шариков с различающейся окантовкой символа Si.
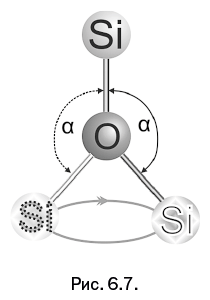
Из показанной схемы вовсе не следует, что атом, словно планета, непрерывно вращается вокруг валентной связи. Отмеченное стрелкой круговое движение означает, что атом в результате теплового движения с равной вероятностью может занять любое место на указанной траектории (основание конуса), а затем легко его изменить.
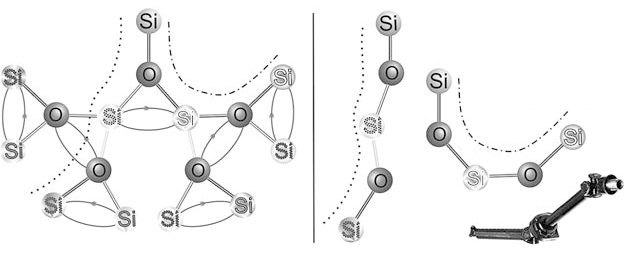
Рис. 6.8. Варианты возможного изгиба молекулы из пяти атомов
Каждый последующий присоединенный атом может точно так же вращаться вокруг одинарной связи. Напомним, на рис. 6.8 у каждого атома Si своя индивидуальная окантовка – и мы можем проследить его положение в различных стадиях поворота всей конструкции. Благодаря вращению молекула из пяти атомов (три Si и два О) может принять любую из показанных на рисунке конфигураций – от почти выпрямленной (обозначена в правой части рисунка пунктирной линией) до согнутой в полукольцо (штрихпунктирная линия). Конечный результат – отчетливая гибкость молекулы. Похоже на механическую конструкцию, собранную из жестких стальных стержней, соединенных шаровыми шарнирами, что придает ей определенную гибкость, подобную той, которую можно наблюдать у карданного вала в автомобиле.
Гибкость цепи – отличительное свойство всех линейных полимеров, однако степень гибкости может быть разной и зависит от того, насколько легко происходит поворот каждого звена. Установлено, что в случае полиорганосилоксанов соответствующая энергия вращения в три-четыре раза ниже, чем у обычных органических полимеров.
Ранее было сказано, что при конденсации силанолов получить полимерные молекулы не удается (причина – все та же гибкость и, как следствие, замыкание циклов). Задачу решили иным путем – размыканием циклов в процессе полимеризации в присутствии катализатора (рис. 6.9).
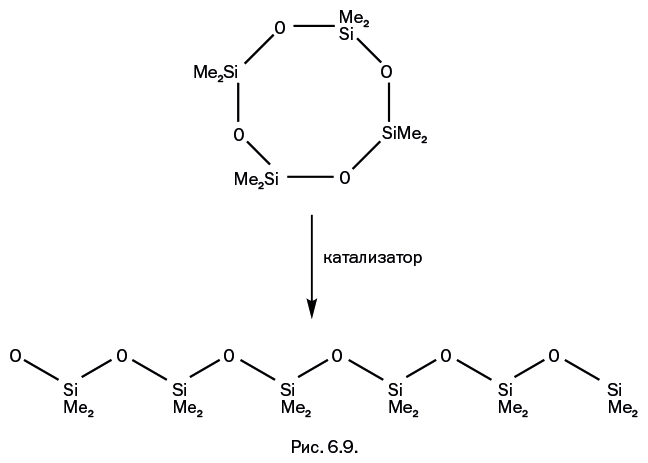
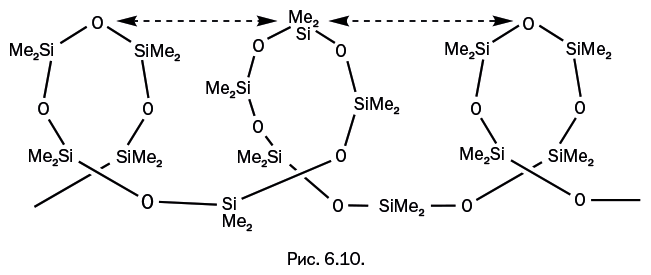
Именно так получают полимерные силоксановые молекулы с молекулярной массой до 1 млн. Несмотря на гибкость цепи и свободу в перемещении отдельных звеньев, молекулы полисилоксана имеют некоторую упорядоченность. Связь кремний – кислород представляет собой весьма слабый диполь с незначительными частичными зарядами на атомах кремния и кислорода Siδ+-Oδ–, однако исключительно гибкая силоксановая цепь реагирует даже на слабые диполи и «старается» выстроить силоксановые звенья таким образом, чтобы положительно заряженный кремний одного звена по возможности располагался напротив отрицательно заряженного кислорода другого звена. В результате возникает своеобразная спиральная конструкция. На рис. 6.10 взаимное расположение атомов Si и О, диктуемое диполями, отмечено двойными пунктирными стрелками.
Здесь уместно привести высказывание выдающегося отечественного геохимика академика В. И. Вернадского, отметившего еще в начале ХХ в., что силикаты в минеральном мире играют такую же роль, какую белки – в органическом. Это высказывание удивительным образом перекликается с нашими сегодняшними знаниями о спиральном строении белков и о подобном строении молекул полидиметилсилоксана. Подобное сходство невольно подводит нас к мысли, что миры кремния и углерода, несмотря на явные различия, в будущем смогут найти неожиданные точки соприкосновения. В смелых фантазиях мы можем предположить существование живых организмов на основе кремния.
От фантазий перейдем к реальности. Полиорганосилоксаны оказались первыми представителями класса полимеров, имеющих неорганические главные цепи молекул. Естественно предположить, что они должны иметь повышенную термостойкость – в сравнении с органическими полимерами, и это вполне справедливо. Энергия связи Si – O – 374 кДж/моль, что в полтора раза выше энергии связи C–C. В то же время энергия связи Si – С, обеспечивающей соединение атома кремния с органической группой, почти такая же, как у связи C–C, то есть органическое окружение цепи – это "слабое место". При частичном термическом отрыве углеводородных групп возникают поперечные сшивки между молекулами, но сама полимерная цепь термически устойчива и не разрушается.
Полидиметилсилоксан с молекулярной массой свыше 300 000 представляет собой каучук, на основе которого изготавливают силиконовую резину, сохраняющую работоспособность при 300 оС в течение 500 ч, в то время как резины на основе изопреновых каучуков при этой температуре разлагаются.
Интересно, что при движении по шкале температур в обратную сторону полидиметилсилоксан также обгоняет своих органических "собратьев". Морозостойкость (температура, при которой резина становится хрупкой) у изопреновых каучуков находится в интервале от –30 до –45 оС, а для силиконовых резин достижима рабочая температура –80 оС.
Широкий температурный диапазон работы силиконового каучука позволил его использовать для изготовления подошв ботинок космонавтов, высадившихся на Луне. Под действием сильнейшего ночного холода подошвы из обычной резины раскрошились бы, а в полдень, когда на безоблачном небе в отсутствие атмосферы сияет солнце, раскаленные пыль и гравий превратили бы обычную резину в липкий продукт.
О силиконовых резинах вспомнили после 28 января 1986 г. – в этот день при запуске с мыса Кеннеди взорвался космический корабль "Челленджер". Расследование показало, что произошла утечка горючего, и после запуска двигателей поток пламени вызвал возгорание топливного бака. Причиной аварии являлось то, что по техническим характеристикам запуск был допустим при температуре не ниже 10 оС, но в ночь перед запуском температура упала до отметки ниже –4 оС, и сильный северный ветер понизил температуру корпуса до –13 оС. В результате резиновые прокладки потеряли эластичность, уплотнение нарушилось, что привело к вытеканию топлива. По мнению специалистов, аварии могло не быть, если бы использовались прокладки из силиконовой резины. Справедливости ради отметим, что существуют и другие версии, объясняющие причину аварии.
Если взять для гидролиза не диорганодихлорсилан R2SiCl2, а моноорганотрихлорсилан RSiCl3, то образуются полициклические каркасные конструкции (рис. 6.11). Сборка таких молекул происходит буквально в одну стадию – необходимо лишь соблюсти определенные условия (температура, катализатор). В отличие от этого, получение подобных каркасов, построенных из атомов углерода, является весьма трудной задачей.
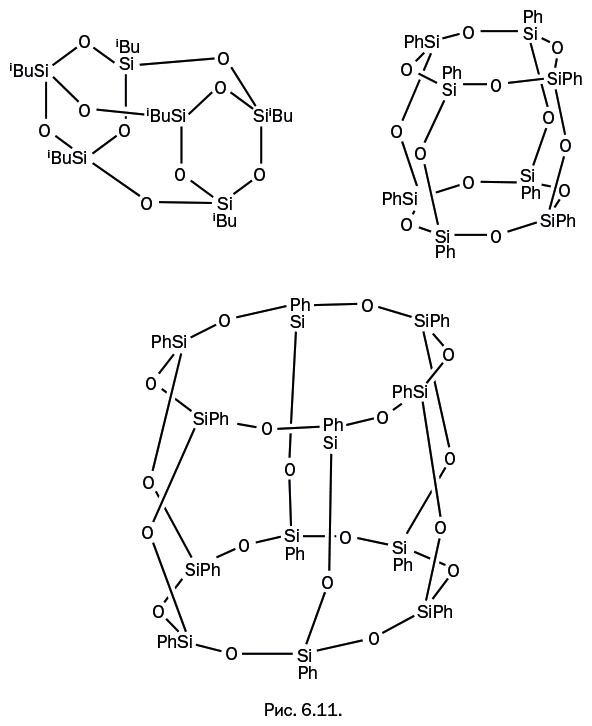
Каркасные соединения тоже можно использовать в качестве исходных соединений для получения силоксанов. Подобно тому, как происходит размыкание диорганосилоксановых циклов с последующей полимеризацией (см. рис. 6.9), возможно размыкание каркасных молекул и образование полимеров. Например, силоксановый каркас (рис. 6.12) может раскрываться, преобразовываясь в ленту, которая удлиняется в процессе полимеризации. В итоге возникает необычная полимерная структура, составленная из двух линейных цепей, связанных между собой перемычками, – в литературе они получили название лестничных.
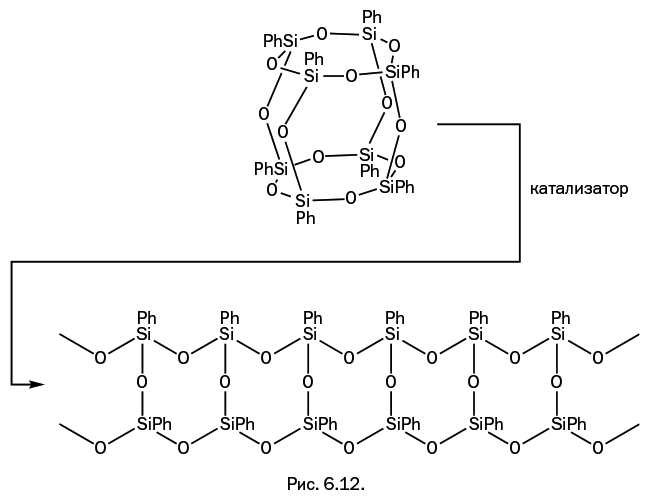
Молекулярная масса такого полимера достигает 3–4 млн. Он способен образовывать гибкие прочные пленки, которые медленно размягчаются в открытом пламени, но при этом не горят. Ранее химики даже в самых смелых фантазиях не могли представить себе полимеры столь необычного строения, к тому же с такими свойствами.
Склонность силоксанов к циклизации была успешно использована при конструировании других довольно необычных полимерных структур. Получены молекулы, в которых циклические фрагменты чередуются с линейными звеньями, при этом можно варьировать размер циклов и величину соединяющих перемычек. Реализовано также соединение циклов без промежуточных перемычек, связывающих центры – атомы кремния, входящие в состав двух циклов одновременно. Такие соединения называют спироциклическими (лат. spīra – «виток»). Подобные конструкции немного напоминают бусы, собранные из шариков (рис. 6.13).
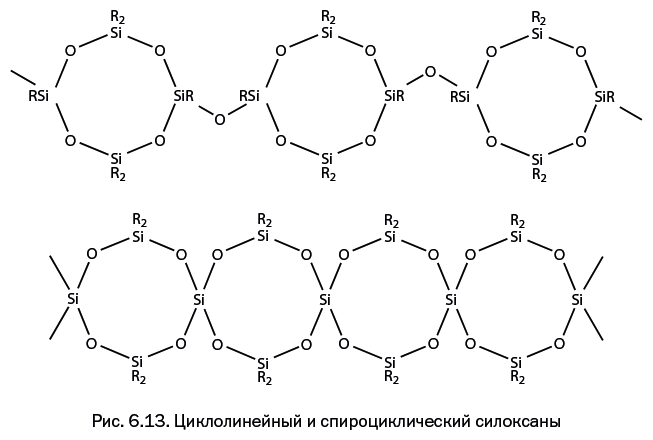
Возможны различные сочетания рассмотренных структур: циклолестничные, спиролестничные, спиролинейные и многие другие.

