Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Чистильщик в живой клетке
Дальше: Послесловие
Светящиеся животные
Все науки настолько связаны между собою, что легче изучать их все сразу, нежели какую-либо одну из них в отдельности от всех прочих.Рене Декарт
Во времена Декарта, автора эпиграфа, науки не разделяли на физику, химию, биологию и т. п. Ученые изучали природу, и областью их интересов (пользуясь современным языком) было естествознание. В наше время следовать совету Декарта не так-то просто: современная химия состоит из органической, неорганической, биохимии, физической химии и еще некоторых других крупных разделов, причем в каждой области – свои методы исследования и свой язык. Однако современная ситуация показывает, что границы между многими науками становятся все более размытыми. Зачастую трудно указать, где кончается биология и начинается физика или химия. Лауреатами Нобелевской премии 2008 г. по химии стали американские ученые-биохимики Осаму Симомура, Мартин Чалфи и Роджер Тсиен. Они удостоены самой престижной научной награды за получение и разработку различных форм зеленого флуоресцентного белка, в английском написании – Green Ffluorescent Protein. В научной литературе этот белок принято сокращенно обозначать как GFP, и далее будем пользоваться именно этим сокращением.
Премированная работа – это интересный пример пересечения научных интересов разных ученых; судьбы некоторых из них сложились весьма драматично. Работа имеет не только большое научное, но и эстетическое значение. Интересно, что авторы никогда не работали вместе, но обстоятельства сложились таким образом, что усилия каждого из них привели к важному общему результату.
Таинственный светящийся мир
Способность некоторых веществ испускать свет называют люминесценцией. Многие, вероятно, видели в темноте свечение древесных гнилушек, светлячков или ночное свечение волн морского прибоя. Когда люминесценцию производят вещества в живых организмах, то это называют биолюминесценцией. Наука никогда не довольствовалась простыми наблюдениями – далее необходимо было описать явление, что в 1761 г. проделал датский зоолог Петер Форскол. Во время экспедиции на корабле по Северному морю он заметил в воде странное свечение: оказалось, что светятся небольшие (диаметром 2–3 см) медузы. Форскол выловил несколько таких медуз и поместил их в ведро, а затем приступил к наблюдениям. Оказалось, если их слегка потревожить, они начинают светиться ярким зеленым цветом. Медузы получили название «эквореи» (Aquorea, от лат. aqua – «вода»), с этого начался долгий путь исследования процессов биолюминесценции.
Среди наземных обитателей светящихся организмов немного: колонии некоторых бактерий, отдельные виды грибов и насекомых; как правило, их свечение непрерывно. Кстати, свечение древесных гнилушек вызвано грибницей опенка в результате химических процессов при окислении.
Громадное количество светящихся существ (более тысячи видов) – среди обитателей морских глубин. Свечение моря волновало людей с незапамятных времен, вызывая не только изумление и восхищение, но и суеверный страх. Отсутствие научных знаний подводило человека к фантастическим объяснениям, отразившимся в мифах, легендах и сказках. Во многих случаях свечение морских обитателей – импульсное: они испускают короткие световые вспышки длительностью 0,1–1 с. Эти вспышки необходимы для отпугивания хищников или быстро движущихся животных, которые при случайном столкновении могут механически повредить нежный светящийся организм – такой как у медузы. У некоторых глубоководных рыб надо ртом имеется подвижный отросток – "удилище", а на нем – световая приманка для жертвы. Другие рыбы используют вспышки для освещения окружающего пространства.
Удачный объект – половина успеха
Вначале отметим, что живым организмам позволяют светиться принципиально различные процессы. Во-первых, это набор биохимических реакций с участием специальных ферментов (биокатализаторов). Такое свечение использует энергию химической реакции и может продолжаться до тех пор, пока не будут исчерпаны необходимые реагенты.
Существует и иной механизм свечения: вещество поглощает из внешнего источника (например, дневное освещение) ультрафиолетовую часть спектра, которая обладает высокой энергией. В результате молекула переходит в возбужденное состояние, но может пребывать в нем очень недолго. Чтобы вернуться к "нормальному" состоянию, ей необходимо избавиться от излишка энергии, которую она получила с ультрафиолетовым облучением, что достигается излучением света, – это и есть флуоресцентный свет. Поскольку часть энергии была потрачена на переход молекулы в возбужденное состояние, испускаемый свет имеет бóльшую длину волны – сдвигается в сторону красной части спектра, что соответствует более низкой энергии. Общее правило флуоресценции – испускающийся свет всегда имеет бóльшую длину волны, нежели поглощенный.
Итак, при флуоресценции не требуются какие-либо реакции с участием ферментов – нужна лишь ультрафиолетовая подсветка. Именно таким свойством, как оказалось, обладает зеленый флуоресцентный белок GFP, имеющийся у медузы эквореи – той самой, которую впервые описал П. Форскол. Этот белок при облучении ультрафиолетовым или синим светом дает голубовато-зеленое свечение.
Осаму Симомура – первый из упомянутых нами лауреатов – сумел в 1962 г. выделить из организма медуз этот флуоресцентный белок GFP.
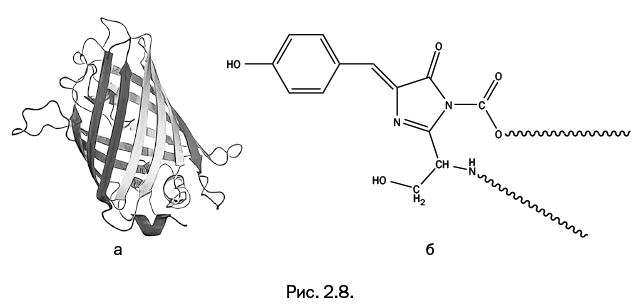
Структура GFP была расшифрована гораздо позже (в 1996 г.) в лаборатории Ремингтона. Молекула имеет форму, близкую к цилиндрической, образованную лентами белковых цепей. Внутри цилиндра расположена хромофорная (греч. χρωμοφόρου – «несущий свет») группа – она показана в виде конструкции из шариков. Эта группа химически связана с основной белковой молекулой (рис. 2.8, а – структура GFP; б – строение хромофорной группы).
На первый взгляд кажется, что строение хромофорной группы достаточно сложное, и непонятно, как она возникает. На самом деле ее образование – результат трех весьма простых последовательных стадий: в результате каждой стадии в качестве побочного продукта выделяется вода. Все происходит внутри белкового цилиндра, показанного на рис. 2.8а. Биохимики давно знают, что внутри живого организма все белковые молекулы собираются из известных аминокислот.
Кратко напомним, что такое аминокислоты. Это органические молекулы, содержащие аминогруппу H2N– и кислотную карбоксильную группу – СООН. Те аминокислоты, из которых собираются белки, имеют отличительный признак: между аминогруппой и карбоксильной группой находится всего один атом углерода. Общий вид всех природных аминокислот NH2-CR2-COOH. Органические заместители R у центрального атома углерода могут быть различными, в том числе и атомы водорода. При образовании белковых молекул концевая аминогруппа взаимодействует с концевой карбоксильной группой соседней молекулы с выделением воды:
NH2-CR2-COOH + NH2-CR'2-COOH → NH2-CR2-CO-NH-CR'2-COOH
Именно таким образом наращивается цепочка белковой молекулы. Кстати, при получении широко известных в быту полиамидов (например, нейлона) используют подобную простую реакцию: молекула с двумя аминогруппами на концах H2N-(CН2)n-NH2 взаимодействует с молекулой, имеющей две карбоксильные группы HCOO-(CН2)n-COOH (подробнее о полиамидах рассказано в главе «Империя длинных молекул»).
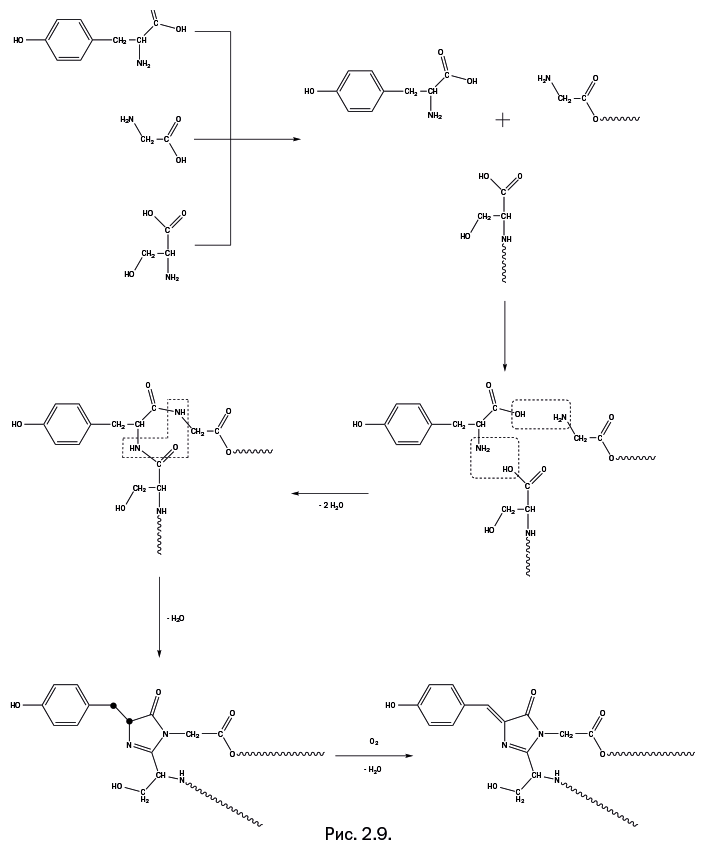
Перейдем к образованию хромофорной группы в GFP. Она собирается из трех аминокислот: тирозина, глицина и серина (рис. 2.9), которые присутствуют в каждом живом организме. Три молекулы объединяются в единый реагирующий центр. Две аминокислоты из трех (глицин и серин) присутствуют не в виде свободных молекул, а в качестве "привесков" к внутренней полости основного цилиндра (на рис. 2.9 это показано с помощью волнистых линий). Далее все происходит точно таким же образом, как описано выше: карбоксильная группа тирозина реагирует с аминогруппой глицина, а аминогруппа тирозина взаимодействует с гидроксильной группой серина (реагирующие группы обведены штриховыми прямоугольниками), при этом выделяются две молекулы воды. Далее реагируют две аминогруппы и карбонильный кислород (обведены г-образным штриховым контуром), образуется пятичленный цикл, называемый имидазольным, с двумя атомами азота и двойной связью, и вновь выделяется молекула воды. На последней стадии молекула кислорода отрывает два атома водорода от двух атомов углерода, показанных на предпоследней стадии в виде утолщенных точек (рис. 2.9). Выделяется молекула воды, и в итоге образуется хромофорная группа. Несмотря на то что строение всей образовавшейся группы можно назвать достаточно сложным, реакции, ведущие к ее образованию, весьма просты, а исходные реагенты – хорошо известные природные аминокислоты.
Показанный на рис. 2.8а белковый цилиндр не только служит "реакционной колбой" для получения хромофорной группы, но и защищает ее от случайных химических воздействий.
Продолжение научной эстафеты
В нашем рассказе появляется драматический поворот: настало время упомянуть имя ученого, без которого исследования могло и не быть. Тем не менее он не стал нобелевским лауреатом. Впрочем, все три лауреата в своих нобелевских докладах с глубоким уважением упомянули его имя. Первым, кто осознал возможности GFP, был американский биохимик Дуглас Прашер – ему пришла в голову интересная идея выделить ген ДНК, который обеспечивает в медузах синтез GFP, а затем ввести его в другие организмы. В результате такой организм начнет синтезировать белки с флуоресцирующим хвостом (своеобразным фонариком). Облучая объект ультрафиолетовым светом, можно будет заметить, где синтезируется и в какие участки клетки направляется белок с «зеленым фонариком» на конце.
Идея оказалась замечательной, и главное – со временем ее удалось реализовать. Сложность состояла в том, что нужно было выделить не сам флуоресцентный белок (это уже проделал ранее Симомура), а ген – участок ДНК, который в организме медузы эквореи отвечает за синтез GFP. В 1992 г. Прашеру удалось выделить нужный ген и определить в нем последовательность групп, которые кодируют синтез зеленого белка. К сожалению, Прашер не смог продолжить исследования (такое часто бывает в науке): финансирование работ было прекращено и работа приостановлена. Эстафету принял другой американец, второй лауреат упомянутой Нобелевской премии – Мартин Чалфи. Узнав на одной из конференций о работах Прашера, он связался с автором работы и получил от него необходимую информацию вместе с образцами.
Чалфи проводил исследования, используя в качестве модельных организмов специальных круглых полупрозрачных червячков (латинское название – Caenorabditis elegans). Они около 1 мм в длину, их движения (судя по имеющимся видеороликам и в полном согласии с латинским названием) достаточно элегантны. Эти червячки, состоящие точно из 959 клеток, очень подробно изучены биологами и считаются одними из наиболее подходящих объектов для экспериментов. Чалфи решил ввести в структуру ДНК изучаемых червей ген ДНК – тот, который он получил от Прашера и который кодирует в медузах синтез GFP. В итоге Чалфи удалось внедрить этот ген в живые клетки изучаемого червячка. Полученный результат произвел на исследователей очень сильное впечатление: снимок червячка со светящимися участками тела был помещен на обложке одного из самых авторитетных научных журналов – Science.
После этого во многих странах количество исследовательских работ с флуоресцирующим белком стало стремительно расти. Ген, вводящий в живой организм светящуюся метку, стали называть репортерным. Он позволил проводить тонкие исследования с различными генетически модифицированными организмами, причем объект не требовалось препарировать или каким-либо образом разрушать – стало возможным наблюдать многие скрытые процессы визуально. Впервые ученые смогли под микроскопом следить в режиме реального времени, например, за ростом и характером связей в нейронах или за распространением раковых клеток в организмах лабораторных животных.
Все цвета радуги
Многие исследователи отмечали, что при воздействии ультрафиолетового света флуоресцентные белки постепенно «портятся», и флуоресценция гаснет. Третий лауреат премии – Роджер Тсиен, американец китайского происхождения, описал схему синтеза хромофорной группы (она была показана на рис. 2.8) и затем нашел способы целенаправленно изменять ее структуру для того, чтобы сделать более стабильной, а флуоресценцию – более яркой. Фактически это была необычайно тонкая работа химика-синтетика. Более того, он разработал способы получения хромофорных групп, которые флуоресцируют разными цветами, благодаря чему можно одновременно следить за несколькими процессами, происходящими в живых клетках, – например, различать раковые и нормальные клетки. В настоящее время эти белки используют практически в любой лаборатории, где ведутся исследования в области молекулярной биологии или биологии клетки.
Рекламная яркость научной работы
Далеко не каждая серьезная научная работа имеет впечатляющее красочное продолжение – причем в той области, которая понятна почти каждому человеку, в том числе и далекому от науки. Имея широкий набор цветных белков, ученые стали вводить флуоресцирующий ген в организмы разных животных, и в результате отдельные участки тела (или даже весь организм) стали светящимися. Научные журналы запестрели цветными снимками флуоресцирующих мушек дрозофил, кроликов, обычных и летучих мышей.
Особенно сильное впечатление произвело сообщение группы тайваньских биохимиков, которые под руководством профессора Шинь-Джи в 2006 г. создали флуоресцирующих поросят, для чего потребовалось с помощью необычайно тонкой экспериментальной техники ввести соответствующие гены в эмбрионы свиней. Эти поросята при дневном свете имеют отчетливый зеленоватый цвет кожи и глаз. Более того, у них даже сердце и внутренние органы – зеленого цвета! В других опытах они имеют ярко окрашенные оранжевые пятачки.
Подобные научные достижения настолько впечатляющи, что привлекают внимание не только ученых, но и широкой публики. Тем не менее все это было проделано не для внешнего эффекта. Опыты с различными биологическими тканями свиней наиболее точно моделируют соответствующие процессы в тканях человеческого организма. Основная цель выведения таких свиней – визуальное наблюдение за развитием тканей при пересадке стволовых клеток. Кратко поясним, что ставшие в последнее время популярными стволовые клетки после введения в организм находят поврежденную зону, далее изменяются в зависимости от того, где они находятся, то есть приобретают нужную "специализацию" и начинают развиваться, как обычные клетки. Иными словами, они могут наращивать поврежденный орган. С помощью цветных индикаторов можно будет определять, получил ли организм генетическую вставку, введенную методами генной инженерии. При изучении онкологических заболеваний стало возможным следить за развитием здоровых и больных клеток.
Не только восторги
Факт присуждения Нобелевской премии всегда сопровождается восторженными отзывами научной общественности в газетах, журналах, на телевидении и на радио. В большинстве случаев такое вполне оправданно, однако ничто не мешает нам взглянуть на эту ситуацию более спокойно. Фактически был найден изящный аналитический метод, позволяющий следить буквально своими глазами за теми процессами, которые происходят в живых организмах, при этом какое-либо внутреннее механическое вмешательство не требуется и жизненные процессы никак не нарушаются. Можно ли все это рассматривать как выдающиеся фундаментальные работы? Академик РАН Евгений Свердлов (заведующий лабораторией структуры и функции генов человека в Институте биоорганической химии РАН) считает, что открытие и использование зеленого флуоресцентного белка сыграло очень большую роль в биологии, хотя, по мнению академика, до нобелевского масштаба оно не дотягивает и не вносит революционных изменений в биологические исследования. Академик поясняет, что до появления зеленого флуоресцентного белка использовались другие светящиеся метки – например, так называемая люцифераза, это фермент, в котором для свечения используется энергия химической реакции.
Еще один грустный момент связан с обсуждением того, сколь справедливо выбраны лауреаты. Помимо упомянутых биохимиков, крупный вклад в создание и развитие флуоресцентных белков внес российский ученый, академик РАН, заведующий лабораторией молекулярных технологий для биологии и медицины Института биоорганической химии РАН Сергей Лукьянов. Вместе со своими коллегами он создал целый ряд исключительно стабильных белков, которые флуоресцируют различными цветами. Одними из первых эти ученые смогли получить красный светящийся белок, выделенный из коралловых полипов.
Подобные обсуждения часто возникают после объявления имен лауреатов. К сожалению, конкретную Нобелевскую премию нельзя присудить более чем трем ученым одновременно (таково непреложное правило), поэтому кто-то всегда остается обделенным – как, например, упомянутый ранее Дуглас Прашер. В частных беседах члены Нобелевского комитета иногда поясняют, что решение комитета не может удовлетворить всех, но если есть мнение, что представитель какой-либо страны несправедливо обойден, то ничто не мешает этой стране присудить своему ученому самые престижные национальные премии и воздать заслуженные почести. Здесь трудно что-либо возразить.
Коротко о самих лауреатах
Осаму Симомура родился в 1928 г. в г. Киото. Он вырос в Маньчжурии, где в японской армии служил его отец. В 1945 г. Симомура, живший тогда в Нагасаки, был свидетелем взрыва сброшенной на город атомной бомбы и в результате на некоторое время потерял зрение. Второй слайд его нобелевской лекции был далек от торжественности происходящего – снимок показывал руины медицинского колледжа в Нагасаки после бомбардировки 1945 г. В 1951 г. он окончил Университет Нагасаки, а с 1955 г. работал в Нагойском университете, где начал исследования флуоресценции морских животных.
В 1960 г. Симомура получил в Нагойском университете ученую степень, затем переехал работать в США. Согласитесь, это несколько необычный поворот судьбы: человек, пострадавший от американской атомной бомбардировки Японии, переезжает в США. Впрочем, все объяснимо: за 15 лет многое изменилось, и он выбрал лучшее место для работы. Кроме того, следует учитывать непривычный для нас образ мыслей жителей Японии. Известно, что атомную бомбардировку японцы со временем стали рассматривать без отрицательной оценки: в результате Япония капитулировала, война была прекращена, что позволило остановить последующее кровопролитие, которое могло унести неизмеримо большее количество жизней, чем сама бомбардировка. Приблизительно такой же подход к этой трудной, болезненной проблеме в годы Первой мировой войны продемонстрировал создатель науки о полимерах Штаудингер (см. главу "Империя длинных молекул", раздел "Создать новую науку").
Симомура вначале работал в Принстоне (где и открыл зеленый флуоресцентный белок, вызывающий свечение у медуз), а с 1982 г. – в Лаборатории морской биологии в Массачусетсе.
В 2001 г. Осаму Симомура вышел на пенсию и жил на полуострове Кейп-Код в штате Массачусетс, недалеко от своего последнего места работы.
Осаму Симомура был очень удивлен, когда узнал о решении Нобелевского комитета, при этом он добавил, что не считает себя химиком и мог скорее предположить, что получит премию в номинации "Физиология и медицина". Последний слайд его нобелевской лекции представлял собой снимок колонии медуз экворей, на фоне которых размещены слова благодарности всем коллегам, принимавшим участие в работе. Подразумевалась и благодарность самой медузе.
В 2011 г. Осаму Симомура стал победителем российского конкурса "мегагрантов" с проектом по исследованию биолюминесценции. Работы велись в Сибирском федеральном университете в тесном сотрудничестве с московским коллективом упомянутого немного ранее Сергея Лукьянова и привели к созданию новых биолюминесцентных систем – светящихся червей и грибов. Результаты были опубликованы, к сожалению, уже после смерти О. Симомуры.
Мартин Чалфи родился в 1947 г. Он учился в Гарварде, где в 1977 г. получил ученую степень за исследования в области нейробиологии. С 1982 г. и по сей день Чалфи – профессор в Колумбийском университете в Нью-Йорке. В 1984 г. он некоторое время работал в лаборатории молекулярной биологии в Кембридже (Великобритания), где изучал нервную систему круглого червя Caenorhabditis elegans вместе с одним из классиков молекулярной генетики – Сидни Бреннером (благодаря трудам которого этот червь и стал одним из важнейших модельных объектов современной биологии). Во время нобелевского доклада Чалфи показывал портреты своих ближайших коллег, чередуя их со снимками червячка в различных ракурсах и на разных стадиях исследования.
Знаменитый светящийся червячок стал для самого Чалфи настоящим символом победы и главным героем его доклада – пожалуй, таким же, как медуза экворея для Осаму Симомуры.
Роджер Тсиен родился в Нью-Йорке в 1952 г. в семье эмигранта из Китая, потомка царствующего дома небольшого дальневосточного государства (на территории которого, в частности, находился город Шанхай), вошедшего в конце X в. в состав Китая. Среди его родственников много выдающихся интеллектуалов: ученых, инженеров и преподавателей. Детство Роджера Тсиена прошло в Ливингстоне, штат Нью-Джерси. Затем он учился в Гарварде и в Кембридже (Великобритания), где в 1977 г. получил ученую степень. До 1981 г. он работал в Кембриджском университете, а в 1982–1989 гг. – в Калифорнийском университете в Беркли. С 1989 по 2014 г. Роджер Тсиен был профессором в Калифорнийском университете в Сан-Диего.
Во время нобелевской лекции он показал снимок пятнадцати образцов флуоресцирующих белков, имеющих диапазон цветов от ярко-голубого до темно-малинового. Работа с многообразными цветными объектами настроила его на поэтический лад, и в одном из интервью он сказал, что очень любит многоцветие и рад, что это сочетается с его исследованиями. На завершающем слайде презентации рядом с именами коллег, участвовавших работе, была помещена красочная флуоресцирующая картина "Закат, вид из окна калифорнийской лаборатории", созданная из разноцветных колоний бактерий, светящихся восемью различными цветами. В своей речи на нобелевском банкете Тсиен, выступая от имени трех лауреатов, сказал, что вся премированная работа – результат деятельности большого сообщества биохимиков, а номинанты – просто три человека, которым повезло быть избранными Нобелевским комитетом. Своей целью в будущем он назвал разработку способов лечения онкологических заболеваний.
Назад: Чистильщик в живой клетке
Дальше: Послесловие

