Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Кинофабрика белка
Дальше: Светящиеся животные
Чистильщик в живой клетке
В любом производстве существуют отходы, и потому нужны специальные службы, которые собирают и уничтожают мусор. В последнее время это особенно актуально в связи с разросшимися свалками в городах и с острой проблемой переработки мусора. Каждый живой организм также представляет собой сложный производственный комплекс, и в процессе его деятельности постепенно аккумулируются ненужные соединения. Отходы образуются не только в результате пищеварения – внутри живой клетки тоже накапливаются вещества, представляющие собой ненужный балласт, от которого необходимо избавляться. Этот процесс заинтересовал трех ученых: химика из США Ирвина Роуза и израильских химиков Аврама Гершко и Аарона Чехановера.
Созидание привлекательнее разрушения
Вторая половина ХХ столетия отмечена многими значительными достижениями в науке, среди которых особое место занимает изучение роли нуклеиновых кислот в живом организме (кто не слышал о знаменитой ДНК?).
Механизм синтеза белков в живом организме с участием нуклеиновых кислот за многие десятилетия исследован весьма детально: он представляет собой сложный и в то же время необычайно впечатляющий процесс. Синтез белка протекает внутри своеобразного биокомплекса – белкового образования, называемого рибосомой. По существу, это небольшая фабрика для сборки белковых молекул из аминокислот по строго определенной схеме, что напоминает работу пишущей машинки, печатающей нужные буквы в установленном порядке (см. предыдущий раздел "Кинофабрика белка").
Всеобщий интерес ученых к процессам сборки белковых молекул оттеснил на задний план изучение того, как происходит их демонтаж. Исследовано было лишь разрушение внеклеточных белков – например, поступающих в организм с пищей. При этом было установлено, что белки, усваиваемые в пищеварительном тракте вместе с другими продуктами питания, поставляют энергию, необходимую для существования организма. Что же касается белков, возникающих и работающих внутри живой клетки, то механизм их уничтожения был мало кому интересен.
Тем не менее в живом организме хорошо отлажены процессы расщепления белков на малые фрагменты, из которых организм затем вновь собирает в рибосоме другие нужные ему белки. Срок жизни белков в организме определяется их ролью: например, белки, входящие в состав хрусталика глаза, сохраняются неизменными в течение десятилетий, а другие нужны организму в течение нескольких минут только для запуска определенного процесса – после чего они должны быть разрушены, иначе их действие окажется губительным. Время жизни более 20 % белков, присутствующих в организме, – от нескольких часов до нескольких дней.
Трое упомянутых ученых, несмотря на всеобщий интерес к синтезу белков, пошли "в обратную сторону", то есть заинтересовались разрушением белков. Исследования помогли понять, каким же образом протекает этот важный для организма процесс.
Фабрика разрушения
К моменту, когда триада ученых приступила к исследованиям, о процессах разрушения белков внутри клетки было известно немного. Если фабрика по производству белков – рибосома, то фабрику, разрушающую белки, называют протеосомой. Она так же, как и рибосома, представляет собой специальное белковое образование – биологический комплекс в виде емкости цилиндрической формы, собранной из кольцевых молекулярных образований. В нем расположен канал, на внутренней поверхности которого находятся активные центры, расщепляющие белки (рис. 2.5). Снаружи канал закрыт торцевыми подвижными крышками. Все это напоминает некий мусоросжигательный контейнер.
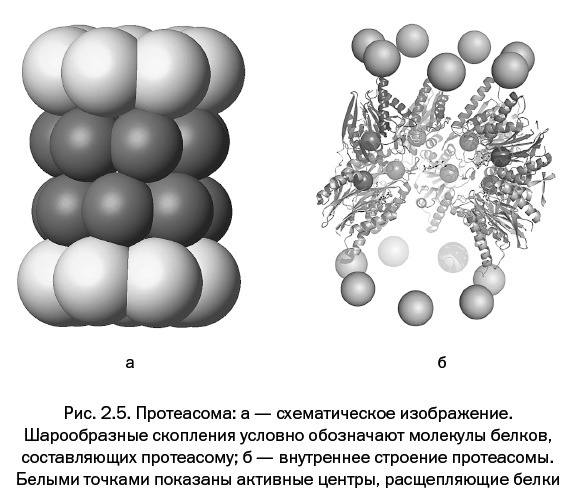
В каждой клетке находится большое количество протеасом, и все они предназначены природой для расщепления белка. Долгое время ученые полагали, что белковой молекуле довольно просто попасть в этот «утилизирующий контейнер», но если бы все было так, то любой, в том числе и нужный белок, попавший во «чрево» протеасомы, уничтожался бы. Было неясно, почему туда попадет не любой, а строго определенный белок – именно тот, который следует утилизировать. Очевидно, какое-то «устройство» проводит сортировку, отбирая только то, что подлежит ликвидации.
Новая роль старого знакомого
Ранее было сказано, что процессы расщепления белков в пищеварительном тракте (вместе с остальными продуктами) протекают с выделением энергии. Начав изучать процессы разрушения внутриклеточных белков, А. Чехановер, А. Гершко и И. Роуз обратили внимание на одно необычное обстоятельство: расщепление белков в клетке протекает не с выделением, а с поглощением энергии. На это указывал следующий обнаруженный факт: расщепление клеточных белков происходило только в присутствии аденозинтрифосфата (сокращенно АТФ – вещество, представляющее собой универсальный источник энергии для всех биохимических процессов), а в отсутствии АТФ расщепления не случалось. Результаты столь простых по замыслу и по исполнению экспериментов вначале не заинтересовали никого из коллег-биохимиков, но именно эти опыты привели к последующим масштабным исследованиям. Обратив внимание на такое явление, ученые провели более детальное его изучение и установили, что разрушение протекает в присутствии еще одного белка, притом обладающего высокой активностью. Оказалось, что белок известен давно – он был открыт в 1970-х гг. американским биохимиком Г. Голдстейном и получил название убиквитин (лат. ubique – «вездесущий»), поскольку его находили во многих тканях и органах.
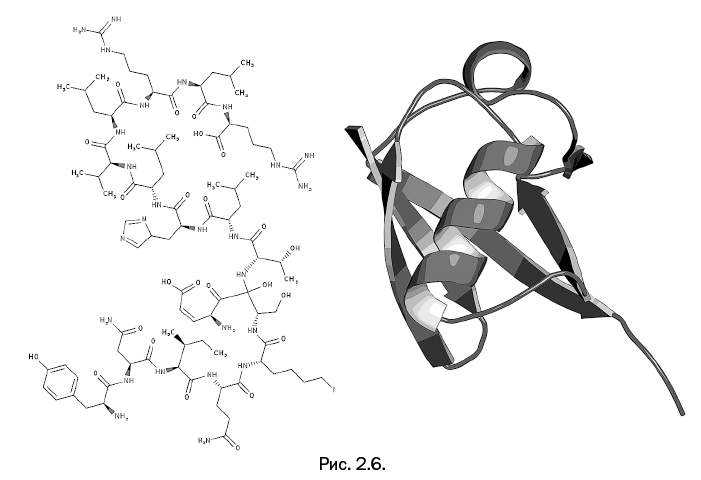
К началу описываемой работы убиквитин был хорошо изучен: он представляет собой белок, собранный из 76 аминокислотных остатков, а его молекулярная масса сравнительно невелика – немногим более 8000. Он весьма стабилен, и участие в различных биохимических процессах не приводит к изменению его структуры. На рис. 2.6 его строение показано в виде трехмерной модели, а также приведена упрощенная структура. Молекула содержит одно спиральное образование (альфа-спираль) и четыре плоские ленты (бета-структуры). Поясним, что это две наиболее распространенные формы белков – спираль и плоская лента.
Несмотря на то что убиквитин находили во многих клетках живых организмов и строение его было установлено, его роль в биохимических процессах была не ясна.
Авторы работы высказали мысль, что решающая стадия в процессе утилизации белков – это присоединение убиквитина к тому белку, который необходимо уничтожить. Последующие исследования это подтвердили, было установлено также, что вход в протеасому (фабрику уничтожения) обычно закрыт. Попасть в нее может только тот белок, который отмечен специальной меткой, и тогда вход в протеасому открывается. Роль "черной" метки играет убиквитин. Процесс прикрепления убиквитина к молекуле белка, подлежащего уничтожению, авторы назвали "поцелуем смерти", изобразив в виде ярлычка с черепом. Столь мрачное название невольно хочется смягчить, добавив к нему три слова: "поцелуй смерти во имя жизни", поскольку очистка от мусора – залог дальнейшего развития.
Входя в протеасому, полимерная цепь уничтожаемого белка разворачивается и "протягивается" через центральный канал цилиндра, при этом она распадается на мелкие звенья (иногда вплоть до отдельных аминокислот), которые выводятся из противоположного отверстия протеасомы (рис. 2.7. Перейдя по ссылке: , читатель сможет посмотреть ролик, в котором показан этот процесс.). Сам убиквитин внутрь протеасомы не заходит, а после уничтожения отмеченной молекулы освобождается и «помечает» другую молекулу.
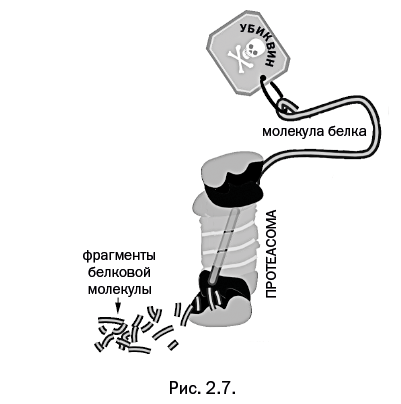
Этот необычный процесс выглядит еще зрелищнее, если мы примем во внимание, что в некоторых случаях к уничтожаемому белку присоединяется не одиночная молекула убиквитина, а сразу несколько молекул, которые связаны между собой в необычную цепочку.
Перед тем как присоединиться к белку, который следует разрушить, убиквитин активируется с помощью специального фермента (биологического катализатора) – именно на этой стадии требуется затрата дополнительной энергии, которую поставляет упомянутый ранее АТФ. Так было найдено объяснение факту, с которого, собственно говоря, и началось изучение всего этого механизма.
Результаты проведенных исследований позволили понять некоторые неразгаданные ранее особенности развития живых организмов. Например, растения в цветке содержат как отцовские клетки (пыльцу), так и материнские (расположенные в пестике цветка). Поскольку они находятся рядом, то, казалось бы, самоопыление неизбежно, что должно приводить к генетическому вырождению и вымиранию вида. Оказалось, что убиквитин помечает белки собственной пыльцы, что приводит к их уничтожению, а пыльца, попавшая в цветок в результате перекрестного опыления, убиквитином не затрагивается.
В процессе деления клетки ее ДНК удваиваются, и все это время специальный белок, словно шнур, удерживает рядом друг с другом удваивающуюся пару. После того как произошло удвоение, молекулы ДНК должны разойтись, следовательно, белок, удерживающий их вместе, должен быть уничтожен, иначе процесс дальнейшего развития остановится. В этот момент в дело вступает убиквитин, ответственный за удаление ненужных белков.
Схема некоторых биохимических процессов напоминает работу устройств с взаимотормозящими противовесами. В иммунных клетках организма присутствует белок, который включает действие иммунной системы, уничтожающей проникший в клетку вирус. В нормальном состоянии действие этого белка заторможено другим белком – ингибитором (замедлителем). Если в клетку попадает вирус, то включается убиквитин, который начинает метить белок-ингибитор. Уничтожение ингибитора ведет к тому, что вступает в действие заторможенный ранее белок, запускающий иммунную систему, и в результате вирус уничтожается.
Изученный убиквитиновый механизм открывает новые перспективы в борьбе с различными заболеваниями. Образование злокачественных опухолей или ослабление иммунной системы клетки так или иначе связаны с нарушением убиквитиновой защиты клетки от нежелательных белков. Процессы ненормального или неправильного расщепления белков приводят ко многим заболеваниям (например, болезнь Паркинсона, болезнь Альцгеймера), некоторым онкологическим заболеваниям и запускают процессы старения организма. Изученный механизм убиквитиновой защиты открывает возможность поиска различных воздействий на процесс – чтобы запускать его в нужную сторону. Очевидно, затормозить действие убиквитина можно, например снизив содержание АТФ, дающего необходимую для его работы энергию. По существу, это использование эффекта, с открытия которого и началась вся работа. Возможны и другие способы воздействия на процесс. В настоящее время ведутся интенсивные разработки различных лекарственных препаратов, основанные на понимании механизма убиквитиновой защиты. В 2004 г. в США было начато производство первого такого препарата – антиракового средства Velcade. Другое реализованное применение – создание надежного теста на бесплодие у мужчин, использующего анализ присутствия убиквитина.
Об авторах работы
Исследования Аарона Чехановера, Аврама Гершко и Ирвина Роуза в 2004 г. были отмечены Нобелевской премией. История химии не стоит на месте, она пишется и в наши дни, а потому рассказ об убиквитиновой защите будет неполным, если не привести некоторые биографические сведения об авторах этой замечательной работы.
Ирвин (Эрни) Роуз (1926–2015) родился 16 июля 1926 г. в Бруклине – одном из районов Нью-Йорка. Его мать была уроженкой Венгрии, а семейство отца происходило из Одессы. Среди родственников, занимавшихся юриспруденцией или предпринимательством, не было никого, кто мог бы посоветовать Ирвину Роузу заняться научной работой, и выбор будущей профессии он сделал самостоятельно. Образование Роуз получил в Вашингтонском колледже, после чего проходил военную службу в американском флоте радиотехником – его служба совпала с окончанием Второй мировой войны. В 1948 г. он получил степень бакалавра в Чикагском университете, там же в 1952 г. защитил диссертацию по биохимии. С 1954 по 1963 г. работал в Йельской военно-медицинской школе, где изучал различные ферментативные реакции. В эти годы Роуз впервые обнаружил, что расщепление внутриклеточных белков протекает с поглощением энергии – и это наблюдение определило всю его последующую работу, в которой было изучено действие убиквитина. Основную часть работы, отмеченной Нобелевской премией, он выполнил в онкологическом центре Пенсильванского университета, куда неоднократно приглашал для совместной работы двух соавторов премированного исследования – Гершко и Чехановера. В результате четырехлетнего сотрудничества ученые сформулировали основные принципы функционирования убиквитиновой системы. Последним местом работы Роуза стал Калифорнийский университет в Ирвайне.
По воспоминаниям соавтора А. Гершко (второго лауреата этой премии), Ирвин Роуз обладал блистательным талантом исследователя. Отличительной его чертой была склонность к острым критическим замечаниям. Не колеблясь, он мог дать резкую оценку работы, что вызвало постоянно напряженные отношения с коллегами. В то же время он отличался исключительной скромностью – коллеги с трудом получали его согласие стать соавтором публикации, несмотря на очевидность и значительность его вклада в совместную работу. Роуз всегда приуменьшал свою роль в разработке убиквитинового механизма, принесшего ему Нобелевскую премию, и в автобиографии, написанной в 1995 г. по просьбе научного журнала Protein Science, не употребил слово «убиквитин» ни разу.
Аврам Гершко родился 31 декабря 1937 г. в небольшом венгерском городке Карцаг, расположенном в 140 км восточнее Будапешта. Его отец был преподавателем в начальной школе, а мать давала жителям этого небольшого городка уроки английского и музыки. После начала Второй мировой войны, в которой Венгрия была союзницей Германии, его отец в числе других венгерских евреев-мужчин был направлен на принудительные работы, а затем попал в плен. Был освобожден в 1946 г.
В 1944 г. А. Гершко вместе с матерью и старшим братом, а также сотнями других еврейских семей отправили в концлагерь Аушвиц, где погибли, как выяснилось позже, многие родственники Гершко. По счастливой случайности поезд, в котором находилась семья Гершко, дошел до Австрии, где евреев не уничтожали, а использовали в качестве рабочей силы. В 1945 г. они были освобождены Советской армией. После освобождения отца из плена вся семья в 1950 г. переехала в Израиль. Юный Аврам Гершко был очень любознательным юношей и с одинаковым успехом постигал математику, физику, литературу и историю. Поскольку определенных устремлений не было, он не мог определиться с выбором будущей специальности и в итоге решил последовать за старшим братом Хаимом, который к этому моменту был студентом-медиком (в настоящее время Хаим Гершко – известный в Израиле врач-гематолог, специалист по заболеваниям крови).
В 1956 г. Аврам Гершко поступил в военно-медицинскую школу в Иерусалиме, где сразу же увлекся биохимией. Причиной этому было, как считает Гершко, великолепное преподавание. С 1960 г. он начинает экспериментальные исследования по энзимологии в лаборатории военно-медицинской школы под руководством Джекоба Маджера – первоклассного биохимика с энциклопедическими знаниями и необычайной широтой научных интересов. После прохождения службы в армии (1965–1967) Гершко возвращается в лабораторию Маджера и в 1969 г. защищает диссертацию. В 1969–1971 гг. Гершко работал в отделе биохимии Калифорнийского университета в Сан-Франциско, где впервые заинтересовался процессами разложения белка. В 1971 г. он возвратился в Израиль, где возглавил биохимические исследования в военно-медицинской школе в Хайфе, а через некоторое время его аспирантом стал Аарон Чехановер (через 33 года их сотрудничество будет отмечено Нобелевской премией). Гершко вспоминает, что у него не было более трудолюбивого аспиранта. Кроме того, энергичный Чехановер настоял на том, чтобы Гершко подал грант в систему национальных институтов здоровья. Работа Гершко и Чехановера была столь успешной, что поддержку от фонда они получали пять раз, что позволило заметно интенсифицировать работы в недавно созданной биохимической лаборатории.
На одной из встреч, организованной Международным фондом Джона Фогарти, Гершко познакомился с уже известным в то время американским биохимиком Ирвином Роузом (будущим третьим лауреатом Нобелевской премии), специалистом по ферментативному катализу. Гершко поинтересовался тем, какое научное направление привлекает Роуза более всего, и тот ответил – разложение белков. На вопрос озадаченного Гершко "Почему же у вас нет ни одной публикации на эту тему?" Роуз ответил: "Потому что ничего не сделано такого, что можно было бы опубликовать". Поскольку интересы ученых совпадали, Гершко попросил предоставить ему возможность поработать у Роуза в Филадельфии.
Вслед за упомянутыми ранее учителями Гершко (методичным Маджером и Томкинсом с "вулканическим" темпераментом) Ирвин Роуз стал третьим, кто оказал, по словам Гершко, наибольшее влияние на его научное творчество. Их совместная работа началась в 1978 г., вскоре к ним присоединился третий будущий лауреат – А. Чехановер, приехавший вслед за Гершко в лабораторию Роуза. В этом тройственном союзе успешно сочетались аналитический ум и оригинальное мышление Роуза, интуиция Гершко и тонкое экспериментальное мастерство энергичного Чехановера: они исключительно удачно дополняли друг друга. В настоящее время Гершко работает в Израильском технологическом институте (Технионе) в г. Хайфе, изучая влияние убиквитиновой системы на процесс деления клетки.
По словам Аврама Гершко, он очень удачливый человек: его семья сумела избежать фашистского концлагеря, у него были замечательные наставники в науке и он сумел использовать полученные знания для дальнейшего развития биохимии. По его словам, он счастлив, когда находится в кругу семьи, у него трое сыновей (двое – медики, а третий – специалист по компьютерам) и шестеро внуков. Единственное его желание – чтобы между Израилем и соседними странами установились наконец мирные взаимоотношения.
Аарон Чехановер родился 1 октября 1947 г. в Хайфе, Израиль, за месяц до того, как Израиль был признан ООН независимым государством. Его отец был адвокатом, а мать – преподавателем английского языка. С детских лет Чехановер увлекся биологией: он собирал гербарии, засушивал растения между страницами книг, учился извлекать с помощью спирта хлорофилл из листьев растений. В одиннадцатилетнем возрасте он получил в подарок от старшего брата микроскоп. Это позволило Аарону проводить первые эксперименты: под микроскопом он впервые увидел клетки растения в тонком срезе луковой мякоти, а затем наблюдал процесс набухания клеток при действии растворов различных солей – явление осмоса. Его интересовала также зоология: он коллекционировал скелеты различных животных – рыб, лягушек, змей, черепах, а знакомый студент-медик подарил ему для коллекции несколько человеческих костей. Во время обучения в средней школе (1953–1963) его интересовала прежде всего биология. В то время она была скорее описательной, нежели экспериментальной наукой. Структура ДНК появилась в учебниках уже после того, как Чехановер окончил школу. После школы каждому выпускнику необходимо было пройти службу в армии, к чему молодые израильтяне всегда относились с воодушевлением. Если же молодой человек хотел получить профессию, представлявшую интерес для армии (например, выбирал область медицины), то ему давали возможность учиться далее. В 1965 г. Аарон поступает на медицинский факультет Еврейского университета в Иерусалиме. Постепенно у молодого студента-медика возникает неудовлетворенность от занятий медициной – прежде всего из-за отсутствия научных представлений о механизме многих заболеваний. С 1969 г. Чехановер начинает заниматься биохимией, первая его работа – изучение влияния фермента фосфотазы при различных заболеваниях печени. В 1974 г. он оканчивает университет и уже твердо знает, что его призвание – биохимия. Коллеги посоветовали продолжить обучение у молодого талантливого биохимика Аврама Гершко, который незадолго до этого стал деканом факультета медицины Техниона в г. Хайфе. Так началось их успешное сотрудничество.
Первое время Чехановер совмещал научную работу с работой в клинике. В лаборатории он часто проводил вечера и ночи, исследуя превращения фосфолипидов в организме. В течение трех лет он служил судовым врачом на военном корабле, периодически совмещая службу с чтением лекций по биохимии студентам-медикам. О годах военной службы он вспоминает с большим удовольствием, поскольку, по его словам, армия – плавильный котел, из которого выходишь, получая верных друзей на долгие годы.
В 1976 г., работая под руководством А. Гершко, Чехановер обратил внимание на то, что разложение дефектного гемоглобина протекает с поглощением энергии. Это было отправным пунктом масштабного исследования. В 1979 г. Чехановер приезжает в онкологический центр Филадельфии для проведения совместных исследований с признанным авторитетом в биохимии – Ирвином Роузом (партнером по будущей Нобелевской премии), к этому моменту Гершко (шеф Чехановера) работал вместе с Роузом уже больше года. Произошло необычайно удачное и плодотворное объединение усилий трех специалистов. По словам Чехановера, именно знание и мудрость старшего коллеги Ирвина Роуза помогли разобраться с накопившимися экспериментальными результатами. 1976–1981 годы были наиболее успешными: Чехановер, Гершко и Роуз сформулировали основные принципы работы убиквитиновой системы. В течение трех лет (1981–1984) Чехановер работает в Массачусетском технологическом институте, после чего возвращается в Израиль и занимает должность заведующего лабораторией в отделе биохимии Технологического института в Хайфе – там, где он в свое время получил высшее образование. Его последующие работы связаны с изучением убиквитиновой системы.
Работа в биохимии, по мнению Чехановера, требует настойчивости при решении задач, которая сопоставима с поисками путей в сложном лабиринте: ученый постепенно отделяет направления исследований друг от друга, как слои от головки репчатого лука. Чехановер полагает, что дальнейшее развитие современной медицины неизбежно будет тесно связано с успехами в биохимии.
Примечательно, что Нобелевская премия была присуждена за совместную работу команде из трех ученых, представляющих две разные и далекие друг от друга страны, – это замечательный пример научного сотрудничества, которому не смогли помешать никакие расстояния.
Назад: Кинофабрика белка
Дальше: Светящиеся животные

