Книга: Пять литров красного. Что необходимо знать о крови, ее болезнях и лечении
Назад: Глава 25 Методы лечения опухолевых заболеваний крови
Дальше: Глава 27 «Пули против рака» – ингибиторы протеинкиназ
Глава 26
Химиотерапия, или Препараты-обжоры
По современным представлениям, злокачественная опухоль – это заболевание клетки, в основе которого лежит повреждение ее генома. Вследствие этого клетка начинает активно делиться и снижается ее способность к физиологическому механизму гибели клеток – апоптозу.
Исследования второй половины XX века привели к формированию концепции, согласно которой противоопухолевые препараты различными способами повреждают внутриклеточные механизмы, активируя апоптоз.
В основе действия почти всех цитостатических препаратов лежит нарушение синтеза нуклеиновых кислот (ДНК и РНК) в опухолевых клетках. Клетки, активно реплицирующие ДНК и готовящиеся к митозу, в отличие от клеток в стационарной фазе роста, имеют меньше времени для исправления повреждений ДНК, вследствие чего погибают.
Как это выглядит?
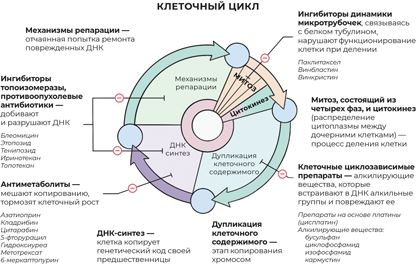
Рис. 27. Классификация и принцип действия химиопрепаратов
В процессе деления клетка проходит несколько стадий. На каждом этапе деления на нее можно воздействовать тем или иным препаратом, чтобы запустить процесс самоуничтожения.
 Митоз, состоящий из четырех фаз, и цитокинез (распределение цитоплазмы между дочерними клетками) – процесс деления клетки.
Митоз, состоящий из четырех фаз, и цитокинез (распределение цитоплазмы между дочерними клетками) – процесс деления клетки. Ингибиторы динамики микротрубочек, связываясь с белком тубулином, нарушают функционирование клетки при делении.
Ингибиторы динамики микротрубочек, связываясь с белком тубулином, нарушают функционирование клетки при делении. Дупликация клеточного содержимого – этап копирования хромосом.
Дупликация клеточного содержимого – этап копирования хромосом. Клеточные циклозависимые препараты – алкилирующие вещества, которые встраивают в ДНК алкильные группы и повреждают ее.
Клеточные циклозависимые препараты – алкилирующие вещества, которые встраивают в ДНК алкильные группы и повреждают ее. ДНК-синтез – клетка копирует генетический код своей предшественницы.
ДНК-синтез – клетка копирует генетический код своей предшественницы. Антиметаболиты мешают копированию, тормозят клеточный рост.
Антиметаболиты мешают копированию, тормозят клеточный рост. Механизмы репарации – отчаянная попытка ремонта поврежденных ДНК.
Механизмы репарации – отчаянная попытка ремонта поврежденных ДНК. Ингибиторы топоизомеразы, противоопухолевые антибиотики (на картинке есть название одного из них – блеомицин) добивают и разрушают ДНК.
Ингибиторы топоизомеразы, противоопухолевые антибиотики (на картинке есть название одного из них – блеомицин) добивают и разрушают ДНК.Почти все приведенные на рисунке препараты применяются в онкогематологии. Теперь немного подробнее о каждой группе.
Антиметаболиты – это вещества, близкие по химической структуре к эндогенным (внутренним, то есть расположенным внутри организма) продуктам метаболизма. Цитостатическое, то есть подавляющее рост и деление клеток, действие всех этих соединений связано с нарушением синтеза нуклеиновых кислот (ДНК и РНК).
Противоопухолевую активность антиметаболитов обнаружили, как уже говорилось, в 1948 году, когда открыли, что аминоптерин заставляет на время отступить лейкоз. В 1956 году выяснилось, что метотрексат, тоже являющийся антифолатом (антиметаболитом фолиевой кислоты), эффективен при некоторых опухолях человека, особенно при хориокарциноме у женщин и при острой лейкемии. В 1951 году был синтезирован препарат 6-меркаптопурин для лечения острого лимфобластного лейкоза, создатели которого Гертруда Элайон (1918‒1999) и Джордж Хитчингс (1905‒1998) получили в 1988 году Нобелевскую премию с формулировкой «За открытие важных принципов лекарственной терапии». Он воздействовал на синтез пуриновых нуклеотидов, входящих в состав нуклеиновых кислот. Позднее в медицинскую практику были внедрены и другие антиметаболиты, например гидроксимочевина, подавляющая метаболизм пиримидиновых нуклеотидных оснований.
В целом антиметаболиты обладают выраженным противоопухолевым действием и эффективны при ряде злокачественных новообразований. Сейчас исследователи уточняют клеточные механизмы действия известных антиметаболитов и ведут направленный поиск новых соединений этой группы.
Алкилирующие средства. В основе механизма их действия лежит нарушение целостности нитей ДНК и РНК из-за реакций алкилирования, когда к этим макромолекулам присоединяются алкильные группы. В итоге образуются поперечные сшивки и разрывы ДНК, нарушается процесс репликации, возникают мутации, клетки гибнут. Высокой чувствительностью к этим веществам обладают ядра клеток гиперплазированных (опухолевых) тканей и лимфоидной ткани, поскольку такие клетки делятся чаще и быстрее, чем нормальные.
Как уже отмечалось, применение алкилирующих средств в онкологии началось в 1943 году с хлорметина. Десять лет спустя к азотистым аналогам иприта добавился диметансульфонат 1,4-бутандиола (бусульфан, миелосан) – производное метасульфоновой кислоты, которое применил для лечения ХМЛ известный британский гематолог Дэвид Гальтон (1922‒2006). К этой же группе препаратов относят и комплексные соединения платины (в том числе цисплатин), несмотря на отсутствие у них активных алкильных групп, просто механизм действия аналогичен – нарушение целостности нитей ДНК. В современной практике при гемобластозах применяется целый ряд алкилирующих препаратов.
Противоопухолевые антибиотики. Про первый противоопухолевый антибиотик – дактиномицин – я уже упоминал, как и про то, что он лечил лейкозы, лимфомы у мышей, но не у людей. Однако следующий противоопухолевый антибиотик – даунорубицин, выделенный из бактерий Streptomyces peucetius в 1963 году итальянскими и французскими исследователями независимо друг от друга, – хорошо показал себя при лечении лейкозов у людей. А другой антибиотик – блеомицин, выделенный из бактерий Streptomyces verticillus примерно в это же время японским микробиологом Хамао Умэдзавой (1914‒1986), – был включен в схемы лечения лимфомы Ходжкина и неходжкинских лимфом. В дальнейшем скрининг природных соединений привел к открытию целого ряда эффективных противоопухолевых антибиотиков, продуцируемых разными видами микроорганизмов, почвенных грибов или являющихся их синтетическими производными.
Механизм цитотоксического действия противоопухолевых антибиотиков связан с подавлением синтеза нуклеиновых кислот (ДНК и РНК).
Эти препараты применяют при многих злокачественных новообразованиях – различных гематологических опухолях, саркомах мягких тканей, карциномах и других солидных опухолях.
Противоопухолевые средства растительного происхождения. Из названия группы следует, что их действующие вещества изначально выделили из растений. Хотя традиционно эта группа и называется так, но многие ее препараты, например таксол (паклитаксел), обнаруженный в коре тихоокеанского тиса (соединения, выделенные из разных видов тиса, получили название таксанов), уже получают не из растений, а путем бактериального или химического синтеза.
Механизм противоопухолевого эффекта этой группы препаратов заключается в нарушении митоза патологических клеток.
Одни препараты этой группы различным образом воздействуют на микротрубочки, останавливая митоз на начальной стадии. Микротрубочки – это основа митотического аппарата деления клетки, а также важный компонент ее цитоскелета. Они необходимы, в частности, для поддержания пространственной формы клеток и равного распределения хромосом между дочерними клетками при митозе. Микротрубочки пребывают в состоянии постоянной быстрой сборки и разборки. Алкалоиды барвинка (винбластин, винкристин) и их производные связываются с белком тубулином, останавливая сборку микротрубочек, тогда как таксаны активизируют их сборку и стабилизируют микротрубочки, что губительно сказывается на делении клетки из-за образования аномального пучка микротрубочек.
Другие препараты, например топотекан и иринотекан, являющиеся производными камптотецина, о котором уже говорилось, ингибируют специальные ферменты – топоизомеразы, принимающие участие в процессах митоза клеток, тем самым блокируя процесс репликации ДНК и останавливая деление клеток.
Все эти препараты, открытие которых в 1940‒1960-х годах было уже описано выше, вначале применялись по отдельности. Но монотерапия позволяла достичь лишь нестойкого ответа (мутирующие опухолевые клетки приобретали устойчивость к лечению), так что в итоге выздоравливал лишь небольшой процент пациентов. Однако уже в 1950-х годах было обнаружено, что резистентные к одному препарату формы туберкулеза излечивались комбинацией из 2–3 препаратов, а последовавшие за этим опыты по успешному лечению лимфоидного лейкоза мышей путем сочетания препаратов привели к мысли о применении системной комбинированной терапии. Пионерами такого подхода были американские онкологи Эмиль Фрей (1924‒2013), Эмиль Фрейрайх (1927‒2021) и Джеймс Холланд (1925‒2018), применившие в 1961 году схему комбинированной терапии VAMP, включавшую в себя использование винкристина, аметоптерина (метотрексата), 6-меркаптопурина и преднизолона для лечения острого лейкоза у детей. С появлением разнообразного арсенала химиотерапевтических агентов исследователи сосредоточились на выработке стратегии разделения пациентов по группам риска и применении интенсифицированных режимов с использованием различных комбинаций препаратов для определенных групп пациентов.
На сленге пациентов такой вид лечения называется «химия», независимо от того, что входит в схему лечения. И всем хорошо известны побочные эффекты («побочки») этой самой «химии»: выпадение волос (алопеция), аллергические реакции, проблемы с кожей и желудочно-кишечным трактом, сопровождающиеся тошнотой и рвотой, а для некоторых препаратов – кардиотоксичность (повреждение сердечной мышцы), нефротоксичность (нарушение функций почек), нейротоксичность (головная боль, неврологические расстройства) и т. д. Когда человеку предстоит принимать новое лекарство, он обычно задает вопросы о безопасности и побочных эффектах. Врачи много объясняют, приводят примеры и статистику, но для некоторых пациентов побочные эффекты могут стать весомой причиной для отказа от терапии.
Стоит ли отказываться от терапии, зная, что лечение будет мучительным? Есть пациенты, которые сталкиваются с таким вопросом, особенно если болезнь диагностирована на поздней стадии. Недавно я посмотрел фильм «Во всё тяжкое» с Джонни Деппом: у его героя обнаруживают неоперабельный рак легких, он отказывается от терапии и живет на полную катушку. И это наводит на раздумья. Действительно, в онкологии есть такие заболевания, когда, взвесив все за и против, и пациент, и врач сходятся на том, что от лечения стоит отказаться. В таком случае может назначаться паллиативная терапия, то есть лекарства, которые улучшат качество жизни последних месяцев.
В гематологии же чаще всего болезни поддаются лечению: благодаря терапии удается улучшить качество жизни и заметно увеличить ее продолжительность. С заболеваниями крови можно сражаться в любой стадии их развития, и, если пациент спрашивает у меня совета, я всегда рекомендую лечение. Бывают совершенно фантастические случаи (и я рассказывал о них в этой книге), когда человек уже был готов опустить руки – а болезнь отступала и все заканчивалось хорошо. Про себя, по крайней мере, я могу сказать, что если заболею, то буду лечиться – и надеяться на выздоровление.
Вернемся же к побочным эффектам химиотерапии: связаны они с тем, что лекарство действует не только на болезнь, но и на нормально протекающие в организме процессы. По этому признаку лекарства можно поделить по избирательности. Избирательность в данном случае – это специфичность воздействия лечебной молекулы на процессы и реакции, лежащие в основе патологических изменений. Таргетная терапия с применением лекарств, направленных на конкретную молекулярную цель, является основой современной медицины. Чем выше избирательность препарата, тем меньше его способность влиять на здоровую часть организма.
Препараты можно сравнить с человеком, пришедшим на завтрак по типу шведского стола. Гурман станет поедать только те блюда, которые выберет в ходе пристального изучения предложенного, и будет почти незаметен в ресторане гостиницы. Через некоторое время в зал ворвется обжора, который шумно накинется на еду и примется поглощать все без разбора. При этом он разольет по столу кофе, разбросает хлопья для завтрака и начнет громко нахваливать поваров. Разница между едоками будет очевидна всем окружающим, особенно официантам, которым предстоит разбираться с последствиями нападения на ничего не подозревающий стол с завтраком.
Так же и лекарства отличаются друг от друга. Одни действуют аккуратно и точно, а другие врываются в наш организм ураганом, выполняя свою задачу, но оставляя после себя заметные разрушения в виде побочных эффектов. Чем ниже избирательность лекарства, чем в большее число нормальных процессов оно способно вмешаться, тем опаснее препарат для организма. Использование «неразборчивых» медикаментов грозит более высоким риском осложнений.
По этой классификации химиопрепараты относятся к неаккуратным обжорам. Очень часто химиотерапевтические агенты назначаются не в монорежиме, а в комбинациях, что значительно повышает риск побочных эффектов. Эти лекарства не разбираются, где опухолевая клетка, а где здоровая. Итогом их применения становится нарушение митоза в здоровых клетках организма. Под раздачу попадают клетки с самыми высокими темпами деления, например кроветворные клетки и клеточные элементы крови – тромбоциты, лейкоциты, предшественники эритроцитов. По этой причине среди побочных эффектов некоторых химиопрепаратов, например, значатся кровотечения из-за недостатка тромбоцитов, подавление иммунитета из-за дефицита лейкоцитов и анемия (уменьшение количества эритроцитов).
Иногда вмешательство в патологические процессы сопровождается нарушениями нормально протекающих процессов, и для этого были разработаны лекарственные методы повышения переносимости противоопухолевых препаратов. Так, высокоэффективные противорвотные средства (блокаторы серотониновых 5-НТ3-рецепторов) позволяют уменьшить тошноту и рвоту, лекарственные препараты колониестимулирующих факторов – ускорить созревание нейтрофилов и снизить риск развития нейтропении. Однако полностью справиться с побочными эффектами пока не получается.
Несмотря на большое количество «побочек», различные комбинации химиопрепаратов до сих пор остаются одним из самых эффективных методов лечения гематологических заболеваний, позволяющим в большинстве случаев добиваться хороших ответов и значительного увеличения продолжительности жизни.
Применяют противоопухолевые средства только по назначению врача-онколога. В зависимости от особенностей заболевания и его течения, эффективности и переносимости химиотерапии может меняться схема назначения, дозы, вводиться сочетание с другими препаратами и т. д.
Назад: Глава 25 Методы лечения опухолевых заболеваний крови
Дальше: Глава 27 «Пули против рака» – ингибиторы протеинкиназ

