Книга: Инфекционные болезни
Назад: Тиф возвратный эпидемический
Дальше: Глава 9 Инфекции наружных покровов
Чума
Чума (pestis) – острое природно-очаговое трансмиссивное заболевание, вызываемое Y. pestis, характеризуется лихорадкой, тяжелой интоксикацией, серозно-геморрагическим воспалением в лимфатических узлах, легких и других органах, а также сепсисом. Является особо опасной карантинной (конвенционной) инфекцией, на которую распространяются «Международные медико-санитарные правила».
Исторические сведения. Эпидемии чумы отмечались задолго до нашей эры. Название болезни происходит от арабского слова «джумба» (боб) и обусловлено частым и характерным симптомом болезни – увеличением воспаленных лимфатических узлов, напоминающих по внешнему виду бобы.
В истории человечества известны три пандемии чумы. Первая пандемия, вошедшая в летопись под названием «юстинианова чума», свирепствовала в странах Ближнего Востока, Европы в VI в. и вызвала гибель около 100 млн человек. Вторая пандемия под названием «черная смерть» была занесена из Азии в Европу в 1348 г. Она унесла более 50 млн человеческих жизней, что составило свыше 1/4 населения Европы. В Венеции, потерявшей 3/4 своих жителей, впервые в истории были введены карантинные меры (guarantena, от qaranta giorni – сорок дней), т.е. все прибывающие в город путешественники и торговцы задерживались на 40 дней, чтобы предохранить город от заноса чумы. В 1352г. чума стала распространяться в России. В первые десятилетия опустошительной эпидемии преобладала легочная чума. В дальнейшем в связи с увеличением заболеваемости бубонной формой чумы существенно изменился характер эпидемий, снизилась смертность. Третья пандемия началась в 1894 г. в Кантоне и Гонконге. За последующее десятилетие чумой было охвачено 87 портовых городов на всех континентах. Характерной особенностью пандемии явилось то, что чума из пораженных портовых городов не проникла в глубь материков.
Во время этой пандемии, вызвавшей гибель более 87 млн человек, были сделаны крупные открытия, заложившие научные основы борьбы с чумой. Французский ученый А.Иерсен, изучавший этиологию чумы в Гонконге, в 1894 г. выделил микроб чумы от больных, а в 1897 г. от крыс, доказав тем самым, что чума от больной крысы к здоровой и от крысы к человеку передается крысиными блохами. В 1912 г. Д.К.Заболотный установил природную очаговость чумы. В 1926 г. В.А.Хавкиным была разработана эффективная вакцина.
Проведение научно обоснованных противочумных мероприятий в XX в. позволило ликвидировать эпидемии чумы в мире, однако спорадические случаи заболевания ежегодно регистрируют в природных очагах.
Этиология. Возбудитель чумы yersinia pestis относится к роду yersinia семейству Еnterobacteriасеае и представляет собой неподвижную овоидную короткую палочку размером 1,5—0,7 мкм; характерно биполярное окрашивание. Она обладает выраженным полиморфизмом (нитевидные, шарообразные, колбовидные формы), спор и жгутиков не имеет, образует нежную капсулу, грамотрицательна, растет на простых питательных средах при оптимальной температуре 28 °С и рН 7,2. Для ускорения роста колоний добавляют стимуляторы – гемолизированную кровь, сульфит натрия.
Y. pestis содержит термостабильный соматический, термолабильный капсульный и около 30 других антигенов. Факторы патогенности – экзо– и эндотоксины. Иерсинии продуцируют ферменты агрессии – гиалуронидазу, коагулазу, гемолизин, фибринолизин и др.
Устойчивость возбудителя чумы вне организма зависит от характера воздействующих на него факторов внешней среды. С понижением температуры увеличиваются сроки выживания бактерий. При температуре –22 °С бактерии сохраняют свою жизнеспособность в течение 4 мес. При 50—70 °С микроб гибнет через 30 мин, при 100 °С – через 1 мин. Обычные дезинфектанты в рабочих концентрациях (сулема 1:1000, 3—5 % раствор лизола, 3 % карболовая кислота, 10 % раствор известкового молока) и антибиотики (стрептомицин, левомицетин, тетрациклины) оказывают губительное действие на Y. pestis.
Эпидемиология. Различают природные, первичные («дикая чума») и синантропные (антропургические) очаги чумы («городская», «портовая», «корабельная», «крысиная»).
Природные очаги болезней сложились в древние времена. Их становление не было связано с человеком и его хозяйственной деятельностью. Циркуляция возбудителей в природных очагах трансмиссивных болезней происходит между дикими животными и кровососущими членистоногими (блохами, клещами). Человек, попадая в природный очаг, может подвергнуться заболеванию через укусы кровососущих членистоногих – переносчиков возбудителя, при непосредственном контакте с кровью инфицированных промысловых животных.
Выявлено около 300 видов и подвидов грызунов-носителей чумного микроба. Основная роль в хранении Y. pestis принадлежит сусликам, суркам, песчанкам, хомякам, полевкам, крысам и морским свинкам. У грызунов, впадающих в спячку в холодное время года, чума протекает в хронической форме; они остаются источником латентной инфекции в межэпидемический период.
Синантропные очаги чумы являются вторичными. В них источниками и хранителями возбудителя служат домовые виды крыс и мышей. Из крыс основное эпидемическое значение принадлежит трем подвидам: серой крысе, или пасюку (Rattus norvegiens), черной крысе (Rattus rattus) и александрийской, или египетской, крысе (Rattus alexandrinus).
У крыс и мышей чумная инфекция нередко протекает в хронической форме или в виде бессимптомного носительства возбудителя.
Синантропные очаги чумы выявлены в местностях между 35° с.ш. и 35° ю.ш. В населенных пунктах во время чумных эпизоотии среди грызунов установлена зараженность некоторых видов домашних животных: кошек, верблюдов и др.
В обоих типах очагов чумы специфическими переносчиками возбудителя служат блохи. Спонтанное инфицирование Y. pestis обнаружено более чем у 120 видов и подвидов блох. Наиболее активными переносчиками возбудителей чумы являются крысиная блоха, блоха человеческих жилищ и сурчиная блоха.
Интенсивное заражение блох чумными бактериями происходит перед гибелью животного в период выраженной бактериемии. Покидая труп грызуна, «бесхозяинная» блоха, не находя нового хозяина среди однородного биологического вида, переходит на человека и заражает его при укусе. Инфицированная блоха становится заразной только после размножения чумных бактерий в ее преджелудке, где они образуют студенистую массу, полностью заполняющую просвет преджелудка («чумной блок»). Такие блохи пытаются сосать кровь, но «чумной блок» препятствует продвижению крови в желудок, вследствие чего кровь и смытые ею бактерии силой обратного толчка возвращаются («отрыгиваются») в ранку на месте укуса блохи.
Заражение человека чумой происходит несколькими путями: трансмиссивным – через укусы инфицированных блох, контактным —при снятии шкурок инфицированных промысловых грызунов и разделке мяса зараженных верблюдов; алиментарным – при употреблении в пищу продуктов, обсемененных бактериями; аэрогенным – от больных легочной формой чумы.
Восприимчивость людей к чуме высокая. Индекс заболеваемости приближается к единице. В развитии эпидемии чумы можно выделить три этапа. Первый этап характеризуется передачей возбудителя по схеме: грызун – блоха – грызун. На втором этапе в эпидемическую цепь оказывается включенным человек. У людей сначала возникают случаи бубонной чумы, в некоторых случаях осложненные развитием легочных поражений (вторичная легочная чума). Третий этап характеризуется аэрогенным путем заражения от человека к человеку, инфекция получает распространение как антропоноз.
Таким образом, наиболее опасны для окружающих больные легочной формой чумы. Больные другими формами могут представлять угрозу при наличии достаточной популяции блох.
В настоящее время заболеваемость людей чумой относительно низкая. Активные энзоотические очаги сохраняются в Юго-Восточной Азии, Африке и Америке.
Патогенез и патологоанатомическая картина. Патогенез (и клиническая форма) чумы в значительной мере определяется механизмом передачи инфекции. Первичный аффект в месте внедрения, как правило, отсутствует. С током лимфы чумные бактерии заносятся в ближайшие регионарные лимфатические узлы, где происходит их размножение. Возбудители фагоцитируются нейтрофилами и мононуклеарными клетками. Но фагоцитоз оказывается незавершенным, что затрудняет запуск иммунного процесса. В лимфатических узлах развивается серозно-геморрагическое воспаление с образованием бубона. Утрата лимфатическим узлом барьерной функции приводит к генерализации процесса. Бактерии гематогенно разносятся в другие лимфатические узлы, внутренние органы, вызывая воспаление (вторичные бубоны и гематогенные очаги). Размножение иерсинии во вторичных очагах инфекции приводит к возникновению септических форм чумы, для которых характерны развитие инфекционно-токсического шока и образование септикопиемических очагов в различных внутренних органах. Гематогенный занос чумных бактерий в легочную ткань приводит к развитию вторичной чумной пневмонии с образованием обильного серозно-геморрагического экссудата, содержащею огромное количество иерсинии.
Септическая форма чумы сопровождается экхимозами и кровоизлияниями в кожу, слизистые и серозные оболочки, стенки крупных и средних сосудов. Типичны тяжелые дистрофические изменения сердца, печени, селезенки, почек и других внутренних органов.
Клиническая картина. Инкубационный период чумы составляет 2—6 дней. Заболевание, как правило, начинается остро, с сильного озноба и быстрого повышения температуры тела до 39—40 °С. Озноб, чувство жара, миалгии, мучительная головная боль, головокружение – характерные начальные признаки болезни. Лицо и конъюнктивы гиперемированы. Губы сухие, язык отечный, сухой, дрожащий, обложен густым белым налетом (как бы натерт мелом), увеличен. Речь смазанная, неразборчивая.
Типично токсическое поражение нервной системы, выраженное в различной степени: у одних больных отмечается оглушенность, заторможенность, у других развиваются возбуждение, бред, галлюцинации, стремление убежать, нарушается координация движений. При тяжелом течении болезни характерны одутловатость, цианотичность лица, выражающего безнадежность, страдание, ужас.
Рано определяется поражение сердечно-сосудистой системы. Границы сердца расширены, тоны сердца глухие, прогрессивно нарастает тахикардия (до 120—160 уд. в 1 мин), появляются цианоз, аритмия пульса, значительно снижается артериальное давление.
У тяжелобольных отмечаются кровавая или цвета кофейной гущи рвота, жидкий стул со слизью и кровью. В моче находят примесь крови и белок, развивается олигурия.
Печень и селезенка увеличены.
В крови – нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево, СОЭ повышена. Количество эритроцитов и гемоглобина изменяется незначительно.
Помимо общих проявлений чумы, развиваются поражения, присущие различным формам болезни. В соответствии с классификацией Г.П.Руднева (1970) различают следующие клинические формы чумы:
А. Преимущественно локальные формы: кожная, бубонная, кожно-бубонная.
Б. Внутреннедиссеминированные, или генерализованные формы: первично-септическая, вторично-септическая.
В. Внешнедиссеминированные (центральные, чаще с обильной внешней диссеминацией): первично-легочная, вторично-легочная, кишечная. Кишечная форма как самостоятельная большинством авторов не признается.
Описаны стертые, легкие, субклинические формы чумы. Кожная форм а. В месте внедрения возбудителя возникают изменения в виде некротических язв, фурункула, карбункула. Для некротических язв характерна быстрая, последовательная смена стадий: пятно, везикула, пустула, язва. Чумные кожные язвы характеризуются длительным течением и медленным заживлением с образованием рубца. Вторичные кожные изменения в виде геморрагических высыпаний, буллезных образований, вторичных гематогенных пустул и карбункулов могут наблюдаться при любой клинической форме чумы.
Бубонная форма. Важнейшим признаком бубонной формы чумы является бубон – резко болезненное увеличение лимфатических узлов. Бубон, как правило, бывает один, реже происходит развитие двух и более бубонов. Наиболее частые локализации чумных бубонов – паховая, подмышечная, шейная области. Ранний признак формирующегося бубона – резкая болезненность, вынуждающая больного принимать неестественные позы. Маленькие бубоны обычно более болезненны, чем большие. В первые дни на месте развивающегося бубона можно прощупать отдельные лимфатические узлы, в дальнейшем они спаиваются с окружающей клетчаткой. Кожа над бубоном напряжена, приобретает красный цвет, кожный рисунок сглаживается. Лимфангитов не наблюдается. По окончании стадии формирования бубона наступает фаза его разрешения, протекающая в одной из трех форм: рассасывание, вскрытие и склерозирование.
При своевременно начатом антибактериальном лечении чаще наступает полное рассасывание бубона в течение 15—20 дней или его склерозирование.
По тяжести клинического течения первое место занимают шейные бубоны, затем подмышечные и паховые. Наибольшую опасность представляют подмышечные в связи с угрозой развития вторичной легочной чумы.
При отсутствии адекватного лечения летальность при бубонной форме колеблется от 40 до 90 %. При рано начатом антибактериальном и патогенетическом лечении смертельный исход наступает редко.
Первично-септическая форма. Развивается бурно после короткой инкубации, составляющей от нескольких часов до 1—2 сут. Больной ощущает озноб, резко повышается температура тела, появляются сильная головная боль, возбуждение, бред. Возможны признаки менингоэнцефалита. Развивается картина инфекционно-токсического шока, быстро наступает кома. Продолжительность заболевания от нескольких часов до трех суток. Случаи выздоровления крайне редки. Больные погибают при явлениях тяжелейшей интоксикации и выраженного геморрагического синдрома, нарастающей сердечно-сосудистой недостаточности.
Вторично-септическая форма. Является осложнением других клинических форм инфекции, характеризуется исключительно тяжелым течением, наличием вторичных очагов, бубонов, выраженных проявлений геморрагического синдрома. Прижизненная диагностика этой формы затруднена.
Первично-легочная форма. Наиболее тяжелая и эпидемиологически наиболее опасная форма. Различают три основных периода болезни: начальный, период разгара и сопорозный (терминальный) период. Начальный период характеризуется внезапным повышением температуры, сопровождающимся резким ознобом, рвотой, сильной головной болью. В конце первых суток болезни появляются режущие боли в груди, тахикардия, одышка, бред. Кашель сопровождается выделением мокроты, количество которой значительно варьируется (от нескольких «плевков» при «сухой» чумной пневмонии до огромной массы при «обильной влажной» форме). Вначале мокрота прозрачная, стекловидная, вязкая, затем она становится пенистой, кровянистой и, наконец, кровавой. Жидкая консистенция мокроты – типичный признак легочной чумы. С мокротой выделяется огромное количество чумных бактерий. Физикальные данные весьма скудны и не соответствуют общему тяжелому состоянию больных. Период разгара болезни продолжается от нескольких часов до 2—3 сут. Температура тела остается высокой. Обращают на себя внимание гиперемия лица, красные, «налитые кровью» глаза, резкая одышка и тахипноэ (до 50—60 дыханий в 1 мин). Тоны сердца глухие, пульс частый, аритмичный, артериальное давление снижено. По мере нарастания интоксикации угнетенное состояние больных сменяется общим возбуждением, появляется бред.
Терминальный период болезни характеризуется исключительно тяжелым течением. У больных развивается сопорозное состояние. Нарастает одышка, дыхание становится поверхностным. Артериальное давление почти не определяется. Пульс учащенный, нитевидный. На коже появляются петехии, обширные кровоизлияния. Лицо приобретает синюшность, а затем землисто-серый цвет, нос заострен, глаза запавшие. Больной испытывает страх смерти. Позже развиваются прострация, кома. Смерть наступает на 3—5-е сутки болезни при нарастающей циркуляторной недостаточности и, нередко, отеке легких.
Вторично-легочная форма. Развивается как осложнение бубонной чумы, клинически сходна с первично-легочной.
Чума у вакцинированных больных. Характеризуется удлинением инкубационного периода до 10 дней и замедлением развития инфекционного процесса.
В течение первых и вторых суток заболевания лихорадка субфебрильная, общая интоксикация выражена нерезко, состояние больных удовлетворительное. Бубон небольших размеров, без выраженных проявлений периаденита. Однако симптом резкой болезненности бубона всегда сохраняется. Если эти больные в течение 3—4 дней не получают лечение антибиотиками, то дальнейшее развитие заболевания ничем не будет отличаться от клинических симптомов у невакцинированных больных.
Прогноз. Почти всегда серьезный.
Диагностика. Распознавание чумы вызывает затруднение при выявлении спорадических случаев, которые могут предшествовать эпидемической вспышке. При развитии лихорадки, лимфаденита, пневмонии у лиц, находящихся в энзоотическом очаге чумы, требуется тщательное направленное обследование.
Решающую роль в распознавании чумы играют методы лабораторной диагностики (бактериоскопический, бактериологический, биологический и серологический), проводимые в специальных лабораториях, работающих в соответствии с инструкциями о режиме работы противочумных учреждений. Для лабораторной диагностики чумы используют пунктаты из бубона, содержимое везикул, пустул, карбункулов, отделяемое из язв, мокроту, материал из зева, отечную жидкость, кровь, мочу, рвотные массы; пробы воздуха из комнаты больного, смывы с предметов и т.д. Кроме того, исследуют секционный патологоанатомический материал: кусочки органов, взятые от трупов людей, верблюдов, грызунов, а также эктопаразитов. Специфическое свечение бактерий при использовании метода флюоресцирующих антител, наличие в препаратах, окрашенных по Граму, овоидных биполярных палочек с учетом клинических, патологоанатомических, эпидемиологических и эпизоотологических данных позволяет поставить предварительный диагноз чумы и проводить соответствующие мероприятия до выделения возбудителя.
В практике лабораторной диагностики чумы широко применяются серологические методы: ИФА, РНГА, РНАт, РНАг, РТНГА. Важное значение имеет постановка биологической пробы на морских свинках и белых мышах, позволяющая увеличить вероятность выделения культур и облегчить их идентификацию.
Дифференциальная диагностика. Кожную форму чумы следует дифференцировать от сибирской язвы, бубонную форму – от острого гнойного лимфаденита, лимфогранулематоза, доброкачественного лимфоретикулеза, туляремии. Септическая форма чумы может напоминать сепсис, молниеносную форму менингококкемии, гипертоксическую форму гриппа, которые сопровождаются развитием инфекционно-токсического шока и геморрагическим синдромом. Легочную форму чумы следует дифференцировать от легочной формы сибирской язвы, крупозной пневмонии, малярии, сыпного тифа, поражения легких при туляремии, сапе, гриппе.
Лечение. Больные чумой подлежат строгой изоляции и обязательной госпитализации. Основная роль в этиотропном лечении принадлежит антибиотикам – стрептомицину, препаратам тетрациклинового ряда, левомицетину, назначаемым в больших дозах.
Стрептомицин эффективен при всех формах чумы. При бубонной форме его вводят в дозах 0,5—1 г 3 раза в сутки, больным с септической и легочной формами чумы – по 1 г 4 раза в сутки в течение первых 4—5 дней, а с 5—6-го дня переходят на трехразовое введение по 0,75 г.
Окситетрациклин вводят внутримышечно по 0,2 г 6 раз в сутки. Используют также доксициклин, метациклин, морфоциклин.
Левомицетин назначают в суточной дозе 6—8 г со снижением дозы после нормализации температуры.
При лечении больных легочными и септическими формами чумы антибиотики тетрациклинового ряда сочетают со стрептомицином, дигидрострептомицином, пасомицином, аминогликозидами. При комбинированном лечении препараты вводят 3 раза в сутки, доза стрептомицина снижается до 0,25—0,5 г. Курс лечения антибиотиками больных всеми формами чумы составляет не менее 7—10 сут.
Для повышения эффективности антибиотикотерапии и целенаправленного действия на чумных микробов используют определение чувствительности возбудителей чумы к антибиотикам.
Наряду с антибактериальным лечением проводят дезинтоксикационную патогенетическую терапию, включающую введение дезинтоксикационных жидкостей (полиглюкин, реополиглюкин, гемодез, неокомпенсан, альбумин, сухая или нативная плазма, стандартные солевые растворы), мочегонных средств (фуросемид, или лазикс, маннитол и др.) – при задержке жидкости в организме, глюкокортикостероидов, сосудистых и дыхательных аналептиков, сердечных гликозидов, витаминов.
В связи с медленным рассасыванием чумных бубонов рекомендуется «местное» назначение антибиотиков, т.е. внутрь бубона (стрептомицин по 0,5 г и др.). После 3—5 введений антибиотиков происходит более быстрое рассасывание бубонов. Местно также применяют различные мазевые повязки.
По окончании лечения через 2—6 дней обязательно производят трехкратный бактериологический контроль пунктата из бубонов, мокроты, слизи дыхательных путей и каловых масс.
Выписка больных из стационара производится при полном клиническом выздоровлении и отрицательных результатах бактериологического контроля.
Профилактика. В России, а ранее в СССР была создана единственная в мире мощная противочумная система, которая осуществляет профилактические и противоэпидемические мероприятия в природных очагах чумы.
Профилактика включает следующие мероприятия:
а) предупреждение заболеваний людей и возникновения вспышек в природных очагах;
б) предупреждение инфицирования лиц, работающих с зараженным или подозрительным на зараженность чумой материалом;
в) предупреждение завоза чумы на территорию страны из-за рубежа.
Система мероприятий против заноса и распространения чумы включает меры по санитарной охране границ и территории страны от особо опасных карантинных инфекций, предусмотренные правилами по предупреждению конвенциальных инфекций, специальными приказами Министерства здравоохранения.
Мероприятия, направленные на предупреждение завоза инфекции из-за рубежа, предусмотрены специальными «Международными санитарными правилами».
Меры по предупреждению заражения людей чумой в энзоотичных районах, лиц, работающих с особо опасными инфекциями, а также предупреждение выноса инфекции за пределы очагов в другие районы страны осуществляются противочумными и другими учреждениями здравоохранения.
Лица, подозрительные на заболевание чумой, должны быть немедленно изолированы и госпитализированы. В очаге инфекции вводится карантин. Подвергшиеся риску заражения подлежат изоляции и наблюдению в течение 6 дней, а также экстренной профилактике (превентивному лечению). При экстренной профилактике препаратом выбора является стрептомицин (по 0,5 г 2 раза в день).
Работа в госпиталях для больных чумой должна проводиться в специальных защитных костюмах с соблюдением строгого порядка надевания и снятия защитного костюма.
В очагах чумы по эпидемическим показаниям в первую очередь проводится профилактическая вакцинация контингентов высокого риска заражения (пастухи, охотники, геологи, работники противочумных учреждений). С этой целью применяется живая вакцина, приготовленная из штамма EV чумных бактерий. Вакцину применяют накожно или внутрикожно. После вакцинации создается относительный иммунитет продолжительностью до 6 мес.
Заболеваемость в результате вакцинации снижается, но случаи чумы среди привитых возможны.
В очагах чумы необходимо постоянно проводить санитарно-просветительную работу среди населения.
Туляремия
Син.: чумоподобная болезнь, кроличья лихорадка
Туляремия (tularemia) – облигатный природно-очаговый зооноз, протекающий с интоксикацией, лихорадкой, развитием лимфаденита и поражением различных органов.
Исторические сведения. В 1910 г. Ч. Мак-Кой, обследуя природный очаг чумы в болотистой местности Туляре в Калифорнии, обнаружил у сусликов чумоподобное заболевание. Он же и Ч.Чепин в 1911 г. выделили от больных сусликов возбудителя этой болезни под названием Bacterium tularense (по месту эпизоотии в районе озера Туляре). Вскоре выяснилось, что люди восприимчивы к данной инфекции, получившей по предложению И.Френсиса (1921) название туляремии.
Заболевание туляремией животных и человека регистрируется во многих странах Америки, Европы и Азии, в том числе и в СНГ.
Этиология. Возбудитель туляремии francissella tularense (bacterium tularense) относится к роду francissella, семейству Вrucellасеае. Выделяют три подвида туляремийного микроба: а) неарктический (американский); б) среднеазиатский; в) голарктический (европейско-азиатский). Неарктический подвид бактерий в отличие от остальных характеризуется высокой патогенностью для человека и лабораторных животных.
Туляремийные бактерии – мелкие кокковидные и палочковидные клетки размером 0,2—0,5 мм, грамотрицательны. Содержат два антигенных комплекса: оболочечный (Vi) и соматический (О). С оболочечным антигенным комплексом связаны вирулентность и иммуногенные свойства возбудителя. Они культивируются на желточных или агаровых средах с добавлением цистеина, кроличьей дефибринированной крови и других питательных веществ. Из лабораторных животных повышенной чувствительностью к туляремии обладают белые мыши и морские свинки.
Во внешней среде возбудитель сохраняется длительное время, особенно при низкой температуре: в зерне и соломе при температуре ниже 0° – до 6 мес, в замерзших трупах животных – до 8 мес. Кипячение убивает бактерии в течение 1—2 мин; лизол, хлорамин и хлорная известь – за 3—5 мин.
Эпидемиология. Для туляремии как одной из природно-очаговых зоонозных инфекций характерна триада биоценоза: возбудитель, резервуары возбудителя, переносчики – кровососущие насекомые. Природные очаги встречаются во всех равнинных ландшафтных зонах, местами в горах, чаще в умеренном поясе северного полушария. В этих очагах установлено свыше 60 видов диких животных – источников инфекции. Из отряда грызунов главными источниками инфекции являются полевка обыкновенная, водяная крыса, домовая мышь, зайцы; из домашних животных – овцы, свиньи, крупный рогатый скот. Переносчиками возбудителя туляремии служат кровососущие членистоногие: иксодовые и гамазовые клещи, слепни, комары, блохи.
Для туляремии характерна множественность путей передачи инфекции человеку: контактный – при контакте с больными грызунами или их выделениями; алиментарный – при употреблении пищевых продуктов и воды, инфицированных выделениями грызунов; воздушно-пылевой – при обработке зараженных зерновых продуктов, фуража; трансмиссивный – путем инокуляции возбудителя кровососущими членистоногими.
Чаще всего заболевания туляремией наблюдаются в сельскохозяйственных районах, примыкающих к поименно-болотным очагам этой инфекции. В условиях городов чаще заболевают лица, выезжающие на охоту и рыбную ловлю в эндемичные очаги, а также рабочие боен, домашние хозяйки. Восприимчивость людей к туляремии не зависит от возраста. Лица, перенесшие заболевание, приобретают стойкий иммунитет.
Патогенез и патологоанатомическая картина. Возбудитель туляремии проникает в организм человека через кожу (даже внешне не поврежденную), слизистые оболочки глаз, дыхательные пути и желудочно-кишечный тракт. Способ проникновения возбудителя, его патогенность, доза и иммунобиологические реакции макроорганизма определяют развитие соответствующей клинической формы болезни. Вслед за внедрением возбудителя (с развитием нередко первичного аффекта в месте входных ворот) следует его лимфогенное распространение. Занос туляремийных бактерий в регионарные лимфатические узлы и их размножение вызывают воспалительные явления лимфаденит. Гибель бактерий сопровождается высвобождением эндотоксина, который усиливает развитие местного патологического процесса, а при поступлении в кровь вызывает интоксикацию организма. Если барьерная функция лимфатического аппарата оказывается нарушенной, туляремийные бактерии проникают в кровь (бактериемия) и распространяются по всему организму. Возникает генерализация инфекции со специфическими поражениями паренхиматозных органов (селезенка, печень, легкие) и аллергизацией организма, имеющей большое значение в патогенезе туляремии.
В пораженных внутренних органах и лимфатических узлах формируются специфические туляремийные гранулемы бело-желтого цвета диаметром 1—4 мм. При микроскопии в центре гранулем выявляются участки некроза, окруженные эпителиоидными клетками и валом лимфоидных элементов с примесью зернистых лейкоцитов. По внешнему виду туляремийные гранулемы сходны с туберкулезными; со временем они подвергаются некрозу и замещаются соединительной тканью. Наиболее демонстративно гранулематозный процесс выражен в регионарных лимфатических узлах, где развивается первичный лимфаденит (бубон). При нагноении и вскрытии бубона на коже образуется длительно не заживающая язва.
Во вторичных бубонах, возникающих при генерализации, гранулематозные и некротические изменения не сопровождаются нагноением.
Клиническая картина. Инкубационный период при туляремии составляет в среднем 3—7 дней. В преобладающем большинстве случаев заболевание начинается остро, внезапно, без продрома. Возникает озноб, температура тела повышается до 38—40 °С. В дальнейшем она часто приобретает ремиттирующий или интермиттирующий характер. Развиваются упорная головная боль, головокружение, мышечные боли, слабость.
Лицо больного гиперемировано и пастозно. Отмечаются инъекция сосудов склер и гиперемия конъюнктив. На слизистой оболочке рта могут быть точечные кровоизлияния, язык обложен. Иногда встречается экзантема – эритематозная, макулопапулезная, розеолезная или петехиальная. Развиваются лимфадениты, локализация которых зависит от клинической формы туляремии (входных ворот инфекции).
Отмечаются относительная брадикардия и умеренная артериальная гипотензия. У части больных на 3—5-й день болезни возникает сухой кашель. У большинства больных выявляют раннее увеличение печени (со 2-го дня) и селезенки (с 5—8-го дня).
В периферической крови в первые дни болезни наблюдаются нормо– или умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ. В дальнейшем гематологические изменения выражены более отчетливо: лейкопения, умеренный сдвиг лейкоцитарной формулы влево, лимфоцитоз и моноцитоз, увеличена СОЭ.
Осложнения в виде нагноений существенно меняют гемограмму.
Длительность лихорадочного периода при туляремии от 5—7 до 30 дней. Общая продолжительность заболевания в большинстве случаев 16—18 сут.
Клинические формы туляремии различают по локализации процесса:
I. Туляремия с поражением кожи, слизистых оболочек и лимфатических узлов (бубонная, язвенно-бубонная, глазо-бубонная, ангинозно-бубонная).
II. Туляремия с преимущественным поражением внутренних органов (легочная, абдоминальная и др.).
III. Генерализованная форма.
По длительности течения выделяют острую, затяжную, рецидивирующую; по тяжести – легкую, средней тяжести и тяжелую формы.
Бубонная форма туляремии возникает обычно при проникновении инфекции через кожу и проявляется воспалением регионарных лимфатических узлов, где накапливается возбудитель. Бубоны бывают одиночными и множественными. Наиболее часто поражаются подмышечные, паховые и бедренные лимфатические узлы. На 2—3-й день болезни в области лимфатического узла, где развивается бубон, появляется отчетливая болезненность. В последующие дни узел заметно увеличивается, достигая размеров от 2—3 до 8—10 см. Болезненность бубона уменьшается. Окружающая его подкожная клетчатка незначительно вовлекается в воспалительный процесс. Бубоны отчетливо контурируются. Над бубоном кожа не спаяна с ним и длительное время сохраняет нормальную окраску.
Эволюция бубонов различна. У половины больных они медленно (1—4 мес) рассасываются и лимфатические узлы приобретают нормальный вид. В других случаях через 3—4 нед и позже туляремийные бубоны нагнаиваются, размягчаются, кожа над ними становится отечной, затем прорывается и гной через свищ выходит наружу. Гной бубонов относительно густой, молочно-белого цвета, без запаха. Туляремийные бактерии обнаруживаются в нем на протяжении 3 нед. Заживление туляремийного свища протекает медленно с образованием рубцов. Иногда наступает склерозирование бубонов.
При язвенно-бубонной форме туляремии на месте внедрения возбудителя развивается первичный аффект. При этом с 1-го по 7-й день последовательно появляются пятно, папула, везикула, пустула, кратерообразная малоболезненная язва с приподнятыми краями. Язва покрывается темной корочкой со светлым шелушащимся ободком «кокардой». Иногда имеется местный лимфангит. Поражение регионарных лимфатических узлов (лимфаденит) протекает по типу первичных бубонов.
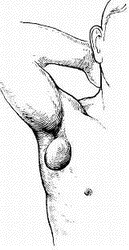
Рис. Подмышечный бубон при туляремии (по Г.П.Рудневу).
Глазо-бубонная форма развивается при попадании возбудителя на слизистую оболочку глаз. Для нее характерны резко выраженный конъюнктивит с гиперплазией фолликулов и эрозивно-язвенные изменения на слизистых оболочках пораженного глаза, сопровождающиеся выделением густого желтоватого гноя. Роговица редко вовлекается в патологический процесс. Общее состояние больных обычно тяжелое, течение заболевания длительное.
Ангинозно-бубоиная форма туляремии возникает при проникновении возбудителей с инфицированными пищевыми продуктами и водой. Наряду с симптомами общего характера выявляются умеренные боли в горле, затруднение глотания, гиперемия зева. Миндалины увеличены, отечны, серовато-белого цвета, с некротическими налетами, спаяны с подлежащей клетчаткой. Эти налеты с трудом снимаются и напоминают таковые при дифтерии, но не распространяются за пределы миндалин. Глубокие некротические поражения значительно разрушают миндалины и приводят к их рубцеванию. Как правило, поражается одна миндалина. У больных появляются шейные, околоушные, подмышечные бубоны, которые спустя длительное время могут нагнаиваться.
Абдоминальная форма туляремии обусловлена воспалительным процессом в мезентериальных лимфатических узлах. Одновременно с симптомами интоксикации возникают схваткообразные и постоянные боли в животе, тошнота, повторная рвота, анорексия. При объективном исследовании выявляют болезненность в области пупка и нередко симптомы раздражения брюшины. У худощавых субъектов иногда пальпируются увеличенные мезентериальные лимфатические узлы. Увеличены печень и селезенка.
Легочная форма туляремии развивается вследствие воздушно-пылевого пути передачи. В этом случае заболевание может протекать в двух вариантах: бронхитическом и пневмоническом.
Бронхитический вариант, при котором поражаются лимфатические узлы грудной клетки (бронхиальные, паратрахеальные, медиастинальные), сопровождается умеренно выраженными признаками интоксикации, загрудинными болями, сухим бронхиальным кашлем. В легких выслушиваются сухие хрипы. Заболевание длится 10—12 дней и заканчивается выздоровлением.
Пневмонический вариант легочной формы туляремии характеризуется острым началом, выраженным синдромом интоксикации и затяжным течением (от 2 мес и более). Больные жалуются на сухой, реже продуктивный кашель, боли в груди. При аускультации выслушивают сухие и влажные мелкопузырчатые хрипы. При рентгенологическом исследовании легких видны увеличенные прикорневые, паратрахеальные и медиастинальные лимфатические узлы. Инфильтративные изменения в ткани легких носят очаговый, реже лобарный или диссеминированный характер.
Туляремийная пневмония отличается склонностью к рецидивам и осложнениям в виде бронхоэктазий, абсцессов, плевритов, гангрены легких, каверны (некротизация в пораженных участках легкого).
Генерализованная форма туляремии наблюдается преимущественно у ослабленных лиц. Развитие ее происходит без местных изменений. Заболевание характеризуется упорной головной болью, общей слабостью, мышечными болями, повышением температуры до 39—40 °С. Характерен неправильно ремиттируюший тип температурной кривой продолжительностью до 3 нед и более.
У больных нередко отмечаются спутанное сознание, бред, низкое артериальное давление, глухость сердечных тонов, лабильность пульса. Уже в первые дни развивается гепатоспленомегалия. В периферической крови наблюдается умеренно выраженный лейкоцитоз со сдвигом формулы влево, СОЭ увеличена до 40—50 мм/ч.
В разгар заболевания у многих больных появляется розеолезная сыпь, которая располагается симметрично на верхних и нижних конечностях, лице, шее, груди (в виде «перчаток», «гетр», «воротника», «маски»). Постепенно сыпь приобретает багрово-медный оттенок, исчезая через 8—12 дней. К осложнениям этой формы туляремии относят вторичную пневмонию, менингит, менингоэнцефалит, инфекционный психоз, миокардиодистрофию, полиартрит, рецидивы болезни.
Прогноз. Как правило, благоприятный. Летальность не превышает 0,5 % и отмечается лишь при генерализованной, легочной и абдоминальной формах туляремии.
Диагностика. В диагностике туляремии, кроме учета клинических симптомов болезни, большое значение имеет тщательно собранный эмидемиологический анамнез.
Для подтверждения диагноза применяют биологический, серологический и аллергологический методы исследования. Биологический метод заключается в заражении лабораторных животных пунктатом бубонов, соскобом со дня язвы, отделяемым конъюнктивы и кровью. Исследуемый материал вводят подопытным животным (морским свинкам, белым мышам) подкожно или внутрибрюшинно. Зараженные животные погибают от туляремии на 3—4-е сутки, иногда позднее. Из органов павших животных делают мазки-отпечатки и посевы на желточную среду для выделения возбудителя. Выделение и идентификация возбудителя туляремии проводятся в специально оборудованных лабораториях отделов особо опасных инфекций.
Из серологических методов исследования применяютРА с использованием туляремийного диагностикума. Диагностическим считается титр 1:100 и выше. Более чувствительной является РПГА.
Ранним методом диагностики служит кожно-аллергическая проба с туляремийным антигеном – тулярином (0,1 мм внутрикожно), которая становится положительной с 3—5-го дня болезни. Учет реакции производят через 24—48 ч.
Дифференциальная диагностика. При дифференциальном диагнозе прежде всего следует исключить чуму в различных ее формах, сибирскую язву, вульгарный лимфаденит, фелиноз, ангину Винцента, дифтерию, туберкулез, грипп, сыпной, брюшной и возвратный тифы, малярию, сепсис и другие заболевания.
Лечение. В лечении больных туляремией ведущая роль принадлежит антибактериальным препаратам. Наиболее эффективны из них стрептомицин, тетрациклин, левомицетин. Стрептомицин назначают по 1 г в сутки в течение 8—10 дней. При легочной и генерализованной формах суточная доза стрептомицина 2 г. Тетрациклин применяют в дозе 2 г в сутки, доксициклин – 0,2 г в сутки, левомицетин – 2—2,5 г в сутки. Лечение проводят длительно. После нормализации температуры тела антибактериальную терапию продолжают еще в течение 5—7 дней.
При затяжном течении показано комбинированное лечение антибиотиками и вакциной. Вакцину вводят виутрикожно, подкожно, внутримышечно или внутривенно в дозе 1—15 млн микробных тел на инъекцию с интервалом 3—5 дней, курс лечения 10—12 инъекций. Однако в последние годы вакцинотерапию не проводят в связи с неблагоприятными аллергическими последствиями.
Наряду с этиотропной проводят патогенетическую терапию, включающую дезинтоксикационные, стимулирующие и гипосенсибилизирующие средства. Осуществляют и местное лечение (компрессы, тепловые процедуры), по показаниям – с использованием хирургических методов (вскрытие нагноившихся бубонов).
Профилактика. Важными мероприятиями в энзоотических очагах туляремии являются истребление грызунов и переносчиков, регулирование численности промысловых грызунов. В системе противотуляремийных мероприятий важное место занимает охрана источников водоснабжения, складских помещений, продовольственных магазинов, жилищ от заселения грызунами.
Особое значение в природных очагах туляремии имеет проведение массовой плановой вакцинации населения живой аттенуированной вакциной. Ее прививают накожно однократно. На 5—7-й и 12—15-й день проверяют прививаемость. При отрицательных результатах прививку повторяют. Вакцинация обеспечивает иммунитет до 5, реже 10 лет.
Вакцинопрофилактику проводят лицам, выезжающим на сезонные работы или отдых в места, энзоотичные по туляремии.
Среди населения районов, неблагополучных по туляремии, необходимо систематически проводить санитарно-просветительную работу.
Малярия
Син.: перемежающаяся болотная лихорадка
Малярия (malaria) – протозойная антропонозная болезнь, характеризующаяся лихорадочными приступами, анемией, увеличением печени и селезенки. Возбудители болезни – малярийные плазмодии – передаются самками комаров рода Anopheles. Очаги болезни наблюдаются преимущественно в странах с теплым и жарким климатом.
Исторические сведения. Малярия – одна из древнейших болезней человека, нашедшая отражение в литературных памятниках многих народов.
В 1696 г. женевский врач Мортон выделил заболевание в самостоятельную форму и обосновал использование с лечебной целью коры хинного дерева, целебные свойства которой, известные еще индейцам Перу, были описаны в 1640 г. Хуаном дель Вето.
В 1717 г. Ланцизи обосновал взаимосвязь возникновения малярии и заболоченной местности (от итал. mala aria – дурной, гнилой воздух).
Возбудитель болезни был описан в 1830 г. французским врачом А.Лавераном и отнесен в 1887 г. И.И.Мечниковым к типу Protozoa. Позднее были описаны различные виды плазмодиев – возбудителей малярии человека и животных. В 1897 г. Р.Росс установил, что плазмодии передаются комарами рода Anopheles. В 1816 г. Ф.И.Гизе получил кристаллический хинин из коры хинного дерева, а в 1820 г. П.Пеллетье и Дж.Каванту выделили алкалоид хинина.
К середине XX столетия были синтезированы эффективные противомалярииные химиопрепараты (например, хлорохин получен Г.Андерзагом и У.Кикутом в 1945 г.) и инсектициды, выяснены основные эпидемиологические закономерности возникновения и распространения малярии, биологические особенности возбудителей болезни, что позволило разработать и принять на VIII пленуме Всемирной ассоциации здравоохранения (ВАЗ) в 1955 г. «Программу глобальной ликвидации малярии», реализация которой способствовала снижению заболеваемости малярией в мире почти вдвое. К 1960 г. малярия в бывшем СССР была практически ликвидирована.
Однако в наиболее активных тропических очагах противомалярийная кампания оказалась малоэффективной, в результате чего заболеваемость малярией в мире возросла, увеличилось число случаев завоза малярии в неэндемичные районы, в том числе в Россию, где стали регистрироваться и местные случаи болезни. Ухудшение маляриологической ситуации в мире потребовало разработки долгосрочной программы ВОЗ по борьбе с малярией.
Этиология. Возбудители малярии относятся к типу protozoa, классу sporozoa, семейству plasmodidae, роду plasmodium.
В естественных условиях у человека малярию вызывают 4 вида простейших: Р. vivax – возбудитель vivax-малярии; Р. malariae – возбудитель 4-дневной малярии; Р. ovale – возбудитель ovale-малярии, Р. falciparum – возбудитель falciparum-, или тропической, малярии.
В редких случаях возможно заражение человека зоонозными видами плазмодиев.
При световой микроскопии препаратов крови с использованием окраски по Романовскому – Гимзе у малярийных плазмодиев различают оболочку, голубого цвета цитоплазму, рубино-красное ядро, пищеварительную вакуоль и на некоторых стадиях развития – золотисто-бурый пигмент, являющийся метаболитом гемоглобина.
Жизненный цикл малярийных паразитов проходит со сменой хозяев и включает две фазы: половую, или спорогонию, которая развивается в организме окончательного хозяина – самках комаров рода Anopheles, и бесполую, или шизогонию, протекающую в организме промежуточного хозяина – человека. В процессе спорогонии из попавших при кровососании половых клеток плазмодиев (гамет) образуются инвазионные стадии – спорозоиты (до 10—50 тыс. из пары гамет). Последние концентрируются в слюнных железах комара, где могут сохраняться до 2—2,5 мес. Продолжительность спорогонии находится в обратной зависимости от температуры воздуха: при понижении ее ниже 15°С спорозоиты не развиваются.
В организме человека малярийный паразит проходит две последовательные фазы шизогонии – тканевую (экзоэритроцитарную) и эритроцитарную.
Тканевая шизогония осуществляется в гепатоцитах с последовательным развитием из спорозоитов тканевых трофозоитов, шизонтов и мерозоитов (до нескольких тысяч из одного спорозоита), последние могут развиваться лишь в эритроцитах. Минимальная продолжительность этой фазы составляет 6 сут у Р. falciparum, 8 сут у Р. vivax, 9 сут у Р. ovale, 15 сут у Р. malariae. Согласно точке зрения К.Шют (1946), А.Я.Лысенко (1959) и др., спорозоиты Р. vivax и Р. ovale фенотипически неоднородны и способны развиваться в гепатоцитах как вскоре после инокуляции («тахоспорозоиты»), так и после длительного, от нескольких месяцев до 1,5-2 лет неактивного состояния («гипнозоиты»). Существует мнение о видовой самостоятельности возбудителей с быстрым и замедленным развитием в гепатоцитах. Таким образом, при vivax– и ovale-малярии возможна не только преэритроцитарная, но и параэритроцитарная шизогония, обеспечивающая возникновение поздних проявлений болезни.
Эритроцитарная шизогония протекает в виде циклического процесса длительностью 48 ч у Р. vivax, Р. ovale и Р. falciparum и 72 ч у Р. malariae. В эритроцитах мерозоиты последовательно трансформируются в трофозоиты и шизонты с образованием после деления последних от 4 до 24 эритроцитарных мерозоитов, которые и инвазируют в новые эритроциты, где цикл повторяется. Часть мерозоитов в эритроцитах превращается в незрелые мужские и женские половые клетки – микро– и макрогаметоциты (гаметоцитогония), завершающие развитие в желудке комара. Гамонты Р. falciparum появляются в крови через 1,5—2 нед после образования и могут сохраняться в кровеносном русле в течение нескольких недель.
В отличие от других видов плазмодиев Р. falciparum проходят эритроцитарную шизогонию в капиллярах внутренних органов в результате феномена цитоадгезии инвазированных эритроцитов и эндотелиальных клеток. В связи с этим при неосложненном течении тропической малярии в крови больных обнаруживаются лишь начальные (юные, кольцевидные трофозоиты) и конечные (гаметоциты) стадии паразита, а промежуточные стадии Р. falciparum выявляются в крови больных при злокачественном течении болезни.
При парентеральном заражении малярийными плазмодиями в эритроцитарной фазе в организме человека протекает лишь Эритроцитарная шизогония.
Эпидемиология. В естественных условиях малярия – антропонозная трансмиссивная инвазия, склонная к очаговому распространению.
Источником возбудителей является инвазированный человек, в крови которого имеются гаметоциты плазмодиев, – больной с первичными и рецидивными признаками малярии, паразитоноситель (в том числе и гаметоноситель).
Основной механизм заражения – трансмиссивный, через укус инвазированной самки комаров рода Anopheles, в организме которой завершилась спорогония (так называемая спорозоитная инвазия).
Заражение малярией возможно парентеральным путем: при трансфузиях крови от донора-паразитоносителя, при проведении лечебно-диагностических манипуляций недостаточно обработанными инструментами, а также в родах или изредка, при тропической малярии, через плаценту (так называемая шизонтная инвазия, в том числе врожденная малярия).
В трансмиссивной передаче малярийных паразитов участвуют около 80 видов комаров Anopheles, из них более активными переносчиками возбудителей малярии являются в России А. maculipennis, А. pulcherrimus и др.
Восприимчивость к малярии высокая, особенно у детей раннего возраста, которые в эндемичных районах составляют основной контингент больных.
Вместе с тем наблюдается естественная резистентность к малярии: например, невосприимчивость человека к большинству зоонозных видов плазмодиев, генетически обусловленная невосприимчивость Duffy (Fya , Fyb ) негативных индивидуумов к Р. Vivax (коренного населения районов Западной Африки), носителей S-гемоглобина и лиц с дефицитом Г-6-ФДГ к Р. falciparum и т.д.
Малярии свойственна сезонность, определяемая комплексом факторов, влияющих на продолжительность спорогонии и активность переносчиков: в умеренных климатических зонах сезон передачи малярии составляет 1,5—3 летних месяца, в субтропических зонах он увеличивается до 5—8 мес, в тропических зонах возможна круглогодичная передача малярии.
Очаги инвазии формируются в результате взаимодействия комплекса биотических и абиотических факторов и различаются в зависимости от интенсивности передачи возбудителя. Наиболее активные (голо– и гиперэндемичные очаги) существуют в странах с жарким и теплым климатом.
Патогенез и патологоанатомическая картина. Малярия – циклический инвазионный процесс, склонный к рецидивирующему течению.
В развитии малярийной инвазии выделяют периоды, обусловленные фазовым характером реакций макроорганизма на различные виды возбудителей малярии.
Проникновение паразита в организм человека вызывает развитие первичной малярии, которая в зависимости от способа заражения протекает в виде спорозоитной или шизонтной инвазии.
При заражении спорозоитами в фазу тканевой шизогонии заметные патологические проявления не развиваются. Эта фаза инвазии соответствует инкубационному периоду болезни.
При заражении малярией, в то время когда плазмодий находится в эритроцитарной фазе, инкубационный период укорочен ввиду отсутствия экзоэритроцитарной фазы развития паразитов.
В результате размножения плазмодиев в ходе эритроцитарной шизогонии паразитемия достигает так называемого пирогенного уровня (в зависимости от вида инвазии в 1 мкл крови может насчитываться от нескольких десятков паразитов у неиммунных лиц до нескольких сотен плазмодиев у частично иммунных людей), что обусловливает возникновение лихорадки и других признаков, характерных для фазы первичных прояв-лений малярии.
Развитие иммунных реакций (синтез опсонинов, агглютининов, реакции клеточного иммунитета) уменьшает уровень паразитемии, что проявляется постепенным угасанием приступов малярии и восстановлением нарушенных функций.
Однако вследствие несовершенства начальных иммунных реакций в течение последующих 1—2 мес паразитемия вновь достигает высокого уровня, что приводит к развитию фазы ранних или эритроцитарных рецидивов в клинически манифестной или бессимптомной («паразитарный рецидив») формах.
Дальнейшее течение заболевания различается в зависимости от вида возбудителя.
В случае тропической малярии после окончания фазы ранних рецидивов паразитемия прекращается и наступает фаза реконвалесценции, при этом в крови реконвалесцентов в течение нескольких недель могут сохраняться гаметоциты Р. falciparum.
При четырехдневной малярии возможно сохранение паразитемии на субпирогенном уровне или на субпатентном уровне, т.е. ниже порога обнаружения (или 5 * 10^6 паразитов в 1 л крови) в течение многих лет, что обеспечивает возникновение эритроцитарных рецидивов спустя длительное время после заражения.
При vivax- и ovale-малярии по окончании фазы ранних рецидивов может наступать латентный период продолжительностью от 2 до 8 мес и более (паразиты в крови отсутствуют), вслед за которым в случаях завершения параэритроцитарной шизогонии «гипнозоитов» вновь возникает паразитемия, обусловливающая развитие фазы поздних (экзоэритроцитарных) рецидивов. Число таких рецидивов, протекающих как в клинически манифестной, так и субклинической («паразитарный рецидив») формах, может значительно колебаться, и после их окончания наступает выздоровление больных.
Продолжительность инвазионного процесса при тропической малярии составляет до 1—1,5 лет, при vivax-малярии – до 2—4 лет, ovale-малярии – до 3—6 (реже до 8) лет, при четырехдневной малярии – от нескольких до десятков лет.
Основные патофизиологические сдвиги, развивающиеся при малярии, обусловлены эритроцитарной шизогонией.
Окончание цикла эритроцитарной шизогонии сопровождается разрушением эритроцита и выходом в плазму крови малярийных паразитов, продуктов их метаболизма, малярийного пигмента, эритроцитарных белков, которые вызывают аллергическую реакцию, сопровождающуюся раздражением терморегуляторного центра, увеличением активности биогенных аминов (гистамина, серотонина, катехоламинов и др.), калликреин-кининовой системы с повышением сосудистой проницаемости, нарушением циркуляции крови, водно-электролитными расстройствами.
Важная роль в генезе тяжелых форм тропической малярии отводится токсическим субстанциям плазмодиев (например, цитотоксическая субстанция Мегрета) и проявлениям тканевой анафилаксии. Наличие циркулирующих растворимых антигенов малярийного паразита и антител к ним способствует образованию иммунных комплементсодержащих комплексов, усугубляющих сосудистые повреждения.
Прогрессирующая паразитемия вызывает повышение активности системы мононуклеарных фагоцитов (СМФ), сопровождающееся усилением фагоцитоза инвазированных эритроцитов, малярийных паразитов и их метаболитов, гиперплазией элементов СМФ в печени, селезенке, размеры которых заметно увеличиваются, в костном мозге и других органах.
В результате разрушения и фагоцитоза инвазированных эритроцитов, фиксации комплементсодержащих иммунных комплексов на мембране эритроцитов, вызывающей понижение их резистентности, а также гиперфункции селезенки, угнетающей костномозговое кроветворение, развивается прогрессирующая анемия, лейкопения и тромбоцитопения (панцитопения).
Вследствие разновременного окончания тканевой шизогонии и, следовательно, начальных этапов эритроцитарной шизогонии в первые дни заболевания у неиммунных лиц лихорадка часто принимает неправильный характер.
В дальнейшем, в результате формирования иммунного ответа в крови сохраняются лишь 1—2 генерации паразитов, которые и придают течению болезни ритмический характер с развитием пароксизмов через 48 или 72 ч.
При малярии формируется нестойкий видоспецифический нестерильный иммунитет (премуниция, по Сержан), поэтому через некоторое время возможно заражение паразитами как гетерологичного, так и гомологичного вида или варианта.
Развитие инфекционного процесса сопровождается заметным нарушением функции различных систем и органов, наибольшая выраженность которого наблюдается при тропической малярии. При этом в головном мозге обнаруживаются явления отека, экстравазии, повреждение капилляров и формирование вокруг сосудов специфических гранул Дюрка. Нередко патологоанатомическое исследование выявляет тяжелые дистрофические изменения в миокарде, кровоизлияния под эпикард и эндокард. Паренхиматозные органы заметно увеличены, приобретают аспидно-серую окраску вследствие отложения в них малярийного пигмента (гематомеланина). Часто обнаруживаются дегенеративные и некробиотические изменения в почках, признаки острого тубулярного некроза, кровоизлияния в капсулу или лоханки. При длительном течении паразитемии Р. malariae развивается прогрессирующий нефроз, обусловленный отложением на мембранах почечных клубочков иммуноактивных комплексов, включающих растворимые антигены Р. malariae, иммуноглобулины класса М и С3 –комплемент.
Малярийные плазмодии дают заметный иммуносупрессивный эффект, что сказывается на течении интеркуррентных заболеваний, развитии вторичной инфекции.
В эндемичных районах описано развитие малярийного суперфициального кератита и серпигинозных язв роговицы, ирита, иридоциклита, хориоретинита, неврита зрительного нерва и т.д. Возможно поражение вестибулярного и кохлеарного аппаратов. Известно развитие язвенного колита при длительном течении тропической малярии.
Клиническая картина. Основными симптомами малярии являются высокая, часто приступообразная лихорадка с фазами «озноба», «жара» и «пота», анемия, гепатоспленомегалия.
Соответственно виду возбудителя различают vivax– (или трехдневную) малярию, ovale-малярию, falciparum-(или тропическую) и четырехдневную малярию, которые могут протекать в виде первичных проявлений и рецидивов – эритроцитарных, а при vivax– и ovale-малярии и экзоэритроцитарных. Болезнь бывает легкой формы, средней тяжести и тяжелой, последняя при тропической малярии сопровождается осложнениями: малярийной комой, острой почечной недостаточностью, гемоглобинурией, малярийным гепатитом и др. У частично иммунных лиц инвазия может протекать в виде паразитоносительства.
При заражении плазмодиями двух и более видов развивается mixt-малярия. Малярия может сочетаться с другими вариантами инфекционной патологии.
Инкубационный период vivax-малярии составляет 10—14 дней (варианты с короткой инкубацией) или 6—14 мес (варианты с длительной инкубацией); оуа1е-малярии – 7—20 дней, тропической малярии – 8—16 дней; четырехдневной малярии – 25—42 дня.
Начало заболевания обычно острое, в ряде случаев возможен непродолжительный продром в виде недомогания, познабливания, сухости во рту.
Малярии свойственно приступообразное течение, при этом в первые дни заболевания (особенно у неиммунных лиц) лихорадка может быть неправильного типа – «инициальная лихорадка».
Развитие малярийного приступа включает фазы «озноба» (1—3 ч), «жара» (6—8 ч), «пота»; общая продолжительность приступа колеблется от 1—2 до 12—14 ч, а при тропической малярии и более. В ходе малярийного пароксизма развиваются общетоксические проявления: быстро повышается температура тела до 40—41 °С, отмечается головная боль, возможны миалгии, при тропической малярии может появиться уртикарная сыпь, бронхоспазм. На высоте приступа головная боль усиливается, развивается головокружение, часто рвота, больные могут быть спокойны, нередко жалуются на боли в поясничной области. При тропической малярии часто возникают боли в эпигастральной области, наблюдается жидкий стул, обычно без патологических примесей. Окончание приступа сопровождается выраженной потливостью, уменьшением явлений интоксикации; ослабленные больные засыпают.
При обследовании больного на высоте малярийного пароксизма выявляются гиперемия лица, инъекция сосудов склер, сухая и горячая кожа туловища и часто холодные конечности. Пульс обычно учащен соответственно уровню температуры, артериальное давление понижено, тоны сердца приглушены. Слизистые оболочки сухие, язык покрыт густым белым налетом, нередко на губах или крыльях носа имеется герпетическая сыпь.
После одного-двух приступов у многих больных отмечается субиктеричность склер или кожи, в конце первой или в начале второй недели болезни отчетливо выявляется гепатомегалия и спленомегалия.
При изучении гемограммы в первые дни болезни обычно отмечаются лейкопения с нейтрофильным сдвигом влево, а в последующие дни – уменьшение числа эритроцитов, снижение уровня гемоглобина, увеличение числа ретикулоцитов, лейкопений с относительным лимфомоноцитозом, тромбоцитопения, ускорение оседания эритроцитов, анизопойкилоцитоз.
В апирексическом периоде больные могут сохранять работоспособность, но с увеличением числа пароксизмов и в периоде апирексии могут отмечаться выраженная слабость, головная боль, распространенные миалгии и артралгии, лицо часто приобретает землистый оттенок, более заметными становятся желтуха, гепатоспленомегалия, больные теряют массу тела.
Наиболее тяжелыми являются первичные признаки тропической малярии, которая у неиммунных лиц или на фоне нарушенного иммунобиологического статуса может приобретать злокачественное течение уже в первые дни болезни с развитием комы, острой почечной недостаточности, геморрагического синдрома и других осложнений.
Коматозная форма тропической малярии нередко развивается после короткого периода предвестников в виде сильной головной боли, головокружения, многократной рвоты, беспокойства больного. Следующий, прекоматозный период, или сомноленция, характеризуется психической и физической вялостью больного, который неохотно вступает в контакт, отвечает односложно, быстро истощается, даже засыпает во время беседы. Через несколько часов развивается период сопора, во время которого сознание больных утрачивается, возможно психомоторное возбуждение, эпилептиформные судороги, менингеальные и реже очаговые симптомы; наблюдаются патологические рефлексы, отмечаются сужение зрачков и угасание зрачкового рефлекса. Период глубокой комы проявляется полной арефлексией, глубоким и шумным дыханием или периодическим дыханием типа Чейна – Стокса, прогрессирующей гипотензией и диффузным цианозом. При отсутствии адекватного лечения больные погибают.
Острая почечная недостаточность, развивающаяся в результате нарушения микроциркуляции в почках и острого тубулярного некроза, нередко сочетается с коматозной формой и проявляется прогрессирующей олигоанурией, азотемией, гиперкалиемией и ацидозом. При адекватном лечении часто наблюдается восстановление почечной функции.
Гемоглобинурийная лихорадка обычно развивается при тропической малярии на фоне лечения хинином или сульфаниламидными препаратами и связана с острым внутрисосудистым гемолизом. Гемоглобинурия начинается внезапно и сопровождается потрясающим ознобом, быстрым повышением температуры тела до максимального уровня, интенсивными болями в пояснично-крестцовой области, повторной рвотой плейохромной желчью, распространенными миалгиями, желтухой. Диурез прогрессивно уменьшается, моча приобретает темно-коричневый или черный цвет, при отстаивании разделяется на грязно-коричневый с детритом нижний слой и прозрачный темно-вишневый или фиолетовый – верхний. В последующем наблюдается острая почечная недостаточность, азотемия, резко выраженная анемия, обусловливающие летальный исход. Наряду с тяжелыми формами описаны легкие и средней тяжести формы гемоглобинурийной лихорадки.
При исследовании мочи выявляются оксигемоглобин, метгемоглобин, гематин, глыбки гемоглобина, белок, эритроциты, гиалиновые и зернистые цилиндры. Наиболее часто гемоглобинурия наблюдается у людей с генетически детерминированной энзимопатией – дефицитом Г-6-ФДГ, обусловливающей понижение резистентности эритроцитов.
Геморрагическая форма тропической малярии сопровождается признаками тяжелого инфекционно-токсического шока, диссеминированной внутрисосудистой коагуляции с кровоизлияниями в кожу, внутренние органы и жизненно важные центры головного мозга или в надпочечники.
Неблагоприятное течение болезни часто наблюдается у беременных, у которых отмечаются замедленное развитие саногенных реакций, множественные висцеральные проявления, высокая летальность. Малярия у беременных иногда может сопровождаться внутриутробным инфицированием плода с последующей его антенатальной гибелью или привести к заражению ребенка в родах.
При благоприятном течении болезни у нелеченых больных первичные проявления малярии включают 10—12 пароксизмов, после чего по мере подавления паразитемии температура нормализуется, однако в течение первых двух месяцев могут возникать эритроцитарные рецидивы. Клиническая картина рецидивов характеризуется ритмичным развитием пароксизмов лихорадки, меньшей выраженностью синдрома интоксикации и быстрым, часто с первых дней, увеличением печени и селезенки, консистенция которых, как правило, плотная. При неадекватном лечении возможен разрыв селезенки. Поздние рецидивы vivax– и ovale-малярии протекают доброкачественно, обычно с четким ритмом лихорадки, быстрым возникновением гепатоспленомегалии и анемии, последняя может прогрессировать. При длительном течении четырехдневной малярии у нелеченых больных нередко наблюдается нефротический синдром, требующий применения иммуносупрессивной терапии.
Диагностика. Распознавание малярийной инфекции основывается на выявлении ведущих клинических признаков – приступообразной лихорадки с ознобами и потливостью, гепатоспленомегалии и анемии, а также на положительных данных эпидемиологического анамнеза – пребывании в эндемичной зоне в течение 3 лет до начала болезни, гемотрансфузии или иных парентеральных манипуляций в течение 3 мес до начала лихорадки. Диагноз подтверждается обнаружением малярийных паразитов в препаратах крови – толстой капле и мазке.
Для исследования используют капиллярную (из пальца) или венозную кровь. Забор крови производят независимо от уровня температуры. Однократный отрицательный результат анализа не исключает диагноза малярии и требует ее повторного исследования через 8—12 ч. Обнаружить плазмодии проще в толстой капле крови, позволяющей в одном поле зрения микроскопа изучить большой объем крови. Дифференцировать вид возбудителя легче удается в мазке. Необходимо учитывать количественную и качественную характеристику результатов паразитологического исследования: интенсивная паразитемия (10 и более паразитов в одном поле зрения толстой капли крови, или более 100 * 10^9 плазмодиев в 1 л крови, или поражение более 5 % эритроцитов) или обнаружение промежуточных стадий развития Р. falciparum, как правило, свидетельствуют о неблагоприятном течении тропической малярии с угрозой развития коматозной или иной злокачественной формы болезни.
Дифференциальная диагностика малярии проводится как с другими инфекционными заболеваниями (грипп, острые кишечные заболевания, лептоспироз, менингококковая инфекция, геморрагические лихорадки, вирусный гепатит, арбовирусные заболевания, риккетсиозы), так и с соматической патологией (воспалительные заболевания мочевых путей, желчных путей, сепсис и др.).
Лечение. Больные малярией подлежат обязательной госпитализации в инфекционный стационар, где им проводят этиотропную купирующую и радикальную терапию, патогенетическое и симптоматическое лечение.
Этиотропные препараты в зависимости от направленности действия подразделяются на 4 группы: 1) гематошизотропные средства – хингамин, хинин, прогуанил, пириметамин, сульфаниламидные препараты, тетрациклиновые производные;
2) гистошизотропные средства – примахин, хиноцид;
3) гамонтоцидные средства – пириметамин, примахин, хиноцид, прогуанил;
4) споронтоцидные средства – пириметамин, прогуанил.
Купирование малярийного приступа и, следовательно, основных клинических проявлений болезни достигается назначением препаратов гематошизотропного действия, чаще всего хингамина (хлорохин, делагил, резохин и другие аналоги): в первые сутки назначают неиммунным лицам 1,0 г препарата на прием и через 6—8 ч еще 0,5 г (всего 6 таблеток), в последующие дни назначат по 0,5 г (2 таблетки) на прием 1 раз в сутки. При трехдневной малярии продолжительность курса лечения 3 дня, при тропической и четырехдневной малярии курс лечения может удлиняться до 5 дней.
Радикальное излечение больных vivax– и ovale-малярией (уничтожение экзоэритроцитарных стадий паразитов) достигается назначением гистошизотропных препаратов: после купируюшей терапии больным назначают примахин по 15 мг основания препарата в сутки в течение 14 дней или хиноцид по 30 мг в сутки в течение 10 дней. Половые стадии Р. vivax, Р. ovale, Р. malariae погибают вскоре после прекращения эритроцитарной шизогонии. Больным тропической малярией с гаметоцидной целью после или на фоне купирующей терапии назначают пириметамин (хлоридин, тиндурин, дараприм) по 50 мг на прием однократно или примахин по 15 мг основания в сутки в течение 3 дней.
Ввиду выраженной устойчивости Р. falciparum к хингамину, широко распространенной в странах Юго-Восточной Азии, Центральной и Южной Америки, больным неосложненной тропической малярией из данных районов с целью купирования приступов назначают мефлохин («Лариам») перорально по 15 мг/кг в 2 приема или артезунат в таблетках в суточной дозе 2 мг/кг в течение 5 дней; эффективна комбинация мефлохина и артезуната или мефлохина и артехинина, применяемая в течение 3 дней. В случаях непереносимости указанных препаратов используют перорально хинина гидрохлорид по 0,5 г 4 раза в день в сочетании с доксициклином по 0,2 г в сутки в течение 7 дней.
С гаметоцидной целью больным Га1с1рашт-малярией назначают примахин по 15 мг основания препарата в сутки в течение 3 дней или пириметамин (хлоридин, тиндурин) по 50 мг однократно.
При лечении злокачественных форм тропической малярии противомалярийные препараты вводят внутривенно капельным способом со скоростью 20 капель в минуту. Препаратом выбора считается хинина гидрохлорид в дозе 30 мг на 1 кг массы тела в сутки, назначаемый в 3 приема с интервалом 8 ч. По мере улучшения состояния больного переходят на пероральный прием препарата. Делагил применяется в такой же дозе, как и хинин (в расчете на основание препарата). В случаях острой почечной недостаточности суточная доза хинина или делагила уменьшается до 10—15 мг/кг.
Наряду с этиотропной терапией проводят интенсивную противошоковую инфузионную терапию с использованием кристаллоидных и коллоидных препаратов в дозе 10—15 мл на 1 кг массы тела больного, глюкокортикоидов 1—2 мг на 1 кг массы тела, антигистаминных и диуретических препаратов. При развитии почечной недостаточности показано проведение гемодиализа, ультрафильтрации крови или гемосорбции. В случаях выраженной анемии проводят гемотрансфузии донорской крови.
Профилактика. Профилактические мероприятия при малярии направлены на основные звенья эпидемического процесса. При этом предусматриваются активное, своевременное выявление больных и паразитоносителей и их лечение, уничтожение комаров рода Anopheles путем обработки мест выплода комаров ларвицидными препаратами (ГХЦГ, малатрон, пропоксур, абат, фенитротин и др.) или имагоцидными средствами (пиретрум, фенитротион) с помощью биологических средств борьбы: гамбузирование водоемов, использование бактерий, гельминтов и насекомых – антагонистов комаров, бонификация местности (мелиорация), а также повышение невосприимчивости населения к малярийной инфекции (химиопрофилактика).
С целью индивидуальной профилактики используют гематошизотропные средства (хингамин, фансидар, хинин и др.), которые начинают принимать за 3—5 дней до въезда в эндемичную зону, продолжают прием в течение всего периода пребывания в малярийном районе (2—3 года) и 4—8 нед после выезда из эндемичной зоны. В зависимости от типа эндемической малярии препараты принимают 1 —2 раза в неделю или ежедневно.
Лицам, живущим в очагах vivax-малярии, проводят предсезонную химиопрофилактику рецидивов болезни примахином по 15 мг основания в сутки в течение 14 дней.
Наряду с химиопрофилактикой целесообразно предупреждать нападение комаров с помощью сеток или пологов в ночное время, нанесение на кожу или одежду репеллентов (ДЭТА, диметилфталат и др.), применение защитной одежды.
С целью профилактики трансфузионной малярии необходим тщательный отбор доноров с использованием как паразитологических, так и серологических методов (РНГА,ИФА, МФА и др.).
В эндемичных районах в настоящее время осуществляется программа ВОЗ по борьбе с малярией, рассчитанная на длительное время, с акцентом на широкое использование химиопрепаратов, в сочетании с противокомариными мероприятиями.
Разработаны и испытываются методы вакцинации (шизонтная и спорозоитная вакцины) с использованием спорозоитных, шизонтных и гаметоцидных антигенов.
Лейшманиозы
Лейшманиозы (leishmanioses) – группа протозойных трансмиссивных заболеваний человека и животных, характеризующихся преимущественным поражением внутренних органов (висцеральный лейшманиоз) или кожи и слизистых оболочек (кожный лейшманиоз). Различают географические типы болезни – лейшманиозы Старого и Нового Света.
Исторические сведения. Первое описание кожного лейшманиоза принадлежит английскому врачу Пококу (1745). Клиническая картина заболеваний была описана в работах братьев Рассел (1756) и отечественных исследователей и врачей Н.Арендта (1862) и Л.Л.Гейденрейха (1888).
Возбудитель кожного лейшманиоза открыт П.Ф.Боровским в 1898г., описан американским исследователем Дж.Райтом в 1903 г. В 1900—1903 гг. В.Лейшман и С.Донован обнаружили в селезенке больных кала-азаром возбудителя висцерального лейшманиоза, идентичного микроорганизму, описанному П.Ф.Боровским.
Предположение о связи лейшманиоза с москитами было высказано в 1905 г. Пресс и братьями Сержан и доказано в эксперименте А.Донатье и Л.Парро в 1921 г. В 1908 г. Ш.Николь и в 1927—1929 гг. Н.И.Ходукин и М.С.Софиев установили роль собак как одного из основных резервуаров возбудителей висцерального лейшманиоза. Большое значение для понимания эпидемиологии болезни сыграли исследования В.Л.Якимова (1931) и Н.Н.Латышева (1937—1947), установивших наличие природных очагов висцерального лейшманиоза в Туркмении. В результате предпринятой в 1950-1970 гг. борьбы с лейшманиозом заболеваемость некоторыми формами его в нашей стране практически ликвидирована (кожный антропонозный и городская форма висцерального лейшманиоза).
Возбудители лейшманиозов относятся к роду Leishmania, семейству Trypanosomatidae, классу Zoomastigophorea, типу Protozoa.
Жизненный цикл лейшманий протекает со сменой хозяев и состоит из двух стадий: амастиготной (безжгутиковой) – в организме позвоночного животного и человека и промастиготной (жгутиковой) – в организме членистоногого москита.
Лейшманий в амастиготной стадии имеют овальную форму и размер (3—5) х (1—3) мкм, при окраске по Лейшману или Романовскому – Гимзе в ней дифференцируется гомогенная или вакуолизированная цитоплазма голубого цвета, центрально расположенное ядро и кинетопласт рубиново-красного цвета; обычно обнаруживается в клетках системы мононуклеарных фагоцитов.
Лейшманий в промастиготной стадии имеют веретенообразную форму длиной до 10—20 мкм и шириной до 4—6 мкм, при их окрашивании наряду с цитоплазмой, ядром и кинетопластом на переднем конце простейшего выявляется жгутик, с помощью которого осуществляется активное движение паразита; выявляются в теле москитов и при культивировании на среде NNN.
Лейшманий передаются кровососущими насекомыми – москитами родов Phlebotomus, Lutzomyia, семейства Phlebotomidae.
Лейшманиоз висцеральный
Лейшманиоз висцеральный (leishmaniosis visceralis) – трансмиссивная протозойная болезнь, характеризующаяся преимущественно хроническим течением, волнообразной лихорадкой, сплено– и гепатомегалией, прогрессирующей анемией, лейкопенией, тромбоцитопенией и кахексией.
Различают антропонозный (индийский висцеральный лейшманиоз, или кала-азар) и зоонозньтй висцеральный лейшманиоз (средиземноморско-среднеазиатский висцеральный лейшманиоз, или детский кала-азар; восточноафриканский висцеральный лейшманиоз; висцеральный лейшманиоз Нового Света). В России регистрируются спорадические завозные случаи болезни, преимущественно средиземиоморско-среднеазиатского висцерального лейшманиоза.
Лейшманиоз висцеральный средиземноморско-среднеазиатский
Этиология. Возбудитель – L. infantum.
Эпидемиология. Средиземноморско-среднеазиатский висцеральный лейшманиоз – зооноз, склонный к очаговому распространению. Различают 3 типа очагов инвазии: 1) природные очаги, в котрых лейшмании циркулируют среди диких животных (шакалы, лисицы, барсуки, грызуны, в том числе суслики и т.п.), являющиеся резервуаром возбудителей; 2) сельские очаги, в которых циркуляция возбудителей происходит преимущественно среди собак – главных источников возбудителей, а также среди диких животных – способных иногда становиться источниками заражения; 3) городские очаги, в которых основным источником инвазии являются собаки, но возбудитель обнаруживается и у синантропных крыс. В целом собаки в сельских и городских очагах лейшманиоза представляют собой наиболее значимый источник заражения людей. Ведущий механизм заражения – трансмиссивный, через укус инвазированных переносчиков – москитов рода Phlebotomus. Возможно заражение при гемотрансфузиях от доноров с латентной инвазией и вертикальная передача лейшмании. Болеют преимущественно дети от 1 года до 5 лет, но нередко и взрослые – приезжие из неэндемичных районов.
Заболеваемость носит спорадический характер, в городах возможны локальные эпидемические вспышки. Сезон заражения – лето, а сезон заболеваемости – осень того же или весна следующего года. Очаги болезни располагаются между 45° с.ш. и 15° ю.ш. в странах Средиземноморья, в северо-западных районах Китая, на Ближнем Востоке, в Средней Азии, Казахстане (Кзыл-Ординская область), Азербайджане, Грузии.
Патогенез и патологоанатомическая картина. Инокулированные промастиготы лейшмании захватываются макрофагами, превращаются в них в амастиготы и размножаются. В месте внедрения паразитов формируется гранулема, состоящая из макрофагов, содержащих лейшмании, ретикулярных клеток, эпителиоидных и гигантских клеток (первичный аффект). Спустя несколько недель гранулема подвергается обратному развитию или рубцеванию.
В дальнейшем лейшмании могут проникать в регионарные лимфатические узлы, затем диссеминировать в селезенку, костный мозг, печень и другие органы. В большинстве случаев в результате иммунного ответа, в первую очередь реакций гиперчувствительности замедленного типа, происходит разрушение инвазированных клеток: инвазия приобретает субклинический или латентный характер. В последних случаях возможна передача возбудителей при гемотрансфузиях.
В случаях пониженной реактивности или при воздействии иммуносупрессорных факторов (например, применение кортикостероидов и т.п.) отмечается интенсивное размножение лейшмании в гиперплазированных макрофагах, возникает специфическая интоксикация, происходит увеличение паренхиматозных органов с нарушением их функции. Гиперплазия звездчатых эндотелиоцитов в печени приводит к сдавлению и атрофии гепатоцитов с последующим интерлобулярным фиброзом печеночной ткани. Отмечается атрофия пульпы селезенки и зародышевых центров в лимфатических узлах, нарушение костномозгового кроветворения, возникает анемия и кахексия.
Гиперплазия элементов СМФ сопровождается продукцией большого количества иммуноглобулинов, как правило, не играющих защитной роли и нередко обусловливающих иммунопатологические процессы. Часто развиваются вторичная инфекция, амилоидоз почек. Во внутренних органах отмечаются изменения, характерные для гипохромной анемии.
Специфические изменения в паренхиматозных органах подвергаются обратному развитию при адекватном лечении. У реконвалесцентов формируется стойкий гомологичный иммунитет.
Клиническая картина. Инкубационный период составляет от 20 дней до 3—5 мес, иногда 1 год и более. В месте инокуляции лейшманий у детей 1—1,5 лет, реже у более старших детей и взрослых возникает первичный аффект в виде папулы, иногда покрытой чешуйкой. Важно правильно оценить этот симптом, так как он появляется задолго до общих проявлений болезни. В течении висцерального лейшманиоза различают 3 периода: начальный, разгара болезни и терминальный.
В начальный период отмечаются слабость, понижение аппетита, адинамия, небольшая спленомегалия.
Период разгара болезни начинается с кардинального симптома – лихорадки, которая обычно имеет волнообразный характер с подъемами температуры тела до 39—40 °С, сменяющимися ремиссиями. Длительность лихорадки колеблется от нескольких дней до нескольких месяцев. Продолжительность ремиссии также различна – от нескольких дней до 1—2 мес.
Постоянными признаками висцерального лейшманиоза является увеличение и уплотнение печени и главным образом селезенки; последняя может занимать большую часть брюшной полости. Увеличение печени обычно менее значительно. При пальпации оба органа плотны и безболезненны; болезненность наблюдается обычно при развитии периоспленита или перигепатита. Под влиянием лечения размеры органов уменьшаются и могут нормализоваться.
Для средиземноморско-среднеазиатского висцерального лейшманиоза характерно вовлечение в патологический процесс периферических, мезентериальных, перибронхиальных и других групп лимфатических узлов с развитием полилимфаденита, мезаденита, бронхоаденита; в последних случаях может возникать приступообразный кашель. Часто выявляются пневмонии, вызываемые бактериальной флорой.
При отсутствии правильного лечения состояние больных постепенно ухудшается, они худеют (до кахексии). Развивается клиническая картина гиперспленизма, прогрессирует анемия, которая усугубляется поражением костного мозга. Возникают гранулоцитопения и агранулоцитоз, нередко развивается некроз миндалин и слизистых оболочек полости рта, десен (нома). Нередко развивается геморрагический синдром с кровоизлияниями в кожу, слизистые оболочки, носовыми и желудочно-кишечными кровотечениями. Выраженная спленогепатомегалия и фиброз печени приводят к портальной гипертензии, появлению асцита и отеков. Их возникновению способствует гипоальбуминемия. Возможны инфаркты селезенки.
Вследствие увеличения селезенки и печени, высокого стояния купола диафрагмы сердце смещается вправо, его тоны становятся глухими; определяется тахикардия как в период лихорадки, так и при нормальной температуре; артериальное давление обычно понижено. По мере развития анемии и интоксикации признаки сердечной недостаточности нарастают. Отмечается поражение пищеварительного тракта, возникает диарея. У женщин обычно наблюдается (олиго) аменорея, у мужчин снижается половая активность.
В гемограмме определяется уменьшение числа эритроцитов (до 1-2 * 10^12 /л и менее) и гемоглобина (до 40—50 г/л и менее), цветового показателя (0,6—0,8). Характерны пойкилоцитоз, анизоцитоз, анизохромия. Отмечаются лейкопения (до 2-2,5 * 10^9 /л и менее), нейтропения (иногда до 10 %) при относительном лимфоцитозе, возможен агранулоцитоз. Постоянный признак – анэозинофилия, обычно выявляется тромбоцитопения. Характерно резкое повышение СОЭ (до 90 мм/ч). Снижаются свертываемость крови и резистентность эритроцитов.
При кала-азаре у 5—10 % больных развивается кожный лейшманоид в виде узелковых и(или) пятнистых высыпаний, появляющихся через 1—2 года после успешного лечения и содержащих в себе лейшмании, которые могут сохраняться в них годами и даже десятилетиями. Таким образом, больной с кожным лейшманоидом становится источником возбудителей на многие годы. В настоящее время кожный лейшманоид наблюдается только в Индии.
В терминальный период болезни развиваются кахексия, падение мышечного тонуса, истончение кожи, через тонкую брюшную стенку проступают контуры огромной селезенки и увеличенной печени. Кожа приобретает «фарфоровый» вид, иногда с землистым или восковидным оттенком, особенно в случаях выраженной анемии.
Средиземноморско-среднеазиатский висцеральный лейшманиоз может проявляться в острой, подострой и хронической формах.
Острая форма, обычно выявляемая у детей младшего возраста, встречается редко, характеризуется бурным течением и при несвоевременном лечении заканчивается летально.
Подострая форма, более частая, протекает тяжело в течение 5—6 мес с прогрессированием характерных симптомов болезни и осложнениями. Без лечения нередко наступает летальный исход.
Хроническая форма, самая частая и благоприятная, характеризуется продолжительными ремиссиями и обычно заканчивается выздоровлением при своевременном лечении. Наблюдается у детей старшего возраста и у взрослых.
Значительное число случаев инвазии протекает в субклинической и латентной формах.
Прогноз. Серьезный, при тяжелых и осложненных формах и несвоевременном лечении – неблагоприятный; легкие формы могут заканчиваться спонтанным выздоровлением.
Диагностика. В эндемичных очагах клинический диагноз поставить нетрудно. Подтверждение диагноза осуществляют с помощью микроскопического исследования. Лейшмании иногда обнаруживают в мазке и толстой капле крови. Наиболее информативным является обнаружение лейшмании в препаратах костного мозга: до 95—100 % положительных результатов. Проводят посев пунктата костного мозга для получения культуры возбудителя (на среде NNN обнаруживают промастиготы). Иногда прибегают к биопсии лимфатических узлов, селезенки, печени. Применяют серологические методы исследования (РСК, НРИФ, ИФА и др.). Может быть использована биологическая проба с заражением хомячков.
У реконвалесцентов становится положительной внутрикожная проба с лейшманиином (реакция Монтенегро).
Дифференциальный диагноз проводят с малярией, тифами, гриппом, бруцеллезом, сепсисом, лейкозом, лимфогранулематозом.
Лечение. Наиболее эффективны препараты 5-валентной сурьмы, пентамидина изотионат.
Препараты сурьмы вводят внутривенно в течение 7—16 дней в постепенно возрастающей дозе. При неэффективности этих препаратов назначают пентамидин по 0,004 г на 1 кг в сутки ежедневно или через день, на курс 10—15 инъекций.
Помимо специфических препаратов, необходимы патогенетическая терапия и профилактика бактериальных наслоений.
Профилактика. Основана на мероприятиях по уничтожению москитов, санации больных собак.
Лейшманиоз кожный
Лейшманиоз кожный (leishmaniosis cutanea) – трансмиссивный протозооз, эндемический для районов тропического и субтропического климата, клинически характеризующийся ограниченными поражениями кожи с последующими изъязвлением и рубцеванием. Клинические формы, тяжесть течения и исходы обусловлены иммунобиологической реактивностью организма.
Различают кожный лейшманиоз Старого Света (антропонозный и зоонозный подтипы) и кожный лейшманиоз Нового Света. В России регистрируются преимущественно завозные случаи болезни.
Лейшманиоз кожный зоонозный
Син.: пустынно-сельский, влажный, остро некротизирующийся кожный лейшманиоз, пендинская язва
Этиология. Возбудитель – l. major, отличающийся по антигенным и биологическим свойствам от возбудителя антропонозного (городского) кожного лейшманиоза – L. minor.
Эпидемиология. Основным резервуаром и источником инфекции является большая песчанка; установлена естественная зараженность других видов грызунов и некоторых хищников (ласка). Переносчики возбудителей – москиты рода Phlebotomus, в основном Рh. pappayasii, которые становятся заразными через 6—8 дней после кровососания на грызунах. Заражение происходит через укус инфицированного москита. Характерна четкая летняя сезонность заболеваемости, совпадающая с лётом москитов. Встречается в сельских районах. Восприимчивость всеобщая. В эндемичных районах выявляется заболеваемость преимущественно у детей и приезжих, так как большая часть местного населения вырабатывает активный иммунитет, повторные заболевания редки. Возможны эпидемические вспышки болезни.
Инвазия распространена в странах Африки, Азии (Индия, Пакистан, Иран, Саудовская Аравия, Йемен, Ближний Восток, Туркмения, Узбекистан).
Патогенез и патологоанатомическая картина. В месте инокуляции лейшмании размножаются в макрофагах и вызывают очаговое продуктивное воспаление с образованием специфической гранулемы (лейшманиомы), состоящей из макрофагов, эпителиальных, плазматических, лимфоцитов и фибробластов. Макрофаги содержат большое число амастигот. Через 1—2 нед в гранулеме развивается деструкция, образуется язва, которая затем рубцуется. Часто наблюдается лимфогенная диссеминация лейшманий с образованием последовательных лейшманиом, лимфангитов, лимфаденита. При гиперергической реактивности наблюдается туберкулоидный тип поражений, лейшманий в очагах поражения обнаруживаются редко. Гипоергический тип реактивности обусловливает диффузно-инфильтрирующие формы болезни с большим числом возбудителей в очагах поражения.
Клиническая картина. Инкубационный период продолжается от 1 нед до 1—1,5 мес, обычно 10—20 дней.
Различают следующие формы кожного лейшманиоза: 1 – первичную лейшманиому – а) стадию бугорка, б) стадию изъязвления, в) стадию рубцевания; 2 – последовательную лейшманиому; 3 – диффузно-инфильтрирующий лейшманиоз; 4 – туберкулоидный кожный лейшманиоз.
На месте внедрения лейшманий в кожу появляется первичная гладкая папула розового цвета, величиной 2—3 мм, которая быстро приобретает большие размеры, иногда напоминая фурункул с лимфангитом и воспалительной реакцией окружающих тканей, но малоболезненная при пальпации (первичная лейшманиома). Спустя 1—2 нед начинается центральный некроз лейшманиомы с последующим образованием язвы различной формы и размером до 1,0—1,5 см и более, с подрытыми краями, обильным серозно-гнойным, часто сукровичным отделяемым, умеренно болезненной при пальпации.
Вокруг первичной лейшманиомы часто формируются множественные (от 5—10 до 100—150) мелкие узелки («бугорки обсеменения»), которые изъязвляются и, сливаясь, образуют язвенные поля. Локализуются лейшманиомы обычно на открытых участках кожи верхних и нижних конечностей, на лице.
Через 2—4, иногда 5—6 мес начинается эпителизация и рубцевание язвы.
С момента появления папулы до формирования рубца проходит не более 6—7 мес. Иногда наблюдаются изъязвление и рубцевание области лимфангитов и лимфаденитов. Туберкулоидный и диффузно-инфильтрирующий типы поражения наблюдаются редко. Вторичная бактериальная инфекция задерживает выздоровление.
Прогноз. Благоприятный, но могут возникать косметические дефекты.
Диагностика. Основывается на анализе клинико-эпидемиологических данных и результатах микроскопического исследования содержимого в соскобах из дна язвы или краевого инфильтрата, в котором обнаруживаются внутриклеточно и внеклеточно расположенные паразиты. Возможно использование биологической пробы. При туберкулоидном типе обнаруживается положительная реакция Монтенегро.
Дифференциальная диагностика. Дифференцировать кожный лейшманиоз приходится от эпителием, лепры, туберкулеза кожи, сифилиса, тропических язв.
Лечение. Тактика лечения и выбор препарата зависят от стадии и тяжести заболевания. В ранних стадиях может быть эффективным внутрикожное обкалывание лейшманиом раствором мепакрина (акрихина), мономицина, уротропина, берберина сульфата, использование мазей и примочек, содержащих указанные средства. На стадии язвы эффективно лечение мономицином (взрослым по 250 000 ЕД трижды в день, 10 000 000 ЕД на курс, детям – 4000—5000 ЕД на 1 кг массы тела 3 раза в день), аминохинолом (0,2 г трижды в день, на курс 11—12 г). Эффективно применение лазеротерапии, особенно в стадии бугорка (по Б.Г.Барджадзе), после которой не образуются грубые рубцы.
В тяжелых случаях применяют препараты 5-валентной сурьмы.
Профилактика. Проводят комплекс мероприятий по борьбе с москитами и пустынными грызунами. Эффективна вакцинация живой культурой Ь. та1ог – не позднее чем за 3 мес ло въезда в эндемичный район. Вакцина обеспечивает пожизненный иммунитет.
Антропонозный кожный лейшманиоз характеризуется меньшей выраженностью и более медленной динамикой («язва-годовик») поражений.
Назад: Тиф возвратный эпидемический
Дальше: Глава 9 Инфекции наружных покровов

