Фармацевтическая отрасль
Общая характеристика
Объем фармацевтического рынка России в 2015 г. достиг 1 259 млрд руб., что на 9,3% больше, чем годом ранее. В долларах США, однако, объемы продаж в сравнении с 2014 годом снизились на 32%, до 20,7 млрд долл. Доля отечественных лекарств выросла на 4% и составила по итогам года 27%. Наиболее яркие примеры отмечены в области инновационных и дорогостоящих позиций, поэтому в сегменте льготного лекарственного обеспечения доля российских лекарств выросла с 13% в 2014 г. до 26% в 2015 г. Пока же российский фармацевтический рынок остается импортозависимым. 73% потребляемых населением в денежном выражении лекарств производятся за рубежом.
Суммарные расходы федерального бюджета на 2016 г. утверждены в размере 16 098 млрд руб. (+4,4% к расходам 2015 г.) с дефицитом в 14,7%. Расходы на здравоохранение в рамках государственной программы «Развитие здравоохранения» составляют 354 млрд руб., или 2,2% от общих расходов федерального бюджета. Если говорить о финансировании отдельных программ лекарственного обеспечения, можно привести следующие данные:
- расходы на закупку препаратов в рамках программы «Семь нозологий» сократились на 1,1% и составили 43,62 млрд руб.;
- часть субвенций на федеральную программу по обеспечению необходимыми лекарственными препаратами, выделяемых напрямую из федерального бюджета бюджетам субъектов, сократилась на 2%;
- трансферты регионам на закупку антивирусных препаратов для профилактики и лечения ВИЧ, гепатитов B и C сократились на 0,5% и составили 17,44 млрд руб;
- трансферты на закупку антибактериальных и противотуберкулезных лекарственных препаратов (второго ряда) сократились на 2% и составили 3,48 млрд руб.
В 2015 г. на получение льготных лекарств в России могут претендовать только отдельные категории граждан: ветераны, инвалиды, неработающие пенсионеры, дети до трех лет и многодетные матери. Из федерального бюджета лекарствами обеспечиваются 4,7 млн человек (12 000 руб. на человека в год). Лекарства для федеральных льготников закупают регионы за счет субвенций, передаваемых из федерального бюджета в регион. При этом каждый субъект РФ формирует и собственный, региональный, перечень. Региональные бюджеты в совокупности финансируют препараты еще для 8,9 млн человек (2400 руб. на человека в год).
Продажи отечественных фармацевтических производителей в сегменте госзакупок за последние пять лет номинально выросли вдвое и достигли 72,6 млрд руб. по итогам 2015 г. Данный рынок сильно сегментирован: на топ-10 компаний приходится 55% продаж в сегменте госзакупок (43% в 2011 г.). Остальные 44% делят между собой 606 компаний. По итогам 2015 г. лидерами в сегменте госзакупок, по данным IMS Health, были специализирующаяся на производстве дженериков компания ЗАО «Ф-Синтез» (11,7%) и ЗАО «Биокад» (10,6%), которые продемонстрировали резкий рост объема продаж в сегменте госзакупок, а также АО «НПО “Микроген”» (5,2%).
За последние пять лет фармотрасль привлекла более 120 млрд руб. частных инвестиций иностранных и отечественных компаний при объеме средств федерального бюджета в 35 млрд руб.
На 2016 г. экспорт — самый быстрорастущий сегмент российского фармрынка. В 2015 г. общий объем экспорта составил 21,8 млрд руб., что на 45% больше, чем в 2014 г. Высокая динамика роста сохранилась и в 2016 г.: в первом полугодии объем экспорта достиг 11,5 млрд руб., что на 42% больше, чем за аналогичный период прошлого года. На 2016 г. на экспорт уходит примерно 1111,5% произведенной в России продукции.
Субъекты корпоративного лоббизма
Фармацевтический корпоративный сектор несколько отличается от других отраслей экономики России в вопросах взаимодействия с органами государственной власти. В нем значительную роль играют так называемые департаменты Market Access, отвечающие за регистрацию и лицензирование лекарств, а также включение их в ограничительные перечни и программы государственного финансирования. GR-функция как оценка регуляторных рисков и их заблаговременное предотвращение играет второстепенную роль в корпоративном секторе фармацевтической отрасли. В некоторых компаниях функции GR и Market Access объединены, в других — разделены на две позиции.
В фармацевтической отрасли выделим российских и зарубежных производителей лекарств, дистрибьютеров, а также аптечные сети. Каждый из указанных субъектов имеет свой ярко выраженный лоббистский интерес, а также свое профессиональное представительство. Рассмотрим субъектов корпоративного лоббизма в фармацевтической отрасли подробнее.
Ключевые российские производители лекарств
Как мы увидим ниже, в российских корпоративных структурах, в отличие от зарубежных компаний, отсутствуют структурные подразделения по взаимодействию с органами государственной власти. Объясняется это, с одной стороны, относительной молодостью российских фирм, в которых процесс корпоративного управления еще не закончен, с другой стороны, как это и бывает в подобных случаях, основную роль во взаимодействии с профильными регуляторами играют акционеры, которые, как мы увидим впоследствии, достаточно успешно достигают как корпоративных, так и отраслевых целей. Перечислим самых заметных отечественных игроков на фармацевтическом рынке России.
АО «Р-Фарм» — одна из крупнейших фармкомпаний России, основанная в 2001 г. российским предпринимателем Алексеем Репиком. Компания специализируется на поставках лекарственных средств для стационарной и специализированной медицинской помощи в медицинские исследовательские центры, госпитали, клинические больницы, лечебно-профилактические учреждения России. Это — абсолютный лидер системы госзаказа по числу выигранных тендеров: сумма господрядов за 2015 г. составила 32,1 млрд руб. 100% акций принадлежит Алексею Репику.
ПАО «Фармстандарт» основана в 2003 г. руководителями компании «ПрофитХауз» Егором Кульковым и Виктором Харитониным, вместе с Романом Абрамовичем и другими акционерами «Сибнефти» выкупившими за 55 млн долл. пять российских предприятий у ICN Pharmaceuticals. Акционерами на 31 марта 2015 г. являются:
- Augment Investments Limited (51,88%, бенефициары — Виктор Харитонин и Егор Кульков);
- ОАО «Фармстандарт-Лексредства» (3,8%);
- остальные акции в свободном обращении .
По данным Лондонской биржи (LSE) от 10 июня 2015 г. и МСФО компании за 2014 г., капитализация составила 805,7 млн долл., выручка — 41,2 млрд руб., чистая прибыль — 11,1 млрд руб.
ООО «Герофарм» — российская фармацевтическая компания, входит в ТОП-20 ведущих российских фармацевтических производителей. Основана семьей бывшего министра топлива и энергетики РФ и заместителя председателя правления ПАО «Газпром» Петром Родионовым в 2001 г. Компания осуществляет проекты по федеральным целевым программам Министерства промышленности и торговли и Министерства образования и науки. В рамках реализации программы «Фарма-2020» компания запустила единственное в России промышленное производство генно-инженерного инсулина полного цикла от синтеза субстанции до выпуска готовой лекарственной формы в поселке Оболенск (Московская область). Согласно единому государственному реестру юридических лиц, учредителями являются Наталья Родионова (20%), Инна Родионова (20%), Петр Петрович Родионов (30%), Петр Иванович Родионов (30%). Согласно отчетности компании в соответствии с Российскими стандартами бухгалтерского учета за 2012 г., выручка составила 2,8 млрд руб., прибыль — 525 млн руб.
ООО «Биотэк» — российская компания, дистрибьютор лекарственных препаратов, занимается научно-практическими изысканиями в области создания современных лекарственных средств. Компания выпускает более 370 наименований лекарств, относящихся к различным фармакотерапевтическим группам. Основана в 1991 г. Борисом Шпигелем.
STADA CIS — российский фармацевтический холдинг в составе международной группы компаний STADA AG, объединяющий одну из ведущих компаний отечественного фармацевтического рынка — АО «НИЖФАРМ» — и сербскую Hemofarm. STADA AG работает на российском рынке с 2001 г., а холдинг STADA CIS образован в 2008 г. и ведет деятельность в трех основных направлениях: разработка, производство и продвижение лекарственных средств. Портфель продукции STADA CIS включает более 150 наименований препаратов различных фармакотерапевтических групп.
Ключевые зарубежные производители лекарств в России
Давая оценку развитию структурных подразделений по связям с госорганами в зарубежных компаниях, ведущих бизнес в России, стоит признать их крайнюю неразвитость, что не соответствует как коренным изменениям регуляторных инструментов фармацевтического рынка в России за последние десять лет и месту в нем зарубежных компаний, так и традиции проактивного влияния глобальной «фармы», например, на рынке США. По данным авторитетного американского Центра за ответственную политику, фармацевтическая отрасль занимает первое место среди всех отраслей по тратам на лоббизм в США. С 1998 по 2009 г. фармацевтические компании потратили на лоббистов в стране 1,817,218,843 долл. В России же ситуация прямо противоположная. Стоит констатировать, что зарубежные компании крайне пассивны в отстаивании своих интересов, их департаменты по связям с госорганами недостаточно развиты, они недофинансированы и кадрово недоукомплектованы, что в итоге не может не отражаться на степени их влияния, которое незначительно. Рассмотрим самых заметных зарубежных игроков корпоративного лоббизма в России в этой отрасли.
Abbott Laboratories — американская фармацевтическая компания с более чем 91 000 сотрудников, основанная в 1888 г. На конец 2015 г. у компании было более 47 000 акционеров, рыночная капитализация составляла 57 млрд долл., а объем выручки в России — 483 млн долл.
Novartis International — транснациональная фармацевтическая корпорация, вторая по величине в мире фармацевтическая компания, второй по размерам рыночной доли в Европе производитель фармацевтических препаратов. Деятельностью по взаимодействию с органами государственной власти в компании занимается Татьяна Логинова, директор по стратегии и взаимодействию с государственными органами.
Pfizer — американская компания была основана в 1849 г. двумя эмигрантами из Германии. Оборот на сегодняшний день превышает 51 млрд долл. Работниками Pfizer являются 78 000 человек. Деятельностью по связям с органами государственной власти в компании занимаются Наиль Егофаров, директор отдела по связям с общественностью, и Владимир Гайдай, Health System & Policy Manager.
Sanofi — французская фармацевтическая компания производит лекарства от различных заболеваний, вакцины, онкологические препараты и т.д., работодатель для 112 000 человек. Деятельностью по связям с органами государственной власти в компании занимается Юрий Мочалин, директор по корпоративным связям.
AstraZeneca plc. — шведско-британская компания была основана в 1999 г. путем слияния шведской Astra AB с британской Zeneca. Оборот AstraZeneca составляет около 25 млрд долл., а капитализация — 93,8 млрд долл. Крупнейшими акционерами, по данным Bloomberg, являются:
- BlackRock (8,05%);
- Wellington Management (5,14%);
- Invesco (4,99%);
- Vanguard Group (4,78%);
- Investor AB (4,09%);
- 79,22% акций в свободном обращении.
За девять месяцев 2014 г. выручка компании составила 19,4 млрд долл., чистая прибыль — 1,6 млрд долл. Деятельностью по связям с органами государственной власти в компании занимается Ирина Иванищева, директор отдела по работе с государственными органами и юридическим вопросам по региону «Россия и Евразия».
Ключевые дистрибьюторы лекарств в России
Продажи лекарств в России осуществляется через дистрибьюторов. В 2015 г. лидерами по объему продаж являются АО «НПК “Катрен”», увеличившее долю до 20%, ПАО «Протек» с долей 18% и АО «Роста» с долей 12%. Рассмотрим наиболее крупных представителей данного сектора.
АО «НПК “Катрен”», основанная в Новосибирске в 1993 г., сегодня является крупнейшим российским фармдистрибьютором, удерживающим, по данным IMS Health за 2014 г., 16,9% рынка прямых поставок лекарственных средств. В группу «Катрен» также входят оптовые дистрибьюторы ООО «Вента.лтд» (Украина), ТОО «Эмити интернешнл» (Казахстан), ОДО «Доминантафарм» (Белоруссия), сеть аптек «Мелодия здоровья» (496 аптек с учетом франчайзинга в 53 субъектах РФ на 31 декабря 2014 г.), интернет-портал . Акционерами, по данным компании от 31 декабря 2014 г., являются:
- Леонид Конобеев (52,77%);
- Владимир Спиридонов (27,44%);
- ЕБРР (15,37%).
Согласно МСФО компании за 2014 г., выручка составила 4,4 млрд долл., чистая прибыль — 69,3 млн долл.
ПАО «Протек» основано в 1990 г., занимается дистрибуцией фармпрепаратов и товаров для красоты и здоровья (основная операционная компания — ЗАО «Центр внедрения “Протек”»), производством лекарственных препаратов (ЗАО «Фармфирма “Сотекс”», ООО «Протеиновый контур», АО «Рафарма») и розничными продажами через аптечную сеть «Ригла» (1202 аптеки в 40 регионах России по итогам 2014 г.). Акционерами, по данным компании от 31 декабря 2014 г., являются:
- Вадим Якунин (74,42%, из которых 50% через ООО «Протек»);
- венгерская компания Gedeon Richter (5%);
- 3,42% выкуплены предприятиями группы;
- остальные акции обращаются на Московской бирже.
По данным от 28 апреля 2015 г. и МСФО компании за 2014 г., капитализация составила 21,6 млрд руб., выручка — 156,9 млрд руб., чистая прибыль — 4,8 млрд руб.
АО «Роста» основана в 2002 г. в результате объединения нескольких фармацевтических компаний. Один из крупнейших дистрибьюторов фармацевтического рынка России. Компания занимается дистрибуцией, розничной торговлей (сети «Первая помощь», «Радуга» и «Ладушка»), производством (завод «Радуга продакшн»). Согласно «СПАРК-Интерфаксу» в 2014 г. выручка АО «Роста» от дистрибуции составила 72,7 млрд руб., от розничной торговли — 3 млрд руб., от производства в 2013 г. — 619 млн руб. Акционерами компании являются Давид Паникашвили (55,5%) и финская компания Tamro (42,5%). В 2009 г. выручка составила 47,24 млрд руб., чистая прибыль — 1,79 млрд руб.
АО «СИА ИНТЕРНЕЙШНЛ ЛТД» — один из крупнейших дистрибьюторов фармацевтического рынка России. Компания основана в 1993 г. и представлена 39 региональными представительствами по всей стране — от Москвы до Владивостока. В феврале 2016 г. стало известно, что крупный пакет акций «СИА ИНТЕРНЕЙШНЛ ЛТД» купил президент инвестиционной компании «А1» Александр Винокуров.
Ключевые аптечные сети в России
ПАО «Аптечная сеть 36,6» было создано в 1991 г. Акционерами, по данным компании от 31 декабря 2014 г., являются:
- Palesora Limited (54,97%, бенефициары — Владимир Кинцурашвили, Игорь Жибаровский, Игорь Саганелидзе, Темур Шакая);
- Leader Distribution Ltd (8,6%);
- Ronin Europe Limited (7,4%).
По данным от 21 апреля 2015 г. и МСФО компании за первое полугодие 2014 г., капитализация составила 1,5 млрд руб., выручка — 4,7 млрд руб., чистый убыток — 383 млн руб.
Аптечная сеть «Ригла» — национальная аптечная сеть. По итогам 2015 г. насчитывает 1387 аптек. «Ригла» представляет розничный сегмент бизнеса АО «Протек». Ассортимент аптечной сети — 18 000 позиций, из которых около 60% занимают парафармацевтические товары.
Ассоциация Независимых Аптек (АСНА) предлагает аптекам присоединиться к собственной сети, деятельность которой направлена на повышение качества обслуживания в фармацевтической сфере, а также снижение закупочной стоимости препаратов. Ассоциация централизованно ведет 150 контрактов с производителями и реализует вместе с сетями-партнерами все существующие на рынке типы маркетинговых мероприятий. Количество точек на конец 2017 г. — 7300.
Аптечная сеть «Имплозия» основана в 1990 г. Грантом Безрученко. По данным DSM Group, по итогам первых трех кварталов 2015 г. компания заняла третье место среди аптечных сетей по объему продаж на рынке лекарственных средств с выручкой в 18,8 млрд руб. Таким образом, «Имплозия» уступила только «Ригле» (24,3 млрд руб.) и «36,6» (22,9 млрд руб.). Количество точек на конец третьего квартала 2015 г. по данным DSM Group) — 1385, лишь на две аптеки меньше, чем у лидера рынка «Риглы». Однако данные компаний разнятся: по информации RNC Pharma, на 1 октября 2015 г. «Имплозия» насчитывала 1510 аптек и была лидером рынка по количеству точек.
Профессиональные организации
Профессиональное представительство в фармацевтической отрасли напрямую связано с корпоративными субъектами и может быть типологизировано по следующим критериям: профессиональные представители российских и зарубежных компаний, дистрибьюторов и аптечных сетей. Кроме того, отдельными представителями являются комитеты и комиссии в РСПП и ТПП, а также пациентские организации. Рассмотрим их подробнее.
Лоббисты российских фармацевтических производителей
Ассоциация российских фармацевтических производителей (АРФП) объединяет ведущие российские фармпредприятия, на долю которых приходится более 80% выпускаемых в стране лекарственных средств, около 45% экспорта, более 75% отечественных лекарственных средств в программе ОНЛС. Генеральный директор — Виктор Дмитриев.
Комитет по предпринимательству в здравоохранении и медицинской промышленности Торгово-промышленной палаты РФ создан в целях содействия развитию отечественной системы здравоохранения, повышения конкурентоспособности фармацевтической и медицинской промышленности, повышения качества медицинского образования и квалификации специалистов отрасли, создания благоприятных условий для предпринимательской деятельности, развития торгово-экономических и научно-технических связей предпринимателей Российской Федерации с предпринимателями зарубежных стран. Комитет в основном лоббирует интересы российских товаропроизводителей в части к участию в торгах со стороны заказчиков. Регулярно обращается с резолюциями в Правительство РФ. В работе действует коалиционно с Комиссией РСПП по фармацевтической и медицинской промышленности. Председатель — Валерий Сергиенко.
Комиссия по фармацевтической и медицинской промышленности Российского союза промышленников и предпринимателей в основном занимается лоббированием интересов отечественных производителей. Так, в 2015 г. комиссией было подготовлено обращение к Председателю Правительства РФ Дмитрию Медведеву с просьбой ускорить принятие проектов постановлений Правительства Российской Федерации об установлении ограничений на допуск лекарственных препаратов и медицинских изделий, происходящих из иностранных государств, при осуществлении закупок для обеспечения государственных и муниципальных нужд. По мнению комиссии, указанные постановления обеспечат динамическое развитие высокотехнологического отечественного производства лекарственных средств и медицинских изделий. Председатель — Юрий Калинин.
Лоббисты зарубежных фармацевтических производителей
Ассоциация международных фармацевтических производителей (AIPM) была создана в 1994 г. и представляет на территории Российской Федерации интересы ведущих международных фармацевтических компаний-производителей современных эффективных, безопасных и качественных лекарственных препаратов. AIPM объединяет 55 международных компаний, на долю которых приходится свыше 80% мирового фармацевтического производства и более 60% объема лекарственных средств, поставляемых на территорию Российской Федерации. Исполнительный директор ассоциации — Владимир Шипков.
Ассоциация фармацевтических компаний «Фарма инновации» (Ассоциация «Инфарма») объединяет крупнейших производителей лекарственных препаратов, входящих в ТОП-20 мировых фармацевтических компаний, активно инвестирующих в научные исследования и разработку. Исполнительным директором ассоциации является Вадим Кукава.
Лоббисты дистрибьюторов и аптечных сетей
Союз профессиональных фармацевтических организаций (СПФО) — профессиональная ассоциация, зарегистрированная в 2002 г. с целью создания платформы для взаимодействия всего спектра участников фармацевтического рынка: дистрибьюторов, аптечных сетей, отечественных и иностранных производителей фармацевтической продукции. Исполнительный директор — Лилия Титова.
Российская ассоциация аптечных сетей (РААС) — некоммерческая профессиональная организация, основанная ведущими российскими розничными фармацевтическими предприятиями. Участники ассоциации объединились в рамках единой некоммерческой организации для координации предпринимательской деятельности и защиты общих профессиональных интересов в фармацевтической отрасли. Исполнительный директор — Нелли Игнатьева.
Ассоциация аптечных учреждений «СоюзФарма» является некоммерческой организацией, созданной по инициативе московских аптек 16 марта 2001 г. В состав ассоциации, по данным от 1 сентября 2016 г., входят 715 аптечных организаций — юридических лица, владеющих 4115 торговыми точками в 43 субъектах Российской Федерации. Президент ассоциации — Андрей Егоров.
Пациентские организации
Пациентские организации — это общественные объединения больных, преимущественно страдающих тяжелыми хроническими заболеваниями, и их родственников, созданные для защиты интересов больных людей. Главным принципом объединения выступает наличие какого-то одного заболевания, например Всемирная ассоциация гемофилии, Европейская коалиция онкологических больных. Основной целью таких организаций является лоббирование интересов пациентов, решение проблем лечения и профилактики заболеваний, социальной реабилитации больных и членов их семей. Рассмотрим несколько наиболее заметных в России пациентских организаций.
Всероссийский союз общественных объединений пациентов является добровольным общественным объединением юридических лиц — общественных объединений пациентов. Основной целью деятельности союза является координация деятельности членов Союза для достижения максимально возможного уровня медицинской помощи и мер по охране здоровья населения в целом и каждого гражданина в отдельности. Сегодня ВСП объединяет 14 общероссийских и межрегиональных организаций и более 80 их подразделений — региональных НКО, представляющих интересы более 5 млн граждан Российской Федерации — пациентов с тяжелыми инвалидизирующими заболеваниями. Сопредседатель — Юрий Жулев.
Общероссийская общественная организация «Лига защитников пациентов» была создана 1 апреля 2000 г. для участия и разработки программ по повышению качества медицинского обслуживания, а также содействия соблюдению прав и интересов пациентов. Президент — Александр Саверский.
Союз пациентов и пациентских организаций по редким заболеваниям — объединение для координации усилий пациентов с редкими заболеваниями, врачей, исследователей, государственных деятелей, общественных организаций и общества в целом для улучшения диагностики, обеспечения доступности лечения и сохранения жизни пациентов с редкими заболеваниями.
Российская диабетическая организация создана для всесторонней помощи больным сахарным диабетом и их близким.
Краткая карта политических стейкхолдеров
На уровне Президента Российской Федерации:
- Совет по стратегическому развитию и приоритетным проектам (председатель Совета — Президент Российской Федерации). Здравоохранение входит в перечень основных направлений стратегического развития Российской Федерации.
- Совет по модернизации экономики и инновационному развитию.
- Экономический совет.
На уровне Администрации Президента Российской Федерации:
на руководящем уровне:
- помощник Президента, курирующий Экспертное управление Президента РФ;
- помощник Президента, курирующий Государственно-правовое управление Президента РФ;
на функциональном уровне:
- Государственно-правовое управление Президента (ГПУ);
- Экспертное управление Президента;
- полномочные представители Президента РФ в палатах Федерального Собрания РФ.
На уровне Правительства Российской Федерации:
на межведомственном уровне:
- Федеральный проектный офис (Президиум Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам) (руководитель — Дмитрий Медведев). Задача Федерального проектного офиса — помочь федеральным и региональным органам государственной власти организовать их проектную деятельность так, чтобы внедрение проектных подходов не нарушало исполнение текущих обязательств. В рамках Федерального проектного офиса формируются Проектные комитеты. Проектный комитет — основной орган управления реализацией приоритетного проекта или программы проектов. В части интересов фармацевтической отрасли сформирован Проектный комитет по основному направлению стратегического развития «Здравоохранение». Руководителем проектного комитета является куратор соответствующего направления или приоритетного проекта в ранге заместителя Председателя Правительства (Татьяна Голикова). Решения проектного комитета приоритетного проекта или программы — обязательны для реализации федеральными органами исполнительной власти.
- Правительственная комиссия по импортозамещению (руководитель — Дмитрий Медведев);
- Рабочая группа «Здравоохранение» Экспертного совета при Правительстве РФ;
на руководящем уровне:
- Татьяна Голикова, вице-премьер, курирует: государственную политику в области оборота лекарственных средств и медицинских изделий, в том числе имплантируемых в организм человека. Определение перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на очередной год. Контроль за применением цен на такие препараты. Вопросы государственной регистрации лекарственных средств и медизделий. Защиту от фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов. Государственное регулирование в сфере донорства крови и службы крови, донорства органов человека. Оборот биомедицинских клеточных продуктов. Оборот наркотических средств в медицинских целях. Координирует и дает поручения в этой части: Министерству здравоохранения (Веронике Скворцовой).
- Дмитрий Козак, вице-премьер, отвечающий за реализацию государственной политики в области промышленности, в том числе в сфере фармацевтической и медицинской промышленности. Курирует: производство лекарственных средств и медицинских изделий, в том числе имплантируемых в организм человека. Производство изделий, товаров и продуктов реабилитационной индустрии, предназначенных для инвалидов. Создание экономических условий для развития фармацевтической и медицинской промышленности в России. Координирует и дает поручения в этой части: Министерству промышленности и торговли (Денису Мантурову).
- Константин Чуйченко, вице-премьер, отвечающий за организацию законопроектной деятельности.
На уровне Аппарата Правительства Российской Федерации:
на руководящем уровне:
- заместитель Руководителя Аппарата Правительства РФ, курирующий Департамент социального развития Правительства РФ (Нелли Найговзина);
- заместитель Руководителя Аппарата Правительства РФ, курирующий Департамент проектной деятельности Правительства РФ.
- заместитель Руководителя Аппарата Правительства РФ, курирующий Департамент промышленности и инфраструктуры Правительства РФ.
- заместитель Руководителя Аппарата Правительства РФ, курирующий организацию законопроектной деятельности Правительства РФ (Андрей Логинов);
на функциональном уровне:
- Департамент социального развития Правительства РФ (руководитель — Сергей Вельмяйкин);
- Департамент проектной деятельности Правительства РФ выступает в роли Федерального проектного офиса (руководитель — Андрей Бадин);
- Департамент промышленности и инфраструктуры Правительства РФ;
- полномочные представители Правительства РФ в Совете Федерации и Государственной Думе Федерального Собрания РФ (Андрей Яцкин, Александр Синенко).
На уровне Федеральных органов исполнительной власти (ФОИВ):
- Министерство здравоохранения и социального развития РФ в части выработки и реализации государственной политики и нормативно-правовому регулированию в сфере здравоохранения, обращения лекарственных средств для медицинского применения, включая вопросы фармацевтической деятельности (руководитель — Вероника Скворцова);
- Министерство промышленности и торговли РФ в части функций по оказанию государственных услуг (лицензирование производства лекарственных средств; выдача документа, содержащего сведения о стадиях технологического процесса производства лекарственного средства; выдача заключений GMP; выдача документов CPP), управлению государственным имуществом в сфере фармацевтической промышленности (руководитель — Денис Мантуров);
- Федеральная антимонопольная служба в части осуществления контроля и надзора соблюдения антимонопольного законодательства в области здравоохранения, социальной политики, торговли и услуг в непроизводственной сфере (руководитель — Игорь Артемьев);
- Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор) в части осуществления государственной регистрации медицинских изделий, а также осуществления функций по контролю и надзору в сфере здравоохранения (руководитель — Михаил Мурашко);
- Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека в части осуществления функций по выработке и реализации государственной политики и нормативно-правовому регулированию в сфере защиты прав потребителей (руководитель — Анна Попова);
- Федеральная служба по интеллектуальной собственности (Роспатент) в части оказания государственных услуг в сфере правовой охраны изобретений.
На уровне Федерального Собрания Российской Федерации:
- Государственная Дума:
- Комитет по охране здоровья;
- Комитет Госдумы по промышленности;
- Совет Федерации:
- Комитет по социальной политике.
Краткая характеристика отраслевого лоббирования
В любой стране мира фармацевтическая отрасль находится в центре повышенного внимания государства. С одной стороны, это объясняется социальным характером продукции отрасли, с другой — значительными рисками негативных побочных последствий употребления лекарств. Именно поэтому процесс выхода лекарственных препаратов на рынок сопровождается огромным количеством регламентирующих бюрократических процедур и согласований. В то же время это считается и первой причиной того, что фармацевтическая отрасль в мире является главным донором на лоббистские цели и политическое влияние. Так, если фармацевтическая отрасль в США в 1998 г. потратила на лоббизм 69 218 254 долл., то в 2010 г. уже 240 325 934 долл. — более чем трехкратный рост за 12 лет.
Определяющим фактором лоббизма в фармацевтической отрасли России является ее зависимость от системы государственных закупок лекарств, на которую приходится порядка 60% всех продаж компаний. Указанное определяет ключевой вектор работы фармацевтических лоббистов, от успехов которых в данной области зависят финансовые показатели компаний.
Важной особенностью работы отраслевых лоббистов также является их влияние на защиту интеллектуальной собственности на тот или иной лекарственный препарат в зависимости от имеющихся интересов. Производители инновационных продуктов заинтересованы в максимальном продлении своих эксклюзивных прав на продажу изобретенного ими препарата, производители аналогов (дженериков), апеллируя к антимонопольной тематике, стремятся разрушить монополию инновационных корпораций, выводя на рынок значительно более дешевые аналоги. Государство же здесь, с одной стороны, заинтересовано в том, чтобы инвестиции в научно-исследовательские разработки продолжались (а именно для этого нужны стимулы в виде патентных гарантий), но с другой, в силу социальной направленности лекарственных препаратов, стремится в том числе за счет конкуренции сделать их более доступными для населения, а также сократить бюджетные затраты.
Другой особенностью лоббизма отрасли являются постоянные спекуляции российских производителей лекарств относительно угроз национальной безопасности России в связи с тем, что до двух третей потребляемых населением лекарств производится за рубежом. Данная риторика особенно усилилась в контексте наложения на Россию большинством западных стран секторальных санкций после «украинских событий». В итоге это привело к поддержке российскими властями локальных производителей и вылилось для них в значительном количестве льгот и преференций, а программа по импортозамещению лекарственных средств стала одной из приоритетных задач российского федерального правительства.
Ключевые предметы лоббизма в органах публичной власти
Работу специалиста по связям с госорганами в фармацевтической отрасли России условно можно разделить на следующие большие этапы:
- Сопровождение допуска лекарственного препарата на рынок России. В рамках этого этапа осуществляются следующие виды работ:
a) проведение клинических исследований препарата,
б) государственная регистрация лекарственного препарата,
в) получение российского сертификата GMP;
- Включение лекарственного препарата в ограничительные перечни таких препаратов, закупаемых за счет федерального и регионального бюджетов;
- Регулирование цен на лекарственные препараты;
- Защита интеллектуальной собственности на лекарственный препарат;
- Получение преференций в рамках государственных программ по импортозамещению.
Рассмотрим подробнее наиболее важные элементы выделенных этапов.
Проведение клинических исследований
Клиническое исследование — научное исследование с участием людей, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного лекарственного препарата.
В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. Эти данные являются важной составляющей регистрационного досье, на основе которого Министерство здравоохранения принимает решение о регистрации препарата или отказе в регистрации. Таким образом, проведение клинических исследований — это первый шаг в процессе вывода лекарственного препарата на фармацевтический рынок России. Клинические исследования проводятся только после получения специального разрешения Минздрава на его проведение. Для получения разрешения необходимо подготовить полное регистрационное досье в бумажном и электронном видах, сформировать заявление о государственной регистрации лекарственного препарата, оплатить государственную пошлину и подать бумажное досье в Департамент государственного регулирования обращения лекарственных средств Минздрава. Министерство проверяет комплектность документов, затем направляет досье на две параллельные экспертизы:
- этическую экспертизу, которую проводит Комитет по этике (Приказ Минздрава России от 10.07.2015 №435н «Об Этическом комитете Министерства здравоохранения Российской Федерации»);
- экспертизу документов для выдачи разрешения на клиническое исследование, которую проводит ФГБУ «Научный центр экспертизы средств медицинского применения» (в соответствии с Федеральным законом «Об обращении лекарственных средств» от 12.04.2010 №61-ФЗ и Приказом Минздрава России от 26.08.2010 №750н.).
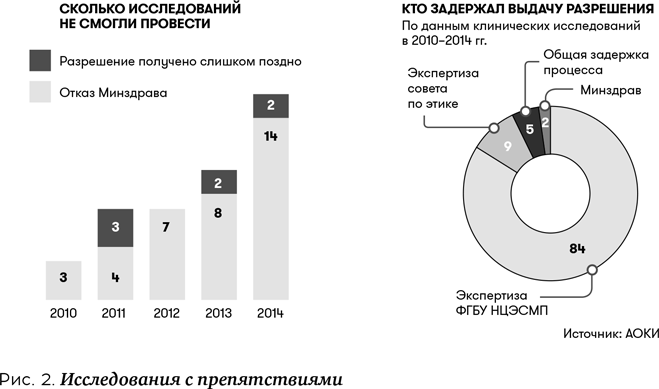
Если результат обеих экспертиз положительный, тогда Минздрав принимает решение о возможности выдачи разрешения на проведение клинического исследования. Данное решение появляется в личном кабинете заявителя на портале . После его получения необходимо подготовить второй комплект документов для клинического исследования, заполнить заявку на портале и сдать бумажные варианты документов в Минздрав. Затем выдается разрешение на проведение клинического исследования препарата в РФ. Все разрешенные клинические исследования вносятся в соответствующий реестр, также доступный на портале (рис. 2).
Контролирует проведение клинических исследований Росздравнадзор. Клиническое исследование может проводиться только в аккредитованном Росздравнадзором центре. В 2016 г. таких организаций в России было более 700. Срок проведения самого исследования зависит от его типа, длительности терапии и т.д., но занимает не менее шести месяцев (в среднем 10–18 месяцев).
По данным, опубликованным в июне 2016 г. «Ассоциацией организаций по клиническим исследованиям» (АОКИ), в которую входят крупнейшие мировые фармкомпании Pfizer, AstraZeneca, Bayer и др. число отказов в проведении клинических исследований в России растет с каждым годом; 84% отказов происходит на уровне ФГУП «Научный центр экспертизы средств медицинского применения» (НЦЭСМП), 9% — на уровне Комитета по этике Минздрава России. Основные причины отказа — недостаточные, по мнению экспертов Минздрава, данные об исследуемых лекарствах, хотя в США, Японии и странах Евросоюза те же самые данные удовлетворяют местного регулятора.
По данным DSM Group, за 2015 г., на российский рынок выведено 243 новых бренда иностранных лекарственных препаратов, 753 новых SKU, в том числе в уже существующих брендах, и проведены 804 клинических исследования.
Государственная регистрация лекарственных препаратов
Регистрация — это государственная экспертиза качества, эффективности и безопасности препарата с целью последующего разрешения медицинского применения препарата в РФ.
На сегодняшний день все, что связано с регистрацией лекарственных средств на российском фармацевтическом рынке, регулируется Федеральным законом РФ от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств». В соответствии с частью 1 статьи 13 данного закона «лекарственные препараты вводятся в гражданский оборот на территории Российской Федерации, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти».
Уполномоченным федеральным органом исполнительной власти, регулирующим вопросы регистрации лекарственных средств, является Министерство здравоохранения. Вопросами регистрации новых и обращения уже зарегистрированных лекарственных средств занимается Департамент государственного регулирования обращения лекарственных средств Министерства здравоохранения.
Государственной регистрации подлежат следующие категории лекарственных препаратов:
- Оригинальные лекарственные препараты;
- Воспроизведенные лекарственные препараты;
- Новые комбинации зарегистрированных ранее лекарственных препаратов;
- Лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке.
Данные о зарегистрированном лекарственном препарате, в том числе о фармацевтической субстанции, входящей в его состав, включаются в Государственный реестр лекарственных средств, а заявителю государственной регистрации выдается Регистрационное удостоверение лекарственного препарата и Решение о включении фармацевтической субстанции в Государственный реестр лекарственных средств.
В соответствии со статьей 28 Федерального закона РФ от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств» «регистрационное удостоверение лекарственного препарата с указанием лекарственных форм и дозировок выдается бессрочно, за исключением регистрационного удостоверения лекарственного препарата, выдаваемого со сроком действия пять лет, на впервые регистрируемые в Российской Федерации лекарственные препараты». По истечении пятилетнего срока выдается бессрочное регистрационное удостоверение лекарственного препарата при условии подтверждения его государственной регистрации.
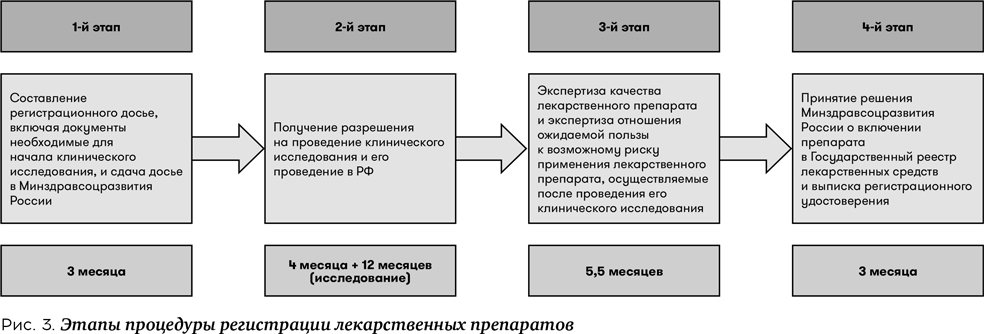
Юридически процедура регистрации лекарственных препаратов состоит из нескольких основных этапов:
- Подготовка документов для формирования регистрационного досье, включая документы, необходимые для получения разрешения на проведение клинического исследования лекарственного препарата, подача регистрационного досье в Министерство здравоохранения РФ;
- Получение разрешения на проведение клинического исследования (для препаратов, разрешенных для медицинского применения на территории Российской Федерации менее 20 лет), проведение клинического исследования;
- Экспертиза качества лекарственного препарата и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата. Данный этап осуществляется после завершения клинического исследования, заявитель сдает отчет с его результатами, вместе с платежкой об оплате госпошлины и заявлением о возобновлении государственной регистрации в Минздрав России. Процедура регистрации возобновляется, и регистрационное досье передается в экспертное учреждение — ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России (ФГБУ «НЦЭСМП») для проведения экспертизы качества и отношения ожидаемой пользы к возможному риску применения препарата. При экспертизе нормативно утвержден запрет на общение представителей производителя с экспертами. В итоге эксперты ФГБУ «НЦЭСМП» на основании представленных данных делают заключение об эффективности и безопасности применения препарата;
- Принятие Министерством здравоохранения РФ решения о включении лекарственного препарата в Государственный реестр лекарственных средств и оформление регистрационного удостоверения. Из ФГБУ «НЦЭСМП» Минздрава России в Минздрав России передается экспертное заключение с результатами проведенных экспертиз. При положительном заключении эксперты Минздрава России вносят препарат в государственный реестр лекарственных средств и выписывают Регистрационное удостоверение. Если в результате проведенной экспертизы невозможно подтвердить качество или эффективность/безопасность препарата, тогда выдается решение об отказе в государственной регистрации препарата. При первой регистрации препарата в России регистрационное удостоверение выдается на пять лет. По истечении данного срока производитель подает документы для подтверждения регистрации препарата и тогда уже регистрационное удостоверение выдается бессрочно.
В соответствии с законом №61-ФЗ от 12.04.2010 «Об обращении лекарственных средств» срок регистрации составляет 160 рабочих дней и 80 рабочих дней (для орфанных, первых трех воспроизведенных препаратов, лекарственных препаратов, предназначенных исключительно для применения детьми до 18 лет).
Таким образом, ориентировочный срок регистрации препарата, требующего проведения клинического исследования в РФ, составляет не менее 18 месяцев (поскольку в вышеуказанные сроки не включено время на предоставление образцов и стандартов, а также время для ответа на запросы Минздрава) (рис. 3).
По закону с 1 января 2016 г. иностранные фармпроизводители не могут зарегистрировать в России новые препараты или перерегистрировать уже вышедшие на рынок лекарства без подтверждения соответствия своих стандартов качества российским требованиям по стандарту GMP, выданного Министерством промышленности и торговли.
Регистрация препаратов в России по местному законодательству может осуществляться по национальной процедуре или по утверждаемой процедуре Евразийского экономического сообщества (ЕврАзЭс) лишь до 31 декабря 2020 г., и только по процедуре ЕврАзЭс после 31 декабря 2020 г.
Процедура получения российского сертификата GMP
Стандарт GMP был разработан в 1963 г. Всемирной организацией здравоохранения (ВОЗ) как фундаментальный элемент обеспечения качества фармацевтических препаратов, а именно правила, регламентирующие условия качественного и безопасного производства лекарств. GMP впервые был применен в США. Первый международный документ, посвященный данным стандартам, был принят в 1967 г., а уже к 1969 г. была принята резолюция ВОЗ, предписывающая всем странам применять и соблюдать стандарт производства фармацевтических препаратов. В настоящее время существуют стандарты GMP для стран Европейского Союза, для стран-членов Ассоциации стран Юго-Восточной Азии (АСЕАН), для стран-участниц Соглашения по фармацевтическому контролю. Подобного рода документы существуют и в национальных системах более чем в 40 государствах мира.
В международной практике сертификат GMP является основным документом, на основании которого выдается лицензия на конкретный фармацевтический продукт. Сертификат GMP означает, что лекарство было выпущено в строгом соответствии с прописанными в заявлении на получение сертификата технологическими требованиями, а также должным образом упаковано, что дает гарантии сохранения всех свойств на протяжении срока годности продукта.
По закону с 1 января 2016 г. иностранные фармпроизводители не могут зарегистрировать в России новые препараты или перерегистрировать уже вышедшие на рынок лекарства без подтверждения соответствия своих стандартов качества российским требованиям по стандарту GMP. 9 августа 2016 г. опубликован Приказ №1714 «Об утверждении Административного регламента Министерства промышленности и торговли РФ по предоставлению государственной услуги по выдаче заключений о соответствии производителей лекарственных средств для медицинского применения требованиям Правил надлежащей производственной практики (GMP)». Процедуру получения сертификата GMP в рамках Минпромторга России осуществляет Департамент развития медицинской и фармацевтической промышленности.
Обязательным условием получения сертификата GMP является инспектирование иностранного производителя. В соответствии с Приказом Министерства промышленности и торговли РФ от 21.12.2015 №4184 ФГУП «Государственный институт лекарственных средств и надлежащих практик» (ФГБУ «ГИЛС и НП») является уполномоченным учреждением на проведение инспектирования иностранных производителей лекарственных средств для медицинского применения.
Длительность получения российского GMP сертификата составляет около 10 месяцев. Последовательность процедуры получения российского сертификата GMP следующая:
- Подача заявления и комплекта документов в Минпромторг России заявителем (Приказ Министерства промышленности и торговли Российской Федерации от 04.02.2016 №261 «Об утверждении форм заявления о выдаче заключения о соответствии производителя GMP»);
- Проверка правильности и комплектности Минпромторгом России (10 рабочих дней);
- В случае необходимости Минпромторг может направить заявителю запрос об уточнении сведений документов, на которое заявитель обязан ответить в течении 20 рабочих дней (в противном случае — отказ);
- Принятие решения о проведении инспектирования. После этого документы направляются в ФГБУ «ГИЛС и НП» для следующего этапа — инспектирования;
- В течение 20 рабочих дней с момента принятия решения о проведении инспектирования ФГБУ «ГИЛС и НП» вносит производственную площадку в график инспектирования, который публикуется в календаре запланированных GMP инспекций. Обновление графика происходит в течение трех рабочих дней с момента его изменения.
Инспектирование должно быть проведено в срок не более 160 рабочих дней со дня принятия решения об инспектировании Минпромторгом. Само инспектирование длится не более 10 рабочих дней.
Далее заявитель заключает договор с ФГБУ «ГИЛС и НП» и оплачивает расходы на инспектирования в течение 20 рабочих дней с момента подписания договора. После проведения инспектирования составляется инспекционный отчет в течение не более 30 календарных дней. Далее в течение трех рабочих дней отчет направляется заявителю и в Минпромторг России. Заключение выдается в течение 10 рабочих дней со дня подписания экспертного отчета или его поступления от ФГБУ «ГИЛС и НП». Заключение оформляется в соответствии с Приказом Министерства промышленности и торговли РФ от 04.02.2016 №261 Об утверждении форм заявления о выдаче заключения о соответствии производителя GMP. Срок действия российского сертификата GMP — три года с даты окончания инспектирования.
С 18 декабря 2015 г. по 1 сентября 2016 г. в Минпромторг России поступило 396 заявлений о выдаче заключений о соответствии иностранного производителя правилам GMP из 44 стран мира. В ФГУП «ГИЛС и НП» для инспектирования было передано 225 заявлений производителей. На сентябрь 2016 г. проверено 58 производственных площадок в 16 странах.
Включение лекарственных препаратов в ограничительные перечни
Порядок формирования перечней лекарственных препаратов осуществляется в рамках государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи, а также в рамках государственной социальной помощи в виде предоставления гражданам набора социальных услуг. В настоящее время существуют следующие государственные программы финансирования льготного лекарственного обеспечения.
Перечень жизненно необходимых и важнейших лекарственных препаратов (перечень ЖНВЛП) — ежегодно утверждаемый Правительством РФ перечень лекарственных препаратов для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации.
Согласно определению ВОЗ, к жизненно необходимым и важнейшим лекарственным средствам относятся препараты, которые отвечают приоритетным потребностям медицинского обслуживания населения и выбираются с учетом значимости для общественного здравоохранения, доказательств эффективности, безопасности и сравнительной экономической эффективности.
В России при формировании перечней ЖНВЛП принимаются во внимание следующие факторы: наличие государственной регистрации предельных отпускных цен производителей лекарственных препаратов, предоставление научно обоснованных данных о клинической эффективности и безопасности, преимуществах и (или) особенностях действия конкретного лекарственного средства при определенном заболевании, синдроме или клинической ситуации, его терапевтической эквивалентности лекарственным средствам со схожими механизмами фармакологического действия, уровень доказательности эффекта. Одним из критериев включения того или иного препарата в перечень ЖНВЛП в соответствии с порядком формирования перечней является локализация его производства в России.
На ЖНВЛП, по данным DSM Group, приходится 34,3% коммерческого сегмента фармацевтического рынка (т.е. продажи лекарств в аптеках, его оборот в 2013 г. — 609 млрд руб.). Рынок лекарств, относящихся к ЖВНЛП, в 2014 г. оценивался в 434 млрд руб. в оптовых ценах, из которых 194 млрд руб. пришлось на госзакупки. Цены на такие лекарства с 1 апреля 2010 г. регулирует государство: Минздрав по согласованию с ФАС регистрирует предельные отпускные цены производителя, регионы устанавливают оптовые и розничные надбавки. Российские производители могут раз в г. повысить цену на прогнозируемый уровень инфляции текущего года, у иностранных возможности перерегистрации цен нет.
Важно отметить, что присутствие лекарственного препарата в перечне ЖНВЛП является обязательным требованием для последующего включения его в другие нижеперечисленные перечни. Таким образом, перечень ЖНВЛП является основой для формирования других списков.
- «Семь высокозатратных нозологий» (7 ВЗН) — это перечень лекарственных препаратов, предназначенных для обеспечения лиц, больных редкими и высокозатратными заболеваниями. По одноименной программе централизованно закупаются лекарства для больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также для пациентов, перенесших трансплантацию органов или тканей. По итогам 2015 г. более 60% финансирования программы занимают миелолейкоз (40%) и рассеянный склероз (24%), еще 22% приходится на гемофилию. В соответствии с Федеральным законом от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» финансирование программы осуществляется за счет бюджетных ассигнований, предусмотренных в федеральном бюджете Минздраву России. Кроме того, министерство ведет национальный регистр лиц, больных орфанными (редкими) заболеваниями. В 2016 г. на программу «7 ВЗН» в бюджете заложено 43,6 млрд руб. В 2015 г. доля зарубежных производителей в госзакупках по этой программе составила 65% в стоимостном выражении и 83% — в упаковках. В программе участвуют 132 000 льготников. Следовательно, финансовое обеспечение одного пациента в среднем составляет 330 000 рублей в год. 7 ВЗН является одной из самых привлекательных программ лекарственного обеспечения в России как для иностранных производителей (предоставляя возможность включения дорогостоящих инновационных препаратов в льготу с гарантированными закупками), так и отечественных (предусматривая окончание патентной защиты на ряд оригинальных препаратов, а также возможность разработки инновационных лекарственных средств). На 2015 г. суммарная доля отечественных препаратов в закупках лекарственных средств составила порядка 30% в денежном выражении и 25% — в упаковках.
- «Обеспечение необходимыми лекарственными средствами» (ОНЛС) — это перечень лекарственных препаратов для медицинского применения, в том числе назначаемых по решению врачебных комиссий медицинских организаций. За предоставлением необходимых лекарственных препаратов, изделий медицинского назначения граждане обращаются в лечебно-профилактические учреждения, оказывающие первичную медико-санитарную помощь, за предоставлением специализированных продуктов лечебного питания для детей-инвалидов — в лечебно-профилактические учреждения, оказывающие медико-генетическую помощь (в редакции Приказа Министерства здравоохранения и социального развития РФ от 07.02.2011 №85н). В программе «ОНЛС» участвуют, т.е. имеют право на бесплатное получение лекарственных средств, порядка 3,8 млн человек. Финансируется программа из средств федерального бюджета.
- Минимальный ассортимент (МА). В соответствии с п. 6 ст. 55 Федерального закона от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств» аптечные организации и индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, обязаны обеспечивать утвержденный Правительством РФ и формируемый в установленном им порядке минимальный ассортимент лекарственных препаратов, необходимых для оказания медицинской помощи. Отсутствие медикаментов, которые входят в перечень обязательного минимального ассортимента лекарственных средств, необходимых для оказания медицинской помощи, является грубым нарушением лицензируемой деятельности, за которое ст. 14.1 КоАП РФ установлена административная ответственность.
Перечень ЖНВЛП требуется регулярно обновлять, поскольку технологии лечения постоянно совершенствуются, появляются более современные лекарства, поэтому он формируется ежегодно. Перечень 7 ВЗН, перечень ОНЛС и МА формируются не реже одного раза в три года. В официальный перечень ЖНВЛП на 2016 г. входят 646 наименований, в ОНЛС — 335 наименований, в 7 ВЗН — 24, в МА — 70 наименований. Лоббисты фармацевтической индустрии стремятся включить свои препараты в указанные списки в силу значительного веса государственных закупок в структуре доходов фармацевтических компаний. Для наглядности представим здесь долгожданный для лоббистов проект распоряжения Правительства РФ от 2016 г., который выходит из Минздрава России по итогам работы межведомственной комиссии (работу которой мы рассмотрим далее).
Как видно из проекта распоряжения Правительства РФ (см. далее), перечень лекарственных препаратов на 2017 г. не изменился. Как следует из пояснительной записки, произошло это, потому что изменения «увеличат финансовую нагрузку» в результате чего «предусматривается продление срока действия до 1 марта 2018 г. перечней лекарственных препаратов и минимального ассортимента, утвержденных распоряжением Правительства Российской Федерации от 26.12.2015 №2724-р.» Соответственно, задача фармацевтических лоббистов — подготовиться уже к 2018 г., проведя соответствующую работу с профильными стейкхолдерами. Рассмотрим далее процесс по формированию списков лекарственных препаратов и минимального ассортимента подробнее.
Формирование перечней и минимального ассортимента
Формирование перечней и минимального ассортимента осуществляется образованной Минздравом России Комиссией по формированию перечней лекарственных препаратов и минимального ассортимента. В состав комиссии входят представители:
- Министерства здравоохранения Российской Федерации;
- Министерства промышленности и торговли Российской Федерации;
- Министерства финансов Российской Федерации;
- Министерства труда и социальной защиты Российской Федерации;
- Министерства регионального развития Российской Федерации;
- Федеральной службы по надзору в сфере здравоохранения;
- Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека;
- Федеральной антимонопольной службы;
- Федерального медико-биологического агентства;
- Федерального агентства научных организаций, иных федеральных органов исполнительной власти, федеральных государственных образовательных организаций высшего медицинского и фармацевтического образования, а также федеральных государственных медицинских и фармацевтических научных организаций.
В состав Комиссии входят председатель, заместитель председателя, секретарь и члены Комиссии. Решения Комиссии принимаются при поддержке не менее двух третей от числа голосов присутствующих на заседании членов Комиссии путем открытого голосования.
Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи утверждены Постановлением Правительства Российской Федерации от 28.08.2014 №871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». Данные правила содержат интегральную шкалу клинической и клинико-экономической оценки лекарственного препарата. Каждый лекарственный препарат, поданный в заявке, оценивается по критериям, связанным с качественными характеристиками проведения клинических исследований, показателями эффективности и безопасности. За каждый критерий начисляется определенное количество баллов. Дополнительные баллы (плюс три к итоговой оценке) полагаются для препаратов, локализованных на территории Российской Федерации.

