Новые данные и информация
Моя ГИС
ПОДХОД: ДЕСЯТЬ НА ДЕСЯТЬ
Цифровые следы, которые мы оставляем каждый день, рассказывают о нас гораздо больше, чем мы знаем. Это может стать кошмаром для конфиденциальности — или это может стать основой более здорового, более процветающего мира.
Алекс «Сэнди» Пентлэнд, медиа-лаборатория МИТ1
Где мудрость, которую мы потеряли в знаниях? Где знания, которые мы потеряли в информации?
Томас Элиот
Цель состоит в том, чтобы превратить медицину в квантовую область.
Джеффри Хаммербачер, Маунт-Синайская медицинская школа Икана2
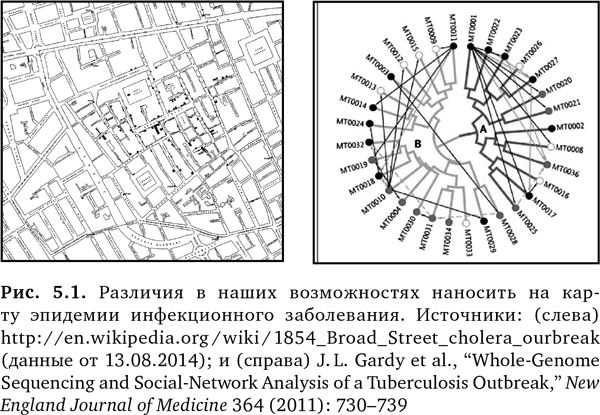
Получить в поисковой системе Google любой маршрут проезда так просто, что вы, вероятно, даже не задумываетесь о том, как это делается. Это классическая географическая информационная система (ГИС) с многочисленными слоями данных — таких как трафик, вид со спутника или вид улицы, — нанесенных на карту. Хотя термин ГИС появился только в 1968 г., первые приложения, которые теперь называются пространственно-временными, были разработаны еще в 1800-е гг.3 Они использовались для отслеживания вспышек заболевания холерой в Париже и Лондоне. Конечно, в наши дни гораздо больше людей пользуются ГИС во время путешествий по дорогам, чем в эпидемиологии, но медицинское применение остается очень важным. Только вместо того, чтобы просто наносить на карту места, где умерли жертвы эпидемии холеры, мы можем сочетать современные инструменты социальных сетей и геномного секвенирования, чтобы определить патогенный штамм, индивидуальную реакцию и точный путь распространения вспышки эпидемии (рис. 5.1)4. Это объясняется тем, что теперь мы можем соединять и интегрировать многочисленные информационные слои, чтобы по сути создать вашу индивидуальную карту наподобие тех, что предлагает Google. История Анджелины Джоли, центром которой была единственная мутация гена BRCA, продемонстрировала роль превентивной медицины в снижении рисков заболеваний среди населения и необходимость массового использования скрининговых технологий. Во многом аналогично этому ГИС миллионов людей становится основным приложением для будущего медицины. Это первая глава раздела книги, каждая из которых начинается со слов «моя» или «мои» и посвящена различным составляющим информации о вас. Ниже мы дойдем до важнейших последствий доступа и владения вашими данными ГИС.
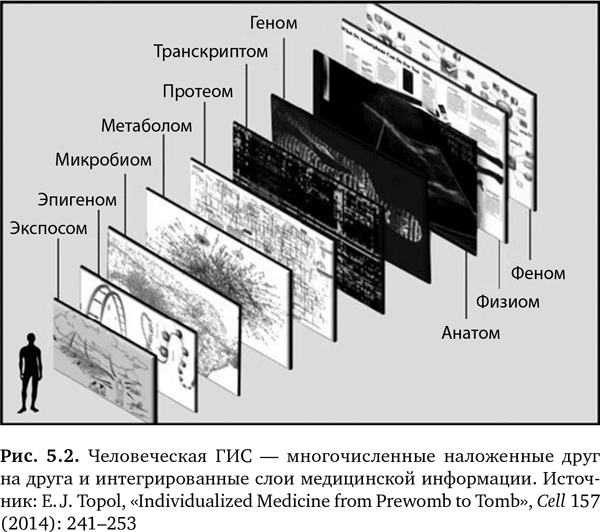
Человеческая ГИС состоит из многочисленных слоев демографических, физиологических, анатомических, биологических данных и данных по окружающей среде (рис. 5.2), касающихся конкретного человека5. Это богатая, широкомасштабная мозаика, представляющая человека, которая может быть использована для определения медицинского портрета человека. Когда данные полностью собраны и интегрированы, получается оцифрованный человек, по крайней мере с точки зрения оказания медицинской помощи.
Паноромный вид
Давайте теперь расшифруем человеческую ГИС, чтобы определить и понять каждый компонент. Суффикс «ом» в каждом из слов указывает на изучение чего-либо. Феном относится ко всем фенотипическим признакам человека, таким как рост, вес, цвет глаз и цвет кожи. Мне нравится комбинировать феном с социальным графом, это расширяет представления о человеке «при взгляде со стороны» в социальной сети. Физиом — это набор физиологических показателей, таких как пульс и кровяное давление. Анатом — наша индивидуальная анатомия. Геном относится к 6 млрд букв, образующим последовательность ДНК. Точно так же остальные биологические «омы» — это протеом, все наши протеины; метаболом, наши метаболиты; микробиом, представляющий микробов, которые живут в нас; и эпигеном, состоящий из ответвлений ДНК и показывающий, как они располагаются. Наконец, есть еще и экспосом, относящийся к нашему окружению, всему, с чем мы сталкиваемся. Для обозначения их всех вместе я придумал слово «паноромный» — как производное от слова «панорамный» и означающее обилие информации и охват многих тем5. Паноромный вид каждого человека дает исчерпывающее представление обо всех «омах», относящихся к здоровью и медицине.
Социальный граф и феном
Термин «социальный граф» подразумевает обширную информацию, включая демографические данные, место жительства, семью и друзей, друзей друзей, интересы, пристрастия, образование, домашних животных, фотографии, видеозаписи и многое другое. Это именно такая информация, которая хранится на сайтах типа Facebook, и этот факт не ушел от внимания исследователей. Выдающийся математик Стивен Вольфрам, создатель базы знаний и вычислительных алгоритмов (computational knowledge engine), известной как Wolfram Alpha, разработал потребительский программный продукт, своего рода личную аналитику для Facebook. Буквально в течение минуты он выдает невероятный набор данных и графиков о вас и ваших социальных связях — сам Вольфрам называет это «приборной панелью для жизни»6, 7. Если вы зарегистрированы на Facebook и не сталкивались с ним, советую посмотреть ваш личный вариант, это бесплатно: http://www.wolframalpha.com/facebook/. От того, что вы увидите, вам может стать немного не по себе, поскольку программа извлекает всю информацию, которую вы когда-либо размещали на Facebook, создает облачное хранилище всех ваших постов, их точного времени и содержания, лайков и комментов, сделанных вами, а также ваших постов, получивших наибольшее количество комментариев, демографических данных по всем вашим друзьям, включая их местонахождение на карте мира, их местное время и дни рождения, карты ваших социальных связей и отдельно друзей и семьи, соседей, социальных коннекторов (связных), инсайдеров (людей с большим количеством общих друзей) и аутсайдеров (тех, у кого с пользователем минимум общих контактов).
Мы знаем, что в социальных сетях есть важные группы, объединенные вопросами здоровья, как убедительно доказывают Николас Кристакис и Джеймс Фаулер в своих впечатляющих публикациях и книге «Связанные» (Connected)8. Эти социологи, а вслед за ними и многие другие обратили внимание на значение влияния наших социальных графов на ожирение, курение и большинство других аспектов поведения и образа жизни. По мере расширения разновидностей данных, и все более активного обмена ими, растет и потенциал социальных сетей с точки зрения их роли в здравоохранении будущего. Тем не менее медицинское сообщество до сих пор обычно не отдает должного этой информации как важнейшей базе данных о состоянии здоровья людей.
Если говорить о феноме, то когда требуются демографических данные и клинические характеристики, то по традиции мы привыкли полагаться на записи в медицинской карте. Они включают возраст, пол, род занятий, наследственность, прием лекарственных препаратов, заболевания, операции и процедуры. В истории болезни есть и физические характеристики, такие как рост, вес, внешний вид и важнейшие признаки. По сути мы получаем феном из этой информации — «смесь поддающихся наблюдению характеристик и особенностей человека»9. Примечательно, что фенотип любого человека, в особенности по мере взросления и старения, не остается неизменным. Скорее, можно говорить о многочисленных состояниях, поэтому индивидуальный феном не такое однозначное понятие, как может показаться. Например, кровяное давление обычно поднимается с возрастом, в то время как острота зрения снижается. В идеале когда-нибудь полный набор данных обо всех будет собран в одном месте как феном каждого человека — социальный граф плюс традиционная информация из истории болезни в медицинской карте — и будет постоянно обновляться. В то время как социальный граф является вспомогательным и второстепенным по отношению к феному, социальные связи человека, безусловно, играют важную роль в его здоровье.
Датчики и физиом
Возможно, самый большой шаг вперед в отслеживании индивидуальной информации в последние годы обязан появлению невероятного количества биодатчиков. Теперь есть беспроводные датчики, которые либо уже доступны, либо проходят клинические испытания. Их закрепляют на теле человека, и с помощью смартфона они улавливают физиологические данные: кровяное давление, сердечный ритм, число дыханий в минуту, концентрацию кислорода в крови, изменения частоты сердечных сокращений, минутный сердечный выброс и систолический объем, кожно-гальванический рефлекс, температуру тела, глазное давление, количество сахара в крови, волны, излучаемые мозгом, внутричерепное давление, мышечные движения и многие другие показатели. Микрофон смартфона можно использовать для получения количественных характеристик, связанных, например, с дыханием и голосом, и тем самым определить расположение духа человека или диагностировать болезнь Паркинсона или шизофрению10, 11. Дыхание человека можно оцифровать для измерения большого количества составляющих, таких как окись азота или химические элементы органического происхождения, позволяя смартфонам отслеживать дыхательную функцию или диагностировать определенные виды рака. Кроме всех этих не инвазивных датчиков, которые можно носить на себе, разрабатываются наночипы, которые можно будет вводить в кровоток, чтобы отслеживать появление опухолевых ДНК, активировать иммунитет или геномные сигналы, указывающие на приближение сердечного приступа или инсульта. Независимо от того, собираются ли такие данные с биодатчиков время от времени или непрерывно, они обеспечивают обзор функций организма, показывая все системы органов и их состояние. В наши автомобили встроено примерно 400 датчиков, в наши смартфоны — более 10. Так почему бы и нам не иметь их в наших телах?
Визуализация и анатом
Магнитно-резонансная томография, компьютерная томография, ядерное сканирование и ультразвуковые исследования обеспечили поразительные возможности для определения анатомии человека (здесь мы называем ее «анатом» для обозначения изучения анатомии того или иного человека) — без хирургического вмешательства. Усредненная анатомия человека не учитывает его индивидуальности; именно поэтому исключительно важно определение анатома тела конкретного человека. Но традиционные методы передачи изображений предполагают доступ к дорогому оборудованию, которое находится в больницах и клиниках. Появление и использование карманных устройств для получения результатов ультразвукового или рентгеновского исследований с высоким разрешением меняет картину, делая оценку индивидуальной анатомии гораздо более простой, быстрой и дешевой. Теперь смартфон или другое компактное устройство может быть использовано и для проведения физического обследования глаз, ушей, сосудов шеи, сердца, легких, брюшной полости и плода, и для пересылки медицинского снимка, что позволит пациенту полностью рассмотреть свое анатомическое строение на планшете или смартфоне.
Секвенирование и геном
Говоря о геноме, мы подразумеваем последовательность ДНК из 6 млрд букв А (аденин), Ц (цианин), Т (тимин) или Г (гуанин), 98,5% которых не включает гены; наши 19 000 генов, кодирующих белки, занимают приблизительно лишь 1,5%, состоят примерно из 40 млн букв генетического кода, и этот компонент известен как экзом12.
За последние 10 лет стоимость секвенирования генома снизилась в 100 000 раз, что значительно превосходит снижение стоимости полупроводниковых чипов, технический прогресс которых до сих пор считался самым быстрым в истории. Стоимость секвенирования человеческого генома упала с $28,8 млн в 2004 г. до менее $1500 в 2015 г.13, 14
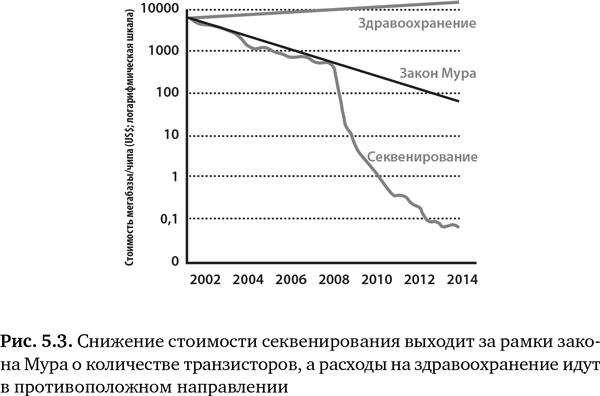
Параллельно со стремительным падением стоимости за последние 10 лет заметно расширились наши базы знаний об основных причинах болезней. Обнаружение редких вариантов последовательности, которые объясняют наследственные болезни, основывается на этой технологии и новых знаниях о причинах редких болезней. Способность диагностировать молекулярную основу редких митохондриальных болезней возросла с 1% до 60%15 — весьма ощутимые темпы прогресса5. Пройдет еще немного времени, и будут определены генетические предпосылки всех 7000 менделевских заболеваний (болезней, которые наследуются по закону Менделя, следуя классическим образцам наследования, например аутосомно-доминантное или аутосомно-рецессивное наследование)5.
Даже делая успехи в решении некоторых задач, мы обнаруживаем, что наши геномы гораздо сложнее, чем мы думали. Из книги «101 ключевая идея. Генетика 101» (Genetics 101) мы узнали, что у одного человека одна ДНК, что все 37 трлн клеток в нашем теле имеют одну и ту же ДНК. Впрочем, это оказалось неправильно — простой, казалось бы неизменный, архетип мутировал. Секвенирование генома отдельных клеток показало, что мы представляем собой своего рода мозаику16, 17. Например, исследователи из Института Солка секвенировали по одной клетке мозга умерших людей и обнаружили поразительные различия между клетками17. Отчасти эта мозаичность объясняется так называемыми мутациями de novo, которые происходят в клетках, когда они делятся на протяжении жизни человека. Мы также узнали о том, насколько разнородны раковые клетки. Поэтому движение от концептуальных рамок секвенирования ДНК отдельного человека к секвенированию клетки уже преподнесло нам некоторые бесценные уроки в отношении заболеваний.
Существуют важные ограничения, связанные с секвенированием, о которых нужно знать. Когда человек проходит секвенирование (некоторые называют его «расшифровкой генома»), обычно примерно 3,5 млн вариантов основных пар сравниваются с эталонным человеческим геномом. Но, как мы уже говорили в связи с BRCA, компанией Myriad Genetics и постановлением Верховного суда, большинство вариантов окажутся так называемыми вариантами неопределенной значимости. О них узнают после того, как пройдут секвенирование миллионы людей с различной наследственностью, с самыми разнообразными множественными заболеваниями, а также члены их семей. Наконец, мы не только представляем собой непостижимые до конца мозаики из ДНК, но мы не все из них можем секвенировать. Хотя и принято использовать термин «полногеномное секвенирование», на самом деле примерно 900 генов из 19 000 недоступны из-за их местоположения или по другим техническим причинам. Так что нам предстоит еще многое узнать о нашем геноме в будущем, и гораздо больше, чем то, чего я коснулся в этом кратком обзоре.
Транскриптом
До того как наши клетки могут что-то сделать с нашей ДНК, они должны транскрибировать ее в РНК. Это известно уже несколько десятилетий, но наше уважение к роли РНК невероятно выросло за последние годы. Были не только обнаружены и охарактеризованы различные формы РНК, но также стало понятнее и их динамическое влияние на правила работы генома. Это и есть транскриптом, и технологии развивались быстро, от первых попыток выявления экспрессии генов по всему геному до секвенирования РНК, которое выявляет гибридные гены и большое количество разнообразных РНК. Многие из них имеют отношение к болезням или профилактике здоровья.
Протеом и метаболом
Мы уже давно оцениваем наличие белков (протеинов) при проведении самых обычных лабораторных процедур, например при исследовании функционирования печени или почек. Но теперь представления о белковой биологии человека заметно расширились, позволяя нам определять взаимодействия белок−белок у человека, а также присутствие аутоантител (антител, направленных против собственных белков человека). Точно так же, используя масс-спектрометрию, можно оценить целый ряд метаболитов (соединений, получающихся в результате нашего метаболизма), которые производит человек в определенный момент. Результат — это широкий обзор с большим охватом, в отличие от оценок одного или группы белков или метаболитов, которые выполняются во время обычных лабораторных исследований. Доступ к целому ряду транскриптов РНК отдельного человека, а также белкам и метаболитам в любой конкретный момент создает невероятные возможности для понимания текущих биологических процессов.
Микробиом
Большинству из нас трудно принять тот факт, что мы на девять десятых — микробы и только на одну десятую — люди, по крайней мере в том, что касается подсчета клеток. Эпоха секвенирования пролила свет на то, что внутри нас или на нашем теле живут триллионы микробов (бактерий, вирусов, грибков). Разнообразие ДНК внутри нас в результате существования микробов значительно превосходит разнородность нашей собственной ДНК — это 100 трлн клеток вместо 37 трлн, свыше 8 млн генов вместо всего примерно 19 000 и более 10 000 видов вместо одного18. Микробиом представляет собой интерфейс между человеком и его окружением. Например, питание человека сильно влияет на его микробиом. И медицинская важность этих микробов существенно выросла, причем так, что большинство из нас этого и предположить не могли, что они влияют на ожирение, рак, сердце, аллергические и автоиммунные заболевания, а также многие другие состояния, в которых особенно важен микробиом кишечника.
Эпигеном
Боковые цепочки и упаковка нашей ДНК в результате метилирования, модификации гистонов и хроматин представляют собой еще одну очень динамичную часть нашей геномной биологии. Например, метилирование основной пары в геноме может отключить ген. Доступ к определенному участку генома для эпигеномных маркеров сегодня технически несложен. Эпигеномические изменения могут передаваться по наследству независимо от последовательности нашей ДНК, и «перепрограммирование» влияет на целый ряд заболеваний, включая рак, диабет, а также аутоиммунные и сердечно-сосудистые заболевания. Как и РНК, и белки, эпигеном является очень специфическим для клетки — изменения в одном типе клетки в боковой цепочке ДНК могут полностью отличаться от изменений в других типах клеток. Учитывая, что в нашем теле свыше 200 типов клеток, понятно, насколько разнообразным может быть влияние на нашу биологию. Человеческий эпигеном можно представить в виде карты, но, в отличие от человеческого генома, это пока еще не удается сделать на должном уровне.
Экспосом
Окружающая среда, в том числе радиация, загрязнение воздуха, цветочная пыльца, пестициды, оказывает огромное влияние на наше здоровье. Уже существуют и активно совершенствуются специальные датчики — беспроводные или подключаемые к смартфонам, которые позволяют отслеживать такие воздействия и делать количественные измерения.
В целом эти десять «омов» предоставляют паноромный обзор человека с беспрецедентным объемом информации, которая по мере развития медицины будет становиться все более доступной и полезной. Ни у одного человека пока еще не было проведено полногеномного исследования, но ближе всего к этому подошел Майкл Снайдер, директор Центра геномики и персонализированной медицины Стэнфордского университета. У Снайдера секвенировали весь геном, а также в различное время — транскриптом, протеом и метаболом19. Польза этого стала очевидна после того, как вскоре после перенесенной инфекции верхних дыхательных путей ему диагностировали сахарный диабет. Данные «омик» могут показаться не связанными, но, похоже, они образуют общую картину, несмотря на то что никто раньше не заявлял о подобной связи. Диагноз привел к тому, что Снайдер изменил образ жизни и восстановил гомеостаз глюкозы, а кроме того, отправил на проверку нескольких родственников, и оказалось, что у них есть не выявленное нарушение толерантности к глюкозе. Диета и физические упражнения помогли и им. В дальнейшем исследовательская группа Снайдера в Стэнфордском университете, в которую входит 40 человек, расширила первоначальную программу секвенирования эпигенома Снайдера, микробиома кишечника и использования многочисленных биодатчиков. Получение этой информации, сопоставимой с ГИС, породило огромное количество данных: 1 терабайт (Тбайт, триллион байтов) для цепочки ДНК, 2 Тбайта для данных эпигенома, 1 Тбайт для транскриптома и 3 Тбайта для микробиома5. Для сравнения: 1 Тбайт информации содержится в 1000 экземпляров Британской энциклопедии, а 10 Тбайт — столько примерно насчитывается в паноромном проекте Снайдера — отражает информационный масштаб всей Библиотеки Конгресса. Каждый год в мире генерируется примерно 5 зеттабайтов данных, или 40 секстильонов байтов20. Если мы разделим это количество на 7 млрд человек, живущих на Земле, то получится, что в среднем на одного человека генерируется почти 1 Тбайт данных в год. Хотя такого понятия, как средний человек, не существует, этот расчет дает представление о том объеме данных, которых можно ожидать от человеческой ГИС.
Нельзя сказать, что анализ этих первых шагов в направлении получения полной человеческой ГИС исходит из практической пользы. Пока еще это невероятно дорого, и генерируемые данные значительно превосходят наши возможности их интерпретации на этом этапе. Однако это осуществимо. Пока мы только начинаем вырабатывать подходы к тому, как мы на самом деле можем оцифровать человека и создать настоящий фундамент для индивидуализации медицины. И помните: «пока еще непрактично» не означает, что это всегда будет непрактично; в конце концов на секвенирование первого человеческого генома потребовалось десять лет и $5 млрд, а теперь это занимает меньше суток и стоит менее $15005.
Использование ГИС для индивидуализации медицины
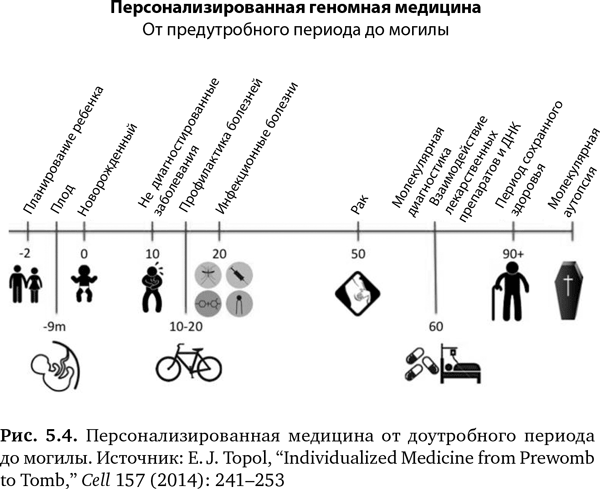
Десять «омов» в совокупности создают невероятный потенциал для обеспечения новой, высокоперсонализированной формы медицины от «предутробного периода» до могилы, как схематично показано на рис. 5.4. ГИС можно применять на протяжении всей жизни человека. Давайте посмотрим, как.
Предутробный период
Одно из самых перспективных направлений профилактики в медицине — использование генетических знаний в целях планирования ребенка. Доля людей с серьезными рецессивными аллелями гораздо выше, чем обычно считается. Вот несколько примеров доли носителей: 1 из 40 для кистозного фиброза, 1 из 35 для спинальной мышечной атрофии и 1 из 125 для синдрома ломкой Х-хромосомы. Среди евреев-ашкеназов доля носителей болезни Гоше составляет 1 из 15 человек, а доля носителей болезни Тея — Сакса составляет 1 из 275. Будущие родители могут без труда проверить на платной основе, не являются ли они носителями серьезных заболеваний. 23andMe проводит скрининг на 50 заболеваний; Counsyl — на более чем 100. Обе эти компании используют набор чипов, выявляющих мутации, которые традиционно связываются с определенным заболеванием, однако, как ранее упоминалось на примере BRCA или в случае генов кистозного фиброза, в любом гене есть сотни вариантов, которые могут быть патогенными, но в настоящее время не подвергаются скринингу. Более прогрессивные подходы включают современные методы секвенирования конкретных генов, оно делается в компаниях Recombine, Good Start Genetics или GenePeeks. Если тестирование обоих родителей показывает присутствие важных рецессивных аллелей, есть много альтернатив, включая приемное родительство или решение не иметь детей. Однако наиболее популярно оплодотворение in vitro (в пробирке), с проведением генетической диагностики перед подсаживанием эмбриона. Технология включает создание эмбриона и определение результата: сойдутся или нет рецессивные аллели. Это вполне эффективная мера по профилактике развития заболевания у плода. Недавние достижения в секвенировании человеческих ооцист (незрелых яйцеклеток. — Прим. ред.) без их разрушения могут потенциально улучшить успешность ЭКО (экстракорпорального оплодотворения) и избежать преимплантационной диагностики на стадии бластоцисты (пятый день развития эмбриона. — Прим. ред.)14. Еще один вариант — использование донорской спермы, хотя банки спермы никак не регулируются и никакой стандартной геномной оценки не проводится21, так что донорская сперма может создать новые проблемы. Многие ставят под вопрос эту практику и уничижительно называют ее «селекционированием детей»22, 23, на самом же деле этот способ предупреждения серьезных заболеваний очень привлекателен и рентабелен и совершенно неоправданно мало используется.
Секвенирование и мониторинг
Революция в пренатальной медицине уже началась благодаря возможности диагностировать важнейшие хромосомные мутации, такие как трисомия 21 (синдром Дауна), трисомия 13 (синдром Патау) и трисомия 18 (синдром Эдвардса), а также другие, в том числе синдром Ди Джорджи, синдром кошачьего крика и синдром Прадера — Вилли, с помощью одной-единственной пробирки с кровью матери уже в период с восьмой до десятой недели беременности. (В прошлом для этого требовались инвазивные процедуры — амниоцентез или проба ворсинчатого хориона, при которых есть риск выкидыша один случай на 400 процедур).
В настоящее время четыре компании предлагают эти новые тесты, и у каждой поразительно высокие показатели точности24, 25. Этот вид молекулярной диагностики был так быстро взят на вооружение, что побил все рекорды в истории медицины. В 2014 г. почти 20% из 4 млн младенцев, родившихся в за год в США, прошли такой дородовый геномный скрининг (рис. 5.5). Ожидается, что в следующие несколько лет эти процедуры получат массовое распространение. На самом деле в штате Калифорния, где действует самая крупная программа пренатального скрининга в мире и ежегодно более 400 000 женщин собираются стать матерями, эти тесты делают всем беременных женщин с повышенной степенью риска26.
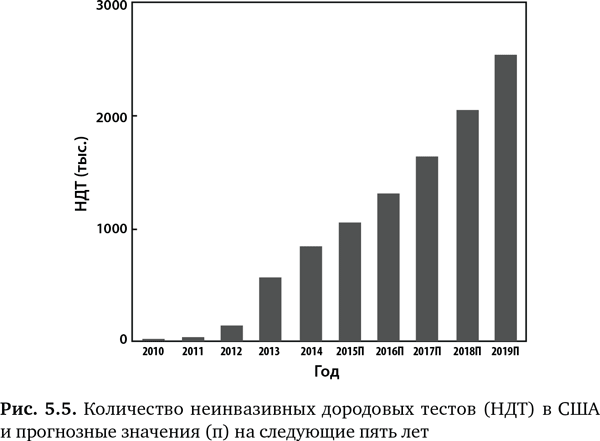
Конечно, мы могли бы также секвенировать весь геном плода вместо того, чтобы проводить более простой скрининг. Этого теста нет в продаже, и есть существенные биоинформационные проблемы, которые требуют решения прежде, чем тест станет доступным в массовом масштабе, вдобавок очень неоднозначны биоэтические вопросы27. Пока еще мы далеки от формулировки геномных критериев для раннего прерывания беременности, поскольку это зависит не только от точности определения ключевого геномного варианта, связанного с серьезным заболеванием, но также от понимания того, проявится ли болезнь на самом деле. Термин «пациенты в ожидании» относится к людям, у которых выявлена мутация, связанная с тем или иным заболеванием, но признаков болезни не обнаруживается28. У многих, если не у большинства, болезнь никогда не разовьется из-за присутствия некоторых (пока еще не совсем понятных) факторов, таких как другие гены, которые модифицируют риск заболевания, или эпигеномное перепрограммирование, которое вовсе отменяет его. Поэтому есть много неясного в отношении дородового скрининга — его точность, насколько серьезен диагноз и очевиден ли риск мутации27. Тем временем сама по себе возможность скрининга многих серьезных заболеваний на таком раннем этапе беременности без вторжения в матку женщины представляет собой гигантский шаг вперед в медицине.
На более позднем этапе беременности простой датчик на теле будущей матери позволяет отслеживать сердцебиение плода и его реакцию на родовые схватки. Это может быть полезно для удаленного беспроводного мониторинга беременностей с высокой степенью угрозы выкидыша с точки зрения максимально раннего диагностирования патологического состояния плода.
Неонатальное секвенирование и наблюдение
Массовый скрининг новорожденных детей, когда кровь берется из пятки младенца, начался в США еще в 1963 г. и мало изменился с тех пор29. Могло быть хуже: в разоблачительном материале, приуроченном к 50-й годовщине применения процедуры и озаглавленном «Смертельное промедление» (Deadly Delays), сообщалось о том, насколько разное количество времени требуется на анализ в разных больницах США30. Хотя это очень недорогой тест, позволяющий без труда проверить более чем 50 редких отклонений типа фенилкетонурии или галактоземии, во многих больницах на это уходит по несколько недель. Это прискорбно, поскольку отсутствие быстрой диагностики многих из этих заболеваний может причинить ребенку непоправимый вред.
Принципиально другой подход предлагает группа специалистов из детской больницы Mercy в Канзас-Сити под руководством Стивена Кингсмора, показавшая, что неонатальное полногеномное секвенирование можно сделать менее чем за 24 часа, а это не только информация о новорожденном, которая нужна для принятия решения в данный момент, но и важный ресурс на всю остальную жизнь4.
Существует ряд беспроводных датчиков для новорожденных, которые помещают на теле, в носочках или одежде, включая Owlet, Mimo и Sproutling, и они оповещают родителей о состоянии ребенка во время сна, о его сердцебиении или дыхании. Уже выражается озабоченность тем, что мониторинг новорожденного может стать навязчивой идеей у родителей — чрезмерное количество информации иногда ведет к лишним волнениям и ненужным медицинским оценкам младенца31. Хотя мы знаем, что в США каждый год происходит свыше 400 000 случаев внезапных смертей детей грудного возраста, мы пока еще недостаточно хорошо осведомлены о том, какие младенцы нуждаются в мониторинге. В будущем инструменты омик могут оказаться полезными для определения необходимости использования таких датчиков в случаях младенцев с повышенной степенью риска.
Недиагностированные болезни
Есть данные, что свыше миллиона американцев страдает тяжелыми заболеваниями, которые делают их нетрудоспособными или даже угрожают жизни, но диагноз при этом не поставлен. Обычно таких людей проверяют в многочисленных медицинских центрах, у них накапливается огромное количество счетов в сотни, а то и миллионы долларов. Теперь можно с помощью секвенирования провести молекулярную диагностику неизвестной болезни, и шансы на успех увеличиваются при сравнительном анализе с ДНК матери и отца или других родственников. Успешность такой диагностики в разных центрах страны варьирует между 25% и 50%. Она требует основательной геномной биоинформационной экспертизы, поскольку обработка данных троих человек дает примерно 750 млрд результатов (6 млрд букв на каждую последовательность, три человека, 40-кратное повторение в каждом случае для обеспечения точности). Конечно, поставить диагноз не значит предложить эффективное лечение. Но есть поразительные примеры детей, жизни которых были спасены или у которых произошли огромные улучшения. После того как основная причина болезни установлена, есть возможность перенацелить существующий лекарственный препарат или изучить препараты, которые в настоящий момент проходят клиническую проверку для потенциального использования. Особенно вдохновляет готовность некоторых страховых компаний покрывать затраты на секвенирование и анализы, поскольку они начинают понимать, что секвенирование способно заменить длительную и дорогостоящую процедуру всесторонней медицинской экспертизы. Если такая практика будет обладать большей юридической силой, она может стать разумной, экономически выгодной стратегией.
Предупреждение болезни
Рак груди — не единственная болезнь, которую мы можем предупредить при помощи геномики. Есть ряд редких мутаций, которые требуют принятия мер, — например, синдром Линча (наследственный неполипозный колоректальный рак). Он диагностируется у 3–5% из 160 000 новых пациентов с колоректальным раком каждый год, и, как и в случае BRCA, вовлеченные гены обычно восстанавливают ДНК и выполняют другую «административно-хозяйственную работу», важную во время деления клеток. Другая важнейшая форма наследственного колоректального рака — это семейный аденоматозный полипоз, возникающий из-за мутаций гена APC. Оба эти состояния передаются по наследству и характеризуются высоким риском развития колоректального рака, но тщательное наблюдение и хирургическое вмешательство могут быть использованы для профилактики. Оба случая представляют аутосомно-доминантный тип наследования, проявляются в каждом поколении семей, но их можно полностью предотвратить путем скрининга носителей и ЭКО, как это описано выше в связи с планированием ребенка.
Существуют и многие другие примеры редких мутаций, к которым стратегия профилактики имеет непосредственное отношение, такие как мутации ионного канала, вызывающие смертельно опасную сердечную аритмию. Людей, у которых были обнаружены патогенные мутации, можно лечить с помощью лекарственных препаратов, специально предназначенных для аномалии ионного канала, или дефибриллятора, который постоянно проводит мониторинг сердечного ритма и обеспечивает дефибрилляционный шок (удар током), когда проявляется серьезная аритмия (как в случае с Ким Гудселл).
Но это примеры редких мутаций, которые следуют простым классическим образцам наследования по закону Менделя. Большинство обычных человеческих болезней, к сожалению, являются полигенными, когда многочисленные гены взаимодействуют сложным образом, а наследственная модель неоднозначна. Геномные маркеры или вызывающие болезнь варианты последовательности ДНК были обнаружены только для ограниченного количества болезней, не говоря уже способах предотвращения. Один из положительных примеров — возрастная макулярная дегенерация, главная причина слепоты. У людей с высоким геномным риском есть ряд способов снизить шанс слепоты, например прекратить курить, избегать прямых солнечных лучей, регулярно наблюдаться, проводя исследование глаз, и соблюдать диету, включающую повышенное потребление овощей и фруктов и пониженное — насыщенных жиров. Еще один пример варианта гена с выраженным риском — это аллель ароε4. Если у человека есть хоть один такой ген, то риск развития болезни Альцгеймера повышается в три раза (с 8% у тех, у кого нет аллеля ароε4, до примерно 24% у обладателей одной копии); если же наблюдается гомозиготность — т.е. присутствует две копии — риск повышается до более чем 75%. Но в отличие от вариантов генов, повышающих риск возрастной макулярной дегенерации, в данном случае пока еще нет какой-либо проверенной превентивной стратегии. В отношении деменции Альцгеймера, серьезного распространенного и устрашающего недуга, идет интенсивная разработка лекарственных препаратов. Некоторые из новых экспериментальных медикаментов, которые сейчас проходят широкомасштабные клинические испытания, специально предназначены для носителей ароε4 или гомозигот.
Но знать о присутствии аллели ароε4 прежде, чем разовьется поздняя деменция на восьмом или девятом десятке жизни, для человека очень важно. В сравнении с людьми, имеющими варианты ароε2 или ε3, которые составляют более 80% населения, у носителей ароε4 и гомозигот чаще возникают осложнения после повреждений головы, включая долгий восстановительный период, нарушение когнитивных функций и раннее развитие деменции. Особенно опасно травматическое повреждение мозга, синдром, охватывающий ряд серьезных неврологических и психиатрических проявлений, для которых не существует эффективного лечения. Виды спорта с высоким риском черепно-мозговой травмы, как, например, бокс или американский футбол, вызывают особую настороженность, и некоторые специалисты предлагают проводить скрининг на наличие варианта ароε4 у спортсменов, занимающихся этими видами спорта. Как говорит об этом один из исследователей болезни Альцгеймера в книге Дэвида Эпштейна «Спортивный ген» (The Sports Gene), «риск деменции при наличии одной-единственной копии ароε4 подобен риску от игры в Национальной футбольной лиге (НФЛ), и… если то и другое сходятся вместе, то это еще опаснее»32. На самом деле, когда я смотрю американский футбол и вижу, как игрок получает какую-то травму головы, я в первую очередь думаю о том, что если игрок является носителем ароε4 и не знает этого, то со временем у него могут произойти необратимые повреждения мозга. В наше время, после десятилетий недоверия к исследованиям, связывающим американский футбол и травматическое повреждение головного мозга, Национальная футбольная лига наконец осознала огромный риск сотрясений мозга. В НФЛ уже начинается тестирование датчиков в шлемах игроков с акселерометрами, улавливающими воздействие, чтобы оценить масштабы травмы головы, даже без сотрясения мозга. Но не проводилось никакого генетического скрининга или оценки большого количества бывших игроков, которые страдают от последствий травматического повреждения мозга. Более того, нам еще предстоит заняться вопросом скрининга детей, которые планируют заниматься высокорискованными видами спорта.
Однако следует пояснить, что ароε4 — это аномальный вариант гена, он встречается достаточно часто (примерно у 20% населения имеется хотя бы один такой ген) и несет в себе большой риск. Самые распространенные геномные варианты, т.е. представленные более чем у 5% населения, несут в себе лишь малый риск. В отличие от них редкие варианты, присутствующие менее чем у 1% населения, связаны с гораздо более существенным риском. Поскольку на сегодняшний день полногеномное секвенирование проводилось только у ограниченного количества людей, без учета разнообразных фенотипов или наследственности, нам еще предстоит долгий путь, чтобы обнаруживать значимые редкие варианты. Такие редкие геномные варианты повышенного риска представляют собой серьезный сигнал и особенно информативны для человека, а потому могут быть полезны для предупреждения определенного заболевания.
Но просто знать о риске недостаточно. Нам нужно знать, когда заболевание проявится. И именно здесь в игру вступают биодатчики. Если бы мы, например, знали, что у ребенка высокий риск развития бронхиальной астмы, то было бы идеально использовать датчики для выявления дыхательных проблем на начальном этапе, когда они только зарождаются, задолго до первых симптомов. Есть много заболеваний, когда мы знаем о геномном риске, но понятия не имеем о том, когда вмешаться, чтобы предотвратить развитие болезни.
Внедренные в кровь датчики, контактирующие со смартфоном хозяина (или в случае детей с устройством родителей), могут быть особенно полезными. С помощью геномик мы можем определить детей, имеющих высокий риск аутоиммунного диабета (типа 1). Мы также знаем, что требуется примерно пять лет, прежде чем критическая доля островковых клеток поджелудочной железы будет разрушена в результате аутоиммунных атак и диабет даст о себе знать. К настоящему времени уже разработаны крошечные нанодатчики для определения ДНК, РНК, белка и сигналов аутоантител. А что, если бы у нас в крови находился датчик, который определял бы активизацию иммунной системы, и в тот же момент иммунная система подавлялась бы подходящим лекарственным препаратом? Возможно, поджелудочную железу можно было бы спасти. Этот тип интервенции может помочь при ряде аутоиммунных заболеваний со спорадическими приступами, таких как рассеянный склероз, ревматоидный артрит или волчанка.
Предотвратить сердечный приступ поможет геномный сигнал в виде клеток, которые отслаиваются от стенок артерии (известных как циркулирующие эндотелиальные клетки), указывающий на подспудный процесс, который предшествует фактическому событию — формированию тромба в артерии, перекрывающего доступ крови к сердечной мышце. Точно зная о процессах, ведущих к сердечному приступу, можно дать человеку лекарственные препараты, предотвращающие формирование тромбов и вытекающие из этого последствия.
И мы знаем, что у людей с раковыми заболеваниями есть опухолевые ДНК, присутствующие в плазме. Можно проводить их мониторинг во время курса терапии и предотвратить необходимость дорогих исследований — позитронной эмиссионной томографии или компьютерной томографии, которые несут в себе высокий риск облучения. Однако вживленный биодатчик может обеспечить сплошное наблюдение, способное отследить рецидив опухоли, а в будущем, вероятно, даже обнаружить первые признаки опухоли задолго до того, как она наберет массу, заметную на сканограмме.
Точно так же привлекательна концепция «молекулярного стетоскопа». Если рассматривать не только бесклеточные ДНК, то транскриптом бесклеточной РНК имеет важный потенциал для определения значимых медицинских сигналов, как это недавно продемонстрировали наблюдения за беременностью и развитием плода или диагностирование болезни Альцгеймера33. В дальнейшем на протяжении всей жизни человека одна-единственная пробирка с кровью может использоваться для скрининга ДНК/РНК и служить еще одним измерением ГИС человека. Однако будут проблемы с интерпретацией данных. Мы вернемся к этой теме ниже, когда будем говорить о предсказательной аналитике.
Инфекционные болезни
Использование полногеномного секвенирования с картированием социальных сетей применялось для борьбы с многочисленными вспышками заболеваемости, связанными с такими патогенами, как клебсиелла пневмонии, метициллин-резистентный золотистый стафилококк, клостридии диффициле и туберкулезная палочка. Это был невероятный шаг вперед в понимании возникновения и передачи заразных болезней. Точно так же впечатляет цифровая наука образования сетей, которая дала важный показатель «эффективного дальнодействия» в качестве объяснения распространения инфекции (и он же относится также к слухам и инновациям)34.
Патогенное секвенирование может потенциально применяться не только для определения происхождения эпидемии. Тем не менее на сегодняшний день обычное обследование пациента с серьезной инфекцией включает взятие крови и других жидкостей организма на посев, двухдневное ожидание результатов и последующее определение чувствительности патогена к антибиотикам. А тем временем в этот двух- или трехдневный период ожидания пациент обычно получает большую дозу сильных антибиотиков широкого спектра действия, чтобы «охватить» все возможные патогены, которые могут служить причиной инфекции.
Чтобы понять спасительную силу секвенирования в случае инфекционных болезней, рассмотрим историю Джошуа Осборна, 14-летнего мальчика, который чуть не умер от мозговой инфекции. У него постоянно случались судороги, но диагноз ему поставить не могли, хотя сделали даже биопсию мозга и развернутый анализ крови на наличие патогенов35. Но секвенирование спинномозговой жидкости сразу же показало, что причиной является лептоспира, редкая бактерия, после чего он был успешно вылечен подходящим антибиотиком.
Благодаря использованию секвенирования наши обычные установившиеся практики лечения могут быть радикально изменены. Теперь есть «лаборатория на чипе» — платформы для секвенирования, которые могут быть интегрированы в смартфон или планшет. В будущем, вероятно, появится возможность легко и быстро провести секвенирование патогенов непосредственно во время осмотра. Надо надеяться, что это обеспечит более точное и раннее лечение сепсиса, который дает один из самых высоких показателей смертности.
Рак
Поскольку рак — это болезнь, корни которой уходят в геномику, то в данном случае особенно важны понимание и терапевтический подход. И действительно, с помощью секвенирования тысяч опухолей пациентов, вместе с гаметической (зародышевой) ДНК каждого человека, примерно в 200 генах, отвечающих за опухолевый рост, мы идентифицировали изменения, известные как мутации-водители (драйверы)5,36. Большинство этих мутаций называются онкогенами; они могут непосредственно управлять формированием опухоли, и их можно лечить адресно лекарственными препаратами. Остальные — это изменения в генах-супрессорах опухолей, например, Р53. Такие лечить гораздо сложнее, поскольку именно утрата ими своих функций позволяет опухоли разрастаться. Лекарственные препараты для усиления биологической функции биологии клеток получить намного труднее, поэтому присутствие генов-супрессоров опухолей в качестве драйверов обычно означает, что нужен какой-то обходной путь, а не прямое воздействие на ген.
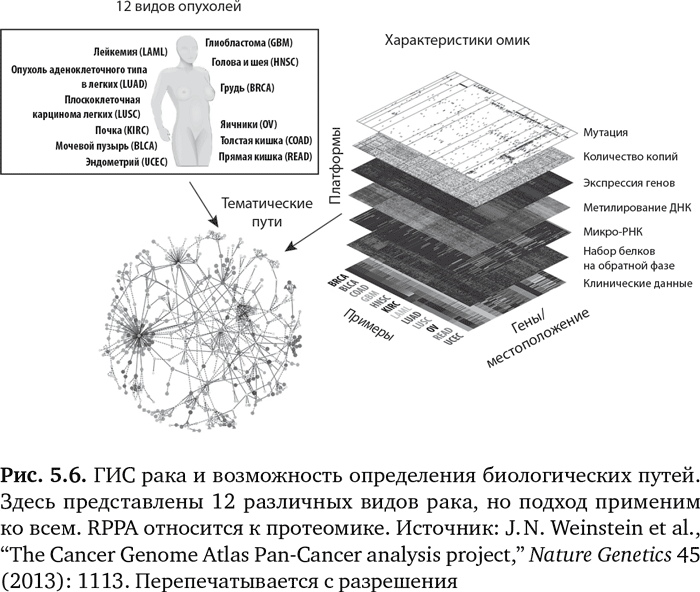
Точно так же, как мы определяли ГИС человека, ведется огромная работа по определению ГИС самых типичных видов рака. Этот проект называется «Атлас ракового генома» (Cancer Genome Atlas), он был запущен в 2005 г. и финансируется Национальным институтом здравоохранения США. На рис. 5.6 показаны различные уровни информации, которую собирают для 12 различных видов опухолей. Данные включают мутации, структурные варианты (означающие изменения в количестве присутствующих копий гена), экспрессию гена, метилирование ДНК, белки (RPPA представляет белковый биочип обратной фазы) и клинические данные. На основании расширенных исследований омик можно определить основной биологический путь или пути развития рака конкретного человека. Это ведет к возможности подобрать определенный лекарственный препарат, нацеленный на мутацию-водителя или путь5.
В то время как подбор лекарственного препарата к мутации-водителю дает поразительно быстрый результат и часто приводит к полному рассасыванию опухоли за несколько недель, обычно остается серьезная проблема рецидива через 9−12 месяцев. Типичный пример этого явления наблюдается, когда лекарственный препарат нацелен на мутацию BRAF, присутствующую или вызывающую болезнь более чем у 60% людей с метастатической меланомой. Одно из важных объяснений этого рецидива или стойкого сопротивления лечению связано с генетической гетерогенностью рака. Когда проводится секвенирование отдельных частей опухоли, обнаруживаются заметные различия в мутациях. Эта проблема усугубляется после того, как рак метастазирует, поскольку мутации метастатических поражений отличаются от обнаруженных в месте первичного появления опухоли. Вероятно, для достижения долгосрочного эффекта терапии необходима комбинация лекарственных препаратов, нацеленных на различные мутации и пути, в соответствии с ГИС-подходом, учитывающим гетерогенность. Это сродни подходу, который оказался успешным при борьбе с вирусами гепатита C и ВИЧ: тогда очень эффективными показали себя комбинации из трех или четырех лекарственных препаратов. Но еще больше усилий потребуется, чтобы выяснить, поддастся ли рак комбинированной терапии, как получилось с вирусами.
В настоящее время большинство врачей и больниц в лучшем случае предлагают лишь выявление точечных мутаций, ограничиваясь HER2 в случае рака груди или KRAS в случае рака кишечника, несмотря на возможности ГИС-подхода. Большинство учреждений, практикующих ГИС-подход, — это научные центры, и делают они это в рамках исследований. Лишь некоторые начали предлагать секвенирование в ходе клинического ведения раковых больных. Одна из компаний, Foundation Medicine, инициировала коммерческий продукт — ограниченное секвенирование примерно 300 генов опухоли, чтобы определить присутствие вероятных мутаций-водителей37. Первые результаты по более чем 2000 пациентов выглядели многообещающими для выявления виновных раковых генов, но для того, чтобы показать, что эта информация ведет к улучшению результатов в сравнении со стандартно используемым подходом (не-ГИС), понадобятся клинические испытания. Далее, учитывая, что оценивается лишь ограниченное число генов (300 из 19 000, или 1,6%), остальная часть генома, составляющая 98,5%, остается темной материей, и мы вполне можем предположить, что такой выборочный ГИС-подход, вероятно, пропустит важные данные. Например, мы уже знаем, что есть много некодируемых (не-генных) элементов в зародышевой ДНК пациента. Тем не менее, хотя стратегия секвенирования Foundation Medicine имеет много ограничений, она представляет ключевое направление для будущего.
В отношении рака есть еще два вдохновляющих достижения. Одно из них связано с диагностикой или наблюдением за опухолью, в этом случае используется «биопсия жидкости» опухоли, получаемой из крови. Как упоминалось ранее, у подавляющего большинства раковых больных в плазме присутствует опухолевая ДНК, которую можно легко выделить из крови и секвенировать. Вполне вероятно, что это будет частью ГИС рака в будущем.
Другая область, где наблюдается гигантский прогресс, — это раковая иммунотерапия, о ней рассказывается в статье «2013. Прорыв года» (2013 Breakthrough of the Year), опубликованной в журнале Science38. В отличие от подхода к лечению рака с помощью геномики, здесь осуществляется воздействие на иммунную систему путем блокирования молекул, которые обычно тормозят иммунный ответ. Явный успех клинических испытаний был подтвержден в случаях разных видов метастатического рака, включая меланому, рак легких и почек. Но показатель отклика варьирует между 20% и 30%, так что нам еще нужно узнать, какие факторы могут говорить о потенциальном результате лечения конкретного человека. Кроме риска, связанного с вмешательством в иммунную систему, эти средства иммунотерапии очень дороги — один только препарат ипилимумаб стоит свыше $120 000. На самом деле стоимость — это главная проблема: почти все лекарственные препараты против рака для лечения на основе геномики обходятся более чем $100 000 за курс лечения. Поэтому персонализированная медицина настоятельно требуется с другой точки зрения — с точки зрения экономичного использования новых, основанных на биологии, видов терапии.
Молекулярная диагностика
По мере закрепления ГИС-подхода к раку естественно применять его к любым медицинским диагнозам. Возьмем, например, диабет 2-го типа, на самом деле это название служит общим термином для разнообразных проблем, связанных с сахаром в крови: устойчивость к инсулину, дефектный ионный канал, аномальный адренергический рецептор, аномальная чувствительность к глюкозе и т.д. Дело не только в механизме(-ах), свою роль может сыграть и наследственность. Недавно было обнаружено, что обычные варианты последовательности в гене-переносчике растворенных веществ (SLC16A11) и редкий вариант в другом гене (HNF1A) увеличивают риск диабета у мексиканцев и латиноамериканцев39, 40, а обычный вариант гена (TBC1D4) у гренландцев мешает проникновению сахара в мышцы и увеличивает риск диабета в 10 раз41. Тем не менее при клиническом наблюдении человека с диагнозом «диабет» мы ничего не делаем для того, чтобы понять причину его возникновения, и пытаемся лечить его наугад. Существует 14 различных классов лекарственных препаратов для лечения диабета, поэтому гораздо более разумный ГИС-подход мог бы стать весьма информативным для эффективного лечения. Вероятно, существует по крайней мере столько же молекулярных подвидов диабета, сколько классов лекарственных препаратов — для лечения этого заболевания. Кроме геномной характеристики использование датчика для постоянного измерения количества сахара в крови даже в течение ограниченного периода времени, от нескольких дней до недель, даст детализированные данные о регулировании сахара в крови у отдельного человека. Проведен ряд исключительных исследований, основанных на омиках, которые подразделяют обычные болезни на отдельные молекулярные подвиды; список постоянно растет и включает астму, рассеянный склероз, ревматоидный артрит, рак кишечника и рак шейки матки. Трудно вообразить какой-либо обычный медицинский диагноз, который сегодня не слишком упрощен и не является редукционистским обобщенным термином, неприемлемым в эру медицины, который готов для ГИС.
Фармакогеномика
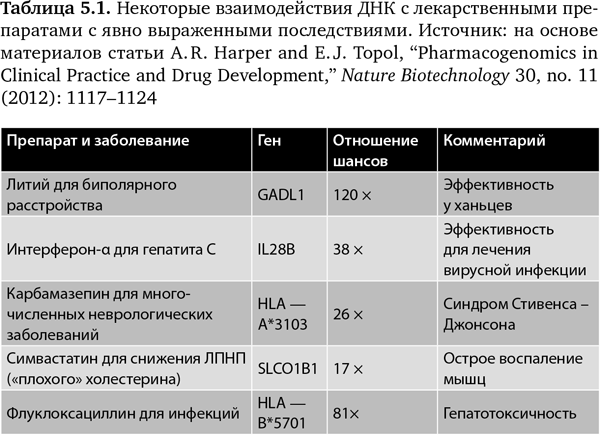
Как мы упрощаем диагнозы, точно так же мы недооцениваем важность персонального генома или то, как он модулирует реакцию на лекарственное лечение. В настоящее время существует немногим более 100 лекарственных препаратов, взаимодействие которых с ДНК признано проверенным и значимым Управлением по контролю за продуктами и лекарствами США42. Вероятно, этот список будет расти; фактически от всех из более чем 6000 рецептурных лекарственных препаратов будет ожидаться реакция, зависящая от ДНК человека. Действительно, все аспекты ответной реакции каждого человека — всасывание, метаболизм, связывание, перенос, выделение — заданы генетически. У нас нет этих данных по 98% препаратов, но еще хуже то, что при наличии фармакогеномной информации примерно по 100 препаратам мы не используем ее в медицинской практике.
Многие из фармакогеномных взаимодействий ярко выражены, некоторые из них я привожу в табл. 5.142. Отношение шансов относится к степени эффективности. Таким образом, при лечении литием биполярного расстройства (маниакально-депрессивного психоза) вариант ДНК ассоциируется со 120-кратным увеличением в достижении терапевтического эффекта (исследование проводилось среди ханьцев)43. При лечении гепатита C с помощью интерферона-α наблюдается 38-кратное увеличение эффективности при привязке к варианту гена42. Три других примера относятся к важным побочным эффектам, где вариант последовательности имеет очень большое влияние на риск развития серьезного осложнения.
В то время как это очень серьезные последствия, ни одно из них пока не учитывается в клинической практике, по крайней мере в США. На Тайване и в Сингапуре новый рецепт на карбамазепин нельзя выписать, пока не определен риск развития у пациента синдрома Стивенса — Джонсона, потенциально смертельного побочного эффекта. К сожалению, мы имеем наследие из более чем 6000 лекарственных препаратов, которые были выведены на рынок до того, как появились технология или желание определять взаимодействие между ДНК и лекарственными препаратами. Еще больше беспокоит то, что при имеющихся на сегодняшний день возможностях пока очень мало примеров разработки лекарственных препаратов и систематической работы по раскрытию их фармакогеномного действия какой-либо фармацевтической или биотехнологической компанией. В идеале в будущем ГИС человека будет включать исчерпывающую характеристику ожидаемых взаимодействий его организма с лекарственными препаратами.
Период сохранного здоровья
Эталонный геном человека, который рассматривается как золотой стандарт для геномной вариации, имеет один важный недостаток — люди, которых брали для его создания, были молоды и не имели никакого фенотипа. Таким образом, кажущийся нам надежным «якорь», возможно, изъеден ржавчиной. Например, сильная предрасположенность к образованию тромбов приписывается варианту гена, известному как фактор V Лейдена. Но если вы найдете фактор V Лейдена в эталонном геноме, то это фактор V Лейдена! Нам нужен эталонный геном со строгими фенотипичными характеристиками, чтобы избежать этой проблемы. Необходимо собрать большое количество людей с исключительно долгим периодом сохранного здоровья (как в проекте Wellderly, которым мы в Институте трансляционных исследований Скриппса занимаемся на протяжении последних восьми лет) и провести полногеномное секвенирование, тогда мы сможем быть уверены в здоровом эталонном геноме для сравнения.
Но есть еще одна веская причина, объясняющая, почему геномика периода сохранного здоровья будет крайне важна для человеческой ГИС. Мы мало знаем о генах-модификаторах и защитных аллелях — вариантах признака, соответственно отменяющих риск или обеспечивающих фактическую защиту от болезни. Заслуживающим внимания примером является ген АРР (Amyloid Precursor Protein— предшественник бета-амилоида). Один из редких вариантов этого гена ведет к ранней болезни Альцгеймера, но другой, похоже, полностью защищает от развития болезни Альцгеймера вообще — даже у очень пожилых людей, имеющих две копии ароε4. К сожалению, этот защитный аллель АРР встречается весьма редко (менее чем у 0,3% людей, имеющих европейских предков), но он может служить бесценным уроком от матери-природы, чтобы мы могли разработать лекарственный препарат для профилактики болезни Альцгеймера в будущем. Точно так же редкие варианты липидного гена под названием АроС3 заметно снижают триглицериды в крови и дают 40%-ное снижение случаев стенокардии44. Более того, бесспорно, имеется большое количество редких вариантов ДНК, которые точно так же снижают риск или дают защиту от болезни, — нам просто нужно их найти! И в конце концов избавиться от того, что можно охарактеризовать как «игноро́м»!45
Молекулярные аутопсии
Каждый день в США от болезней сердца внезапно умирают свыше 100 000 человек. Только 10% из этих людей удается реанимировать46. Физические аутопсии для определения причин смерти проводятся редко, а даже когда проводятся, многие молекулярные диагнозы просто упускаются, такие как генетические дефекты ионного канала, например синдром удлиненного интервала QТ или синдром Бругада. Не зная причины внезапной смерти члена семьи, его близкие лишены информации о собственных рисках. Родители ребенка, умершего от СВДС (синдрома внезапной детской смерти), часто очень страдают и остаются в неведении о причинах случившегося. Молекулярная аутопсия, состоящая из полногеномного секвенирования покойного, наряду с секвенированием некоторых здравствующих членов семьи может оказаться особенно информативной. Ниже мы поговорим о необходимости и возможности создания подобного глобального информационного ресурса для молекулярных аутопсий.
Человеческая ГИС в перспективе
Путешествие от утробы до могилы дало нам представление о том, на что похоже будущее ГИС — огромное количество широкомасштабной, паноромной информации для каждого человека. Назовем это 10 на 10: 10 инструментов «омов» и 10 остановок на пути продолжительностью в человеческую жизнь. Но это путешествие посвящено не просто ГИС, или чьей-либо ГИС; оно посвящено моей ГИС. Необходимо, чтобы человек владел своей ГИС, а в случае детей это должны быть родители, пока они не передадут право собственности ребенку. Она будет использоваться человеком для того, чтобы сделать важный клинический выбор, как сделала Анджелина Джоли.
Это данные отдельного человека, его медицинская суть, то, что объясняет его устройство, и никто другой не заинтересован в их правильном использовании. Право собственности станет более очевидным благодаря режиму передачи данных по мере того, как ГИС в конечном счете будет поступать к человеку через принадлежащие ему портативные беспроводные устройства. Фактически вся моя собственная геномная последовательность уже введена в мой iPad; все мои данные передаются с устройства на устройство и отражаются на экране смартфона. Однако отображение на экране — это просто опыт конечного пользователя. Как все эти данные будут собираться, храниться и интерпретироваться? Как в конечном счете они докажут свою пользу любому конкретному человеку? Для моей ГИС потребуется облачное хранилище данных. Гораздо важнее сбора и хранения данных возможность проведения предсказательной аналитики. Ниже вас ждет целая глава, посвященная этой увлекательной теме.
Но пока у нас нет никакой реальной ГИС или индивидуального облачного хранилища данных. Отрезвляющая реальность состоит в том, что мы до сих пор имеем дело с довольно примитивным, беспорядочным и бессистемным набором данных, медицинскими картами, лекарственными назначениями, лабораторными анализами и сканами, разбросанными по различных учреждениям. И при сегодняшнем устойчивом патернализме все они, по сути, принадлежат врачам и медицинскому сообществу и контролируются ими. Пока мы дождемся человеческой ГИС, есть жизненно важные способы, с помощью которых мы можем заметно улучшить и даже революционизировать методы использования традиционных компонентов медицинской информатики на службе человека. Об этом в следующей главе.

