Глава 6. Квантовая модель атома
…Борн основал большую школу теоретической атомной физики с интернациональным коллективом учеников и сотрудников. К ней принадлежали такие исследователи, как Ферми, Дирак, Оппенгеймер, Мария Гепперт-Майер, И. фон Нейман, Теллер, Вигнер, Полинг, Гайтлер, Вайскопф, Розенфельд и другие знаменитые ученые, многие из которых стали лауреатами Нобелевской премии. Ассистентами Борна были Вольфганг Паули и Вернер Гейзенберг. Вместе с ним или под его руководством работали советские физики Фок, Тамм, Френкель и Румер. Его институт посещали Иоффе и Капица; американский физик Гамов, получивший известность благодаря своим космологическим исследованиям, также был учеником Борна.
Ф. Гернек.
Пионеры атомного века
Развитие исследований радиоактивности и построение квантовой теории постепенно привели к созданию квантовой модели атома. Однако этому предшествовали многие попытки построить атомарные структуры лишь на основе классических электродинамических и даже просто механических схем. Так, в 1904 году свои представления о строении атома опубликовали японский физик Хантаро Нагаока (1865-1950) и английский теоретик Д. Д. Томсон.
Нагаока несколько неожиданным образом исходил из астрономических исследований построения колец Сатурна, представляя строение атома аналогичным Солнечной системе. В его работе рассматривалась идея придания роли Солнца положительно заряженной центральной части атома, вокруг которой располагается планетарная система электронов. При орбитальных смещениях электроны генерируют электромагнитные импульсы, образующие спектральные линии соответствующих химических элементов.
После того как стало ясно, что электроны являются составными частями атомов всех веществ, Томсон построил собственную электромагнитную модель атома, назвав ее «пудинг с изюмом», где отрицательно заряженные корпускулы – электроны – располагались как изюминки-вкрапления внутри положительно заряженной сферы – пудинга. Этот «атомный пудинг Томсона» был распространенной моделью атома до открытия ядра Резерфордом и модели атома Бора.
В «пудинговой» модели атома Томсона положительное электричество представлялось как бы «размазанным» по всему объему атомной структуры, чаще всего представляемой сферой с четко очерченными границами. В этот положительный пудинг, как изюм, и были вкраплены электроны. Для простейшего атома водорода электрон вообще находился в центральной части некоего положительно заряженного сфероида. При этом смещение электрона из центра должно было порождать некую квазиупругую силу электростатического притяжения, заставлявшую электрон совершать вынужденные колебания. Параметры таких колебаний должны были определяться радиусом атомного сфероида, положительным зарядом и массой электрона. Для многоэлектронных атомов Томсон рассчитал набор устойчивых конфигураций, в которых и должны были располагаться «изюмины» электронов. При этом кембриджский ученый считал, что каждая из подобных конфигураций однозначно определяет химические свойства атомов. Томсон даже попытался теоретически объяснить схему построения Периодической системы элементов Д. И. Менделеева.

Нильс Бор (1885-1962)
Вскоре проверкой опытных данных занялся выдающийся физик-экспериментатор Эрнест Резерфорд, убедительно опровергнувший модель Томсона и утвердивший триумф планетарной модели. В это же время исследованием строения атомов занимался еще один из основателей новой физики, датский теоретик Нильс Бор. После анализа модели Резерфорда Бор взял ее за основу своих построений. К тому времени было достоверно известно, что заряд атомного ядра и число электронов строго равны в «электронейтральном» состоянии атома, определяя место данного химического элемента в Периодической системе Менделеева. Несомненно, это было важнейшим шагом в интерпретации физико-химических свойств веществ. Однако при этом не находила приемлемых объяснений необычайная устойчивость атомных структур, совершенно несовместимая с представлениями о вращении электронов по замкнутым орбитам, и тем более строение конкретных атомных спектров, состоящих из набора определенных линий. В общем-то понятно, что фиксированность вида спектров с их четко выраженной химической индивидуальностью должна быть как-то связана с атомным строением.
При этом сама устойчивость атома в целом противоречила основным положениям электродинамики, согласно которым любой электрон, двигаясь ускоренно по замкнутой орбите, должен был бы непрерывно излучать энергию, теряя при этом свою скорость в неминуемом падении на ядро. Ко всему прочему и сам характер движения электронов по классическим законам электродинамики не должен был бы приводить к наблюдаемым характеристикам линейчатых спектров. Ведь известные к тому времени линии спектров можно было сгруппировать в определенные серии, сгущающиеся в коротковолновой части серии. В то же время частоты спектральных линий для соответствующих серий подчинялись каким-то непонятным арифметическим закономерностям.
Так, Иоганн Бальмер (1825-1898) в 1885 году нашел, что четыре спектральные линии, соответствующие нейтральному водороду вполне могут быть выведены из единого соотношения. Несколько позже было получено около двух десятков линий в ультрафиолетовой части спектра, полностью укладывавшихся в формулу спектральной серии Бальмера. В последующем Иоганн Ридберг (1854-1919) в 1889-1900 годах нашел серийное распределение для спектральных линий щелочных металлов. При этом выяснилось, что частоты линий для каждой серии представимы в виде разности двух термов – простейших численных выражений, определяемых неким постоянным числом, названным постоянной Ридберга.
Строение атома Бора – Резерфорда
Так как планковская квантовая гипотеза в то время еще считалась спорной, неудивительно, что попытка Бора основать модель атома на понятии квантов не имела сначала у физиков большого успеха. Большинству теория Бора казалась гибридом, полученным с помощью прививки некоторых черт квантовой теории, исходящей из представлений о прерывности материи, к теории планетарных орбит – типичной классической теории, рассматривающей мир как нечто непрерывное.
Н. Винер. Автобиография
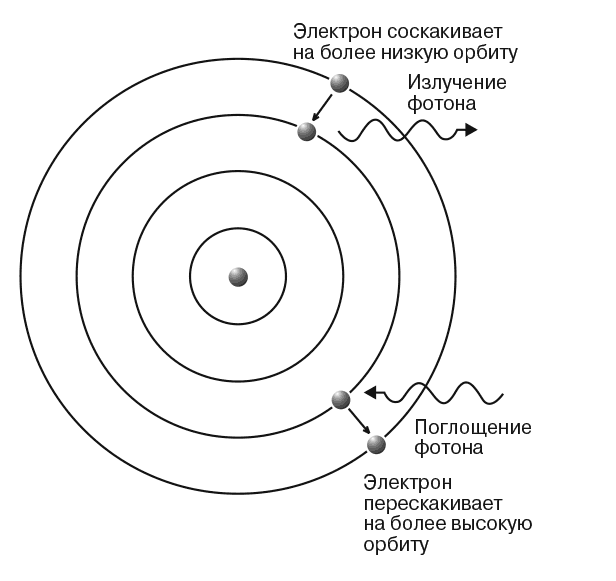
Бор долго искал объяснение спектральным сериям Бальмера и Ридберга, ему удалось вычислить постоянную Ридберга, оперируя такими фундаментальными понятиями, как масса и заряд электрона, постоянная Планка и скорость света. Для этого ему пришлось разработать модель атома исходя из физических представлений, совершенно чуждых классической науке. Это были прежде всего представления о так называемых стационарных атомных состояниях, когда существует ряд орбит, на которых электроны не излучают, хотя и движутся с ускорением. При переходе с одной орбиты на другую электрон излучает и поглощает энергию, равную кванту. В заключительных замечаниях к трем своим статьям «О строении атомов и молекул» Бор сформулировал свои основные гипотетические предположения:
1. Испускание (или поглощение) энергии происходит не непрерывно, как это принимается в обычной электродинамике, а только при переходе системы из одного «стационарного» состояния в другое.
2. Динамическое равновесие системы в стационарных состояниях определяется обычными законами механики, тогда как для перехода системы между различными стационарными состояниями эти законы недействительны.
3. Испускаемое при переходе системы из одного стационарного состояния в другое излучение монохроматично, и соотношение между его частотой v и общим количеством излученной энергии Е дается равенством E = tiv, где ħ – постоянная Планка.
4. Различные стационарные состояния простой системы, состоящей из вращающегося вокруг положительного ядра электрона, определяются из условия, что отношение между общей энергией, испущенной при образовании данной конфигурации, и числом оборотов электрона является целым кратным А/ 2 я. Предположение о том, что орбита электрона круговая, равнозначно требованию, что момент импульса вращающегося вокруг ядра электрона был бы целым кратным ħ/2 л.
5. «Основное» состояние любой атомной системы, т. е. состояние, при котором излученная энергия максимальна, определяется из условия, чтобы момент импульса каждого электрона относительно центра его орбиты равнялся ħ / 2n.
Бор дал объяснение спектральной серии, наблюдаемой в 1896-1897 годах Пикерингом в звездных спектрах, показав, что это соответствует ионизированному гелию. В дальнейшем Бор непрестанно уточнял и дополнял основы своей теории, неоднократно возвращаясь к вопросам теории пространственного квантования, позволившей объяснить влияние электромагнитных полей на вид атомных спектров. Одним из первых Бор включился в рассмотрение атомных рентгеновских спектров, предположив следующее: характеристическое рентгеновское излучение испускается при возвращении системы в нормальное состояние, если каким-либо воздействием, например катодными лучами, были предварительно удалены электроны внутренних колец.
Теоретическое исследование рентгеновских спектров атомов по идее Бора состояло в том, что электроны излучали высокоэнергетические кванты при переходах на глубоколежащих внутренних оболочках. Теория рентгеновских спектров Бора получила серьезное экспериментальное подтверждение после публикации результатов экспериментов Джеймса Франка (1882–1964) и Густава Людвига Герца (1887–1975). Эти физики-экспериментаторы начиная с 1913 года приступили к изучению соударений электронов с атомами различных газов. В результате анализа экспериментов выяснилось, что электроны могут сталкиваться с атомами газов упругим и неупругим образом. В случае упругого удара электрон как бы отскакивает от намного более тяжелого атома, практически не теряя энергии, а при неупругом соударении энергия электрона передается атому, который при этом может стать ионом путем ионизации либо перейти в возбужденное состояние. За свои многолетние исследования, наглядно подтвердившие квантовые закономерности событий в микромире, Франк и Герц в 1925 году стали нобелевскими лауреатами.
Модель атома Бора получила всестороннее развитие в работах многих исследователей и прежде всего самого ее автора. После множества экспериментальных подтверждений теория Бора стала общепризнанной, однако осталось еще много трудных вопросов, в первую очередь связанных с построением теоретических моделей многоэлектронных атомов. Кроме того, требовалось объяснить так называемый аномальный эффект Зеемана и многое другое, показывающее, что в атомной теории Бора, несмотря на ее поразительные успехи, есть и существенные недостатки, можно сказать, принципиального характера. В конце концов противоречия и трудности «боровской атомистики» превысили критический уровень, и целый ряд видных теоретиков принялись за поиск выхода из сложившегося положения.
При бурном развитии атомных моделей Бора в «арьергарде» с самого начала осталось много загадочных вопросов. Прежде всего, их озвучил сам соавтор планетарной модели атома – Резерфорд. Ознакомившись еще с первыми работами Бора, Резерфорд сразу же заострил внимание автора на трудностях, проистекавших из эклектического сочетания квантовых идей и классической механики электродинамикой. Действительно, в классической науке совсем нет места квантовым скачкообразным переходам, тем более совершенно непонятно, откуда электрон «знает», на какую же орбиту необходимо совершить переход.
Бор с очень большим вниманием отнесся к замечаниям Резерфорда, ясно показывавших противоречивость случайных квантовых переходов и строго детерминированных закономерностей движения электронов по атомарным орбитам. Одно время успехи модели Бора при объяснении спектральных серий во многом затмили противоречия атома Бора – Резерфорда. Однако затем недостатки теории снова всплыли на поверхность, особенно это было заметно на примере интерпретации эффекта Зеемана.
История открытия этого замечательного явления началась в 1896 году, когда голландский физик Питер Зееман (1865–1943) провел ряд экспериментов, пытаясь воспроизвести знаменитый опыт Фарадея. Этот великий экспериментатор помещал пламя натриевой горелки между полюсами достаточно сильного магнита и пытался найти изменение в спектре излучения. В своей модификации этого исторического опыта Зееман использовал мощный электромагнит с просверленным каналом для наблюдения не только перпендикулярного силовым линиям поля (поперечный эффект), но и вдоль поля (продольный эффект). В наблюдении поперечного эффекта, кроме линии с частотой колебаний, равной частоте колебаний в отсутствие поля, наблюдались еще и две дополнительные линии, не нашедшие разумного объяснения в модели атома Бора – Резерфорда.
Большой вклад в дальнейшее развитие модели атома Бора внес видный немецкий физик Арнольд Зоммерфельд (1868–1951). В своих рассуждениях он говорил, что, если атом подобен Солнечной системе, электроны могут, как и планеты, вращаться по эллипсам. При этом эллипсы с одинаковыми большими полуосями могли бы соответствовать электронам одинаковой энергии с одними и теми же главными квантовыми числами. Для характеристики вытянутости эллиптических орбит Зоммерфельд предложил последовательность целых орбитальных квантовых чисел.
Зоммерфельд много сил приложил к развитию теории Бора, введя принцип пространственного квантования. Считая, что движение электронов по разрешенным орбитам определяется их особыми параметрами, названными радиальными и азимутальными квантовыми числами, главным квантовым числом, определяющим энергию электрона, и побочным квантовым числом, определяющим форму орбиты, он попытался объяснить эффект Зеемана. Для этого Зоммерфельд учел, что пространственное положение электронных орбит должно определяться третьим магнитным квантовым числом. Именно введение этого дополнительного числа и последующее квантование по отношению к внешнему магнитному полю и позволило дать разумное объяснение эффекта Зеемана. Однако и это объяснение в известном смысле было неполным, поскольку ничего не говорило о поляризации линий, а разъясняло лишь частотные характеристики линий, не объясняя их интенсивность.
Таким образом, противоречия в теории атома Бора – Резерфорда стали множиться на каждом шагу, при этом квантовое описание спектроскопических эффектов постоянно усложнялось. Наиболее запутанное положение сложилось в теории света, где Эйнштейн после своей классической работы по теории фотоэффекта, введшей световые кванты (1917), решил перейти к дальнейшему развитию теории света. Великий физик предположил, что атом не просто излучает фотоны, а генерирует кванты света во вполне определенном направлении. При этом квант света будет обладать такими корпускулярными свойствами, как энергия материальной частицы, масса и импульс.
Эта идея блестяще подтвердилась после открытия, сделанного американским физиком Артуром Комптоном (1892–1962). В 1922 году Комптон изучал рассеяние рентгеновских лучей графитом как веществом со слабо связанными электронами. В ходе различных опытов он выяснил, что частота рассеянных рентгеновских лучей неуклонно изменяется в зависимости от углов рассеяния. При увеличении угла падения излучения на вещество частота «излучения отдачи» существенно уменьшается, оно становится более «мягким». В 1927 году Комптон стал нобелевским лауреатом за открытие этого эффекта.

