Вещества
Крики птиц, гнездящихся там, и далекий скрежет океана, что грызет обломки автомобилей, кирпичи и камни, — почти как рев машин в выходной день.
Нынешнее общество относится к «химии» довольно критически. Нам постоянно говорят, что полезна та еда, которая не содержит искусственных веществ, и мне встречались рекламы бутилированной воды «без химикатов». Однако на деле самая чистая вода — химическое соединение, как и все то, из чего состоят наши организмы. Еще до того, как человечество перешло к оседлости и основало в Месопотамии первые города, выживание человека зависело от целенаправленного поиска, обработки и применения природных химических соединений. За столетия мы придумали немало способов превращения веществ: те, что легко добываются на месте, превращаем в те, что нужнее, получая сырье, из которого строится цивилизация. Эволюционный успех нашего вида объясняется не только изобретением земледелия и животноводства или применением орудий и машин, облегчающих труд, но еще и умением добывать и создавать материалы и вещества, обладающие нужными свойствами.
Разные типы химических соединений как набор плотницких инструментов: каждый приспособлен для решения особой задачи, и, превращая сырье в необходимые нам продукты, мы берем для каждой задачи свое орудие. Мы увидим, что длинные цепочки углеводородов хорошо запасают энергию и отталкивают воду, то есть без них невозможны непромокаемые ткани. Мы рассмотрим различные растворы, применяемые для экстрагирования и очистки, и узнаем, как щелочи и химически противоположные им кислоты использовались в истории человечества для решения самых важных задач. Увидим, что некоторые вещества могут «сокращать» другие, оттягивая кислород — необходимый процесс для производства чистых металлов, а другие, называемые оксидантами, показывают обратную способность, например усиливая горение. В последующих главах мы поговорим о химической природе электричества, о химии, которая удерживает свет на фотографиях.
Здесь же я остановлюсь на самых необходимых и базовых веществах и процессах, притом самой малой их выборке. Химия во всей ее полноте — необъятная сеть взаимодействий, возможных превращений и переходов между разнообразными компонентами. Чтобы вернуть былые знания, постапокалиптическому обществу придется совершить большую работу по исследованию этой области, нащупать наиболее эффективные методы, переоткрыть эталонные пропорции соединяемых реагентов, записать верные химические формулы и молекулярные модели.
Термическая энергия
С течением времени человечество все лучше овладевало огнем, все более умело управляло процессом горения и применяло его. Целый ряд основных функций цивилизации немыслим без химических и физических превращений, вызываемых высокой температурой: плавка, ковка и литье металлов, стеклоделие, рафинирование соли, производство мыла, выжигание извести, обжиг кирпича, черепицы и керамических водопроводных труб, отбеливание тканей, хлебопечение, пивоварение и винокурение, а также выполнение сложных промышленных процессов Габера и Сольве, к которым мы вернемся позже. Вспышки пламени, заточенного в цилиндрах двигателей внутреннего сгорания, движут автомашины, и, даже щелкая выключателем лампы, вы, скорее всего, используете огонь, пусть и горящий где-то далеко на электростанции, — огонь, энергия которого извлекается, преобразуется и по проводам течет в вашу лампочку. Нынешняя техническая цивилизация зависит от применения огня не меньше, чем зависели наши предки, готовившие еду на очагах в первых рукотворных жилищах.
Сегодня основную часть необходимой термической энергии мы получаем напрямую или опосредованно (в виде электричества), сжигая ископаемое топливо: нефть, уголь и природный газ. Одна из технологий, открывших путь промышленной революции, — это производство кокса и его использование во многих промышленных процессах, в том числе упомянутых выше, особенно для плавки металлов и производства стали. С тех пор прогресс нашей цивилизации обеспечивался не возобновляемыми, восстанавливаемыми по мере потребления источниками энергии, а расходованием ископаемого топлива — энергии, запасенной миллионы лет назад, заключенной в преобразованной растительной массе.
Когда истощатся уцелевшие запасы бензина и газа на заправочных станциях, общество, отброшенное планетарной катастрофой к истокам, вероятно, не сможет удовлетворить прежнюю потребность в тепловой энергии. Бóльшая часть доступных месторождений высококачественного топлива уже выработана: изобилие законсервированной готовой к употреблению энергии, которое облегчило нам задачу в первый раз, осталось в прошлом. Нефть больше не бьет из мелких скважин, а за углем нужно все глубже забираться в земные недра, применяя сложнейшие технологии водоотведения, вентиляции и укрепления против обвала. Угля на планете еще много: США, Россия и Китай вместе располагают более чем 500 млн т, но легкодобываемые запасы в основном исчерпаны. Каким-то группам землян, уцелевших после апокалипсиса, может быть, повезет оказаться у неглубоко залегающих угольных пластов, которые можно разрабатывать открытым способом, но все же перезагрузка цивилизации, вероятно, поневоле будет «зеленой».
Как мы увидели в главе 1, после глобального катаклизма леса быстро захватят сельскую местность и даже брошенные города. Небольшая популяция переживших апокалипсис не ощутит дефицита дров, особенно если будет возобновлять вырубки быстрорастущими породами. Спиленный ясень или ветла дадут новые побеги от пня, и через 5–10 лет вырастет новое дерево; таким образом, с гектара лесного хозяйства в год можно получать в среднем от 5 до 10 т древесины. Поленья хороши для камина, для обогрева дома, но для различных задач, неизбежных на долгом пути возрождения цивилизации, потребуется топливо, дающее гораздо больше тепла, чем древесина. Поэтому придется вернуться к старинной практике — выжиганию угля.
Дерево сжигается с ограниченным притоком воздуха: при дефиците кислорода оно не сгорает полностью, а карбонизируется. Летучие вещества, такие как вода и другие небольшие легкие молекулы, легко переходящие в газ, выделяются вовне, а сложные компоненты, составляющие древесину, под действием жара разрушаются — древесина пиролизируется, — и получаются черные куски практически чистого углерода.
Древесный уголь не просто горит жарче своего прекурсора — поскольку из него удалена вся влага и остался только чистый топливный углерод — он примерно в два раза его легче, а значит, более компактен и транспортабелен.
Традиционно для бескислородного пережигания дерева — в чем заключалось ремесло углежога — поленья укладывали в пирамиду с полым каналом в центре, затем обмазывали глиной или обкладывали дерном. Дерево поджигали через отверстие на вершине, и затем за тлеющими дровами тщательно следили, регулируя их горение в течение нескольких дней. Нужного результата можно достичь проще: выройте траншею, заполните ее дровами, подожгите их, дайте разгореться, а потом накройте траншею найденными листами гофрированного железа и присыпьте землей, чтобы перекрыть кислород. Дерево будет тлеть и остывать. Древесный уголь окажется незаменимым чисто сгорающим топливом при возрождении ключевых производств: например, производства керамики, кирпича, стекла и металла, о чем мы поговорим в следующей главе. Если вы окажетесь в местности, где есть доступные залежи каменного угля, у вас под рукой тоже будет прекрасный источник тепловой энергии. Тонна каменного угля дает ее столько же, сколько целый акр леса. Неудобство состоит в том, что сгорает каменный уголь не так жарко, как древесный. К тому же это довольно грязное топливо — копоть может испачкать выпекаемый вами хлеб или выплавляемое стекло, а сталь от содержащихся в угле сернистых примесей становится хрупкой и малопригодной для ковки. Чтобы этого избежать, уголь коксуют.
Это похоже на выжигание древесного угля из древесины. Каменный уголь спекают в печах с ограниченным притоком кислорода, чтобы устранить примеси и летучие вещества, которые, как и побочные продукты сухой перегонки древесины, имеют свое особое применение и для этого конденсируются и запасаются.
Сжигание топлива также дает свет, и, пока возрождающееся общество восстанавливает электросети и заново изобретает лампочку Эдисона, уцелевшим людям придется довольствоваться масляными лампами и свечами. Растительные масла и животные жиры благодаря особенностям их химии служат лучшим компактным источником энергии с управляемым горением. Особенность этих соединений — длинные углеводородные цепи: гирлянды из атомов углерода с прицепленными по бокам атомами водорода, похожие на гусеницу с множеством коротких ножек. Энергия заключена в связях между разными атомами, так что длинные углеводороды представляют собой туго набитые упаковки, которые нужно вскрыть. В процессе горения эти крупные структуры распадаются, и все атомы соединяются с кислородом: водородные образуют воду, а звенья углеродного хребта улетучиваются в составе углекислого газа. Быстрая разборка длинных массивных молекул в ходе окисления высвобождает поток энергии — теплое мерцание свечного огонька.
Простейшей масляной лампой может служить глиняный сосуд с узким носиком или горлышком или просто большая морская раковина. Фитиль, сделанный из волокон льна или из камыша, поднимает жидкое топливо из резервуара туда, где оно испаряется от жара пламени и затем возгорается. С 1850-х гг. обычным топливом для ламп стал керосин (который сегодня носит над облаками реактивные лайнеры), но керосин получают путем дробной перегонки сырой нефти, и произвести его после краха современной технологической цивилизации будет затруднительно. Подойдет любая маслянистая жидкость: рапсовое масло, оливковое или даже топленое сливочное (чистое).
Свече не нужна оболочка, потому что топливо в ней остается твердым, пока в соприкосновении с пламенем не растечется в небольшую лужицу; то есть свеча — это цилиндр твердого топлива, в сердцевине которого проходит фитиль. С выгоранием топлива фитиль обнажается все больше, пламя становится ярче и коптит, если фитиль не подрезать. Избавляет от этой заботы не приходившее никому в голову до 1825 г. усовершенствование: волокна фитиля сплетают в форме плоской ленты, которая естественным образом загибается книзу, так что излишек фитиля уничтожается пламенем.
Современные свечи делаются из парафина, продукта перегонки сырой нефти, а пчелиный воск никогда не будет широкодоступен, однако вполне пригодные свечи можно изготовить из топленого животного жира. Сварите в соленой воде мясную обрезь, соберите с поверхности отвердевший слой жира. Из свиного лярда получаются пахучие и дымные свечи, но говяжий и бараний жир вполне сгодятся. Растопленный жир заливается в форму, либо ряд фитилей просто окунают в расплав и оставляют на воздухе, чтобы слой жира на них застыл. Затем операция повторяется, добавляются слой за слоем, пока не получится нужная толщина.
Известь
Первое вещество, не являющееся топливом, которое придется добывать и обрабатывать возрождающемуся постапокалиптическому обществу, — это карбонат кальция. У него множество назначений, абсолютно необходимых для основ любой цивилизации. Это простое соединение, и его легко получаемые производные можно использовать для повышения производительности земледелия, поддержания гигиены и очистки питьевой воды, выплавки металлов и изготовления стекла; из него получают широко применяемый в строительстве материал и ключевые реагенты, необходимые для восстановления химической промышленности.
Богатыми источниками карбоната кальция служат коралл и морские ракушки, а еще мел. Мел — это, строго говоря, биологическая порода: белые скалы Дувра — это, по сути дела, стометровой толщины плиты из спрессованных ракушек со дна доисторического моря. Но самый обычный источник карбоната кальция — известняк. К счастью, это относительно мягкая горная порода, и со стен карьера ее можно без особых хлопот скалывать молотами, клиньями и кирками. Или просто расплющить и заострить конец у автомобильной оси и применять ее как отбойный молоток, вбивая в край карьера или стену, чтобы получался ряд отверстий. Затем в отверстия загоняют деревянные клинья и постоянно смачивают, пока они не разбухнут и в конце концов не расколют скалу. Впрочем, довольно скоро вы захотите переизобрести взрывчатку и применять вместо этого изнурительного ручного труда динамитные шашки.
Карбонат кальция также повсеместно применяется как известковое удобрение: для обработки полей и повышения урожайности культур. На кислых почвах толченый мел или известняк разбрасывают, чтобы восстановить нейтральный уровень кислотности. В кислой почве растению труднее добыть питательные вещества, о которых мы писали в главе 3, особенно фосфор, и посевы будут голодать. Известкование почвы повышает эффективность органических и искусственных удобрений, вносимых на поля.
Однако особенно полезным для нужд цивилизации известняк становится после химических превращений, которые происходят при его нагреве. Если карбонат кальция обжечь в печи при достаточно высокой температуре — как минимум при 900 °C в горне, — он разложится на оксид кальция и углекислый газ. Оксид кальция известен в быту как жженая известь или живая известь. Это чрезвычайно едкое вещество, его применяют при массовых захоронениях — к которым, вероятно, придется широко прибегать после апокалипсиса, — чтобы уничтожить запах и предупредить распространение заразы. Другое нужное вещество получается путем осторожного соединения жженой извести с водой.
Живой жженую известь называют за бурную реакцию при соединении с водой: она высвобождает жар и так кипит, что кажется живым существом. Химическая природа реакции в том, что оксид кальция разрывает молекулы воды пополам, и получается гидроксид кальция — гидратная, или гашеная, известь.
Гашеная известь сильнощелочная и очень едкая, у нее множество применений. Если нужна белая краска для стен, чтобы здания в жарком климате не перегревались, легко сделать белила, смешав известь с мелом. Гашеную известь также можно использовать для очистки использованной воды: она связывает мелкие взвешенные частички и выводит их в осадок, а прозрачная вода идет в дальнейшую очистку. Гашеная известь — важнейший строительный материал, мы увидим это в следующей главе. Не будет преувеличением сказать, что без нее наши города и поселки не были бы такими, какими мы их знаем. Но как породу превратить в живую известь?
Современные заводы по обжигу известняка выжигают живую известь во вращающихся стальных барабанах струей горячего газа, получаемого от сожжения мазута, но в постапокалиптическом мире придется обходиться простейшими методами. Если вам случится начинать на пустом месте, можно выжигать известь в яме в середине большого костра, дробить ее и гасить мелкими партиями, чтобы пустить в раствор, годный для устройства нового горна, выложенного изнутри кирпичом, в котором вы продолжите выжигать известь с большей производительностью.
Наилучший низкотехнологичный вариант для обжига извести — это шахтная печь смешанной загрузки. В сущности, это высокая кирпичная труба, заполненная чередующимися слоями топлива и кальцинируемого известняка. Такие печи часто врезали в склон крутого холма, чтобы прочнее была опора и полнее термоизоляция. Проходящая по трубе партия известняка сначала высушивается и разогревается восходящим током жара, затем в зоне горения кальцинируется и наконец на дне остывает. Раздробившуюся известь выгребают через специальные люки. Пока топливо сгорает и известь накапливается внизу, через верх можно загрузить в печь новые слои дров и породы, чтобы горн горел не угасая.
Для гашения обожженной извести понадобится неглубокий резервуар с водой, можно использовать подручную ванну. Важно так добавлять воду, чтобы смесь подходила к температуре кипения, и выделяющееся тепло использовать для ускорения реакции. От мелких частиц извести вода станет белой, затем они постепенно осядут на дно и образуют пульпу, поглощающую все больше воды. Слив воду, вы обнаружите вязкую массу гашеной извести. В главе 11 мы рассмотрим, как известковая вода используется для производства пороха, а сейчас давайте разберем одно важное применение самой гашеной извести — создание химического оружия против опасных орд микроорганизмов.
Мыло
Мыло можно легко сделать из обычных природных материалов, оно совершенно необходимо, чтобы избежать множества болезней. Как показывают санитарные исследования в развивающихся странах, почти половины случаев заражения желудочно-кишечными и респираторными инфекциями можно было избежать, если бы люди просто мыли руки.
Сырьем для производства всех видов мыла служат масла и жиры. Так что если, готовя утром завтрак, вы брызнули на рубашку жиром от бекона, чтобы отстирать его, вам, как ни странно, понадобится вещество, также полученное из жира. Мыло удаляет жирные пятна с одежды и смывает насыщенный бактериями жир с кожи за счет того, что оно легко смешивается и с жирными соединениями, и с водой, которые не смешиваются между собой. Такую легкость в общении мылу придают молекулы особого типа: у них длинный углеводородный хвост, который хорошо соединяется с жирами и маслами, и электрически заряженная голова, быстро растворяющаяся в воде. Молекула масла или жира сама по себе состоит из трех углеводородных цепочек жирных кислот, прикрепленных к соединительному блоку. В производстве мыла ключевой момент — сапонификация, то есть разрыв химических связей, соединяющих три жирные кислоты. Это делается с помощью щелочей, обширного класса веществ, которые гидролизируют сцепляющие мостки в молекулах. Щелочи — противоположность кислот, и при соединении эти вещества друг друга нейтрализуют, образуя воду и соль. Так, обычная поваренная соль, хлорид натрия, получается нейтрализацией щелочи (гидроксида натрия) соляной кислотой.
Следовательно, для приготовления мыла нужно получить соль жирной кислоты путем гидролизации жира щелочью. Хотя жир и вода не смешиваются, соль жирной кислоты умеет внедрять свой длинный углеводородный хвост в жир, оставляя снаружи голову, растворяющуюся в воде. Облаченная в щетину этих длинных молекул капелька масла закрепляется в воде, которая ее пытается отторгнуть, и таким образом жир можно отделить от кожи или материи и смыть. На флаконе с «укрепляющей, оживляющей, увлажняющей чистой морской свежестью» — гелем для душа у меня в ванной — перечислено около тридцати составляющих. Но при всех пенообразующих, стабилизирующих, консервирующих, желирующих и сгущающих добавках активным агентом остается мягкое мылоподобное поверхностно-активное вещество (ПАВ) на основе кокосового, оливкового, пальмового или касторового масла.
Таким образом, перед гражданами постапокалиптического мира, где производства химических реактивов больше нет, остро встает вопрос, где раздобыть щелочь. На их счастье, пережившие апокалипсис могут обратиться к старинным способам химической экстракции и к такому не самому очевидному сырью, как зола.
Сухие остатки костра состоят в основном из негорючих минеральных компонентов: это они придают белый цвет золе. Первый шаг к восстановлению примитивного химического производства восхитительно прост: бросьте золу в котел с водой. Черная недогоревшая угольная пыль всплывет на поверхность, а поскольку многие древесные минералы нерастворимы, они в виде осадка выпадут на дно. Но вам нужно заполучить те, которые растворяются.
Снимите с поверхности и удалите угольную пыль, а водный раствор слейте в другую посуду, стараясь, чтобы туда не попал осадок. Выпарите воду из второй посудины путем кипячения или, если вы находитесь в жаркой стране, вылейте раствор в широкие мелкие сосуды и оставьте на солнце испаряться. После выпаривания воды в сосудах останется белый кристаллический осадок, похожий на соль или сахар, так называемый поташ (именно от английского народного слова potash («горшок золы») происходит латинское название калия (potassium) — элемента, составляющего основу полученного вещества). Для получения поташа важно брать золу костра, выгоревшего дотла, а не залитого водой или дождем, иначе из нее уже будут вымыты нужные вам растворимые минералы.
Белый кристаллический осадок на самом деле состоит из нескольких компонентов, но главный, добытый из древесного пепла, — это карбонат кальция. Если вместо дров вы сожжете охапку высушенных водорослей и повторите тот же процесс экстракции, то соберете кальцинированную соду, карбонат натрия. Для жителей западных побережий Шотландии и Ирландии сбор и пережигание водорослей не первое столетие остаются важным доходным промыслом. Водоросли также содержат йод, темно-фиолетовое вещество, которое окажется весьма полезным для обеззараживания ран и для фотографического процесса, к которому мы еще вернемся.
Описанным способом можно собрать около 1 г карбоната кальция или натрия с каждого килограмма сожженных дров или водорослей — это около 0,1%. Однако поташ и кальцинированная сода — настолько нужные вещества, что на их выпаривание и очистку стоит потратить усилия, к тому же выпаривать можно на огне, уже разведенном для каких-то иных целей. Древесина служит удобным хранилищем этих веществ, дело в том, что корневая система дерева десятилетиями собирает воду и растворенные в ней минералы с огромного объема почвы и огонь помогает эти минералы концентрировать.
И поташ, и кальцинированная сода — щелочи; само латинское слово alkali происходит от арабского al-qalīy, что значит «выгоревшие угли». Если засыпать выпаренный поташ в чан с кипящим маслом или жиром, жир сапонифицируется, и получится мыло. И в постапокалиптическом мире вы сможете соблюдать чистоту и защищаться от заразы, обходясь такими простыми веществами, как жир и пепел, плюс небольшое знание химии.
Реакция гидролиза будет полнее, если взять более крепкий щелочной раствор: щелок. Тут мы и возвращаемся к гашеной извести, гидроксиду кальция.
Саму гашеную известь применять для сапонификации нельзя, потому что известковое мыло не растворяется и вместо мягкой пены оставляет на воде пленку. Но гидроксид кальция реагирует с поташом или содой: гидроксильная группа меняет партнера, и мы получаем гидроксид кальция или гидроксид натрия: едкое кали или едкий натр, оба они называются щелоком. Едкий натр — сильная щелочь (он запросто превратит жиры в вашей коже в человеческое мыло, поэтому обращайтесь с ним с особой осторожностью), и таким образом он идеально подходит на роль сапонифицирующего агента для получения твердых мыльных брикетов.
Другая легко получаемая щелочь называется аммиак. Организм человека, как и любого млекопитающего, выводит излишки азота в виде водорастворимого состава, который называется мочевиной и выходит с мочой. Жизнедеятельность определенных бактерий превращает мочевину в аммиак — многим знакома характерная вонь в плохо вымытом общественном туалете, — так что эту важнейшую щелочь тоже можно добыть, не прибегая к сложным технологиям, а просто ферментируя мочу в банках. Исторически этот метод сыграл важную роль в производстве одежды, окрашенной индиго (традиционный краситель для джинсов), а к разнообразным применениям аммиака мы еще вернемся.
Сапонификация жирных молекул дает еще одну полезную субстанцию. После того как жир превратится в мыло, остается побочный продукт глицерин — химическая составляющая липида, которая служит связующим звеном, соединяя три хвоста жирных кислот. Глицерин сам по себе восхитительно полезная вещь, и его легко экстрагировать из пенного мыльного раствора. Содержащиеся в мыле соли жирной кислоты в соленой воде растворяются хуже, чем в пресной, так что, если раствор посолить, они выпадут в осадок в виде твердых частиц, а в жидкой фракции останется глицерин — важнейшее сырье для производства пластика (об этом мы поговорим в главе 11).
Реакция гидролиза, трансформирующая животные жиры в мыло, также применяется для производства клея.
Клей получают, проваривая кожу, жилы, рога и копыта: все, что содержит прочную соединительную ткань, состоящую из коллагена, который разлагается до желатина. Желатин растворяется в воде, так что получается вязкая клейкая масса, которая, высохнув, становится твердой и прочной. Необходимое для этого гидролитическое разложение много быстрее происходит в сильнощелочной среде — еще одно применение щелока — или в кислой (этого момента мы коснемся позже).
Пиролиз древесины
Дерево может дать много больше, чем уголь для топлива и вытянутые из золы щелочи. Когда-то оно служило главным источником органических соединений — химического сырья и прекурсоров для самых разных процессов и производств, — и лишь в конце XIX в. его потеснила каменноугольная смола, а чуть позже — процесс получения нефтепродуктов из сырой нефти. Так что в постапокалиптическом мире, где у вас может не оказаться доступных залежей угля или постоянного источника сырой нефти, старинные «древесные» технологии помогут возродить химическую промышленность.
Главный принцип выжигания угля: удалить из древесины летучие вещества, чтобы остался жарко горящий почти чистый углерод. Но отходы этого выжигания на самом деле весьма полезные вещества. И небольшое усовершенствование процесса позволит захватить улетучивающиеся пары. Во второй половине XVII в. химики заметили, что сжигание дерева в закрытом сосуде высвобождает горючий газ и пары, которые можно конденсировать в водянистую жидкость. Эти вещества стали называть пиродревесными или пирогенетическими, и они представляют собой сложную смесь многих компонентов. В идеале возрождающееся сообщество могло бы сразу освоить технологию выжигания дерева в герметичных металлических контейнерах с отводными трубами для откачки паров и конденсации путем охлаждения в резервуаре с холодной водой. Газы, выделившиеся при горении, не конденсируются, и их можно использовать для топки печей под контейнерами. В главе 9 мы увидим, что пирогенетическими газами можно даже заправлять машины.
Собранный конденсат легко разделяется на водянистую жидкость и плотный смолистый осадок: и то и другое — сложные смеси, которые можно разделить ранее описанным способом дистилляции. Жидкая фракция, изначально называемая пирогенетической (пироуксусной) кислотой, состоит в основном из уксусной кислоты, ацетона и метанола.
Уксусная кислота применяется для консервирования пищевых продуктов: как мы отмечали, пищевой уксус — это, по сути дела, ее слабый раствор. Реагируя с соединениями щелочных металлов, она производит широкий круг полезных солей. Например, соединяясь с едким натром или едким кали, дает ацетат натрия, который используется как закрепитель при окрашивании тканей. Ацетат меди применяется как фунгицид и с античных времен служит сине-зеленым пигментом для изготовления красок.
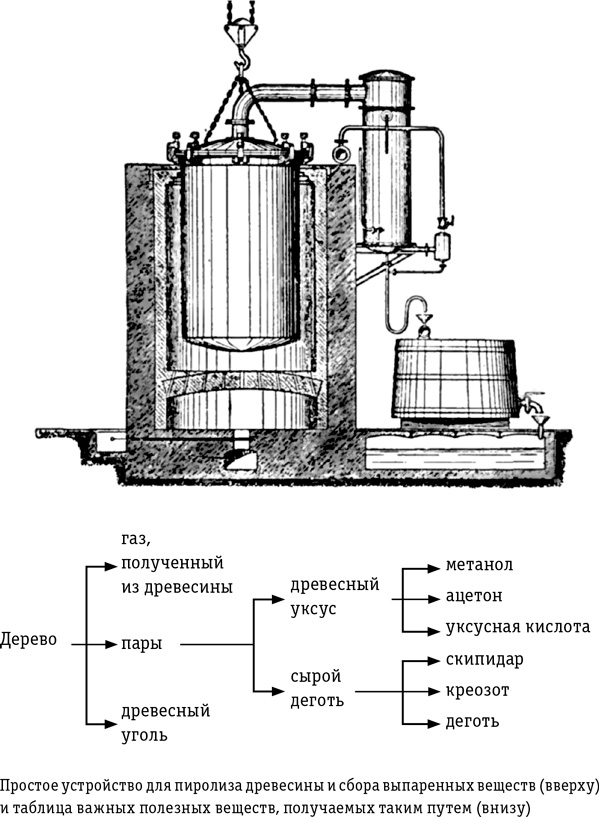
Ацетон — хороший растворитель и применяется как основа для красок (это им так резко пахнут лаки для ногтей) и как обезжиривающий состав. А еще он нужен для производства пластика и кордита, взрывчатого вещества, которым в Первую мировую войну снаряжали патроны и снаряды. В какой-то момент Британия даже опасалась проиграть войну из-за дефицита ацетона. Огромная потребность в ацетоне для кордита намного превосходила то количество, которое можно было получить путем дистилляции древесины, — даже с учетом ацетона, ввозимого из богатых лесом стран, таких как США. Увеличить производство позволило изобретение новой технологии секреции ацетона определенным видом бактерий в процессе брожения и море каштанов, собранных школьниками для такой закваски.
В больших количествах сухой дистилляцией древесины получают метанол, изначально называвшийся древесным спиртом: каждая тонна дерева дает около 10 л. Молекула метанола — простейшая из всех спиртов: она содержит лишь один атом углерода, в то время как этанол, например, то есть питьевой спирт, строится на основе блока из двух. Метанол используется как топливо и растворитель, служит антифризом и играет важнейшую роль в производстве биотоплива, к чему мы перейдем в главе 9.
Сырой деготь, выпаренный из обожженного дерева, тоже можно разложить дистилляцией на основные составляющие: легкий текучий скипидар (плавает на поверхности воды); плотный густой креозот (тонет в воде) и темный вязкий деготь. Скипидар — широко востребованный растворитель, исторически употребляемый для красителей, к нему мы вернемся в главе 10. Креозот — удивительно сильный консервант, им покрывают или пропитывают древесину, чтобы сохранить ее от гниения и воздействия стихий. Также он обладает антисептическими свойствами, замедляет размножение микробов и консервирует мясо — именно он придает характерный вкус копченостям. Деготь — самый клейкий из трех экстрактов, плотная микстура из длинноцепных молекул, его воспламеняемость делает его идеальной пропиткой для факелов. Смолистый деготь отталкивает воду и годится для замазывания худых ведер и бочек; не одно тысячелетие им герметизируют стыки между досками в корабельных и лодочных корпусах.
Эти важные химикалии в каких-то количествах дает древесина любых деревьев, но дегтем особенно богаты смолистые плотные породы, например хвойные — сосна, ель и пихта. Береста тоже дает много дегтя, и с каменного века ею закрепляли оперение на стрелах. Но вообще-то, если вам нужен только деготь, можно собирать его, когда он истекает из смолистых дров, обжигаемых в горне, и даже просто в жестяном ящике, поставленном на огонь.
Дистилляция — широко применимый способ разделения жидких смесей, основанный на разнице температур кипения разных фракций, и возрождающемуся человечеству хорошо бы освоить его как можно скорее. Дистилляция разделяет перемешанные продукты пережигания древесины, вытягивает, как мы уже видели, спирт из бродящего сусла, а еще раскладывает сырую нефть на фракции: от плотного вязкого битума до легких и летучих компонентов типа бензина. A по достижении определенного уровня индустриализации дистиллировать можно даже самый воздух. Его охлаждают примерно до –200 °C, повторяя процесс расширения и охлаждения, и запирают в резервуаре с вакуумной изоляцией, гигантском термосе вроде тех, в которых мы берем чай на пикник. После этого жидкий воздух понемногу нагревают и каждый газ, испаряющийся из него, собирают — чистый кислород, например, применяется в медицинских целях.
Кислоты
До сих пор мы говорили в основном о щелочах, поскольку их сильные разновидности относительно легко получить. Кислоты, химическая противоположность щелочей, не меньше распространены в природе, но сильные кислоты встретить не так просто, как, например, щелок, и их широкое хозяйственное применение началось значительно позже. Мы уже видели, как растительные продукты сбраживаются для дистилляции спирта и как спирт, в свою очередь, можно окислить, выставив его на воздух, чтобы получить уксус. Уксусная кислота первой из всех кислот оказалась в распоряжении человека и бóльшую часть человеческой истории оставалась у него единственной. Цивилизация располагала широким выбором щелочей — поташ, кальцинированная сода, гашеная известь, аммиак, — но тысячелетия прогресс в химии сдерживался тем, что из кислот была доступна лишь одна, и та слабая.
Следующей кислотой, которую человек научился использовать, стала серная. Изначально ее выгоняли, прокаливая редкий стеклоподобный минерал купорос, а позже стали массово производить, сжигая в заполненных паром свинцовых контейнерах чистую желтую серу с селитрой. Сегодня мы получаем серную кислоту как побочный продукт очистки нефти и природного газа от сернистых примесей. Так что постапокалиптическое человечество, вероятно, застрянет посредине: не сможет добывать эту нужнейшую кислоту традиционным способом, потому что все вулканические месторождения элементной серы давно выработаны, и не сможет добывать ее более современными методами за отсутствием необходимого катализатора.
Придется попробовать химический способ, никогда в истории не использовавшийся в промышленных масштабах. Сернистый газ можно выжечь из распространенного минерала колчедана (железный колчедан известен как «самоварное золото», также колчеданы — это руды, из которых добываются свинец и олово) и соединить с газообразным хлором, добытым посредством электролиза соленой воды, используя катализатор — активированный уголь (пористую разновидность древесного угля). В результате получится жидкость, так называемый хлористый сульфурил, которую можно концентрировать путем дистилляции. В воде это соединение распадается на серную кислоту и хлористый водород, который тоже следует собрать и вновь растворить в воде, чтобы получить соляную кислоту. Нам повезло, что существует к тому же простой способ проверить, относится ли порода к колчеданам (сульфидам металлов): нужно капнуть немного разведенной кислоты, и, если порода зашипит и появится запах тухлых яиц, это то, что надо (вот только сероводород ядовит, поэтому не вдыхайте слишком много!).
В наши дни серной кислоты производится больше, чем любого другого химического соединения, — это хлеб современной химической индустрии, который очень поможет ускорить восстановление после планетарной катастрофы. Серная кислота важна, потому что она лучше всех других решает несколько важных задач. Это не только сильная кислота, это сильный дегитратант и окислитель. Большая часть производимой сегодня серной кислоты употребляется в производстве искусственных удобрений: ею растворяют фосфатные породы (или кости животных), чтобы извлечь важнейшее для растений питательное вещество — фосфор. Но список применений серной кислоты бесконечен: приготовление железистых чернил, отбеливание хлопка и льна, производство стирального порошка, очистка и подготовка поверхности чугуна и стали для дальнейшей обработки, изготовление смазок и синтетических волокон, использование в качестве электролита.
Научившись получать серную кислоту, вы откроете дорогу производству других кислот. Соединив ее с поваренной солью (хлоридом натрия), получите соляную кислоту, а с селитрой — азотную. Азотная кислота особенно полезна своей выдающейся способностью окислять: она окисляет даже те вещества, которые не по силам серной. Поэтому азотная кислота незаменима в производстве взрывчатки и подготовке соединений серебра для фотографии.

