3. Описание атома
Происхождение квантовых энергетических уровней
Электрон, который свободно перемещается в пространстве, очень похож на фотон: это волновая функция, которая распространяется, длина волны составляет λ=h/mν. Если мы попробуем его обнаружить, электрон окажется в одной точке этой волны, вероятнее всего «на гребне волны». В момент, когда мы ее обнаружим, «волна-носитель» мгновенно исчезнет (электрон-волна становится электроном-частицей).
Также и фотон является волной до тех пор, пока его не попытаются обнаружить: в опыте Юнга это произошло при установке на его пути стенки. В момент обнаружения фотон становится точечной частицей, поскольку касается стены в одной конкретной точке, в то время как волна исчезает (мы уточним понятие «обнаружение» и условия превращения волны в точечную частицу в параграфе 4).
Аспект электрона в атоме, напротив, совсем другой. На этот раз электрон пленник электростатического поля ядра, то есть он не может вести себя как волна, которая распространяется. Наоборот, волна остается запертой в ограниченном пространстве. «Волна, запертая в ограниченном пространстве»: вам это ничего не напоминает? Мы уже изучали эту ситуацию в случае с акустической волной, запертой в полости, как у духовых инструментов (глава 12). И тогда мы сделали вывод, что в таком виде могут существовать лишь волны определенной длины, соответствующей размеру полости.
Также и волна электрона, запертого в атоме, не может обладать произвольной длиной. Это значит, что электрону позволены только определенные скорости (λ=h/mν) и определенная энергия.
А вот и долгожданный результат, который позволит понять модель атома Бора! Электрон может обладать лишь определенным уровнем энергии, потому что может иметь волны некоторой определенной длины: это именно то, что нужно было модели Бора, чтобы объяснить спектр излучения и поглощения атомов. Когда электрон переходит от одной энергии к более низкой, эмитируется фотон, компенсируя разницу энергий. Поскольку электрон может обладать только определенными величинами энергии, то же происходит и с эмитированными фотонами: только волны строго определенной длины могут быть выпущены.
«Форма» волн
Результаты, полученные в случае с акустическими волнами, также позволяют понять вид, который принимают волны электронов в атоме. Если длина волны равна двойной длине полости, это значит, что есть только один гребень в центре, как показано на рис. 23.4.а1. Если длина волны равна длине полости, это значит, что есть один гребень и одна впадина (➙ рис. 23.4.а2).
Напомним, что в случае с электроном возможность присутствия дана через квадрат волновой функции: это дает формы, показанные на рис. 23.4.b1 и 23.4.b2. Отметим, что они соответствуют полости, ориентированной по определенной оси, как это было при описании акустической волны. На самом деле «полость», которая составляет атом, имеет три измерения: представление волны в зависимости от расстояния в ядре от этого несколько изменилось бы. В дальнейшем мы предположим, что гребни являются вероятностью присутствия электрона в зависимости от расстояния в ядре, но нужно не забывать, что в этом случае вид гребней не совсем соответствует реальности.
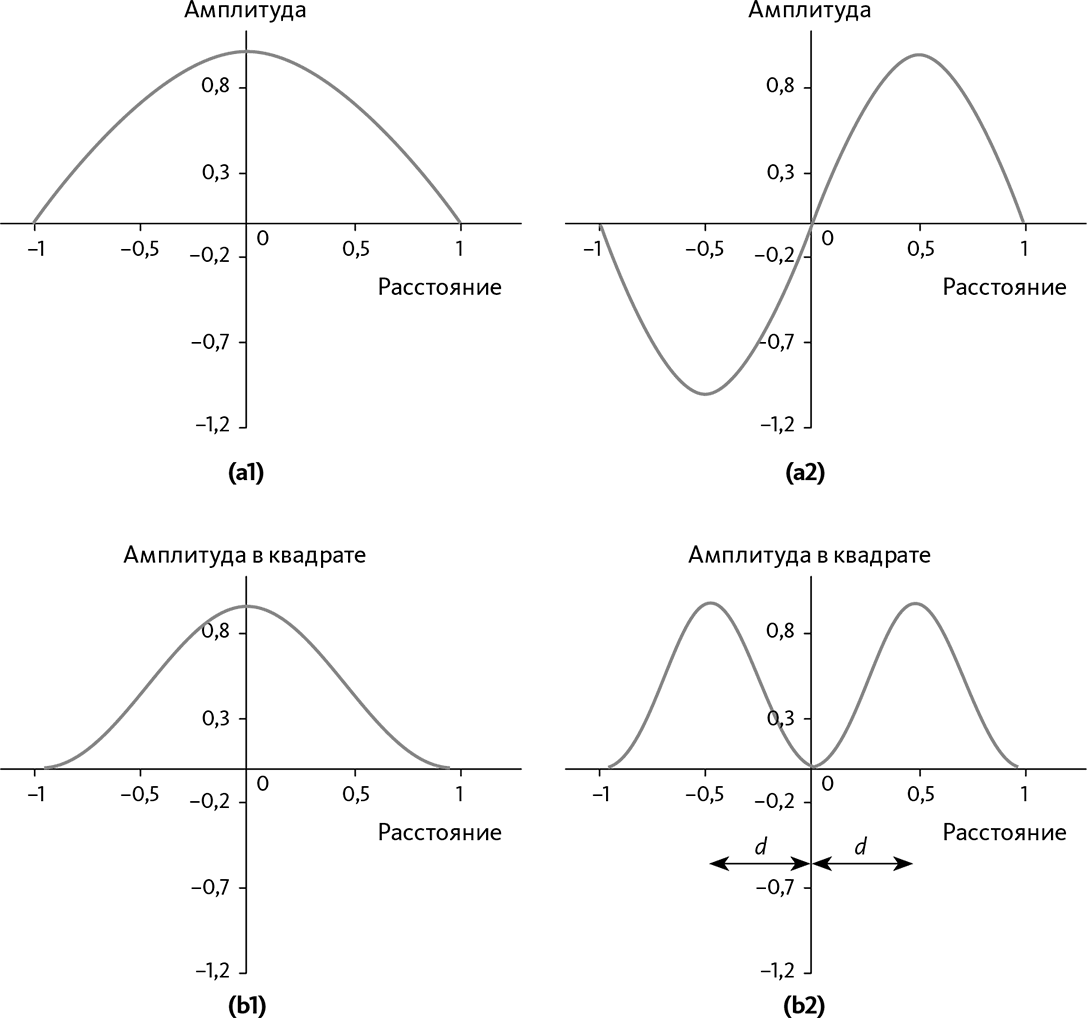
Рис. 23.4 – Волны, запертые в полости
Значения на осях являются произвольными.
В части (а) мы представили две волны самой большой длины, которые могут существовать в полости (λ = 2а в случае (а1) и λ = а в случае (а2), где а – длина полости).
В части (b) мы представили квадрат этих двух функций. В случае с электронами атома это означало бы вероятность присутствия электрона, начало координат соответствует расположению ядра.
Каждая волна соответствует строго определенному среднему расстоянию в ядре, связанному с определенной энергией.
На этих рисунках нулевая точка оси представляет собой центр полости: в случае с атомом речь идет о ядре. Мы видим, что на графике b2 электрон находится от ядра в среднем на определенном расстоянии d. Эта волна была представлена на рис. 23.5 более наглядно: мы снова видим то же расстояние d до ядра. Видно, что это очень напоминает традиционный облик «орбиты», расположенной на расстоянии d от ядра; но здесь электрон не проходит по этой орбите, он находится везде сразу. По аналогии с классическим понятием орбиты волна электрона в атоме называется «орбиталь».
Разные возможные волны имеют каждая свое собственное среднее расстояние до ядра. Какой бы ни была волна, это среднее расстояние до ядра всегда не нулевое, поскольку волна распределяется по целому диапазону расстояний: это значит, что энергия электрона также не равна нулю.
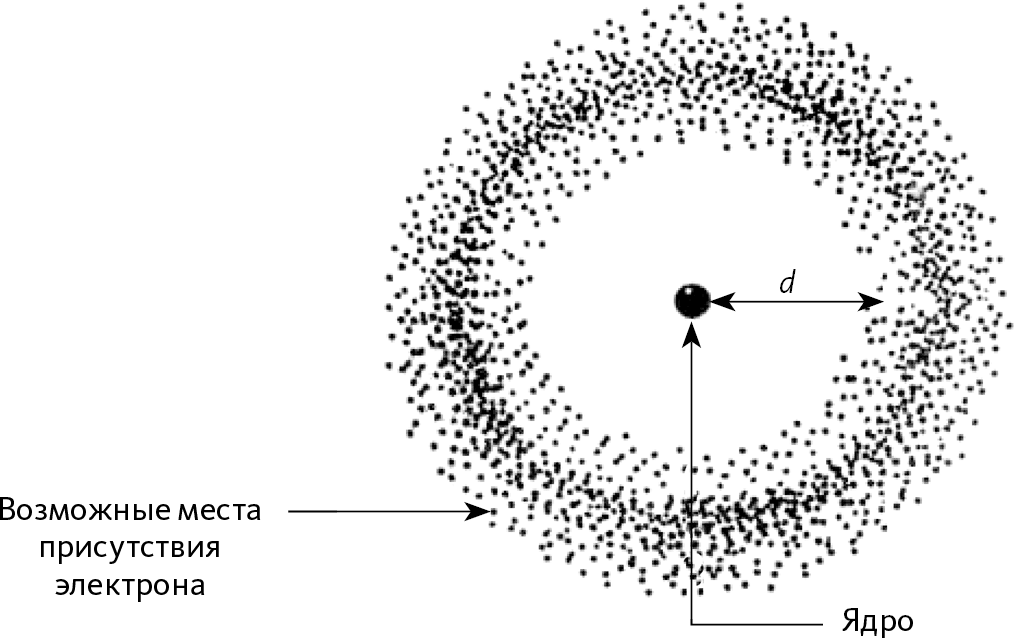
Рис. 23.5 – Вероятность присутствия электрона в атоме
Каждая точка представляет собой обнаружение электрона. Накладывая точки большого количества обнаружений, мы получаем внешний вид волны вероятности присутствия в двух измерениях. Мы видим, что вероятность найти электрон выше на определенном расстоянии от ядра. На заданной высоте ясно просматривается аналогия с понятием орбиты; но электрон не перемещается по этой орбите, он находится «везде сразу». Это называется «атомная орбиталь».
Другими словами, существует минимальный энергетический уровень, ниже которого электрон спуститься не может: он не может подойти к ядру ближе, потому что среднее расстояние до ядра никогда не может быть нулевым. Волновая сущность электрона также объясняет, что электрон не мог бы спуститься ниже минимальной орбиты, соответствующей наименьшему среднему расстоянию до ядра.
Наконец, необходимо уточнить, что волны электронов могут распределяться в трех пространственных измерениях внутри атома. Но волна не обязательно распространяется таким образом во всех направлениях (сферическая симметрия не обязательно присутствует). Уравнение Шрёдингера позволяет уточнить эту геометрию в трех измерениях: мы представили несколько примеров на рис. 23.6.
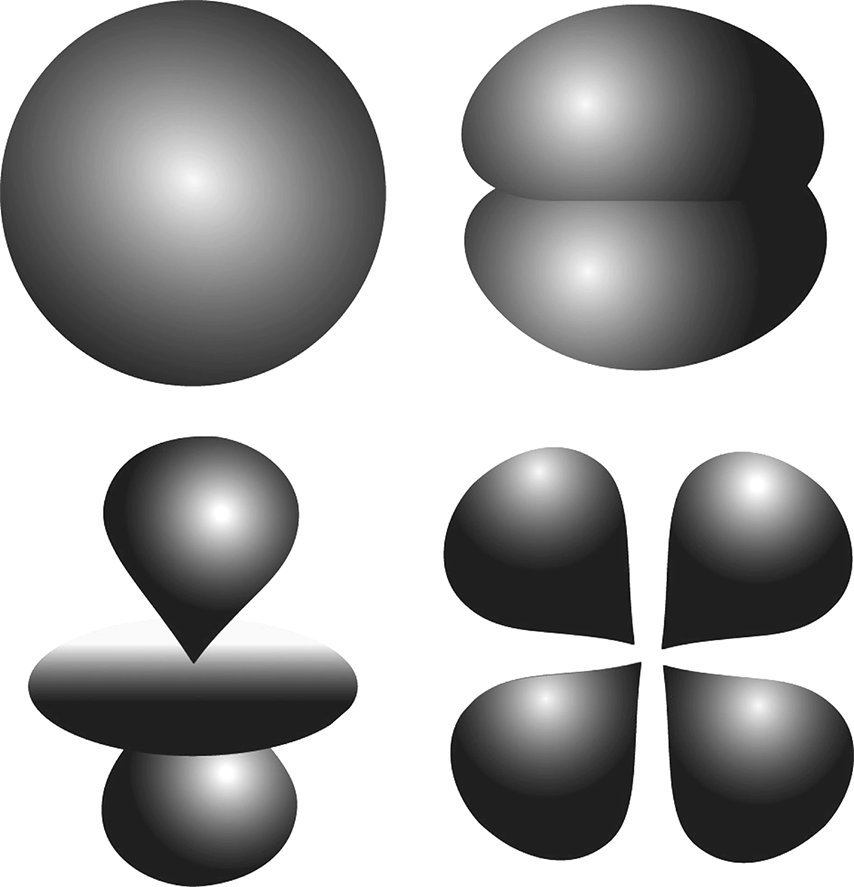
Рис. 23.6 – Геометрия атомных орбиталей
Мы представили разные возможные формы электрона атома (ядро в центре). Некоторые электроны являются сферическими облаками, другие вытянуты в различных направлениях, у третьих более сложная форма.
В качестве замечания, волна на рис. 23.5 соответствовала бы сферической геометрии слева вверху.
На этом рисунке центром всех волн является ядро. Поверхность представляет границу, за которой шанс обнаружить электрон становится ниже 5 %, если мы постараемся его найти. Иными словами, в девяноста пяти случаях из ста мы найдем электрон внутри поверхности. Мы видим, что некоторые волны имеют форму сферы: можно обнаружить электрон вокруг ядра, невзирая на предпочтительное направление. Другие волны имеют более странную форму, вытянутую в разных направлениях.
Вид атомов и молекул
Геометрия атома
Мы видели, что электроны образуют в атоме «облака». Если электронов много, каждый будет иметь разную форму волны. Все эти электроны – отдельные облака, которые накладываются друг на друга в атоме: нужно представить различные волны с рис. 23.6, которые проникают друг в друга внутри атома. Это дает достаточно верное представление о внешнем виде материи этого масштаба…
Размер образованного облака отождествляется с размером атома: порядка десятой доли нанометра. Атом есть не что иное, как это облако, к которому добавляется совершенно микроскопическое центральное ядро (где-то в 100 000 раз меньше электронного облака).
Размер ядра
Более точное описание ядра будет дано позднее, когда мы перейдем к ядерной физике, но мы уже сейчас можем понять разницу в размерах между ядром и электронами, которые его окружают. На самом деле не только электроны являются волной: волновая природа присуща всем частицам материи, в том числе протонам и нейтронам.
Выражение λ=h/mν дает нам представление о длине волны протона и нейтрона: они примерно в 2000 раз тяжелее электрона, что означает, что длина их волны в 2000 раз короче (при той же скорости).
Волна электронов распределяется по всему атому (десятая часть нанометра); волна ядра, которая является совокупностью всех нейтронов и протонов, распределяется в гораздо меньшем объеме, сосредоточенном в центре атома. Разница в размере связана прежде всего с разницей в массе.
Внешний вид молекулы
Завершим это «открытие» микроскопических частиц, поговорив о внешнем виде молекул. Молекула состоит из нескольких атомов, «склеенных» друг с другом электростатической силой. Таким образом, электроны разных атомов оказываются рядом со множеством ядер, а не с одним-единственным. То есть они заперты в электростатическом поле, весьма отличном от поля одного атома. Это значит, что электрон, как волна, может принимать очень разные формы, которые мы обозначили для одного атома. «Облако», которое образует электрон, может даже распространяться на всю молекулу, не сосредотачиваясь на одном ядре.
В качестве примера возьмем молекулу воды H2O: электроны атома кислорода не остаются запертыми вокруг ядра кислорода, они распределены по всей молекуле. Зато электрон атома кислорода имеет бóльшую «плотность вероятности» возле ядра кислорода, чем возле ядра водорода: если мы попытаемся его обнаружить, у нас больше шансов найти его рядом с кислородом.
В итоге такая молекула, как H2O, вовсе не является совокупностью трех «смежных шариков» (О, Н, Н), склеенных друг с другом. Это единая волна, состоящая из наложения друг на друга всех электронов молекулы, внутри которой находятся разные ядра, расположенные в определенных местах.
Такое положение вещей очень важно, чтобы понять химические реакции, которые происходят при взаимодействии между электронами. Мы подробно поговорим об этом в следующей главе.

