10. Газ, жидкости и твердые тела
Овладев принципами давления и температуры, мы готовы понять, почему существует так много состояний материи (твердое тело, жидкость и газ) и разные способы перехода одного в другое. Мы объясним, почему теплый воздух поднимается вверх и почему, расширяясь, газ охлаждается, что поможет понять понижение температуры на высоте и принцип работы холодильника. Мы расскажем о феномене поверхностного натяжения и его последствиях: формирование капель, способность ходить по воде. Наконец, мы представим некоторые свойства текущей жидкости, что позволит понять, как летит самолет или как придать мячу сложную траекторию.
1. Формирование жидкостей и твердых тел
Три состояния материи
Мы уже вкратце упоминали о различиях, которые существуют между твердыми телами, жидкостями и газами на микроскопическом уровне. В двух словах: молекулы удалены друг от друга в газах, касаются друг друга в жидкостях и «скреплены» друг с другом в твердых телах (и могут лишь вибрировать, оставаясь на одном месте).
Это объясняет, почему твердые тела жесткие, а жидкости и газы нет. Это также объясняет, почему твердые тела и жидкости тяжелее воздуха: в них молекулы ближе друг к другу, следовательно, в заданном объеме в них содержится гораздо больше молекул.
Разница в весе у жидкостей и твердых тел не столь очевидна, поскольку в обеих субстанциях молекулы слеплены друг с другом: так, некоторые предметы плавают (как древесина), а некоторые тонут (большинство металлов).
Мы можем так кратко описать три состояния материи:
• твердые тела жесткие и плотные;
• жидкости не жесткие и плотные;
• газы не жесткие и не плотные.
И все же остается важный вопрос: почему молекулы соединены друг с другом в твердых телах и жидкостях, а в газах нет? Почему, когда мы нагреваем воду, она переходит от твердого состояния (лед) сначала в жидкое, а потом в газообразное (пар)? Почему эти изменения происходят при определенной температуре (от 0 до 100 °C для воды при атмосферном давлении)?
Чтобы это понять, необходимо изучить взаимодействие молекул на микроскопическом уровне. Для этого мы рассмотрим два типа молекул, которые ведут себя совершенно по-разному: полярные и неполярные молекулы.
Связь между молекулами
Полярные молекулы
Некоторые молекулы состоят из нескольких различных атомов, например молекула воды H2О (два атома водорода, прикрепленные к атому кислорода). Как мы видели, каждый атом состоит из ядра, окруженного электронами. В одной молекуле эти электроны оказываются в контакте с соседними атомами.
Однако случается, что некоторые атомы имеют свойство притягивать электроны соседних атомов. Например, в молекуле H2О кислород имеет тенденцию притягивать к себе электроны атомов водорода. Такое поведение невозможно понять, не познакомившись со свойствами квантовой физики (учитывая микроскопические масштабы).
Поскольку электроны имеют отрицательный заряд и группируются ближе к кислороду, это значит, что кислород молекулы воды имеет отрицательный заряд. Водород же, напротив, заряжен положительно.
В то же время отметим, что два атома водорода в молекуле воды не находятся с противоположных сторон атома кислорода, а образуют между собой угол (➙ рис. 10.1).
Поставим теперь две молекулы воды (темную и светлую, как показано на рис. 10.1) друг против друга. Кислород светлой молекулы притягивает атомы водорода темной и отталкивает кислород темной. Электростатическая сила заставит молекулы повернуться таким образом, чтобы атомы водорода темной молекулы были повернуты к атому кислорода светлой.
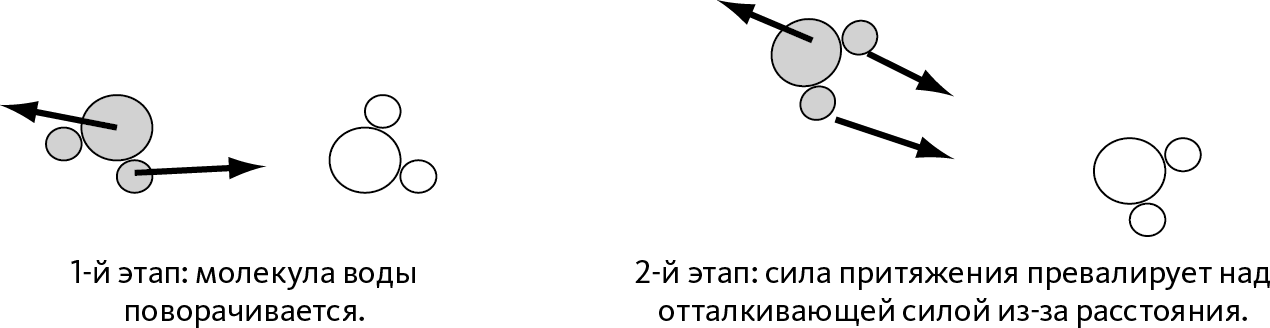
Рис. 10.1 – Взаимодействие между двумя молекулами воды
Молекулы воды представлены в виде одного большого шарика, символизирующего атом кислорода, и двух маленьких – атомы водорода.
Поскольку обе молекулы нейтральны, можно подумать, что на этом все и закончится. Но на рис. 10.1 справа мы видим, что расстояние между светлым кислородом и темными атомами водорода меньше, чем расстояние между двумя молекулами кислорода. Из-за расстояния сила притяжения между водородом и кислородом превалирует над отталкивающей силой молекул кислорода. Таким образом, в целом между молекулами воды существует сила притяжения, которая объясняет их стремление присоединиться друг к другу: именно в этом причина существования твердого и жидкого состояния материи.
Молекулы, имеющие положительный и отрицательный заряд одновременно, называются полярными. Все другие называются неполярными.
Неполярные молекулы
Некоторые молекулы не имеют свойств полярных молекул. Так бывает, когда все атомы одной молекулы одинаковые. В качестве примера мы можем взять двухатомную молекулу азота N2 и молекулу двухатомного кислорода О2, которые являются основными составляющими воздуха. Поскольку оба атома каждой молекулы идентичны, нет причин, чтобы один из этих атомов притягивал больше электронов, чем другой. Так, атомы этих молекул не несут никакого заряда.
Это объясняет, почему О2 и N2 при средней температуре и давлении газы, а H2О жидкость: молекулы H2О притягиваются друг к другу и соединяются (жидкость), в то время как О2 и N2, чьи атомы лишены заряда, летят своей дорогой и не взаимодействуют, если не считать столкновений (идеальный газ).
Однако двухатомный кислород О2 и двухатомный азот N2 также могут превратиться в жидкость, если до определенного уровня понизить температуру и повысить давление. Это значит, что эти молекулы тоже могут крепко притягиваться друг к другу. То есть между ними также существует сила притяжения, даже если она и слишком слаба.
Причина в том, что электроны в атомах постоянно вибрируют. Возьмем пример двухатомного кислорода О2: в определенный момент из-за колебания электроны могут оказаться скорее со стороны одного из атомов кислорода, чем с какой-нибудь другой. Этот кислород несет отрицательный заряд, а другой несет положительный: перед нами снова полярная молекула. Таким образом, две молекулы О2 также смогут притянуть друг друга (➙ рис. 10.2).
Важное различие с полярной молекулой в том, что через мгновение отрицательный заряд может перейти к другому атому кислорода (из-за колебания электронов), то есть, чтобы снова притягиваться другими молекулами, молекула должна сменить заряд (➙ рис. 10.2).
Таким образом, в среднем между молекулами О2 существует притяжение, однако оно всегда сомнительно из-за колебания электронов, то есть оно определенно слабее, чем у полярных молекул.
Это объясняет, что гораздо труднее привести в жидкое состояние воздух (О2, N2), чем воду.
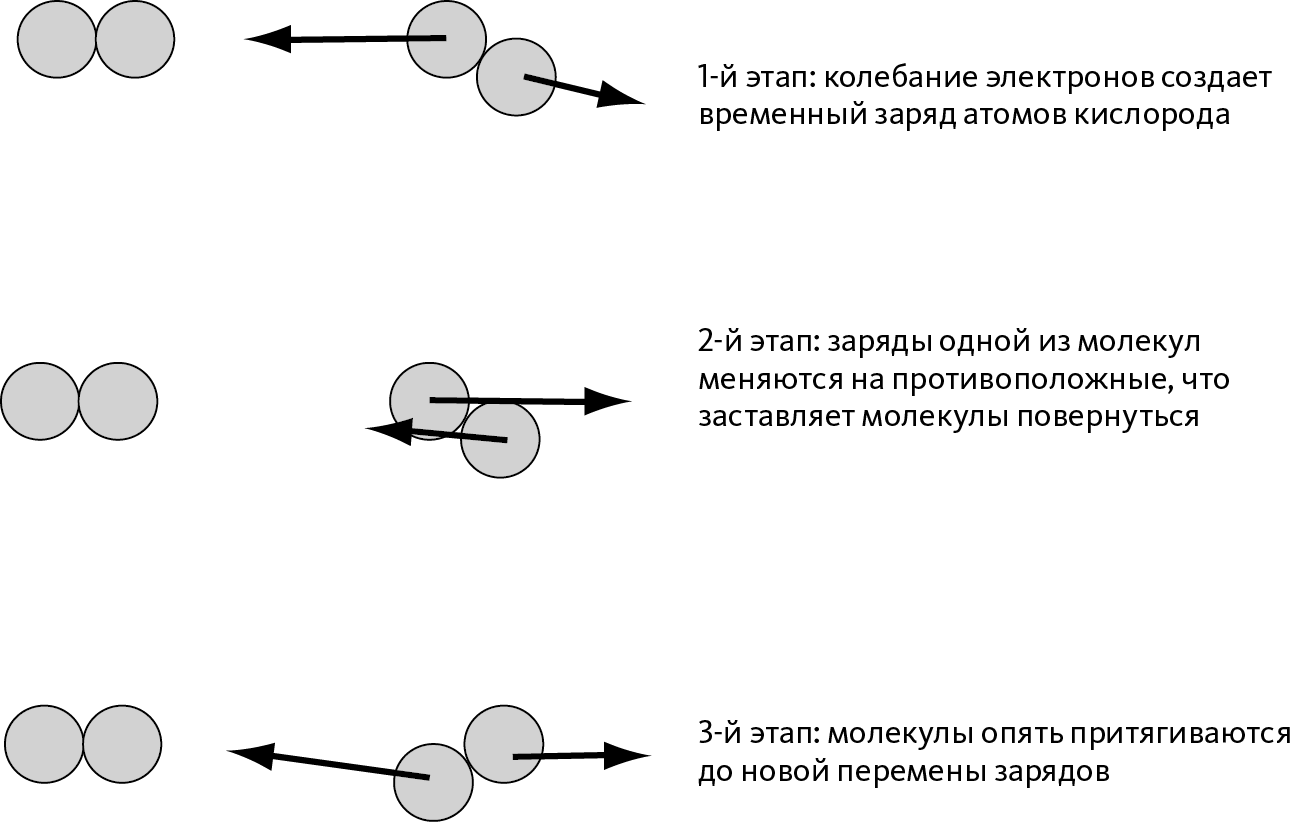
Рис. 10.2 – Взаимодействие между двумя молекулами двухатомного кислорода
МЕТАЛЛЫ
Металлы представляют собой чрезвычайно устойчивые структуры: большинство из них может перейти в жидкое состояние только при очень высокой температуре. То есть связь между их атомами должна быть очень сильной, гораздо сильнее, чем между молекулами, о которых мы говорили в этом параграфе (металлы отнюдь не плавятся при 0 °C, как это происходит со льдом).
Чтобы объяснить эту связь, нам понадобятся понятия из квантовой физики, а значит, мы остановимся на этом более детально в главе 25. А пока мы объясним, почему атомы могут соединяться в молекулах, как в воде (H2О) или в воздухе (О2, N2) В действительности механизмы, объясняющие связь в металлах и в молекулах, очень похожи.
Микроскопические аспекты газа
В конечном счете, даже не будучи заряженными, все молекулы притягиваются друг к другу под действием электростатической силы. У этого притяжения, однако, есть пределы:
• Когда две молекулы вступают в контакт, это значит, что электроны этих молекул почти касаются друг друга. Между тем электроны отталкиваются друг от друга (как отрицательно заряженные), то есть на молекулярном уровне сила притяжения превращается в мощную отталкивающую силу, что не дает двум молекулам «смешаться».
• Напротив, когда две молекулы удаляются, сила притяжения быстро ослабевает, ибо она действует на очень малом расстоянии (поскольку в целом молекулы являются нейтральными, они не осуществляют никакой силы на большом расстоянии). Таким образом, мы можем уточнить траекторию молекул в газе:
• Когда давление газа невелико, это значит, что молекулы значительно удалены друг от друга (слабая концентрация, ➙ рис. 10.3.а). В этом случае движение их очень просто: их траектория долго остается равномерной и прямолинейной до того, как они наконец приблизятся к другой молекуле. Тогда молекулы вступают во взаимодействие (притягиваются или отталкиваются, если есть «контакт»), но это происходит на чрезвычайно коротком расстоянии относительно дистанции между молекулами. Это краткое локальное взаимодействие выглядит как простой «удар», который резко меняет траекторию молекул. И они вновь следуют по равномерной прямолинейной траектории. Такой газ называют идеальным.
• Когда давление газа повышено, молекулы расположены близко друг к другу (высокая концентрация, ➙ рис. 10.3.b). В этом случае молекулы находятся в постоянном взаимодействии из-за сил притяжения, и их траектории уже далеко не равномерны и не прямолинейны.
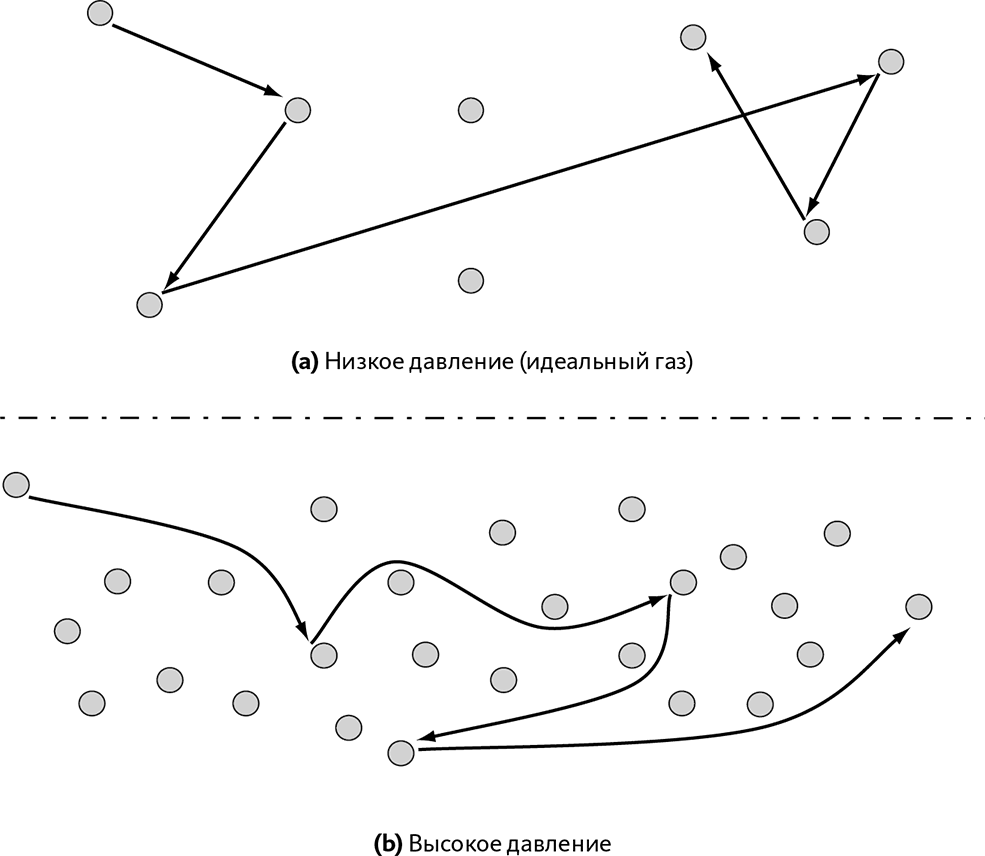
Рис. 10.3 – Движение молекул газа в зависимости от давления


