7
Голодный нейрон

«Я начал стажировку в 1987 году, – вспоминает исследователь проблемы ожирения Майк Шварц годы работы в Вашингтонском университете. – И сразу же заразился идеей о том, что существует система контроля адипозности». Шварц стал частью команды, которая вела необычный исследовательский проект под руководством специалистов в области ожирения и диабета Дэна Порте и Стива Вудса. «Я работал над проектом, который выделялся на фоне общепринятых концепций об ожирении того времени», – рассказывает Шварц. – Считалось, что ожирением страдают люди, которые много едят. Если они смогут себя контролировать и меньше есть, то избавятся от своей проблемы».
В то время только некоторые ученые признавали возможность естественного контроля адипозности, большинство не находили эту идею состоятельной. Когда Шварц начал свою исследовательскую деятельность, Лайбел и Фридман еще не открыли лептин, и в целом про липостат было известно очень мало. Шварц поставил цель доказать, что адипозность находится под биологическим контролем, и подвергнуть систему контроля терапевтическому воздействию. Шварц мог достичь намеченных целей, только изучив работу мозга и его систем. Исследование этого и многих других ученых пролили свет на принцип работы мозга по регулированию полноты тела. Они выяснили, каким изменениям подвергается липостатическая система в мозге человека, страдающего от ожирения, и почему некоторые люди склонны к перееданию и накапливанию лишнего жира.
За три года до начала стажировки Шварца исследователь Сатья Карла обнаружила, что инъекция белка под названием нейропептид Y (NPY) в мозг крысы вызывает приступ переедания. Кроме того, ученые выяснили, что NPY производят нейроны дугообразного ядра, которое находится в гипоталамусе рядом с вентромедиальным ядром гипоталамуса, или центром сытости. Концентрация нейропептида Y возрастает после голодания, поэтому ученые предположили, что NPY отвечает за чувство голода (рис. 34). Эти сведения позволили Шварцу, Порте и Вудсу выдвинуть теорию о существовании в мозге некоего аппарата, который контролирует объем потребляемой пищи и состояние адипозности.
Рис. 34. Дугообразное ядро гипоталамуса.
В то время в центре внимания Шварца был гормон инсулин, который играет важную роль в регуляции сахара и жира в крови. Уровень инсулина в крови повышается, когда человек переедает и набирает лишний вес, и снижается, если человек недоедает и худеет. По этой причине Шварц стал рассматривать инсулин как сигнал, идущий в мозг, с целью запустить механизм регуляции адипозной ткани. Совместно с коллегами Шварц сумел доказать, что инъекция инсулина в мозг крысы уменьшает темп производства NPY в гипоталамусе и снижает аппетит. Тогда впервые ученым удалось нарисовать биологическую карту, ведущую от потребления пищи к гормону крови, затем – к мозгу и снова к потреблению пищи.
Однако, по словам Шварца: «Мы знали, что дело не только в инсулине». Он и его коллеги хорошо были знакомы с результатами работы Коулмэна, который проводил опыты с парабиозом мышей с геном Жирдяя. Они понимали, что инсулином нельзя объяснить выводы Коулмэна. За этим стояло нечто большее.
Когда Фридман опубликовал статью о гене ob, Шварц, Порте и Вудс сразу же поняли, что лептин как раз и является тем недостающим звеном, которое они пытались отыскать. «Нам казалось логичным подозревать, что лептин, как и инсулин, функционирует схожим образом, то есть угнетает деятельность нейронов, стимулирующих голод», – вспоминает Шварц. После четырех месяцев изнурительной работы и спустя тысячи использованных микроскопических слайд-планшетов подозрения ученых оправдались. Лептин снижает концентрацию «голодного» NPY. Таким образом, можно утверждать, что лептин контролирует объемы потребляемой пищи (отчасти) посредством снижения уровня концентрации NPY в головном мозге. Это открытие стало первым шагом на пути истинному пониманию работы липостата.
Шварц отправил работу своей исследовательской группы в журнал Science – самое влиятельное периодическое издание в мире науки. «Я тогда только получил звание профессора и приступил к серьезной исследовательской деятельности, – вспоминает Шварц. – Меня еще никто не знал, так что мне выпала хорошая возможность себя проявить». Через месяц после отправки работы в журнал он получил письмо от редактора Science, текст которого навсегда запечатался в памяти Шварца. «До нашего сведения дошло, что статья была принята для публикации в другом месте, что в значительной степени ставит под угрозу новизну вашего открытия».
Группа конкурентов под руководством Марка Хеймана из фармацевтической компании EliLilly присвоила себе его открытие. Шварцу пришлось опубликовать новую версию статьи в журнале Diabetes, что тоже было неплохо, но, конечно, не настолько престижно, как в Science. Неудача возмутила ученых. «Мы знали, что впереди нас ждет еще много состязаний и почти из всех мы вышли победителями, так как на карту было поставлено все».
Следом обрушилась настоящая информационная лавина. Шварц, Порте, Вудс, молодой ученый Рэнди Сили из лаборатории Вудса и несколько других конкурирующих между собой ученых начали публиковать данные своих исследований. Вскоре после исследования NPY Шварц опубликовал работу, где доказал, что гипоталамус, а конкретно дугообразное ядро, содержит высокую концентрацию лептиновых рецепторов. Кроме того, росло количество свидетельств о новой группе белков под названием меланокортины, которые выполняют функцию, обратную воздействию нейропептидов Y, или NPY. Инъекции меланокортинов в мозг грызунов способствовали снижению объемов потребляемой пищи. Так же как и NPY, меланокортины содержатся в определенных нейронах в одном из участков дугообразного ядра. Нейроны получили название проопимеланокортин-нейрон (ПОМК-нейрон), или кортикотропинподобный иммунный пептид. Ученые из группы Шварца обнаружили, что уровень меланокортина регулируется лептином, который также регулирует уровень NPY, но только противоположным образом. С помощью меланокортина и NPY, содержащихся в мозге, лептин на клеточном уровне обеспечивает контроль над потреблением пищи и состоянием адипозности.
Результаты этих исследований позволили сделать весьма очевидный вывод о работе лептина и его месте в липостатической системе: он выключает работу нейронов, вызывающих чувство голода, и включает нейроны, которые его подавляют. Когда уровень лептина снижается, «голодные» нейроны начинают активно работать, а «сытые» прекращают свою деятельность. В результате возникает сильная тяга к пище. Эта двухтактная система возникла очень давно и обладает огромной силой. Только действительно серьезные повреждения основных узлов системы могут нарушить порядок ее работы.
Повреждение основных узлов системы – именно это сделали Гетерингтон и Рансон, когда физически повредили центр сытости в вентромедиальном ядре гипоталамуса. Об их опытах с крысами вы прочли в предыдущей главе. В ядре гипоталамуса располагаются нейроны, которые стимулируют работу ПОМК-нейронов. Когда исследователи их уничтожили, то ПОМК-нейроны стали работать менее активно и не могли подавить растущий аппетит крыс. Как показали эксперименты Гетерингтона и Рансона, эти нарушения в работе нейронов заставили крыс страшно переедать и полнеть до невероятных размеров.
Но для достижения такого эффекта не обязательно причинять механические повреждения мозгу. Можно еще полностью удалить из организма лептин и, как мы с вами убедились на примерах, результаты будут точно такими же.
Идеи Шварца о функции лептина выдержали проверку временем. Нейроны NPY и ПОМК до сих пор остаются главными героями истории переедания. Однако сегодня мы располагаем более точной информацией о работе всей системы. Например, нейроны NPY в дугообразном ядре секретируют не только NPY. Они производят как минимум еще две другие субстанции, которые стимулируют желание поесть. Все стимулирующие аппетит субстанции находятся в синергетической связи и совокупно воздействуют на нижестоящие участки мозга. Ученые определили, что нейроны NPY являются колыбелью пищевого инстинкта. Если в мозге и существует «голодный нейрон», то это, без сомнения, нейрон NPY.
Нейробиолог Скотт Стернсон, научный сотрудник Национального института здоровья Джанелия, знает об этом не понаслышке. Команда ученых под его руководством впервые провели эксперимент по стимуляции нейронов NPY у бодрствующих здоровых мышей. Когда исследователи оказывали воздействие на нейрон NPY, мыши принимались есть, и много. Я повторял этот эксперимент в своей лаборатории и результат меня действительно изумил. Достаточно всего один раз повернуть выключатель – и животное, не помня себя, уже набивает рот всем подряд. Оно могло съесть в десять раз больше, чем обычно.
Кроме того, ученым удалось выяснить, как именно нейрон NPY заставляет мышь искать и потреблять пищу – животное испытывает неприятные ощущения до тех пор, пока не начинает есть. Мышам так же, как и людям, неприятно терпеть чувство голода. Болезненные ощущения пропадают, когда в рот попадает еда или, в случае Стренсона, когда прекращается стимуляция нейронов NPY. Таким образом, отсутствие неприятного чувства само по себе становится вознаграждением. Если мы дополним этой информацией те знания, которые получили в третьей главе, то обнаружим, что акт принятия пищи характеризуется двумя особенностями, которые взаимно подкрепляют друг друга: голодный нейрон успокаивается, и нейроны пищевого вознаграждения приходят в действие.
Исследователь из Вашингтонского университета Ричард Пальмитер, имя которого уже появлялось на страницах этой книги, наконец достал туз из рукава. Пальмитер может уничтожить практически любую популяцию нейронов, при этом он имеет возможность воздействовать на необходимую область с высокой точностью, чтобы не причинить вреда соседним нейронам. Когда он воспользовался своим умением, чтобы истребить нейроны NPY у мышей, страдающих ожирением, то заметил, что аппетит животных пришел в норму, они начали худеть и в конечном итоге стали выглядеть так же, как другие здоровые мыши. «Мне удалось скорректировать все главные симптомы», – сообщил Пальмитер. Можно говорить о том, что основной причиной, которая побуждала животных с генетической предрасположенностью к ожирению чрезмерно потреблять пищу, была гиперактивация нейронов NPY. Организм мышей не производил лептин, который мог бы контролировать секрецию NPY и других субстанций. Стоило ученому избавиться от NPY-нейронов, как мыши похудели даже без лептина. Отсюда можно сделать еще более общий вывод: голод, одержимость едой и другие физиологические и психологические нарушения, с которыми вынуждены бороться люди, сидящие на диете, голодающие или родившиеся без лептина, возникают на фоне работы гиперактивных NPY-нейронов. Их популяция настолько мала, что может уместиться на кончике иголки.
После этих открытий исследователи взялись за изучение систем мозга, отвечающих за регуляцию аппетита и адипозноть. Результаты их работы крайне обширны и разнообразны, сейчас я не стану рассказать о них подробно. Но в общих чертах могу сказать, что были найдены и другие гормоны и нейроны, которые оказывают свое влияние на работу этих систем головного мозга. На самом деле этой информации достаточно для того, чтобы разобраться в основах работы липостата. Представьте себе песочные часы, в узкой части которых располагаются NPY- и ПОМК-нейроны (рис. 35). В верхнюю часть песочных часов поступают сигналы, которые сообщают мозгу о текущем уровне энергии в теле. Среди них есть лептин и инсулин. NPY- и ПОМК-нейроны конвергируют разносторонние сигналы, и на основании полученных данных активность нейронов изменяется. В основании песочных часов находятся продукты NPY и ПОМК-нейронов, то есть ответные реакции, которыми пользуется мозг, чтобы управлять энергетическими запасами тела. То есть регулировать голод, пищевое вознаграждение, скорость обмена веществ и степень физической активности.
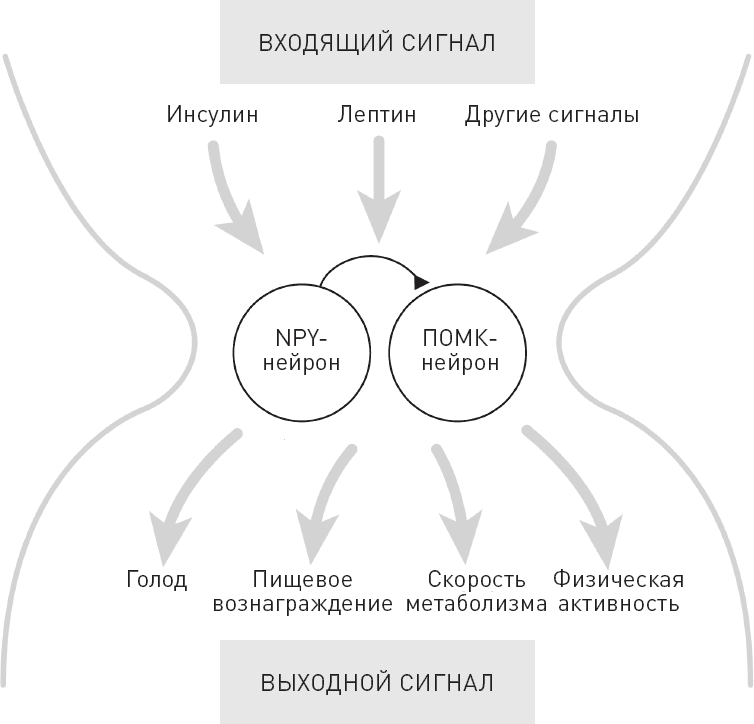
Рис. 35. Регуляция адипозности нейронами дугообразного ядра головного мозга. Вверху – входящие сигналы, которые воспринимают NPY- и ПОМК-нейроны. Внизу выходной сигнал NPY- и ПОМК-нейронов. Как показано на изображении, NPY- и ПОМК-нейроны взаимодействуют. В момент активации NPY ингибирует ПОМК, и вместе они прекращают работу механизма насыщения.
Насколько нам известно, NPY- и ПОМК-нейроны являются самыми важными точками конвергенции, где входящие сигналы регуляции адипозности превращаются в выходные сигналы мозга. Поэтому они привлекли к себе повышенное внимание целого сообщества исследователей. Многие ученые, среди которых Стернсон, Пальмитер и Брэд Лоуэлл, нейробиолог из Гарвардской медицинской школы, занимаются расшифровкой входящий и выходных сигналов NPY- и ПОМК-нейронов. Надо сказать, что они успели добиться значительного прогресса. «Возможность идентифицировать отдельные нейроны и затем отображать нейронные сети позволит поднять нашу научную отрасль на новый уровень», – считает Шварц.
В широком смысле мы уже вышли на тот новый уровень, о котором говорит Шварц. Нам удалось вылечить от ожирения бесчисленное количество грызунов. Сегодня мы имеем возможность извлечь гены любого биологического вида и преобразовать их так, как нам захочется. Затем ввести новые гены в геном мыши, чтобы они проявились в определенной популяции клеток мозга. Измененные клетки можно использовать для регуляции пищевого поведения, адипозности и многих других функций организма. Мы можем активировать, заглушить или истребить популяцию нейронов в мозге мыши, очень точно воздействуя на определенную область. Мышь буквально превращается в марионетку ученых. Они могут контролировать объем потребляемой пищи и адипозность животного. Современная нейробиология оперирует такими понятиями, которые несколько десятилетий назад казались чистой научной фантастикой.
Исходя из результатов исследований Мора, Лайбела, Фридмана, О’Райли, Фаруки и других ученых мы знаем, что нейронные сети, которые контролируют пищевое поведение и адипозность у человека, схожи с теми, которые выполняют эти функции в мозге грызунов. Со временем, я уверен, мы сможем адаптировать все вышеописанные процессы для человеческого мозга. Так что же удерживает нас от лечения ожирения? Только одно: этика. Сегодня технически возможно модифицировать организм человека на генетическом уровне и, возможно, даже напрямую воздействовать на нейронные сети, которые контролируют пищевое поведение, но эти манипуляции невыполнимы с точки зрения этики. И на это есть и более веские причины, например недостаточно изученные последствия и безопасность подобных процедур.
Но наше общество считает этически приемлемым использование лекарственных средств, которые воздействуют на области мозга, отвечающие за пищевые инстинкты. Ученые создали множество медицинских препаратов для похудения, которые вмешиваются в работу мозга. К сожалению, лекарства – это очень ненадежный метод. Они едва ли могут оказывать должное влияние на работу такого сложного органа, как мозг. Когда мы выпиваем таблетку или делаем инъекцию, то мозг полностью погружается в активные компоненты лекарственного средства: все 86 миллиардов нейронов, триллионы связей между ними и бесчисленное множество операций, которые они контролируют, попадают под действие лекарства. Также следует принять во внимание, что химические сигналы, которые контролируют пищевое поведение и адипозность, используются в других отделах мозга и тела для выполнения иных задач. В этой связи очень сложно воздействовать на определенную нейронную сеть и не нанести сопутствующий ущерб другим частям организма. Представьте, что вы забиваете в стену гвоздь кувалдой. Гвоздь забить получится, но в стене останутся огромные вмятины. Таким же образом действие большинства лекарств для похудения сопровождается неприемлемыми побочными эффектами, как, например, опасные психологические нарушения, которые вызывает препарат римонабант (так называемая «реверсивная» марихуана). На сегодняшний день существует очень мало лекарств, которые обладают приемлемыми побочными эффектами. Но и они не настолько хорошо решают проблему ожирения, как нам того бы хотелось. Но поиски продолжаются и есть надежда на счастливый прорыв. Очень вероятно, что новые знания однажды помогут нам создать хороший препарат.
Шварц считает, что современные научные открытия помогли ему добиться одной из своих целей: повышение уровня осведомленности общественности о функциях энергетического гомеостаза. Некоторые ученые и даже врачи до сих пор сомневаются, что аппетит и полноту тела контролируют бессознательные системы мозга. Шварц надеется, что благодаря дальнейшему изучению липостата он сможет достичь второй своей цели, а именно вылечить ожирение у людей и предотвратить его появление в дальнейшем. Мне кажется, что его цель уже близка. Но, по словам Шварца, он «думал, что этот момент уже наступил, когда ученые обнаружили NPY».
Мы знаем многое о работе липостата при нормальных условиях, но не можем сказать, какие изменения происходят в мозгу человека, страдающего ожирением, когда его организм начинает защищать высокий уровень адипозности. Также неизвестно, каким образом можно запустить обратный процесс и вернуть организму нормальное состояние. Чтобы сдвинуться с места, наша научная отрасль нуждается в ином походе.

