Глава 12
Последние сомнения разрешены
Атом как физическая реальность
К середине XIX века открытие первого начала и связанные с ним исследования нанесли окончательный удар по теплородной теории и ввели понятие энергии. Хотя не все были убеждены, но популярная теория, что тепло возникает вследствие движения элементарных частиц вещества, привлекла еще больше внимания к атомам.
В XIX веке ученые-новаторы, такие как Клаузиус, Максвелл и Больцман, строили свои теории, основываясь на предположительно существующих атомах. Позже, в 1905 году, молодой Альберт Эйнштейн написал труд (работая в патентном бюро) о хорошо известном физическом явлении того времени – броуновском движении, которое впервые было упомянуто в 1827 году.
Теория Эйнштейна правильно описала броуновское движение и основывалась на существовании атомов, которые пребывали в постоянном движении. Кроме того, теория Эйнштейна позволила получить первые экспериментальные доказательства существования атомов. Опыты, проведенные вскоре после этого, наконец подтвердили прогнозы, сделанные в новой теории Эйнштейна. Атом как физическое явление природы (а не просто удобный инструмент наглядного представления) теперь навсегда закрепился в современной химии и физике.
Смешивая объемы
В 1808 году Жозеф Гей-Люссак (1778–1850) повторял известный эксперимент по получению водяного пара из газов – водорода и кислорода. Ему удалось сделать это путем смешивания определенных объемов каждого из газов и воспламенения смеси при помощи электрической искры. Он заметил, что объемы кислорода и водорода, участвующие в реакции (объединяющиеся объемы), относятся друг к другу как небольшие целые числа. На самом деле, при тщательном исследовании не только собственной работы, но и других работ, он пришел к заключению, что объемы газов, участвующих в химической реакции, всегда относятся друг к другу как простые целые числа:
«Кажется, что газы при взаимодействии всегда объединяются в простых отношениях; и мы в действительности наблюдали во всех предыдущих примерах, что это такие отношения, как 1: 1, 1: 2, 1: 3».
Кроме того, Гей-Люссак заметил, что если конечным продуктом реакции также был газ, то его объем и объемы газов, участвующих в реакции, также относились как целые числа. Например, он обнаружил, что при смешивании объемов водорода и кислорода для получения водяного пара происходит следующее:
2 объема водорода (газ) + 1 объема кислорода (газ) → 2 объема водяного пара.
Закон объемных отношений Гей-Люссака похож на другой известный закон. Дальтон точно так же рассуждал не об объемах, но об атомах, вовлеченных в химические реакции: атомы при химической реакции с образованием молекул объединяются в простых отношениях целых чисел. Таким образом, можно предположить, что Дальтон был счастлив услышать об этих результатах, возможно даже считал их полезными для переосмысления противоречий его собственной атомной теории. Но это было очень далеко от истины.
Дальтон справедливо предположил, что у разных атомов разные размеры. Он также полагал, что атомы газа расположены очень плотно, что они прямо соприкасаются друг с другом. За счет малого расстояния между ними атомы остаются неподвижными. Поэтому, согласно модели Дальтона, если вы хотите заполнить воздушный шар каким-либо газом, для этого понадобится больше маленьких атомов, чем больших.
По аналогии вообразите обычную коробку (в этом примере она выступает вместо шара), в которую мы хотим поместить шары (атомы), заполнив ее целиком. Теперь представим, что мы используем мячи для гольфа, укладывая их в коробку максимально плотно. Отметив, сколько мячей для гольфа потребовалось, чтобы заполнить коробку, мы освобождаем ее и начинаем снова. Однако на этот раз вместо мячей для гольфа мы используем баскетбольные мячи. Как и с мячами для гольфа, мы укладываем их максимально плотно. Как и ожидалось, чтобы полностью заполнить ту же самую коробку, требуется меньше баскетбольных мячей, чем мячей для гольфа.
Что беспокоило Дальтона в результатах Гей-Люссака: казалось, что они гласили, будто независимо от типа атома (элемента) или его размера всегда нужно одно и то же количество атомов, чтобы заполнить один и тот же объем – то есть коробку полностью заполнит одинаковое количество мячей для гольфа или баскетбола. Что еще хуже, Дальтон думал: что если результаты Гей-Люссака означают, будто все атомы имеют одинаковый размер?
Дальтон отказывался верить результатам исследований Гей-Люссака и находил утешение в собственных экспериментах, которые показывали ошибки в результатах Гей-Люссака. Однако реальность была такова, что именно результаты исследований Дальтона были неверными, поскольку опыты были довольно трудными, а Дальтон был посредственным экспериментатором. Однако новая теория, казалось, давала некое новое понимание.
Число Авогадро
В 1811 году Амедео Авогадро (1776–1856) (урожденный Лоренцо Романо Амедео Карло Авогадро ди Куаренья э ди Черрето), посмотрев на результаты исследований Гей-Люссака, пришел к заключению, что при равных температуре и давлении равные объемы газа (например, два воздушных шара одинакового размера) содержат одинаковое количество «частиц». Эти частицы могут быть отдельными атомами, молекулами или даже составлять их смесь.
Таким образом, если два воздушных шара имеют одинаковый размер, один из которых заполнен гелием, а другой простым воздухом (смесью кислорода, углекислого газа, азота и водяного пара), то количество частиц в каждом из них будет одинаковым при том условии, что их температура и давление (комнатная температура и атмосферное давление) одинаковы. Авогадро не был первым, кто предложил эту теорию, но он первым сформулировал ее как полноценную научную концепцию. Из закона Авогадро следуют некоторые очень интересные выводы.
Если при постоянных температуре и давлении в определенном объеме содержится одинаковое количество частиц, то теории Дальтона и Авогадро противоречат друг другу. В чем же проблема? Вспомните: Дальтон считал, что у атомы разных типов отличаются размерами. Это было разумным предположением, и сегодня мы знаем, что оно было верным. Однако Дальтон также предположил, что атомы газа расположены очень близко друг к другу, из-за чего он не верил в действие на расстоянии. Поэтому для Дальтона воздушный шар, заполненный газом, внутри был плотно заполнен атомами. Проблема была именно в этом. Давайте вернемся к нашей аналогии.
Ранее мы укладывали шары (или мячи для гольфа, или баскетбольные мячи) в коробку до тех пор, пока она не заполнялась целиком. На этот раз давайте откажемся от этого требования, но вместо одной коробки мы представим две одинаковых. В одну мы поместим баскетбольный мяч, а в другую – мяч для гольфа. Мы продолжим класть мячи в коробки до тех пор, пока одна из них не заполнится. Коробка с баскетбольными мячами заполнится первой (так как они больше, чем мячи для гольфа, а коробки имеют один и тот же размер), поэтому мы остановим эксперимент, как и обещали.
Таким образом мы закончим с двумя коробками равного размера (объема), которые содержат одинаковое количество «частиц». Конечно, атомы действительно ведут себя иначе, чем баскетбольные мячи или мячи для гольфа, но в этом случае (будьте уверены) наша аналогия по форме абсолютно верна. Таким образом, если мы сможем сосчитать количество малых и больших частиц в двух разных шарах, то обнаружим, что шары одинаковы по размеру и количество больших внутри одного равно количеству малых частиц внутри другого, а также что внутри довольно много оставшегося свободного пространства.
Как вы видите, частицы (атомы, молекулы или их смесь) газа расположены не так уж плотно по отношению друг к другу. Скорее они находятся в движении, перемещаясь в окружающем их вакууме. Действительно, модель атомов в свободном пространстве уже знакома нам из древнегреческих атомных теорий Демокрита и Эпикура. Закон Авогадро о равных количествах частиц для равных объемов при постоянной температуре и давлении значительно продвинул понимание природы газов. Авогадро никогда не доказывал свою теорию, он также не мог определить фактическое количество частиц при определенной температуре или давлении. Однако закон Авогадро следует из кинетической теории газов.
Основываясь на кинетической теории газов, можно рассчитать среднюю полную поступательную кинетическую энергию (Eк) идеального газа при температуре T и количестве частиц N при помощи уравнения
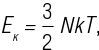
где k – просто константа, известная как постоянная Больцмана. Поступательная кинетическая энергия – кинетическая энергия, связанная с движением по осям x, y или z (направления измерения длины, ширины и высоты). Этот результат, который можно прямо получить при помощи распределения Максвелла (как обсуждалось в части 2), показывает, что Eк не зависит от массы частиц или их типа, но зависит только от температуры. Это означает, что при равной температуре, если два объема различных газов содержат то же количество частиц, у обоих объемов значение Eк будет одинаковым.
Другой вывод из кинетической теории газов состоит в том, что давление P идеального газа в объеме V можно описать при помощи уравнения
P = 2 / 3V · Eк,
или, проще,
P = NkT / V
после подстановки одной из формул, приведенных выше, в другую. Учитывайте, что два различных газа обозначены как 1 и 2. Их соответствующие выражения для давления будут:
P1 = N1kT1 / V1
и
P2 = N2kT2 / V2.
Поэтому если два разных идеальных газа имеют равные объемы, давление и температуру, то количество их частиц будет равным, так как имеется равенство P1 = P2, где объем и температура одинаковы при условии
N1kT / V = N2kT / V,
или попросту
N1 = N2.
Это и есть закон Авогадро. Однако реальные газы отличаются от идеальных газов тем, что частицы в них претерпевают воздействия притяжения и отталкивания. Как следствие, в реальных газах количество частиц равняется числу Авогадро, только когда они ведут себя «идеально», что происходит при низком давлении и/или высоких температурах.
Сегодня мы узнаем закон Авогадро по фундаментальной константе, названной числом Авогадро – это количество частиц в одном моле вещества. Один моль любого вещества – количество вещества (в граммах), которое равно его атомной массе. Например, атомный вес углерода составляет 12 граммов на моль, и поэтому 1 моль углерода равняется 12 граммам. Другой пример – вода, атомный вес которой 18 граммов на моль, и поэтому 18 граммов воды (или приблизительно одна столовая ложка) – это один моль воды. Хотя Авогадро говорил всего лишь о количестве частиц в объеме газа, числом Авогадро называется число частиц, в определенном количестве вещества (один моль), и оно применимо к газу, жидкости и твердому телу.
В 1909 году Жан Батист Перрен (1870–1942) впервые экспериментально определил число Авогадро, изучая броуновское движение (позже мы обсудим это более подробно), и получил результат 6,7 · 1023 частиц/моль. Он был первым, кто связал его со значением моля вещества и предложил назвать его в честь Авогадро. Сегодня значение определено более точно – 6,022 · 1023 частиц/моль. Идеальный газ при 32 °F и атмосферном давлении заполнил бы объем (воздушный шар), равный 22,4 литра и содержал бы ровно 6,022 · 1023 частиц.
Авогадро думал, что газ, состоящий из одного элемента (как кислород, водород, азот и т. д.), мог состоять из молекул, тогда как Дальтон настаивал, что они могли существовать только как атомы. В то время было принято считать, что атомы одного элемента отталкивают друг друга, тогда как атомы разных элементов притягивают друг друга. Идеи Авогадро явно противоречили этому.
Далее, если бы атомы одного элемента на самом деле притягивали друг друга, то было бы непонятно, что останавливало их от слияния и перехода в жидкое агрегатное состояние. Сегодня мы знаем, что атомные взаимодействия имеют разные виды и силу, что позволяет одним элементам притягивать друг друга в определенной мере.
Закон Авогадро и тот факт, что атомы одного элемента в газе могут сформировать молекулы, позволяет нам объяснить закон объединяющихся объемов Гей-Люссака. Вспомните результат исследования Гей-Люссака по образованию водяного пара из кислорода и водорода:
2 объема газа водорода + 1 объем газа кислорода → 2 объема водного пара.
Вспомните, Дальтон считал, что верное уравнение смешения отдельных атомов в общем объеме выглядит так:
1 атом водорода + 1 атом кислорода → 1 молекула водного пара.
Другими словами, Дальтон думал, что образование водяного пара происходит с помощью одного атома водорода, объединяющегося с одним атомом кислорода – вместе они формируют одну молекулу воды. Поэтому, если у нас есть объем вещества, содержащий несколько атомов кислорода и несколько атомов водорода, согласно теории Дальтона процесс будет происходить до тех пор, пока все атомы не разделятся на пары.
Давайте попытаемся совместить уравнение Дальтона и результаты исследования Гей-Люссака. Возьмем одинаковое количество атомов в равных объемах газа (при одинаковых температуре и давлении) в соответствии с законом Авогадро.
На рис. 12.1 у нас есть правильные величины объемов каждого газа, вовлеченных в химическую реакцию, как это определил Гей-Люссак, взаимодействующие по правилам уравнения Дальтона. Далее, так как мы используем закон Авогадро, количество атомов в каждом объеме должно быть одинаковым, но какое именно это количество – неважно.
По-видимому, в этой схеме есть неточность, поскольку в результате процесса у нас остаются атомы водорода. Это было бы нормально, если бы мы знали, что так и происходит, но экспериментальные свидетельства показывают, что нет. Давайте исключим из нашего процесса уравнение Дальтона – в конце концов, это были всего лишь его размышления. Вместо этого допустим, что атомы одного и того же элемента в газообразном состоянии могут объединиться, чтобы формировать молекулы, как считал Авогадро, а не существуют в виде отдельных атомов, как того требовал Дальтон.
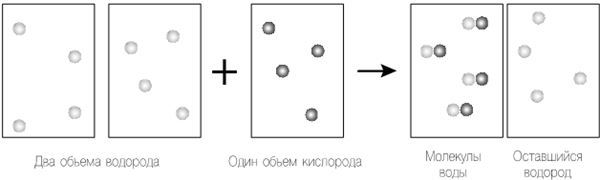
Рисунок 12.1. Следуя теории Гей-Люссака, мы берем два объема водорода, объединяющихся с одним объемом кислорода для создания одного объема водяного пара. Далее мы применяем уравнение Дальтона для объединения объемов. Поскольку объем, давление и температура объемов одинаковы, мы применяем закон Авогадро, сохраняя одинаковое число «частиц», которые в этом случае являются отдельными атомами в каждом объеме.
А именно, давайте предположим, что в водороде и кислороде два отдельных атома объединяются, чтобы сформировать двухатомные молекулы H2 и O2 соответственно, а не просто существуют как отдельные атомы H и O. Теперь вернемся к нашему эксперименту, используя только результаты Гей-Люссака для объединенных объемов и закон Авогадро (рис. 12.2).
Так как мы исключили уравнение Дальтона, мы просто возвращаемся к закону Авогадро и используем одинаковое количество частиц в каждом объеме. Единственное оставшееся у нас требование Гей-Люссака напоминает нам, что все атомы водорода и кислорода превратятся в итоге в водяной пар; другими словами, у нас не может остаться свободных атомов, как было прежде. И вот тут мы наблюдаем нечто интересное. Если мы считаем истинными теории Гей-Люссака и Авогадро, мы видим, что формулой молекулы воды является H2O – не HO, как считал Дальтон.
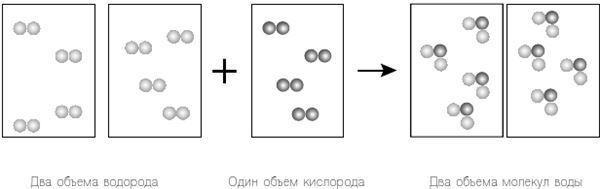
Рисунок 12.2. Еще раз рассмотрим результаты исследований Гей-Люссака вместе с законом Авогадро. Однако на этот раз мы игнорируем уравнение Дальтона и вместо этого предполагаем, что водород и кислород существуют как двухатомные молекулы, H2 и O2 соответственно. Это соответствует теории Гей-Люссака и закону Авогадро, и в результате не остается «лишних» атомов.
Однако мы в некотором смысле сжульничали; в конце концов, мы предположили, что кислород и водород существуют как двухатомные молекулы. Мы знаем, что это действительно так, но во времена Дальтона это было неизвестно. Даже с исключением допущения Дальтона и применением результатов Гей-Люссака с законом Авогадро у нас остается еще множество вариантов. Все, что мы сделали, так это обнаружили один достаточно хорошо (и, как известно сегодня, правильно) работающий принцип. Таким образом, остается вопрос: как мы согласуем все эти методы и результаты?
В то время как закон объемных отношений Гей-Люссака и закон Авогадро решают не только проблему того, как соединяются водород и кислород при образовании воды, они все же вынудили нас отклонить предположение Дальтона о том, как объединяются атомы (правило наибольшей Дальтона). Более того, изучая различные реакции, а не только одну, как это сделали мы, можно достигнуть соответствия между разными реакциями, придя к правильным химическим уравнениям. На самом деле у Авогадро было собственное простое правило. Он утверждал, что верное уравнение для данной химической реакции будет согласовываться с уравнениями других связанных химических реакций, а также результатами Гей-Люссака и его, Авогадро, законом.
Закон Авогадро был совершенно новым взглядом на атомы газа. То, что у газов при равном объеме, температуре и давлении одинаковое количество частиц, будь это атомы или молекулы, также означало, что внутри газа имеется большое количество свободного пространства и что атомы не находятся в постоянном контакте друг с другом. Далее, предполагая, что атомы газа могут объединиться, формируя молекулы, бросало вызов популярной идее, что одинаковые атомы могут только отталкивать друг друга.
В 1811 году эта идея были не слишком популярна, а Авогадро не предложил разумного доказательства. Он не вычислил и не определил экспериментально количество частиц, занимающих данный объем при постоянном давлении и температуре, чтобы показать, что оно одинаково независимо от вида частиц. По этой причине идеи Авогадро оставались забытыми в течение почти полувека.
Понятие атома и его роли в химии все еще оставалось предметом открытого спора. В целом все были согласны, что предположение, будто вещество состоит из атомов, было хорошим инструментом для химических реакций и наглядного отображения структур молекул, которые формировались. Означало ли это, что вещество по природе состоит из неделимых микроскопических частиц, которые следует называть атомами, – было совсем другим вопросом. Нехватка однозначного метода для определения относительной (и, конечно, абсолютной) массы атомов и молекул и их химических формул привела к возникновению нескольких несовместимых атомных теорий. Тем не менее атомная теория, так или иначе, внесла свой вклад в химию.
Поворотный момент наступил в 1858 году (спустя два года после смерти Авогадро), когда Станислао Канниццаро опубликовал статью, показывающую, что работа Авогадро, за незначительными исключениями из общего правила, позволяла определить относительные массы многих веществ, существующих в газообразном состоянии. Вспомните, что подход Дальтона требовал знания количества исходных материалов, используемых в химической реакции при создании интересующей молекулы, и предположения, из скольких атомов состоит молекула. Подход, предложенный Канниццаро, сокращал процесс определения относительной атомной массы до почти тривиального измерения удельного веса. К сожалению, статья Канниццаро в научном сообществе сперва привлекла внимание очень немногих. Но скоро это изменилось.
В 1860 году Канниццаро выступал на международной химической конференции, проходившей в немецком городе Карлсруэ. Его речь произвела большое впечатление на аудиторию, состоявшую главным образом из выдающихся европейских химиков. Позже друг Канниццаро Анджело Павези раздал ту самую брошюру со статьей Канниццаро посетителям. Систему Канниццаро, основанную на законе Авогадро, вскоре приняли.
Успех Канниццаро, утвердившего работу Авогадро как первостепенную в рамках атомной теории, был обязан точным вычислениям. Однако, пожалуй, самым значительным фактором послужило то, что в отличие от Авогадро, Канниццаро обеспечил (практически тривиальные) экспериментальные средства, позволяющие проверить гипотезу. Следовательно, то, что прежде было всего лишь предположением, теперь можно было легко проверить и внедрить. Более того, это произошло в самый подходящий момент.
По сравнению со своими первыми днями атомная теория изменилась. Благодаря первому началу (в формулировке 1850 года) тепло больше не рассматривали как поток частиц (известных как теплород); атомы больше не были покрыты слоем тепла (как предполагал Дальтон), а кинетическая теория благодаря трудам Клаузиуса, Максвелла и позднее Больцмана вступала в свои права.
Революционная работа Максвелла 1860 года описывает атомы газа как частицы, двигающиеся со скоростями, значения которых лежат в четко определенном диапазоне и подчиняются так называемому распределению. Таким образом, атомы газа не только не расположены в определенных местах, как представлял Дальтон, они еще и движутся с разными скоростями. С согласованной теорией относительных масс можно было разработать периодическую таблицу элементов, которая распределила бы их в группы или семьи, выявляя таким образом определенные тенденции в их свойствах. Атомная теория, которая наконец-то работала с экспериментальными данными, дала химикам средства объяснять химические реакции, а также наконец-то появилась возможность записывать химические формулы.

