1878. Аппарат Виктора Мейера
Разработка концепции атомных масс в химии начинается с работ Джона Дальтона. В конце XVIII века большинство химиков, если не считать Клода Бертолле и его последователей, приняло идею того, что «элементы» (это понятие предложил Антуан Лоран Лавуазье) входят в состав химических соединений в строго определенных соотношениях.

Сами соотношения исследователи выводили, опираясь на результаты двух классических для химии измерений – взвешивания и определения объёма. Джон Дальтон первым высказал предположение о том, что фундаментальными единицами химии являются атомы, которые отличаются друг от друга и весом, и химическими свойствами. Дальтон предложил первую таблицу атомных весов, в которой вес водорода был определён как единица. Однако, все остальные значения атомных весов в этой первой таблице в большинстве своем были ошибочны, что в скором времени и раскритиковал специалист по химическому анализу и автор известного газового закона Жозеф Гей-Люссак. Тем не менее, следует отметить, что определение соотношения вес/объём не было простым занятием. Для определения этого соотношения Гей-Люссак помещал взвешенный образец жидкости в запаянный стеклянный контейнер и ставил под заполненную ртутью трубку. Всё это сооружение нагревали на жаровне, от увеличения внутреннего давления стеклянный контейнер разбивался, высвобождая пары, объём которых измеряли по изменению высоты столба ртути. Необходимость учитывать влияние температуры на результаты измерения и привела к тому, что Гей-Люссак вывел свой газовый закон.
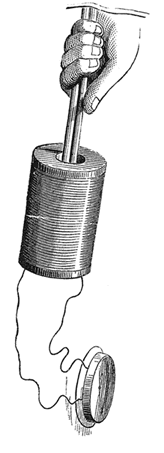
В 1826 году Жан-Батист Дюма разработал более гибкий метод определения соотношений вес/объём, который можно было применять для работы с веществами, реагирующими с ртутью, что позволило добиться определённых успехов. Правда, Дюма неоднократно заявлял с опасением, что из его современников только физики пытаются определять атомные веса, в то время как химики были слишком увлечены получением новых веществ. Это было похоже на часовую бомбу, заложенную под фундамент химии. Отсутствие точной информации об атомных весах (говоря современным языком – атомных массах) не позволяло однозначно определять состав молекул, в особенности органических. В 1861 году Август Кекуле заметил, что в литературе имеется девятнадцать вариантов формулы уксусной кислоты. Кризис органической химии, да и химии вообще, наступил, и причиной кризиса было именно разночтение в атомных массах элементов.
Чтобы сократить число формул уксусной кислоты, а также для того, чтобы навести порядок в совместных делах, 3 сентября 1860 года ведущие химики собрались в Карлсруэ, заложив тем самым традицию решать общие проблемы, собираясь на международные конференции, причем проводить такие конференции в местах, где можно совмещать решение научных задач и приятное времяпрепровождение (как-то не припомню ни одной международной конференции химиков, проводившейся в декабре в американском Фербенксе на Аляске, нашей Кандалакше, канадском Саскатуне или, скажем в Могадишо в любое время года). На конференции итальянский химик Станислао Канниццаро произнес пламенную речь, в которой попытался открыть глаза коллегам на труды своего земляка Амедео Авогадро, который ещё в 1811 году предположил, что молекулярную массу можно вычислить, используя значение плотности паров вещества. Отношение к пламенной речи Каниццаро было различным: кто-то посчитал высказанные идеи упражнениями в нумерологии, каковыми, например, считались составленные Дёберейнером триады элементов, для других это было откровением. Вскоре после конгресса в Карлсруэ плотность паров стала важнейшей характеристикой вещества, её было необходимо указывать при описании нового соединения. Тем не менее, пока один молодой химик, воодушевлённый новыми идеями химии, не разработал новый метод определения этого параметра, измерение плотности паров вещества было делом, связанным с большим количеством трудностей.

Виктор Мейер родился в Берлине в еврейской семье в 1848 году, он учился химии у Роберта Бунзена и получил докторскую степень в возрасте 19 лет. В двадцатитрехлетнем возрасте Мейер присоединился к работавшей в Цюрихе группе Йоханесса Висцелиуса. Работая в Цюрихе, помимо всего, Мейер доказал, что глюкоза проявляет свойства альдегида, изучал нитроалканы, обнаружил изомерию оксимов и выделил тиофен из недостаточно очищенного образца бензола, применявшегося, однако, для демонстрационных экспериментов. Мейер первым обнаружил, что объёмные группы атомов могут замедлять химические реакции, ввёл понятия «стереохимия» и «дипольная молекула». Когда Мейер начал исследовательский проект, связанный с изучением свойств большого количества органических и неорганических соединений, он столкнулся с необходимостью измерения плотности паров. Его не устроил метод, ранее предложенный Дюма, и взамен он решил разработать свой собственный подход.
Мейер предложил следующий способ: навеску вещества помещали в стеклянную трубку, оборудованную боковым отводом, соединенным с газовой бюреткой, уровень жидкости в которой уравновешивался жидкостью в уравнительной склянке. Трубку запаивали или закрывали герметичной пробкой, после чего погружали в водяную или масляную баню. Вещество испарялось, и его пары вытесняли воздух из газовой бюретки, объём паров измерялся, и при знании точной массы навески определение плотности паров было простым делом. С помощью аппарата Мейера можно было значительно ускорить измерение столь важной для химиков того времени экспериментальной характеристики вещества.
Сам Мейер, бесспорно, был трудоголиком. Он изнурял себя работой, что не могло не приводить к частым нервным срывам. Срывы, однако, не мешали ему двигаться по карьерной лестнице – сначала он стал заведующим кафедрой химии в Геттингене, а затем сменил своего учителя Бунзена на посту заведующего кафедрой химии в Гейдельберге. Тем не менее, нагрузка была столь сильной, что в 1897 году Мейер написал прощальное письмо-извинение своей семье и принял цианистый калий. К моменту самоубийства, метод измерения плотности паров по Мейеру стал элементом лабораторного студенческого практикума.
В наши дни, отправляя статью, описывающую синтез нового соединения, в научный журнал, мы уже не приводим значения плотности паров, появились другие, более точные методы установления состава и строения вещества. Однако относительная или абсолютная плотность паров встречается в заданиях химических олимпиад школьников, и, пользуясь этой величиной, участники конкурсов de facto делают то, что когда-то делали Канниццаро и Мейер – определяют молекулярную массу неизвестного (в смысле зашифрованного в условии задачи) вещества, правда, школьникам не приходится находить эти параметры экспериментально.


