Книга: Гиппократ не рад. Путеводитель в мире медицинских исследований
Назад: Производственный ад
Дальше: Два брата-близнеца: плацебо и ноцебо
Работающая гипотеза
Надо сразу оговориться, что мы будем обсуждать с вами общую модель того, как проводят исследования, но это вовсе не значит, что такая модель применима абсолютно ко всем случаям. Сейчас за производством новых лекарств стоит большая команда самых разных специалистов. Но ещё некоторое время назад лекарства получали даже совершенно случайно, чего стоит история с выделением пенициллина. Некоторые препараты создавали, основываясь на представлениях о том, что какая-то трава помогла снять симптомы – а давайте попробуем из неё что-то выделить!
Например, в древности люди использовали кору белой ивы для снятия жара. Оказалось, что в ней содержится целый коктейль разнообразных веществ: салицин, хинин, полифенолы и прочие вещества, которые оказывали противовоспалительное и жаропонижающее действие. Благодаря салицину у нас теперь есть аспирин (его научное название – ацетилсалициловая кислота). Сейчас аспирин входит в списки важнейших лекарств, повсеместно используется и вообще приносит много пользы.
Самое интересное, что теперь аспирин используется немного иначе: его больше используют в терапии и профилактике сердечно-сосудистых заболеваний. Кроме того, сейчас его исследуют ещё и как препарат с противораковой активностью. Например, ещё в 2010 году были опубликованы данные о том, что приём аспирина на протяжении многих лет уменьшает заболеваемость раком прямой кишки и смертность от него[46].
Через 8 лет учёные решили докопаться, что же такого делает аспирин. Тут я сделаю небольшое отступление и расскажу немного о раке. Раковые клетки, как правило, быстро делятся. Их задача – поделиться, распространиться. Здоровая клетка просто позволить себе такой роскоши не может. Она как человек, который постоянно забывает, выключил ли он утюг. Такой человек, уехав на работу, будет мучиться, в итоге приедет домой, всё перепроверит, а на следующий день снова забудет, выключил ли он утюг. Ещё здоровую клетку можно сравнить с дотошным главным бухгалтером перед отчётным периодом: он перепроверяет все таблицы, распечатывает их и начинает сверять вручную… То же самое со здоровой клеткой: она не может начать делиться просто так, ей надо всё проверить. Раковая же клетка такую дотошность не проявляет.
Когда клетка делится, ей нужно много строительного материала, роль которого в том числе выполняют белки. То есть в раковых клетках белок синтезирующий аппарат постоянно активирован, на поддержание его работы уходит большое количество энергии. Белки в клетке синтезируются в специальных структурах, которые называются рибосомами. Сами рибосомы тоже не просто из воздуха появляются, они синтезируются в ядрышках. Если сравнить рибосомы с кирпичным заводом, то ядрышко – это бригада, которая построила сам кирпичный завод. Кроме того, в синтезе чего бы то ни было в клетке всегда участвуют молекулы, которые регулируют тот или иной этап реакции. Такие молекулы называются по-разному, но в конкретно данном исследовании это был транскрипционный фактор TIF-IA.
Оставим теперь в стороне раковые клетки и вернёмся к исследованию аспирина. Учёные выяснили, что аспирин снижает активность этого транскрипционного фактора в опухолевых тканях пациентов с раком прямой кишки[47]. Без него, как оказалось, рибосомы образовываться не могут, а значит, новых кирпичных заводов нам не видать. Нет заводов – нет кирпичей, нет кирпичей – нет новых домов. Для клеток же это означало значительное снижение способности синтезировать белки.
Конечно, не каждый пациент с раком прямой кишки отреагирует на такую терапию, поэтому сами исследователи отметили необходимость дальнейшего исследования механизмов. Но даже из общих соображений безопасности можно сказать, что в долгосрочной перспективе такое лечение точно всем не подойдёт. Дело в том, что аспирин повышает риск кровотечений, поэтому всем его не назначить. Но зато это исследование сделало куда больше, чем кажется на первый взгляд: оно нашло новую мишень для терапии. То есть учёные потенциально могут создать такое лекарство, которое будет направлено против этого транскрипционного фактора TIF-IA, но которое при этом не будет повышать риск кровотечений.
Для того, чтобы такое лекарство появилось на свет, сначала необходимо ознакомиться с данными литературы. Раньше лекарства делали, основываясь на знаниях о свойствах лечебных трав. Сейчас же пласт информации больше, а значит, прочитать и обработать нужно куда больше информации, но принцип остаётся тот же. После этого моделируется молекула. Сейчас это делается с помощью компьютера, и занимаются этим отдельные специалисты. После моделирования химики синтезируют саму молекулу, тестируют разные системы очистки и определяют оптимальные условия синтеза. Да, сразу оговорюсь, что всё это – настоящее творчество в разумных пределах.
Снова попахивает шаманством? В реальности исследователи, как правило, предполагают получить какой-то определённый результат ещё до того, как эксперимент начался. Эти предположения они строят на собственных знаниях, данных литературы и неопубликованных данных, которыми с ними любезно поделились коллеги из другой лаборатории. Нет, безусловно, бывают исследования, в которых никто до конца не понимает, что же произойдёт, каков будет результат, но в разработке лекарств сюрпризов стараются не допускать. Всё это связано с большой ответственностью, так как всё, что имеет отношение к человеку, тестируется максимально тщательно, поэтому сюрпризы если и есть, то только на начальных этапах.
Как обстоят дела в современности? Если описать совсем кратко, то после создания молекулы её начинают тестировать на различных биологических моделях. Всё начинается с исследований in vitro. Затем учёные создают модельных животных, как правило, сначала это мыши или крысы специально выведенных линий, то есть исследования переносятся in vivo. И только потом, если молекула показала себя достаточно эффективной, а главное – безопасной в исследованиях на животных, начинаются исследования с участием людей. Существуют разные типы исследований, все они имеют разные дизайны, то есть способы набора пациентов, наблюдений за ними, сбора информации и прочие параметры. В зависимости от того, какое именно перед нами исследование, какая именно статья, мы можем сделать разные умозаключения.
Мне очень нравится одно из представлений иерархии доказательств в медицине, которое представлено в виде пирамиды. В основании этой пирамиды лежат самые слабые утверждения, тогда как на вершине расположились самые сильные утверждения. Давайте познакомимся поближе с этой пирамидой и разберёмся, почему доказательства расположились именно в такой последовательности.
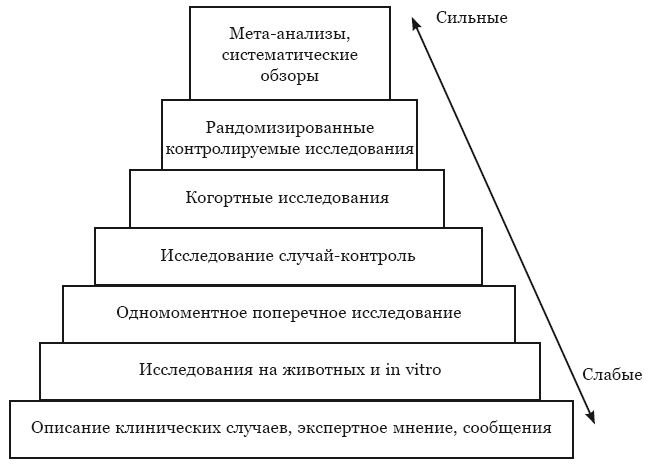
Рис. 10. Иерархия научных доказательств. С некоторыми оговорками и дополнениями
Один эксперт сказал
Как видно из рис. 10, в самом низу пирамиды находятся описания различных клинических случаев, экспертные мнения, какие-то единичные сообщения. Почему так происходит? Начнём с клинических случаев и сообщений. Тут всё можно объяснить, например, статистикой. Допустим, у пациента развилась какая-то очень-очень редкая болезнь или очень редкая реакция на препарат. Необходимо ли об этом знать? Безусловно. Это может быть просто очень интересный клинический случай, который можно из года в год рассказывать на конференциях, изучать его, проверять на такую же реакцию других пациентов… Но проблема в том, что этот эффект наблюдался у одного пациента. Мы не можем воссоздать точно такие же условия – клонировать пациента, а у других пациентов таких эффектов не наблюдается. Один из принципов исследований на лекарственных препаратах – терапевтический эффект должен повторяться. Действительно, было бы странно, если бы на мне парацетамол действовал, а на вас, дорогие читатели, нет. Поэтому такие сообщения можно и даже нужно рассматривать, но не следует забывать о том, что реальная клиническая практика довольно сильно отличается от того, что творится в сериале «Доктор Хаус».
Теперь что касается экспертов. Эксперт – это человек. Причём один. Раз эксперт – человек, ему свойственно ошибаться, быть заинтересованным в вопросе и намеренно или ненамеренно искажать данные, чего-то не знать. Говоря «эксперт», мы, конечно, подразумеваем, что человек знает много всего по теме, он авторитетен для нас. Но факт в том, что в науке нельзя творить себе кумиров и авторитетов. Поэтому и вас я тоже призываю критически относиться к любой информации, в том числе и к той, которая написана в этой книге. При этом вовсе необязательно, что эксперт пытается нас обмануть. Он может просто чего-то не знать. Например, возьмём снова за пример эту книгу. Может случиться так, что с момента написания этой книги мной до момента покупки её вами произойдёт какой-то научный прорыв – и всё. Часть из написанного здесь уже будет неверна.
Единственное, к чему я сразу рекомендую относиться с бóльшей осторожностью, – апелляция к собственному авторитету. Когда человек говорит о том, что он вот специалист, он знает, как лучше, это для меня всегда повод вчитаться в то, что говорит человек.
Стёкла и животные
Необходимыми для проведения исследований на людях и для регистрации любого препарата на данный момент являются исследования in vitro и in vivo. Чего тут только не исследуют! И механизм действия препарата на клеточном уровне, и то, какие у него эффективные и токсические дозы (все ведь помнят, что лекарство и яд разделяет только дозировка?), и переносимость препарата, и даже канцерогенность, и ещё многое-многое другое в зависимости от вида препарата. Ну и от количества денег у фармкомпании, которая взялась за разработку препарата. Результаты исследований на животных и in vitro иногда также включаются в инструкции о препарате.
Безусловным плюсом исследований на животных и клетках является тот факт, что мы можем смоделировать нужную нам ситуацию. Возможно, не полностью, но об этом чуть позднее. Каких только сейчас клеточных и мышиных моделей не существует! Есть мыши с эпилепсией, мыши с ожирением, сахарным диабетом и сердечно-сосудистыми заболеваниями, с разными видами рака. Это людей нам запрещено генетически модифицировать, а вот с мышами люди давно научились делать весьма интересные с точки зрения науки вещи, которые регулярно вызывают бурю негативных эмоций у зоозащитников, причём такая реакция часто бывает оправданной.
Человек может создать, например, мышь с поломкой в определённом гене или вообще вырезать его. Для этого необходимо, конечно, обладать определённой сноровкой, так как это довольно сложные манипуляции. Кроме того, с млекопитающими довольно сложно работать в силу особенностей строения женской половой клетки – ооцита. Переносить необходимые для создания трансгенных животных конструкции в ооцит можно различными способами, как химическими, так и физическими. Также зачастую для создания трансгенных мышей используются специальные вирусы, например SV40[48].
Читатель может возразить, что не всегда мы обладали теми технологиями, что есть сейчас, мы не могли залезть мышам в ДНК и наворотить там бед. Да, это так, но этот факт вовсе не мешал людям проводить исследования на животных. Такие исследования способствовали развитию многих областей науки, например трансплантации органов. Учёные изучали мышей, чьи иммунные системы немного отличаются, и обнаружили, что пересаженные органы отторгаются организмом хозяина из-за иммунологических реакций. Эти работы привели к разработке методов типирования тканей, которые позволяют определить наилучшего донора[49].
Ещё один пример того, как исследования на животных могут подтолкнуть к открытию, – препараты лития. Их начали использовать в психиатрии довольно давно. Механизм действия препаратов лития пока точно не выяснен, но предполагается, что ионы лития комплексно воздействуют на проведение нервных импульсов в головном мозге, возможно, оказывают защитное действие на нейроны (обладают нейропротекторными свойствами)[50–52]. Сейчас препараты лития довольно эффективно используют в терапии различных психиатрических расстройств. Использование лития в психиатрии восходит чуть ли не к середине XIX века (известны случаи в ранней психиатрической практике, когда соли лития назначали в качестве противосудорожного и снотворного средства, а также для терапии «острой нервозности»), но официальной исторической датой открытия считается 1949 год[53].
В ходе своих исследований австралийский психиатр Джон Фредерик Джозеф Кейд обнаружил, что урат лития (соль мочевой кислоты) оказывал успокаивающее действие на морских свинок[53]. Психиатр проверил свою гипотезу в исследовании с участием людей и получил потрясающие результаты: у пациентов, которых считали безумными и неизлечимыми в течение многих лет, улучшилось состояние. Препаратам лития потребовалось ещё много лет для того, чтобы получить регистрацию. Это было связано с соображениями безопасности. В 1940-х годах он использовался в очень высоких дозах, что приводило к тяжёлой интоксикации. Кроме того, соли лития использовались в качестве заменителей поваренной соли (то есть диета пациентов была бедна натрием), что привело к смерти некоторых пациентов.
Исследования на животных проводятся далеко не только для того, чтобы поближе с ними познакомиться. Ту же мышь мы изучили вдоль и поперёк. Более того, чем крупнее животное, тем сложнее с ним работать. Беременность мышей длится около двадцати дней, тогда как у коровы он может составлять все десять месяцев. Срок беременности шипанзе и бонобо – около восьми месяцев. Кроме того, существуют этические проблемы с проведением исследований на наших ближайших сородичах, мы к ним больше привязаны. Ну и конечно финансовая проблема, которую мы уже обсуждали ранее. Купить десяток мышей и содержать их пару-тройку месяцев гораздо дешевле, чем купить десяток коров.
Животные и клетки – это экспериментальные модели со всеми вытекающими проблемами. Некоторые животные имеют биологическое сходство с людьми, что делает их отличными моделями для конкретных заболеваний, например для создания вакцины от полиомиелита проводили эксперименты на обезьянах и на культурах клеток обезьян; кроликов часто используют в качестве экспериментальной модели атеросклероза.
Кроме того, если мы представляем из себя фармкомпанию или фонд, желающий инвестировать в разработку лекарства, мы желаем минимизировать риски. Допустим, у нас есть десять-двадцать вариантов молекулы. Нам нужно проверить, какие из вариантов будут наиболее эффективными, и работать дальше над их усовершенствованием. В таких случаях исследования на клетках и на животных позволяют отобрать интересующие нас варианты.
Кроме этических существуют и другие проблемы. Во-первых, вновь вспомним об истории с талидомидом. Во-вторых, ни одно животное не заменит человека. В-третьих, само определение термина «модель» подразумевает упрощение системы.
Рис. 11. Различные пути апоптоза (клеточной смерти). На схеме представлены различные сигнальные каскады с участием множества белков
Давайте взглянем с вами на две схемы (рис. 11 и 12). Я попрошу не обращать вас пока внимание на названия и на то, что эти схемы на английском. По сути для объяснения это не будет иметь значения (но если кого-то эти схемы заинтересуют так, что он решит почитать подробнее про апоптоз, это будет вообще очень классно). Итак, существует такое понятие, как клеточная смерть. Если опустить некоторые подробности и особенности классификации, то апоптоз – это такая программированная клеточная гибель. Иногда случается так, что клетка повреждается, и эти повреждения необратимы. У клеток есть несколько вариантов: или стареть (это вообще отдельная тема), или переродиться в раковые, или умереть. Часто клетка избирает именно путь смерти. Есть даже такая концепция, которая предполагает, что клетка по своей натуре очень суицидальна, а не умирает она только потому, что ей не дают умереть различные стимулы.
Рис. 12. Тоже схема апоптоза (клеточной смерти).
В данном случае отображены внешний (extrinsic) и внутренний (intrinsic) пути апоптоза. Количество изображённых молекул уступает количеству изображённых молекул на предыдущей схеме, но по обоим рисункам можно понять последовательность, с которой происходят события
Так вот, сигнал о том, что пора умирать, может поступить как извне, так и изнутри. Например, если снаружи что-то случилось, то к специальному рецептору клетки, который весьма поэтично называют рецептором смерти, подойдёт сигнальная молекула, которая запустит каскад биохимических реакций. Этот процесс не менее поэтично называют «поцелуем смерти». В итоге клетка умрёт. Иногда повреждения бывают внутренними, например, что-то случилось с ДНК, клетка это поняла и решила не плодить ошибки. Так как молекул и снаружи, и внутри великое множество, вариантов тут на самом деле невероятно много.
Обе схемы, и на рис. 11, и на рис. 12, показывают нам, как может происходить апоптоз. Мы вполне можем изучить его и понять, какая реакция за какой происходит. Но первая более подробная, чем вторая. Это не делает вторую неправильной, просто вторая схема не учитывает множества других факторов. По правде говоря, в учебных целях используются схемы именно второго типа, а схемы первого типа обычно вешают куда-нибудь на стенку для красоты.
Самое интересное в том, что даже первая схема не отражает всей картины. Мы просто можем чего-то не учесть, так как это модель, а модель – это всегда упрощение. В этом и заключается глобальная проблема с модельными животными и с клетками. К слову, именно поэтому нельзя просто так перенести результаты исследований in vitro на in vivo, а с in vivo на человека. Это является в том числе одним из основных аргументов зоозащитников, которые не без оснований говорят о том, что исследования на животных проводятся часто ради исследований, а не для достижения какого-то результата или решения какой-то проблемы. Многие работы даже чисто методологически неправильно выполнены.
Поэтому для проведения исследований на животных сейчас существуют специальные довольно жёсткие предварительные процедуры. Ни один уважающий себя журнал никогда не опубликует статью об исследовании, на проведение которого не дал добро этический комитет. В заявке надо обязательно указывать все процедуры, которые будут проводиться, в том числе надо указывать, что будет с животными после испытаний. Как правило, животные, которые участвовали в одном исследовании, не участвуют в других. Значит, их содержание – лишние траты, следовательно, животных после исследований обычно убивают. С учётом невозможности экстраполирования всех результатов на человека такой исход кажется совершенно негуманным, поэтому тысячи учёных по всему миру сейчас бьются над решением этой проблемы. Возможно, через десять или двадцать лет мы сможем обходиться без исследований на братьях наших меньших.
Одномоментное поперечное исследование
Чуть выше в иерархии научных доказательств стоят исследования с участием людей, которые по сути представляют из себя некий срез ситуации. Представьте, что исследователи делают научную «фотографию» какой-то ситуации.
Целью такого исследования может быть оценка распространённости заболевания или какого-то исхода в исследуемой популяции или эффективности диагностики, лечения. Такие исследования, как правило, довольно недорогие, их просто проводить. Но так как исследования довольно непродолжительные, то всесторонне изучить вопрос нереально.
Кроме того, в таких исследованиях в силу самого их дизайна сложно установить причинно-следственную связь, а также рассмотреть скоротечные случаи. Например, данные о том, что конкретно сейчас испытуемые употребляли алкоголь и у них развился цирроз, не позволят нам изучить то, как влияло на здоровье употребление алкоголя год назад, как влияли какие-то другие факторы на развитие цирроза. Мы ведь не можем по одной фотографии сказать, что люди, запечатлённые на ней, делали год назад или что происходило на этом место неделю назад или даже час назад.
Есть ещё один интересный момент: если исследователь полагается на опрос пациента, то по заветам доктора Хауса необходимо помнить о том, что люди лгут. Причём это может зависеть даже не от желания самого человека, просто наша память так устроена. Мы склонны что-то забывать, наш мозг может искажать информацию, просто потому что ему удобнее её так хранить. Ну и, конечно, нельзя исключить чувство вины или чувство стыда. Например, человек может сознательно или несознательно назвать меньшее количество ложек сахара, которое он обычно кладёт в чай, «уменьшить» количество выкуренных сигарет или выпитых алкогольных напитков.
Такие исследования относятся к типу обсервационных, или наблюдательных, то есть учёный просто собирает имеющуюся информацию, а непосредственного вмешательства в ситуацию не происходит. Учёным довольно сложно опрашивать и осматривать всю популяцию, которая представляет для них интерес. Поэтому такие исследования часто проводятся в крупных учреждениях здравоохранения, где большой поток пациентов.
Участники набираются на основе критериев включения и исключения. Это такие параметры, которым участникам необходимо удовлетворять, чтобы участвовать в исследовании. Например, в анализ были включены пациенты обоих полов от 18 до 30 лет включительно, а ещё у них у всех был сахарный диабет второго типа; критерием исключения, например, служил сахарный диабет первого типа и несахарный диабет. Это значит, что пациенты с несахарным диабетом не включались в исследование. Такие исследования, как правило, позволяют увидеть какую-то определённую картину мира и составить дальнейший план действий. Можно даже оценить связь болезни и фактора риска через отношение шансов. Приведу пример такого исследования.
Nikiphorou и её коллеги поставили цель изучить уровни витамина D и их связь с состоянием здоровья пациентов с ревматическими заболеваниями[54]. Учёные проводили исследование в крупной клинике в Финляндии. Всего было включено 3203 пациента. Дальше исследователям нужно описать свою выборку: возраст пациентов был от 15 до 91 года, средний возраст – 54 года, 68 % пациентов составили женщины. Также исследователи оценили распространённость различных ревматических заболеваний в выборке, например заболевания соединительной ткани встречали у 213 пациентов. Далее у пациентов оценивался уровень витамина D. Можно было сделать вывод о распространённости дефицита витамина, а также оценить степень тяжести этого дефицита. Так, у 17.8 % пациентов наблюдался дефицит, при этом у 1.6 % – тяжёлый дефицит (<25 нмоль/л). Более высокий уровень витамина связали с более старшим возрастом, более низким показателем индекса массы тела и регулярными физическими упражнениями (p < 0.001).
Это исследование показало, что у большинства людей из исследуемой выборки в Финляндии был оптимальный уровень витамина D. При этом сами исследователи отметили, что повышение уровня витамина с возрастом – это парадокс, так как в принципе следует ожидать более низкого потребления витамина, меньшего всасывания в кишечники и снижения способности организма преобразовывать молекулу в её активную форму в коже. Авторы заметили, что этот феномен может быть объяснён тем, что вот, мол, какой у нас хороший скрининг, как все хорошо принимают добавки. Поэтому у нас и нет дефицита у большинства пациентов в популяции. Но опять же – это всего лишь предположение, учёные довольно сдержанны в своих формулировках и стараются обычно не делать голословных утверждений.
Случай? Контроль!
Ещё чуть выше в иерархии доказательств стоят исследования случай-контроль. Тут нам нужно вспомнить о таком понятии, как фактор риска. Фактор риска – это какое-то свойство или особенность организма или какое-либо воздействие на него, что в итоге повышает вероятность развития болезни или травмы. Например, если ходить по стройке без каски, то вероятность получить серьёзную травму головы выше, чем если каску надеть. Другой пример – курение, которое повышает риск развития рака лёгких.
Тут нужно, к слову, отметить, что по определению вероятность повышается. То есть она изначально может быть не нулевой. Например, если человек всё же надел каску, но так случилось, что серьёзную травму головы он всё же получил; или если человек не курил, но раком лёгких всё равно заболел. Это не какая-то мифическая карма, просто вероятность не была равна нулю.
Это тоже обсервационное исследование. Пациенты обследуются исследователем, но воздействия на них не оказывается. Потенциальная связь фактора риска с заболеванием изучается путём сравнения больных и здоровых пациентов на основании того, как часто представлен какой-то фактор или признак (или уровни этого признака или фактора) в каждой из групп пациентов.
Например, возьмём снова курение и рак лёгких. В исследовании, которое показывает, что люди, которые курят (фактор), с большей вероятностью заболеют раком лёгких (исход/результат), «случаями» назывались бы люди с раком лёгких, а «контролями» – люди без рака лёгких. При этом часть пациентов из каждой группы будут курильщиками. Тогда если курильщиков окажется больше в группе с раком лёгких, чем в группе без рака лёгких, можно будет сказать, что наша изначальная гипотеза была верна. При этом однозначно утверждать, что одно является следствием другого, всё ещё нельзя. Для этого требуется дальнейшее изучение.
Такие исследования могут быть ретроспективными. Это значит, что анализ основывается на архивных данных или опросах участников, то есть это обзор уже имеющихся данных. Конечно, из такого дизайна сразу могут вытекать все возможные плюсы и минусы. Так, эти исследования довольно простые, дешёвые и быстрые. Но из-за особенностей дизайна такие исследования чаще позволяют выдвинуть гипотезу для дальнейшего анализа, а не проверить её.
Ещё одна проблема исследований случай-контроль – возникновение систематических ошибок при наборе участников и при проведении анализа данных. Исследователю нужно как можно конкретнее определить критерии включения и невключения. От этого зависит то, насколько точно он сможет определить возможное (!) влияние фактора риска на развитие или течение заболевания. Участники из контрольной группы не всегда должны обладать богатырским здоровьем. Например, это могут быть пациенты с тем же заболеванием, что в группе «случаев», но с более лёгкой степенью тяжести. Но вот этот момент, – чем именно отличаются «случаи» от «контролей», – должен быть определён абсолютно точно.
Ещё один недостаток – сложно получить достоверность информации о степени воздействия фактора риска на пациента с течением времени. Например, в прошлом году пациент выкуривал в день полпачки сигарет (если пациент вообще правильно помнит, сколько он выкуривал), а в позапрошлом – две. В этом же году пациент выкуривает чуть меньше пачки сигарет в день. Этот фактор риска мы можем, в принципе, количественно как-то оценить. А что делать, например, с количеством полученного ультрафиолета? Мы можем оценить количество солнечных дней в году или месяце, но конкретных данных о воздействии этого фактора на пациента мы не получим. Ну и, конечно, надо помнить, что лишь тот факт, что событие произошло после воздействия фактора риска, не означает, что событие произошло вследствие его воздействия.
Приведу пример исследования случай-контроль. Перед тем как мы перейдём непосредственно к самому исследованию, надо бы, наверно, сказать, что все статьи, которые я буду приводить в этом разделе, не надо расценивать как руководство к действию или способ лечения или профилактики. Это просто примеры, не говоря о том, что некоторые данные могут быть «сырыми», непроверенными по сто раз, не прошедшими сотни контролей, и так далее по списку.
Рак поджелудочной железы – это довольно печальное заболевание. По разным оценкам, пятилетняя выживаемость (то есть количество пациентов в процентах, которые проживут пять лет) составляет от 2 % до 9 %, в среднем этот показатель колеблется в районе 5–6 %[55]. Самое интересное, что курение повышает риск развития рака поджелудочной железы, хотя причины развития этого заболевания до сих пор не до конца ясны. Скорее всего, тут как всегда много чего намешано: и курение, и диабет, и диета, и образ жизни, и генетические факторы, куда же без них.
В 2014 году Streicher с коллегами опубликовали своё исследование[56], посвящённое взаимосвязи аспирина и снижения заболеваемости и смертности от рака поджелудочной. Что интересно, учёные использовали данные другого исследования. Такое тоже часто случается, особенно если исследовательские группы тесно общаются или просто работают над одной проблемой. Также некоторые данные просто публикуются в свободном или относительно свободном (доступном по подписке, например) доступе. Учёные выяснили, что регулярный приём аспирина был связан со сниженным риском рака поджелудочной железы (ОШ 0.52, 95 % доверительный интервал (ДИ) 0.39–0.69 – как раз потренируйтесь: что же я тут написала?). Чем дольше аспирин принимался, тем ниже был риск, а если аспирин прекращали принимать, риск возрастал.
При этом исследователи, конечно, отмечают необходимость оценки здоровья сердечно-сосудистой системы пациентов, так как от регулярного приёма аспирина повышается риск кровотечений. Ну и вообще аспирин совсем не безобидный препарат, чтобы его принимали все подряд, поэтому тут вступает в дело оценка рисков и пользы.
Вмешаемся в ваш организм. За дорого
Итак, мы дошли с вами до когортных исследований. Давайте сначала разберёмся с тем, что такое когорта. Когорта – это какая-то группа людей, с которыми что-то происходит или произошло, причём примерно в одно и то же время. Определение весьма расплывчатое, но основная суть в том, что мы вновь не экспериментируем самостоятельно, а наблюдаем за пациентами. Пациентов отбирают на основании того, подвержены они какому-то фактору риска или нет, таким образом формируется две группы пациентов (рис. 13).
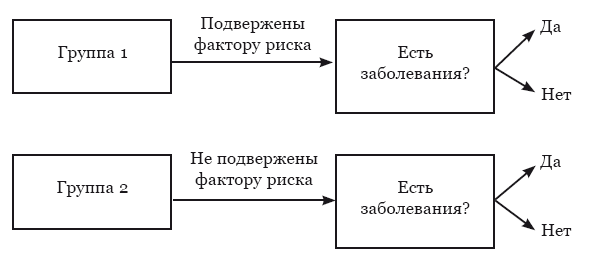
Рис. 13. Краткая схема дизайна когортного исследования.
Стрелка обозначает отрезок времени
За пациентами какое-то время наблюдают, оценивают их состояние, а затем проверяют, у кого из пациентов обнаружилось какое-то заболевание, кто из них умер. На основании анализа этих данных можно установить относительный риск и частоту новых случаев заболеваний. В этом заключается принципиальное отличие от исследований типа случай-контроль. Исследования случай-контроль работают с шансами, то есть выявляют связь между каким-то воздействием и исходом (развитие заболевания, смерть, ухудшение состояния и т. д.). Шанс – это всего лишь отношение вероятности того, что событие произойдёт, к вероятности того, что оно не произойдёт.
Гипотеза в когортных исследованиях представляет из себя вопрос: является ли что-то потенциальной причиной болезни? Именно на этот вопрос и пытаются ответить исследователи. Порой когортные исследования занимают довольно продолжительное время, в течение которого исследователи просят фиксировать все интересующие их события в специальных дневниках пациента. Дизайн исследования может быть как ретроспективным (то есть основываться на уже имеющихся данных), так и проспективным (то есть исследователи наблюдают и держат руку на пульсе). Проспективный вариант более предпочтителен потому, что он позволяет уменьшить вероятность ошибок и искажений информации.
Плюсом когортного исследования является надёжность данных. Такой тип исследований позволяет изучать множество различных исходов при воздействии одного фактора. Например, если мы наблюдаем за пациентами с повышенным уровнем содержания холестерина в крови, мы можем оценить частоту возникновения у таких пациентов сразу нескольких заболеваний. Тут, конечно, нужно убедиться, что ни у кого из пациентов не было интересующего нас заболевания изначально, но этот вопрос решается ещё на стадии планирования. Также на стадии планирования необходимо учесть сбор максимального количества данных об испытуемых. Это позволяет уменьшить систематическую ошибку при анализе данных.
Если воздействие редкое, то когортное исследование позволяет его изучить более подробно. Не во всех исследованиях типа случай-контроль можно изучить редкие заболевания, например, меланому в африканских странах, где она не является таким распространённым заболеванием. Следовательно, если мы наблюдаем за пациентами из Африки для оценки заболеваемости меланомой, этот подход может быть неэффективен. Но если мы знаем, что исследуемые люди постоянно подвергаются воздействию какого-то канцерогенного химиката, мы можем изучить заболеваемость меланомой в этой группе пациентов.
Но даже у такого замечательного типа исследований есть свои ограничения. Во-первых, всё как всегда упирается в деньги. Набор специалистов, которые будут наблюдать за пациентами, разработка дизайна, набор пациентов, сбор данных о них – всё это требует значительных затрат времени и финансов. Многие исследования продолжаются в течение многих лет и даже десятилетий. В ретроспективных когортных исследованиях измерения могут быть неточными. Плюс мы не можем оценивать причины редких заболеваний, в этих случаях нужно разрабатывать дизайн исследования случай-контроль, так как в них сначала подбираются случаи заболевания, а потом уже происходит анализ факторов риска, в то время как в когортных исследованиях сначала собираются данные о факторах риска.
Когортные исследования не дают точного ответа на вопрос о причинах заболевания, они лишь могут дать подсказки учёным, в каком направлении им думать, где искать дальше. А теперь приведу пару примеров когортных исследований.
Одно из самых известных когортных исследований – Фрамингемское исследование (Framingham Heart Study)[57]. Это когортное исследование было запущено в 1948 году Институтом сердца в США в городе Фрамингем. Дело в том, что у тогдашнего президента США Франклина Делано Рузвельта были серьёзные проблемы со здоровьем. Годы его президентства (а находился он на своём посту с 1933 по 1945 г.) пришлись на очень сложный период как в истории США, так и в истории всего мира. Артериальное давление Рузвельта неуклонно росло, при этом он отказывался от предложений врачей об уменьшении нагрузки, жертвуя, по сути, своим здоровьем. В итоге Рузвельт умер от кровоизлияния в мозг в 1945 году. Президентский пример показывает то, к чему может привести отсутствие лечения повышенного артериального давления, хотя в те годы мало кто в действительности придавал значение повышенному давлению в зрелом возрасте. Это считалось возрастным изменением.
Однако вскоре после смерти Рузвельта был открыт Институт сердца США. Исследователи принялись искать, какие же существуют факторы риска сердечно-сосудистых заболеваний, в чём их причины. В итоге было отобрано 5209 человек в возрасте от 30 до 62 лет, проживавших в городе Фрамингем, в котором численность населения около 28 000 человек. Пациенты проходили медицинское обследование, общались с врачами, подписывали необходимые бумаги, а потом возвращались на повторные обследования каждые два года. Через два года ситуация повторялась: сдавались анализы, проводились беседы с врачами, врачи анализировали данные. В 1971 году в исследование были включены дети участников первого набора, а также их супруги, а в 2002 году – внуки пациентов из первого набора.
Фрамингемское исследование – одно из самых знаковых когортных исследований, которое внесло неоценимый вклад в существующие данные о факторах риска развития сердечно-сосудистых заболеваний. Всего по собранным за 70 лет исследователями данным было опубликовано более 3000 статей. Именно это исследование позволило выяснить, что курение, ожирение и повышенный уровень холестерина являются факторами риска таких заболеваний, а регулярные физические активности позволяют снизить риск заболеваний сердца, что психосоциальная среда в значительной степени оказывает влияние на здоровье сердца. На основании этого исследования была разработана специальная шкала, которая позволяет оценить риск инфаркта миокарда или смерти. Ссылку на калькулятор вы можете найти в списке источников, но для этого вам нужно будет измерить давление и уровень холестерина[58].
Здесь также нужно отметить, что в Европе пользуются немного другой шкалой, по которой можно определить вероятность смерти в процентах с учётом пола, возраста и воздействия факторов риска. Россия и большинство стран СНГ входят в группу с высоким риском развития сердечно-сосудистых заболеваний, поэтому при подсчёте необходимо опираться на шкалу для стран с высоким риском. Ссылку на неё вы также можете найти в списке источников в конце книги[59].
Ещё один хрестоматийный пример когортного исследования – исследование здоровья медицинских сестёр (Nurses’ Health Study)[60], которое было инициировано в 1976 году. Впоследствии, в 1989 году, исследование было расширено. В исследовании анализируются данные, полученные от более чем 200 000 медсестёр. В начале 1970-х годов доктор Фрэнк Спейзер начал это исследование с надеждой узнать больше о долгосрочных факторах риска развития рака и сердечно-сосудистых заболеваний у женщин. Были включены замужние медсёстры из 11 самых густонаселённых штатов. В общей сложности приглашения для участия были отосланы 170 000 медсестёр, ответов получено – 122 000. Именно эти медсёстры стали участницами первого исследования, при этом 90 % из этих медсестёр до сих пор участвуют.
В 1989 году доктор Уолтер Виллетт и его коллеги инициировали второе исследование. Учёные поставили цель изучить факторы риска, связанные с рационом питания и образом жизни, в когорте женщин, которые были моложе участниц первого исследования. Если самым молодым медсёстрам в первом исследовании было 43 года, то во второе включили женщин в возрасте от 25 до 42 лет. В итоге к исследованию подключилось ещё 116 686 медсестёр, многие из которых были дочерями или племянницами женщин, участвовавших в первом исследовании. Большинство из них продолжают участие по сей день. В 1996 и 2004 годах участницам второго исследования было предложено записать своих детей в возрасте от 9 до 14 лет в аналогичное долгосрочное исследование для изучения факторов, влияющих на изменение массы тела. Это исследование также продолжается по сей день.
Если зайти на сайт исследования, можно заметить, что сейчас продолжается набор на третью фазу исследования здоровья медсестёр. По словам учёных, опасность курения и польза здорового питания – это совершенно обыденные вещи для нас сейчас. Но когда-то мы не знали кажущихся очевидными теперь элементарных вещей. Исследование здоровья медсестёр поменяло наше представление о здоровье, поэтому нам есть чему ещё научиться, в этом и смысл проведения третьего исследования.
* * *
Прежде чем мы двинемся дальше вверх по пирамиде доказательств, нам нужно будет ввести несколько понятий и разобраться с тем, что именно понимают под рандомизированными плацебо-контролируемыми двойными слепыми (иногда даже тройными) исследованиями, поэтому далее будет небольшое лирическое отступление, после которого мы вновь вернёмся к иерархии доказательств.
Назад: Производственный ад
Дальше: Два брата-близнеца: плацебо и ноцебо

