Глава 4
Управление войсками
Примерно через год после того, как наша статья о CRISPR вышла в журнале Science, я оказалась в Кембридже, штат Массачусетс, – в первой своей поездке по стране для обсуждения нашего открытия (впоследствии такие поездки случались каждый месяц).
То был июнь 2013-го, и я отправилась в Гарвардский университет, чтобы встретиться там с восходящей звездой с местной кафедры изучения стволовых клеток и регенеративной биологии. Кабинет профессора Кирана Мусунуру находился в здании имени Шермана Фэйрчайлда, в котором я слушала лекции по химии в 1980-х, когда была аспирантом. Тридцать лет спустя здание снаружи выглядело почти так же, но внутри его полностью обновили. Ушли в прошлое старомодные потоковые аудитории и биохимические лаборатории с устаревшим оборудованием. На смену им пришли белые, просторные, ярко освещенные помещения, оборудованные по последнему слову техники. В тот день, когда я была там, это современное пространство кипело жизнью: десятки исследователей работали сообща ради разгадки самых глубоких тайн клеток и тканей.
В некотором смысле преобразование Фэйрчайлд-билдинг – особенно смещение фокуса внимания с фундаментальной биохимии на прикладную биологию – совпадало с той метаморфозой, что произошла в моем мировосприятии и научной работе. Предыдущий год пронесся как ураган. Исследователи со всего мира – гораздо больше, чем могла бы вместить любая лаборатория, – быстро подхватили полученные нами сведения о биохимических свойствах CRISPR-Cas9 и стали их применять. Они уже успели использовать эти новые знания, чтобы изменить нужным образом ДНК бесчисленного множества организмов, включая генетический материал клеток человека. И ученые, и врачи воспринимали CRISPR как священный Грааль генетических манипуляций: быстрый, простой и точный способ устранить дефекты генетического кода. Будто в мгновение ока я перенеслась из области изучения бактерий и биологии CRISPR-Cas в мир медицины и биологии человека. Для такого узкоспециализированного ученого, как я, это был квантовый скачок – как если бы я заснула в Беркли и проснулась на Марсе.
Моя встреча с Мусунуру была прекрасной иллюстрацией ажиотажа вокруг этой новой технологии. Я приехала в Гарвард, чтобы обсудить варианты применения CRISPR в лечебных целях, но Киран уже был на шаг впереди меня. Прежде чем мы прошли в его кабинет, он пригласил меня прогуляться по лаборатории. В ходе этой экскурсии он живо описал мне множество способов применения CRISPR, которые его сотрудники использовали для разработки методов лечения генетических заболеваний.
Одной из мишеней экспериментов его команды, объяснил Киран, была серповидноклеточная анемия – состояние, при котором одна мутация в ДНК нарушает способность красных кровяных телец разносить кислород по телу. Сотрудники лаборатории использовали CRISPR для того, чтобы найти и вырезать мутировавший ген бета-глобина, тем самым запуская возвращение “правильного” Т, 17-го по счету нуклеотида в гене, на место “неправильного” А. И если бы у них получилось доработать технологию на реальных человеческих клетках в лаборатории, то были бы все основания предполагать, что того же самого можно достичь и у пациентов – и таким образом заложить основы терапии, позволяющей устранить саму причину генетического заболевания.
Я вслед за Кираном подошла к монитору, на котором слева направо одна под другой отображались длинные цепочки нуклеотидов ДНК. Мусунуру указал на две последовательности в верхней части экрана и объяснил, что они представляют собой “буквы” ДНК бета-глобина из клеток крови двух пациентов – здорового и страдающего серповидноклеточной анемией. Ожидаемо, что у здорового человека семнадцатый нуклеотид в этом гене был Т, а у больного – А.
Затем Киран обратил мое внимание на самую нижнюю строчку. Последовательность ДНК там также была взята из гена бета-глобина пациента с серповидноклеточной анемией, но после того, как ученые ввели ему в кровь три элемента CRISPR-системы. Первым из них был набор генетических инструкций из Streptococcus pyogenes для синтеза белка Cas9. Второй элемент представлял собой построенную на основе информации от CRISPR молекулу направляющей РНК, составленную таким образом, чтобы она взаимодействовала точно с мутировавшим участком гена бета-глобина. Третий элемент – это специально синтезированная замена фрагмента ДНК, кусочек “здоровой” последовательности гена бета-глобина, которую клетки используют для починки этого гена после того, как Cas9 его разрезал. Киран применил систему CRISPR-Cas9, чтобы вырезать определенную целевую часть генома, а также пометить место разреза таким образом, чтобы сама клетка могла заменить дефектную последовательность на нужную, правильную.
Взглянув на нижнюю часть монитора, я, к своему восторгу, увидела, что именно это и произошло: последовательность ДНК у больного серповидноклеточной анемией теперь была неотличима от той, что взяли у здорового человека. Используя CRISPR, сотрудники Кирана с идеальной точностью заменили вызывающую заболевание “букву” А на нормальную “букву” Т, никак не изменив при этом другие участки генома. В простом эксперименте с использованием клеток крови пациента они показали, что система CRISPR-Cas9 способна вылечить заболевание, поражающее миллионы людей по всему миру и приводящее к инвалидности.
В тот вечер я вышла на пробежку по набережной реки Чарльз. Я не раз бегала здесь, пока работала над получением степени доктора философии, а теперь, когда рядом снова струились такие знакомые воды Чарльза, я чувствовала, будто снова вернулась в те времена. Пока я бежала, память уносила меня назад, к обсуждениям репарации ДНК, большинство которых вращалось вокруг исследования, которое опубликовали мой научный руководитель Джек Шостак и его аспирантка Терри Орр-Вивер. В то время многие ученые были озадачены предложенной ими моделью, которая описывала, каким образом клетки устраняют повреждения двойной спирали ДНК. В еще большее замешательство всех привело предположение, выдвинутое Марией Джесин и ее коллегами из Мемориального онкологического центра имени Слоуна – Кеттеринга: ученые могут использовать механизмы устранения этих повреждений для изменения требуемых последовательностей ДНК. Однако эта стратегия сработала для предшествующих технологий, таких как ZFN и TALEN, и теперь мы наблюдали воочию, что это предположение оказалось верным и для CRISPR. Более того, основанный на CRISPR метод редактирования генов было гораздо проще применять. Вытеснит ли он более старые технологии так же, как компакт-диски вытеснили магнитофонные кассеты (а те, в свою очередь, вытеснили виниловые пластинки)? Я размышляла об этом, пока бежала от Гарвард-сквер до моста Лонгфелло и обратно, и совершенно не замечала, как вокруг меня сменяется городской пейзаж: его затмевал рой мыслей о CRISPR.
Что действительно воодушевляло меня, так это мысль, что методика, которую использовали в лаборатории Кирана, может быть применима и при массе других генетических заболеваний. Если ученые смогут безопасно и эффективно доставлять CRISPR в тело человека, так что нужный ген будет отредактирован и у пациентов, и у клеток в культуре, то возможности для преобразования медицины будут безграничными. Впрочем, реализация этой “безграничности” потребует такого количества ресурсов и рабочих рук, сколько ни одна исследовательская лаборатория не в состоянии предоставить – если будет действовать отдельно от других. Именно поэтому я и некоторые мои коллеги подумывали о том, чтобы основать компанию по разработке методов лечения, основанных на CRISPR, – собственно, это и было целью моего визита в Кембридж. Мы мечтали приспособить CRISPR для лечения генетических заболеваний – это был бы метод, совершенно недоступный раньше.
Во время череды встреч летом и осенью 2013-го из пяти человек составилась команда организаторов этой гипотетической компании: Джордж Чёрч, Кит Джоунг, Дэвид Лю, Фэн Чжан и я. В ноябре 2013-го мы основали Editas Medicine, получив от трех венчурных фирм финансирование в размере 43 миллионов долларов. Всего шестью месяцами позже Эммануэль стала соосновательницей другой компании, CRISPR Therapeutics, с начальным капиталом 25 млн, а в ноябре 2014-го на сцену вышла и третья компания – Intellia Therapeutics, с финансированием на первом этапе также 25 миллионов долларов. К концу 2015-го эти три компании собрали совокупно еще более полумиллиарда долларов инвестиций для исследований и разработок методов лечения множества заболеваний – от кистозного фиброза и серповидноклеточной анемии до миодистрофии Дюшенна и врожденной формы слепоты. И все – с использованием технологии CRISPR, которую впервые разработали и описали мы с Эммануэль.
Какими бы невероятными ни казались возможности применения CRISPR в медицине, все же требуются еще годы для того, чтобы эта технология “доросла” до клинических испытаний. А пока в ее исследование вовлекалось все больше и больше коллективов, так как в мировом научном сообществе быстро распространялась информация, что редактирование генов в живых клетках теперь можно осуществить всего за несколько дней. Многие эксперты прогнозировали, что CRISPR станет воплощенной мечтой ученых-биологов и позволит проводить эксперименты, о которых раньше можно было только мечтать. Я представляла себе, что это сделает технологию более доступной и она перестанет быть привилегией меньшинства. До CRISPR редактирование генов требовало сложных протоколов проведения, колоссального уровня научных знаний и умений и существенных финансовых вливаний, а еще это удавалось сделать лишь на нескольких видах модельных организмов. А ко времени моего визита в Гарвард даже в тех лабораториях, где раньше не работали с редактированием генов, уже применяли CRISPR.
Времена, когда упоминание CRISPR на семинаре или научной конференции вызывало по большей части непонимающие взгляды, давно прошли. Теперь казалось, что CRISPR буквально у всех на устах и его упоминают в каждом разговоре. И тем не менее это было еще только верхушкой айсберга.
Сидя в самолете Бостон – Сан-Франциско на обратном пути из той первой поездки в Кембридж, я уже видела на горизонте новую эру генетического “управления войсками” – эру, в которой CRISPR преобразит арсенал инструментов биолога, позволив ученым переписывать геном буквально любым образом, каким они пожелают. Из неудобочитаемого документа, с трудом поддающегося переводу, геном станет таким же податливым, как фрагмент литературного произведения в руках умелого редактора. Представляя себе эти новые широкие возможности, я с трудом верила, насколько быстро развились события с момента первых успешных попыток Мартина и Кшиштофа запрограммировать CRISPR на нарезку ДНК в пробирке. А теперь научное сообщество оказалось в стремительно расширяющемся круге света – и для него открывались всё новые невероятные прозрения о том, как работает CRISPR и как однажды его станут использовать для улучшения здоровья человека.
В экспериментах, опубликованных в статье в Science 2012 года, Мартин и Кшиштоф продемонстрировали нечто совершенно новое: что ассоциированный с CRISPR белок под названием Cas9, изолированный из плотоядных бактерий, взаимодействует с двумя молекулами РНК для нацеливания на подходящие двадцатибуквенные последовательности ДНК и их разрезания. РНК играет роль проводника, указывая “GPS-координаты” для атаки, а Cas9 действует как орудие для уничтожения цели. У бактерий, инфицированных вирусом, аппарат CRISPR был мобилизован для разрезания и уничтожения определенных молекул ДНК вируса – это было частью адаптивного иммунного ответа.
Виргиниюс Шикшнис и его коллеги осенью 2012-го опубликовали статью, сходную с нашей; она описывала функции белка Cas9, найденного в производящих йогурт бактериях, относящихся все к тому же роду стрептококков. Как и мы, литовские исследователи обнаружили, что Cas9 разрезает последовательности ДНК, “буквы” которых подходят к “буквам” РНК CRISPR. Но команда Шикшниса не смогла раскрыть важнейшую роль второй РНК (так называемой трансактивационной РНК, tracrRNA), которая, как удалось показать нам, была неотъемлемой частью реакции нацеливания на нужный участок ДНК и разрезания этой молекулы.
В своей статье мы максимально подробно описали молекулярные требования этой защитной системы и показали, насколько легко и просто можно настроить новые версии CRISPR для разрезания ДНК любым нужным образом. Мы сделали еще один шаг вперед и из направляющей РНК, состоящей у бактерий из двух отдельных молекул РНК (РНК CRISPR и трансактивационной РНК), сделали одну молекулу РНК-гида, тоже дающую Cas9 возможность находить и вырезать определенную последовательность ДНК. Мы также предположили, что эту систему защиты можно настроить на выполнение других функций в клетках – например, не на разрушение вирусной ДНК, а на прицельное редактирование ДНК самой клетки. Если мы поменяем двадцатибуквенный код РНК таким образом, чтобы он был комплементарен последовательности отдельно взятого человеческого гена, и затем введем Cas9 и новую направляющую РНК в клетки человека, CRISPR сделает хирургически точный разрез в гене-мишени, отметив это место как нуждающееся в репарации. Разрезав ДНК, CRISPR приведет клетку в полную боевую готовность, и она устранит внутри себя повреждения – но так, что мы сможем контролировать этот процесс.
Как мы предполагали, использование CRISPR в человеческих клетках подтвердит широту возможностей этого нового способа редактирования генов. И для этих предположений были веские причины. Наше собственное исследование показало, что белок Cas9 и его направляющая РНК очень избирательны и крепко связаны друг с другом, а это свидетельствует, что они без проблем найдут друг друга в человеческой клетке. А что касается отправки их в клеточное ядро, где расположена ДНК, то тут нам достаточно присвоить этим молекулам подходящий химический “адрес получателя”, и клетка сама сделает остальную работу за нас. До этого сотрудники многих лабораторий преуспели в переносе белков и молекул РНК от бактерий в клетки человека, и в нашем распоряжении было немало молекулярно-биологических инструментов, которые помогли бы CRISPR работать должным образом и за пределами его обычных мест обитания.
Нам оставалось только показать, что все работает именно так, как мы и предположили.
Мартин начал с переноса бактериальной ДНК, кодирующей Cas9, и синтезированной на основе информации от CRISPR РНК в две плазмиды – небольшие колечки ДНК, которые ведут себя как искусственные мини-хромосомы. Первая плазмида содержала генетические инструкции для направляющей РНК, а также отдельные инструкции для человеческих клеток, чтобы они тоже понемногу производили такие молекулы РНК. Во второй плазмиде находился ген cas9, но он был “гуманизирован”, чтобы его могли прочесть белок-синтезирующие аппараты человеческих клеток. Мартин также слил с геном cas9 еще два гена, часто используемых биологами: один, совсем небольшой, под названием клеточный сигнал ядерной локализации, направляющий белок в клеточное ядро, и ген зеленого флуоресцентного белка, благодаря которому каждая человеческая клетка, производящая белок Cas9, должна была засветиться зеленым, если на нее подействовать ультрафиолетом.
Соединив все эти молекулярные компоненты в единую систему, мы с Мартином намеревались превратить человеческие клетки в фабрики для производства CRISPR, которые, сами того не ведая, штампуют молекулы, запрограммированные на разрезание заданных частей собственного генома. И еще мы знали, что CRISPR не убьет человеческие клетки “шинкованием” ДНК, как он делает это с вирусами в бактериях, разрезая вирусную ДНК. ДНК человека (да и всех эукариотических организмов, если уж на то пошло) постоянно получает повреждения – например, это происходит, когда она подвергается воздействию канцерогенных веществ, ультрафиолета либо рентгеновского излучения. И чтобы приводить в порядок поврежденную ДНК, клетки разработали хитроумные системы репарации двуцепочечных разрывов в ней. Таким образом, в самом вероятном сценарии, если CRISPR вырежет нужный ген, клетка ответит на это просто “склеиванием” фрагментов молекулы ДНК обратно в единое целое, будто приварит одну металлическую трубу к другой. Ученые именуют этот процесс негомологичным соединением концов, ведь он, в отличие от гомологичного, не требует ДНК-шаблонов для починки молекулы. (Слово “гомологичный” происходит от греческого homologos, означающего “согласный с законом”.)
Ключевая особенность этого процесса репарации – заложенная в самой его природе небрежность. Как сварщик перед работой должен удостовериться, что у обеих труб очищены торцы, подлежащие сварке, так и клетке перед соединением фрагментов разорванной ДНК тоже нужно убедиться, что концы этих фрагментов чистые. Создание чистых концов иногда требует удаления или вставки нескольких “букв” ДНК, что приводит к изменениям состава генов после окончания процесса репарации. Это означает, что ген, скорее всего, изменится после “атаки” и вырезания его CRISPR и последующей починки за счет клетки. Этот неточный и порождающий ошибки способ репарации должен был обеспечить нам с Мартином простой метод выявления успешных попыток редактирования генов. Выбирая в качестве мишени конкретный ген и анализируя последовательность его нуклеотидов буква за буквой до воздействия CRISPR и после него, мы могли бы найти любой признак неаккуратной репарации, а это доказало бы, что CRISPR обнаружил свою цель и разрезал ее.
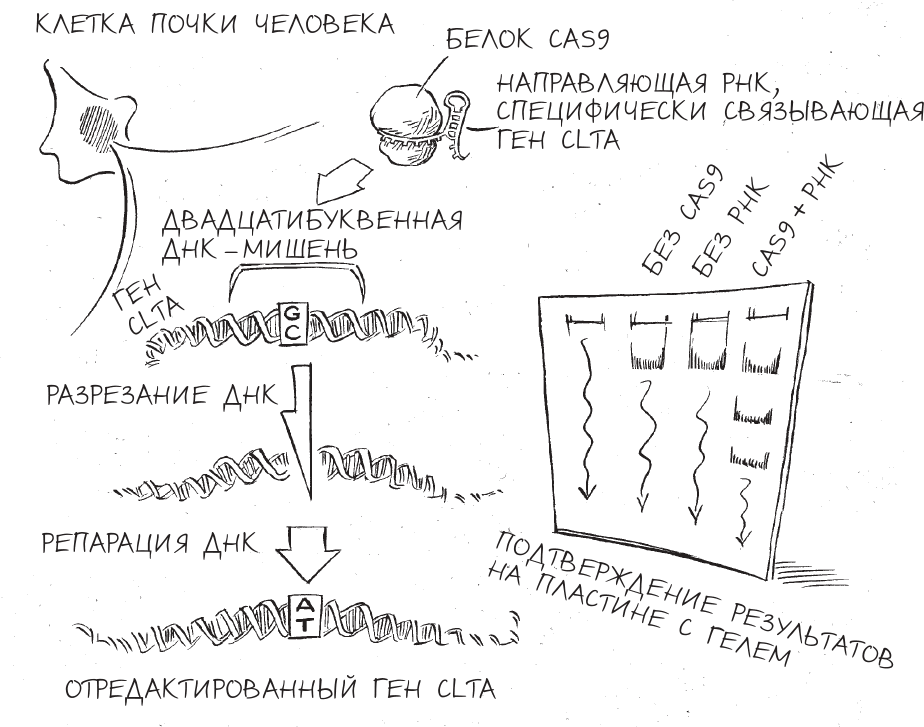
Мы с Мартином решили запрограммировать CRISPR таким образом, чтобы он атаковал человеческий ген, который называется ген легкой цепи клатрина A (CLTA) и задействован в эндоцитозе – процессе, который клетки используют для захвата питательных веществ и гормонов. Мы не изучали эндоцитоз, но ген CLTA уже был отредактирован по более старой технологии ZFN в лаборатории профессора Дэвида Друбина, которая тоже находится в Беркли. Поэтому мы знали, что редактирование этого гена возможно, а тестирование CRISPR на материале, на котором уже изучали ZFN, помогло бы нам выявить сходства и различия действия двух методов. Конечно, создание инструмента на основе ZFN для редактирования CLTA требовало нескольких месяцев работы и тесного сотрудничества с компанией, бесплатно предоставившей команде Дэвида ZFN (в то время разработка одного ZFN стоила непозволительно дорого – 25 000 долларов). В случае Мартина все было совсем иначе: ему потребовалось всего несколько минут, чтобы смоделировать на компьютере аналогичный вариант CRISPR, и синтезировать нужные молекулы можно было за несколько десятков долларов. В конце концов, это и есть одно из главных преимуществ CRISPR – то, что вам фантастически легко указывать в качестве мишени определенные гены. Все, что нужно было сделать, – выбрать желаемую двадцатибуквенную последовательность ДНК для редактирования и затем перевести ее в соответствующий двадцатибуквенный код РНК. Когда эта РНК окажется в клетке, она соединится с подходящей последовательностью ДНК по принципу комплементарности, и Cas9 разрежет ДНК.
Экспериментальной площадкой для нашего первого испытания редактирования генома должны были стать клетки линии HEK 293. Впервые полученные в 1973 году из клеток почки абортированного плода, клетки HEK 293 снискали популярность среди специалистов в клеточной биологии благодаря простоте их культивирования в лаборатории и тому, насколько легко они принимали в себя чужеродную ДНК. Когда мы смешали две плазмиды (одну – с генетическими инструкциями по производству Cas9 и вторую – с генетическими инструкциями по сборке направляющей РНК) в маслянистом растворе молекул, которые называются липидами, то мини-хромосомы (плазмиды) стали спонтанно захватываться жировыми пузырьками, очень похожими на капли жира на поверхности куриного бульона. После того как мы добавили эту смесь к культурам клеток HEK 293, жировые пузырьки должны были слиться с клеточными мембранами и выбросить содержащуюся в них ДНК внутрь клеток. Оказавшись в клетке, ДНК подверглась бы копированию, транскрипции и трансляции, в результате чего получатся белок Cas9 и направляющая РНК, специфически связывающая ген CLTA. Разрезающий ДНК аппарат должен был затем транспортироваться внутрь ядра, где находились наши целевые последовательности ДНК. Мы предполагали, что он найдет правильную двадцатибуквенную последовательность ДНК и разрежет ее. А клетка починит поврежденную ДНК таким образом, что мы это заметим.
Эксперименты Мартина тут же продемонстрировали, что мини-хромосомы действительно давали клеткам человеческой почки возможность производить компоненты CRISPR. Когда Мартин изучал эти клетки под микроскопом, он увидел, что значительная доля клеток светилась зеленым, что могло получиться только в результате образования Cas9, связанного с зеленым флуоресцентным белком. Собрав часть клеток и превратив их в кашицу для анализа различных содержащихся в них молекул РНК, Мартин также обнаружил, что клетки почки производили солидные количества направляющей РНК.
Перенос CRISPR из бактериальных клеток в человеческие сработал так, как мы ожидали, но оставался один резонный вопрос: редактирует ли CRISPR ДНК человека?
Мартин и Александра Ист-Селетски, молодая студентка, недавно присоединившаяся к проекту, измельчили еще некоторое количество клеток, выделили из них ДНК и проанализировали состав гена CLTA. Ошибки быть не могло: ген был отредактирован именно на участке, точно совпадающем с последовательностью направляющей РНК. Для неспециалиста результаты не выглядели впечатляющими – какие-то темные полоски на тонкой пластинке гелеподобного материала, – однако выводы из этих “полосок” и потенциальные применения этих выводов имели грандиозное значение.
Всего в несколько простых и хорошо отработанных стадий мы с Мартином выбрали произвольную последовательность ДНК в состоящем из 3,2 миллиарда “букв” геноме человека, спроектировали вариант CRISPR для ее редактирования и стали наблюдать, как крохотная машинерия выполняла то, на что была запрограммирована, – и не где-нибудь, а в живых человеческих клетках. Своими результатами мы подтвердили работу новой технологии, дающей ученым удивительную способность переписать код жизни с хирургической точностью и поразительной простотой. В мгновение ока CRISPR по своему развитию догнал технологии редактирования генома, исследование и разработка которых шли почти двадцать лет.
Редактирование ДНК в человеческих клетках c помощью CRISPR
Фактически в такой же спешке, как и шестью месяцами ранее, когда мы готовили публикацию с Кшиштофом и Эммануэль, мы написали текст научной статьи с изложением наших новейших результатов. Если наша первая публикация 2012 года содержала прямое указание на то, что CRISPR следует применить в качестве новой платформы редактирования генома в клетках, то во второй статье уже содержались четкие демонстрация и подтверждение внушительных возможностей этой недавно открытой системы.
Когда 2012-й подходил к концу, я ощущала заметную иронию, читая, что журнал Science, опубликовавший нашу статью о CRISPR всего за полгода до этого, поставил редактирование генома на вторую строчку списка прорывов года (первое место отдали бозону Хиггса), но упомянул в этом пункте более старую технологию, TALEN, открытую непосредственно перед началом нашей работы с CRISPR. Мне было интересно, какие еще сюрпризы CRISPR преподнесет научному сообществу.
К моему глубокому удовлетворению, первые две недели 2013 года ознаменовались публикацией еще пяти научных статей о CRISPR (не считая нашей), и все они описывали сходные эксперименты, в которых эту систему применяли для редактирования генов непосредственно в клетках – как мы и предсказали в 2012-м. И профессор МТИ Фэн Чжан, и гарвардский профессор Джордж Чёрч предварительно связывались со мной, чтобы сообщить о готовящихся публикациях. Статьи Чжана и Чёрча появились на сайте журнала Science в начале января, а чуть позже в том же месяце вышли и наша с Мартином статья, и три другие за авторством профессора Джин Су Кима из Сеульского национального университета, профессора Рокфеллеровского университета Лучано Марраффини и профессора Гарвардской медицинской школы Кита Джоунга.
Это было бурное время. Меня окрыляло то, что наша с Эммануэль работа, опубликованная предыдущим летом, вдохновила других ученых на проведение серий экспериментов, подобных нашим. Лишь позднéе содержание этих статей и даты их публикации начали скрупулезно разбирать и сопоставлять для обоснования той или иной позиции в патентных спорах о CRISPR – досадный поворот событий в истории, которая начиналась как сотрудничество исследовательских коллективов, в атмосфере неподдельного общего восторга по поводу того, что смогут дать человечеству наши исследования!
Сравнив все шесть статей, я осознала, что суммарно в этих экспериментах было отредактировано больше дюжины разных генов. Еще больше радовало разнообразие типов клеток, подвергшихся редактированию. Вдобавок к редактированию генома клеток эмбриональной человеческой почки механизм CRISPR был запрограммирован на то, чтобы разрезать ДНК в клетках человека, пораженных лейкемией, стволовых клетках человека, клетках нейробластомы мыши, бактериальных клетках и даже одноклеточных эмбрионах данио-рерио, популярного модельного организма для генетических исследований. CRISPR не просто демонстрировал отдельные признаки успешного применения; он показывал невероятную гибкость в использовании. Казалось, что любой ген можно сделать мишенью CRISPR, разрезать его и отредактировать, если в клетке присутствует белок Cas9, а направляющая РНК имеет участок, комплементарный двадцатибуквенному коду ДНК.
Ажиотаж вокруг CRISPR усилился в мае, когда лаборатория Рудольфа Йениша в МТИ сообщила о создании мышей с геномом, отредактированным с помощью CRISPR. Всего шестью годами ранее Нобелевскую премию по физиологии или медицине присудили нескольким ученым за разработку методов внедрения изменений в геном мышей – наиболее популярных модельных животных в изучении генетики млекопитающих. Более двадцати лет этот эффективный, но трудоемкий метод был наилучшим – и фактически единственным – способом воспроизведения в организмах мышей мутаций, вызывающих рак или другие болезни у человека. В 1974-м Йениш стал первым, кто создал трансгенную мышь, чьи клетки содержали чужеродный генетический материал, а пятнадцатью годами спустя он вновь вызвал сенсацию, одним из первых применив этот метод, удостоенный Нобелевской премии. А сейчас успех Йениша с CRISPR привлек внимание к новой технологии, которая не просто вытеснила старый подход, но и давала возможность без сучка и задоринки редактировать геномы других животных.
Предыдущий метод редактирования генома нуждался в эмбриональных стволовых клетках, масштабном обратном скрещивании, скрещивании различных линий животных и во множестве поколений мышей; нередко главным результатом какой-нибудь кандидатской диссертации становилось создание и описание всего одной линии генетически модифицированных мышей. Аналогичных результатов команда Йениша, используя CRISPR, достигла всего за месяц, применив простой четкий протокол – микроинъекции компонентов CRISPR непосредственно в одноклеточный эмбрион с последующей имплантацией эмбрионов с отредактированными геномами в матку самки. Более того, эти исследователи показали, что для отдельно взятого CRISPR не обязательно программировать только одну направляющую РНК; их может быть много, и тогда они способны нацеливать Cas9 на разрезание и одновременное редактирование нескольких последовательностей ДНК в эмбрионах мышей. Такой вариант одноступенчатого множественного редактирования генов раньше никогда не применяли на мышах.
Возможно, самое прекрасное в работе Йениша – по крайней мере, с точки зрения генетиков, работающих не с мышами, а другими животными, – так это то, что в ходе нее был открыт почти не требующий усилий способ редактирования генома едва ли не любого организма. И если изначальный метод с применением эмбриональных стволовых клеток применяли только на мышах, то теперь создавалось впечатление, что CRISPR можно ввести в любые половые клетки (яйцеклетки и сперматозоиды) или эмбрионы – и генетические изменения на выходе точно скопируются во все клетки и всегда будут передаваться будущим поколениям. В тот момент я не могла вообразить, что расширение области применения CRISPR на человеческие эмбрионы породит одну из самых сложных этических дискуссий вокруг CRISPR – и в эту дискуссию очень скоро затянет и меня.
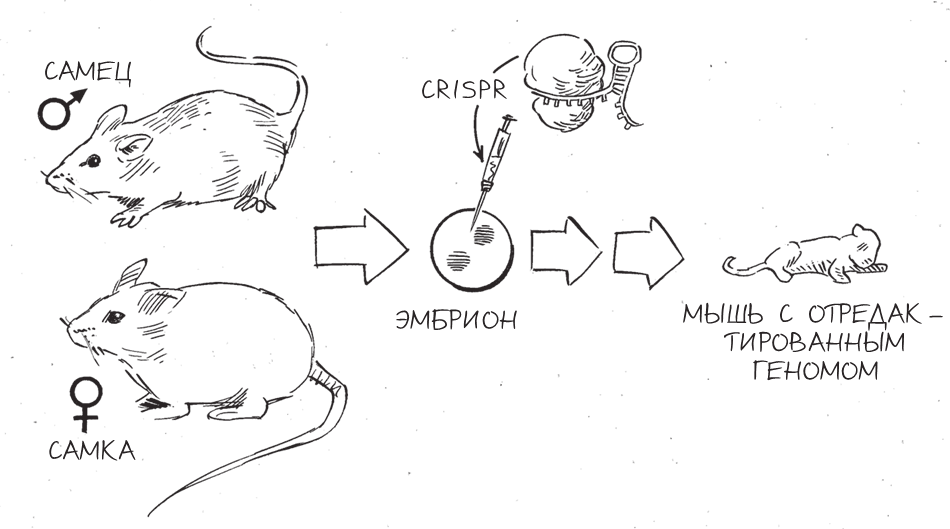
Создание мышей с геномом, отредактированным с помощью CRISPR
Летом 2013-го, восхищаясь, с какой скоростью распространяется метод CRISPR, я начала составлять список всех типов клеток и всех видов живых организмов, чьи геномы уже были отредактированы с использованием этой технологии. Сначала это было легко: в январе-феврале список включал в себя данио-рерио и культуры клеток бактерий, мышей и человека, потом к нему добавились дрожжи, живые мыши, плодовые мушки и микроскопические черви. К концу того же года в перечень вошли крысы, лягушки и гусеницы шелкопряда. За следующий год я добавила в список кроликов, свиней, коз, асцидий и обезьян – и после этого, как я честно признавалась слушателям на семинарах, где рассказывала о своем списке, потеряла счет. Наблюдение за тем, как молекулы белков и РНК, в природе служащие для защиты бактерий от вирусов, все шире используются для разрезания и точного редактирования последовательностей ДНК самых разнообразных животных, захватывало дух.
Однако метод находил применение не только на животных. Ботаники, пусть они сначала и двигались медленнее, тоже открывали для себя невероятный потенциал CRISPR в редактировании ДНК сельскохозяйственных и диких растений. Вал публикаций осенью 2013-го сообщал об успешном применении CRISPR для редактирования генома в главных пищевых культурах, таких как рис, сорго и пшеница, а год спустя список “отредактированных” растений расширился за счет сои, помидоров, апельсинов и кукурузы.
Перечень “откриспрованных” растений и животных продолжал расти. К 2016-му исследователи успели отредактировать ДНК едва ли не во всех организмах – от капусты, огурцов, картофеля и грибов до собак, хорьков, жуков и бабочек. Даже вирусам, этим биологическим объектам на границе живого и неживого – они неспособны самостоятельно размножаться, но тем не менее обладают наследственным материалом, – переписали геномы с помощью CRISPR, то есть той самой бактериальной системы, которая изначально сформировалась для их уничтожения.
Стоит отметить, что хотя взрослые Homo sapiens – это вид животных, к которым CRISPR будет применен в самую последнюю очередь, клетки человека подвергались экспериментам по редактированию генома чаще, чем клетки какого-либо другого организма. Ученые вводили CRISPR в клетки легкого, чтобы исправить генную мутацию, вызывающую кистозный фиброз, в клетки крови, чтобы устранить мутации, приводящие к серповидноклеточной анемии и бета-талассемии, и в мышечные волокна, чтобы избавиться от мутаций, служащих причиной миодистрофии Дюшенна. Исследователи использовали CRISPR для редактирования и исправления мутаций в стволовых клетках, которые впоследствии можно трансформировать практически в любые типы клеток, составляющие самые разнообразные ткани тела. А еще ученые отредактировали с помощью CRISPR тысячи генов в раковых клетках человека в попытке найти новые мишени для противораковых лекарств и новые методы лечения онкологических заболеваний.
Но если и было что-то более вдохновляющее, чем наблюдение за тем, как CRISPR используют едва ли во всех вообразимых организмах, так это свидетельства того, как расширяются сами границы редактирования генома. В 1980-х ученые довольствовались редактированием отдельных генов с эффективностью всего в несколько долей процента. К началу 2000-х доля успешных попыток выросла до нескольких (обычно не больше трех) процентов, плюс теперь стало возможно изменять гены еще парой новых способов. Но с появлением CRISPR редактирование генома стало давать столько разнообразных возможностей, что его начали называть геномной инженерией – этот термин отражает беспрецедентные возможности манипуляций с генетическим материалом, находящимся внутри живых клеток.
Применяя CRISPR к самым различным организмам, ученые разработали и доработали множество подходов к редактированию ДНК. В дополнение к простому разрезанию ДНК и вставке новых последовательностей в геном-мишень исследователи теперь могут выводить из строя гены, переставлять последовательности в генетическом коде и даже исправлять ошибки всего в одной “букве”, как и продемонстрировал Киран Мусунуру, когда я была у него в лаборатории. Эти достижения, в свою очередь, дали исследователям возможность проводить новые типы экспериментов на представителях царств растений и животных, включая наш собственный вид. Так что перед тем как продолжить рассказ о спектре применений редактирования генома, важно понять множество потенциальных применений этого невероятно многофункционального инструмента.
Весной 2014-го учитель шестого класса, в котором учился мой сын Эндрю, пригласил меня к ним на урок объяснить ученикам, что такое CRISPR. Я почла за честь это приглашение, но при этом волновалась: как же мне понятно рассказать о редактировании генома детям, у которых есть только самые базовые знания о ДНК?
Я решила принести с собой напечатанную на 3D-принтере модель белка Cas9 и его направляющей РНК, связанной с ДНК. Эта модель стала главным украшением моего кабинета: ее ярко-оранжевая РНК и бриллиантово-голубая ДНК сплелись с белоснежным белком в структуру размером с футбольный мяч; вместе их удерживали магниты. Я рассудила, что детали молекулярных механизмов в основе CRISPR будут сложны и неинтересны для школьников, и решила просто отдать им “футбольный мяч”, чтобы они, передавая его друг другу, смогли рассмотреть структуру вблизи.
Я недооценила любознательность школьников. Практически сразу же после того, как я отдала им модель, они нашли способ разорвать ДНК в месте, где ее разрезает Cas9, и поняли, как помещать ДНК внутрь системы CRISPR и извлекать ее оттуда. А я так волновалась, что не смогу объяснить им все эти сложные принципы!
Как я сказала ребятам, CRISPR можно представить себе как сделанные на заказ молекулярные ножницы, поскольку их основная функция – “садиться” на заданные двадцатибуквенные последовательности ДНК и разрезать обе цепи двойной спирали. Однако варианты результатов редактирования генома, которых могут добиться ученые, поразительно разнообразны. По этой причине CRISPR лучше сравнить не с ножницами, а со швейцарским ножом, множество функций которого обеспечивает одна и та же молекулярная машина.
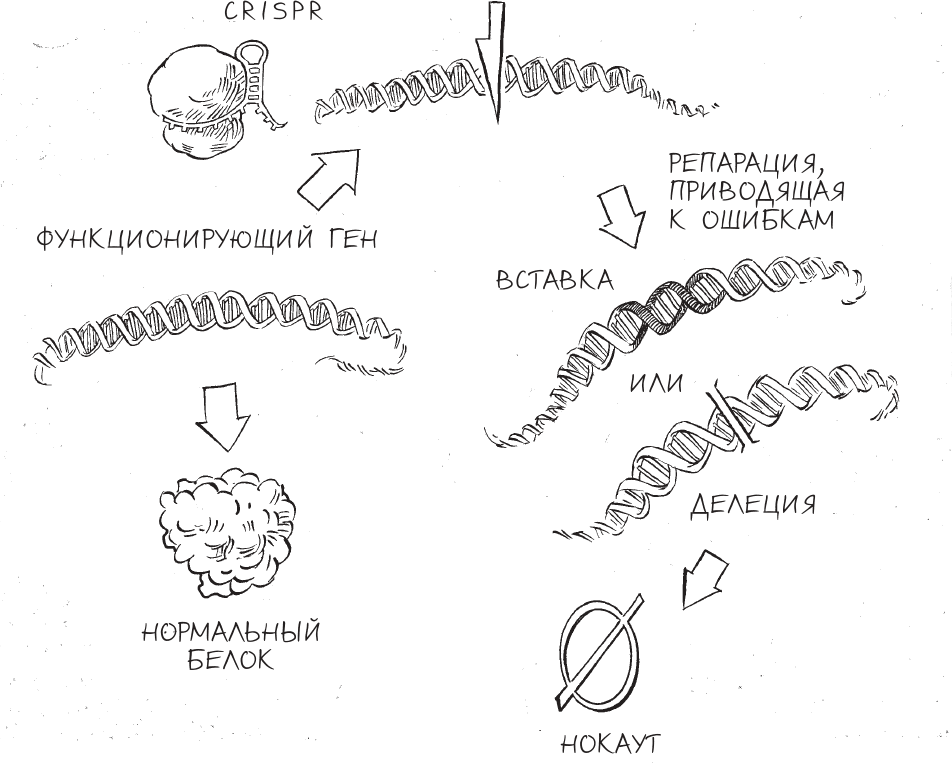
Простейший вариант применения CRISPR одновременно и наиболее популярный: систему используют, чтобы вырезать определенный ген и затем дать клетке возможность устранить повреждение повторным соединением цепей ДНК. Этот неточный и чреватый ошибками процесс оставляет явные следы – короткие вставки или делеции ДНК (инделы), стоящие по бокам от последовательности, вырезанной CRISPR. Даже несмотря на то, что ученые не в состоянии контролировать, как именно пройдет процесс репарации ДНК в каждом конкретном случае использования CRISPR, они понимают, насколько полезным может быть такой вариант редактирования генома.
В конце концов, гены – всего лишь носители информации, что-то вроде чертежей здания; цель редактирования генома состоит не в том, чтобы просто изменить чертеж, а в том, чтобы поменять форму здания, которое вы собираетесь построить. Во многих случаях это означает изменение структуры белков, которые кодируются генами и производятся клетками при экспрессии этих генов.
Экспрессия генов – это процесс, в ходе которого не имеющие значения по отдельности “буквы” ДНК дают начало функциональным белкам в соответствии с центральной догмой молекулярной биологии. Сначала в ядре клетки создается временная копия информации с ДНК, именуемая матричной РНК (или мРНК). Как и цепочка ДНК, мРНК представляет собой последовательность нуклеотидов, и она совпадает с таковой для ДНК, которую она воспроизводит (с единственным значимым отличием – тимины (Т) заменены на урацилы (У)). Матричная РНК выводится из клеточного ядра и доставляется к фабрике по производству белков под названием рибосома, а рибосома переводит информацию с основанного на четырех буквах (А, Г, Ц и У) языка РНК на язык белков, алфавит которого состоит из двадцати букв (различных аминокислот). Перевод производится согласно генетическому коду – шифру, в котором каждая тройка “букв” РНК, называемая кодоном, указывает рибосоме, какую одну аминокислоту ей добавить к уже имеющейся цепочке. (Поскольку различных кодонов 64, а аминокислот, которые надо закодировать, только 20, многие аминокислоты обозначаются несколькими кодонами, а три кодона служат сигналами остановки, обрывающими синтез белка.) Рибосома собирается на одном конце мРНК и, начиная с него, без пропусков читает один за другим кодоны в составе этой молекулы, добавляя необходимые согласно “правилам перевода” аминокислоты к растущему белку до тех пор, пока не достигнет противоположного конца мРНК; процесс во многом похож на сборку автомобиля на конвейере. Для корректной работы этой системы критически важно, чтобы рибосома работала только с правильной трехбуквенной рамкой считывания; даже минимальный сдвиг этой рамки способен привести к катастрофическим последствиям для процесса трансляции.
Чтобы лучше это понять, представьте себе, что из предложения “Собака тяпнула почтальона за ногу” убрали первую букву и заново разбили предложение на “слова” прежней длины. У вас получится бессмысленное “Обакат япнулап очтальоназ ан огу”. Если рибосома сделает нечто подобное при чтении генетического кода, она соберет на основе искаженного бессмысленного сообщения совершенно неправильную последовательность аминокислот. Ну а если, предположим, получившаяся каша из символов РНК содержит один из трех вариантов стоп-кодонов, процесс трансляции прервется раньше времени. Экспрессия генов нарушится.
Отсюда следует главное свойство CRISPR как средства редактирования генома: он может нарушить способность гена служить источником информации для создания функционирующего белка. Если в отредактированном CRISPR гене появится небольшая вставка или удаление (делеция), структура мРНК, которая была произведена на основе информации от этого гена, также будет нарушена. В большинстве случаев эти лишние или недостающие “буквы” нарушат четкую структуру элементов генетического кода, сгруппированного в тройки, так что белок окажется либо совершенно не таким, каким должен быть, либо, что гораздо вероятнее, вообще не синтезируется. В любом случае белок не сможет корректно выполнять свои функции. Генетики называют это явление “нокаут гена” (KO), по аналогии с боксом: ген тут успешно “вырубили”, и он больше ничего не способен сделать.
Нокаут генов с помощью CRISPR
Когда специалисты по генетике животных начинали использовать CRISPR, они собирались создать четко проявляющие себя генные нокауты. Одной из их излюбленных мишеней был ген под названием TYR. Он возник более полумиллиарда лет назад и широко распространен среди животных, растений и грибов; этот ген кодирует белок тирозиназу, участвующий в процессе синтеза меланина – важного пигмента. Мутации TYR у людей приводят к недостаточности тирозиназы и вызывают кожно-глазной альбинизм I типа – генетическое нарушение, для которого характерны дефекты зрения, бледная, слабо пигментированная кожа и красные глаза. Если CRISPR запрограммировать на редактирование мышиной версии гена TYR, то вызовет ли его действие альбинизм у мышей? В 2014 году коллектив ученых из Техасского университета спроектировал версию CRISPR, атакующую двадцатибуквенную последовательность ДНК в гене TYR, и ввел ее в оплодотворенные мышиные яйцеклетки. Развившиеся из них грызуны поразили ученых: хотя все их родители имели шерстку нормального темного цвета, многие мышата родились с красными глазами и абсолютно белой шкуркой. Такой результат можно было объяснить только мутациями в ДНК, нарушившими дешифровку гена TYR. Изменение цвета кожи, шерсти и глаз мышей было именно таким четким признаком нокаутирования гена, как того и хотели исследователи.
Хотя по результатам секвенирования ДНК всегда можно подтвердить факт редактирования генома, прелесть использования гена TYR в качестве мишени заключалась в том, что ученые могли увидеть результаты своих экспериментов воочию. Простой подсчет числа черных (тех, у которых редактирования генома не произошло) и белых (тех, чей геном оказался отредактирован) мышат дал удивительно точную оценку эффективности CRISPR. Кроме того, аналогичным способом можно было следить за изменением этой эффективности во времени, по мере того как в различных лабораториях оптимизировали строение и создание CRISPR-систем. В работе техасцев только 11 % потомства родителей, чьи зиготы были отредактированы, были полными альбиносами, и немалое количество мышат на фотографиях этих пометов были черно-белыми – и порой черного у них в шерсти было заметно больше, чем белого. Не прошло и года, как исследовательский коллектив из Японии повторил эти эксперименты с минимальными изменениями методики и добился эффективности в 97 %: шерсть тридцати девяти из сорока мышат сияла белизной, а пигментов в радужке не было. Всего за несколько недель ученые точно заданным образом навсегда изменили генофонд целого поколения мышей (и всех их будущих потомков) – таким образом, каким это никогда не задумывала природа.
Генные нокауты – лишь один из множества подходов к редактированию генома, которые ученые довели до совершенства с помощью CRISPR. Нередко генным инженерам требуется нечто более точное, чем неспецифическое внедрение мутаций в ген за счет случайных вставок или делеций нуклеотидов ДНК. В конце концов, главная цель редактирования генома, по крайней мере применительно к медицине, – это избавление от генетических заболеваний, абсолютное большинство которых вызывается мутациями, “выключающими” важные гены. В таких случаях генные нокауты не принесут пользы, так как у них уже есть неработающие гены – и именно они служат причиной проблем со здоровьем. Что необходимо ученым, так это способ выявлять отдельные ошибочно расположенные “буквы” ДНК, редактировать их и таким образом приводить состав генов в норму.
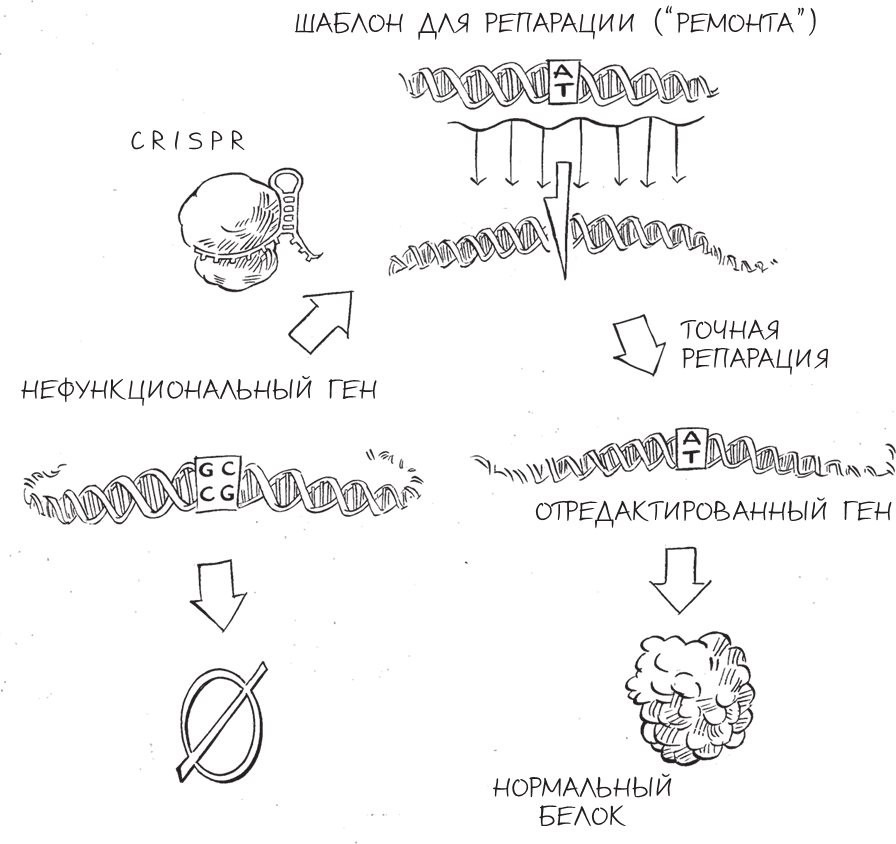
К счастью, клетки имеют молекулярные машины для осуществления второго типа репарации клеток, гораздо более точного и лучше поддающегося контролю, чем простое склеивание фрагментов разорванной ДНК. Вместо соединения отрезков ДНК, последовательности нуклеотидов в которых никак не связаны друг с другом, этот второй вариант репарации – цепь биохимических реакций, которую пионеры редактирования генома использовали в своих целях, – соединяет только отрезки ДНК, последовательности нуклеотидов которых частично совпадают. По причине такой избирательности процесс называют двумя синонимичными терминами: гомологичная рекомбинация и репарация, направляемая гомологией.
Гомологичная рекомбинация сходна с процессом сборки панорамного снимка из трех частично перекрывающихся фотографий. Чтобы в итоговом изображении они составляли единое целое, фотографу нужно правильно наложить бока центральной фотографии на правую сторону фото слева и левую сторону фото справа. Если середина панорамы вырезана или повреждена, фотографу достаточно взять дубликат центрального снимка и по описанному принципу восстановить панораму. А если изображаемый пейзаж в реальности изменился – например, там построили новый дом или срубили большое дерево, – фотограф в состоянии справиться и с этой ситуацией. Для этого ему нужно вставить новое центральное изображение взамен старого, используя тот же самый подход.
Получается, что ферменты внутри клетки выполняют аналогичные операции вырезания и вставки, но вместо панорамы у них ДНК. Способ репарации, о котором мы уже говорили, – соединение концов, иногда приводящее к ошибкам в последовательности нуклеотидов, – применяется, когда клетка сталкивается с такой серьезной и неотложной проблемой, как разорванная хромосома, и “на авось” заново соединяет разрезанные концы – подобно тому как фотограф склеивает панораму, в которой не хватает кусочка пейзажа. Однако когда у клетки есть и разорванная хромосома, и второй фрагмент ДНК, совпадающий с двумя разъединенными концами, – шаблон для починки, по функциям напоминающий дубликат центрального снимка из примера выше, – она выбирает лучший вариант: вставить фрагмент ДНК в разорванную хромосому, но таким образом, чтобы он без шва наложился на соответствующие концы. При реализации такой стратегии вредоносную генетическую мутацию в точке, куда нацелен CRISPR (или в непосредственной близости от нее), можно навсегда устранить, заменив новой, “здоровой” последовательностью ДНК. Пока исследователи снабжают клетку CRISPR шаблоном для репарации, последовательность которого совпадает с таковой для поврежденного гена, клетка будет добросовестно использовать выданные ей запчасти для устранения повреждений.
Гомологичная рекомбинация с CRISPR
Помимо тонкой настройки генов путем “небрежной” (негомологичной) или точной (гомологичной) репарации, ученые приспособили CRISPR для вырезания или переворачивания больших фрагментов ДНК, что позволяет изменять гораздо более крупные участки генома. В рамках этого метода используется готовность клеток “пойти на все”, лишь бы восстановить целостность хромосомы. Вооружив Cas9 двумя разными направляющими РНК, исследователи могут запрограммировать CRISPR на разрезание хромосомы в двух соседних генах; клетка справляется с этим повреждением, собирая хромосому заново по одному из трех сценариев.
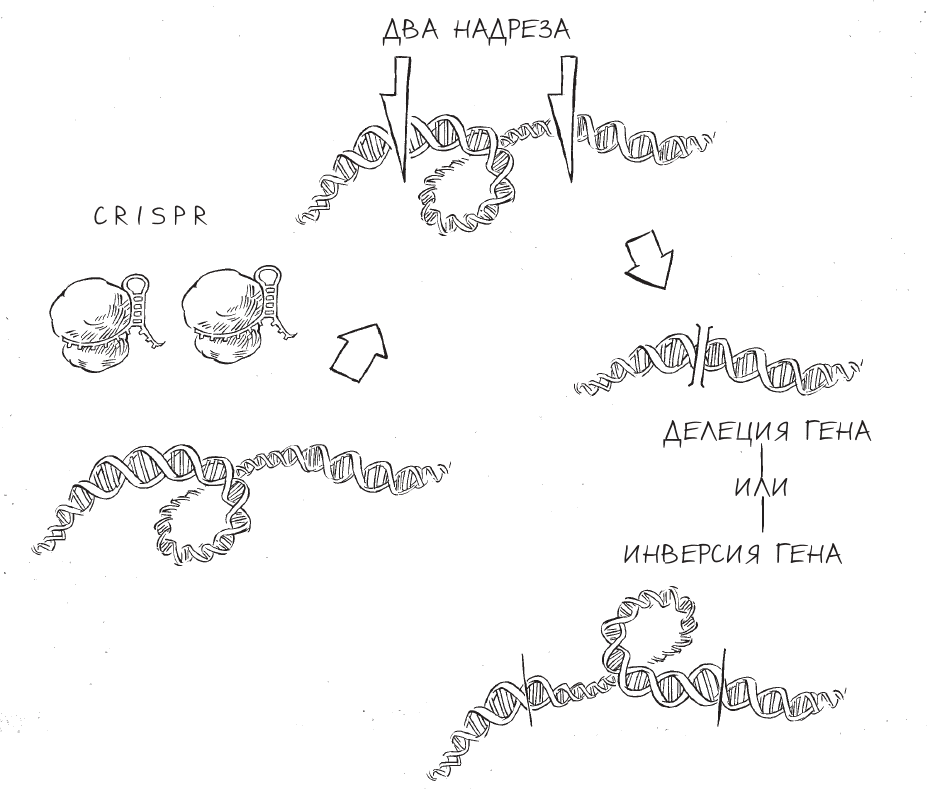
Создание инверсий или делеций в генах с помощью CRISPR
В этой ситуации клетке нужно соединить в два раза больше концов разорванных молекул, чем в случаях, которые мы рассматривали раньше. Первый способ это сделать – на максимальной скорости, одновременно, “склеить” молекулу сразу в двух местах. Впрочем, часто отрезок времени, в течение которого репарацию можно провести таким путем, очень незначителен, поскольку молекулы в клетке непрерывно хаотично перемещаются. Если участок ДНК между двумя точками, в которых молекула была разрезана, “уплывет” куда-нибудь в сторону, клетка будет действовать согласно плану Б – и соединит концы порванной ДНК без разделяющего их фрагмента, который перестал быть доступным. Этот способ репарации можно сравнить с методом, с помощью которого режиссеры монтажа раньше удаляли ненужные сцены из фильма. Они просто разрезали пленку в двух местах – перед началом и по завершении ненужной сцены, – затем запись этой сцены выкидывали, а оставшиеся два конца пленки склеивали один с другим.
Третий способ репарации предполагает инверсию вырезанного фрагмента ДНК. В данном случае вырезанная часть ДНК перемещается таким образом, что остается примерно на том же месте, но переворачивается на 180 градусов, так что ее передний конец теперь находится там, где располагался задний, и наоборот. Те же ферменты, что способствуют соединению концов, “вклеят” недостающий кусочек в ДНК невзирая на его ориентацию.
Существует и другая область применений CRISPR, не имеющая ничего общего с редактированием генов. Вместо того чтобы пользоваться возможностью CRISPR разрезать ДНК, ученые буквально ломают механизм – нарочно. Специально “выключая” молекулярные ножницы, они могут управлять геномом дистанционно – не внося перманентные правки в ДНК, а изменяя то, как эта ДНК считывается, транслируется и экспрессируется. Прямо как невидимые ниточки дают “кукловоду” практически полный контроль над движениями и действиями “марионеток”, эта нережущая версия CRISPR позволяет ученым управлять поведением клетки, тем, что она производит.
Основы этого “марионеточного управления” фактически были заложены в ходе ранних экспериментов с CRISPR-Cas9, проводившихся у меня в лаборатории. Белки обычно состоят из сотен или тысяч “кирпичиков” – аминокислот, большинство которых служит для придания молекуле определенной формы, а способность фермента катализировать определенные химические реакции определяется функциональными группами всего нескольких из множества входящих в его состав аминокислот. Когда Мартин Йинек впервые определял биохимические функции Cas9, он показал, какие конкретно аминокислоты расщепляют химические связи между звеньями каждой из цепей двойной спирали ДНК. Провоцируя такие мутации в гене сas9, чтобы эти аминокислоты заменились на другие, он создал версию соответствующего белка, абсолютно утратившую способность разрезать ДНК, но, что примечательно, по-прежнему способную взаимодействовать с направляющей РНК и прочно соединяться с комплементарными последовательностями ДНК. Мы разрушили структуру каталитического центра фермента, но инактивированный Cas9 все же сохранил некоторые из своих функций: он мог находить и фиксировать конкретные последовательности ДНК в геноме, только не был способен их разрезать. Похожую работу опубликовал Виргиниюс Шикшнис с коллегами.
Неподалеку от нас, в Калифорнийском университете в Сан-Франциско, организовывал собственную лабораторию Стэнли Ки, получивший степень доктора философии в Беркли. В ходе совместной работы с Джонатаном Вайссманом и Уэнделлом Лимом (оба они были профессорами Калифорнийского университета в Сан-Франциско) Стэнли продемонстрировал, что дезактивированная версия CRISPR тоже может найти применение в управлении геномом. В отличие от обычной версии, редактирующей ДНК, версия Стэнли Ки позволяла ученым вносить временные изменения в геном: эти изменения не затрагивали последовательность нуклеотидов, но при этом влияли на то, каким образом экспрессируется генетическая информация. В частности, Ки преобразовал CRISPR в аппарат контроля экспрессии генов, способный “включать” и “выключать” их, выкручивать их чтение на максимум или опускать до минимального уровня – примерно как реостат регулирует яркость свечения лампочки.
Дезактивированная система CRISPR работает подобно молекулярной вьючной лошадке. Ученые создали систему из Cas9 и направляющей РНК с присоединенным к ней грузом из молекул определенных белков, которая доставляет эти белки к выбранным генам-мишеням вместо того, чтобы разрезать данные гены. Эта “белковая посылка” включает в себя молекулы, влияющие на экспрессию генов, – эти молекулы либо повышают интенсивность этой экспрессии, либо “гасят” ее (напоминаю пример с реостатом).
Контроль экспрессии генов – сложный процесс, состоящий из множества частично пересекающихся сигнальных путей и определяющий, когда и с какой скоростью генетическая информация в форме ДНК преобразуется в белки. Вероятно, этот процесс не менее важен с биологической точки зрения, чем та наследственная информация, с которой этот контроль работает. Почти все клетки из тех пятидесяти триллионов, что слагают наше тело, несут один и тот же геном, и тем не менее их формы, размеры и функции невероятно разнообразны – равно как ткани и органы, которые эти клетки формируют. Некоторые клетки атакуют патогены (возбудителей заболеваний) в крови, другие сокращаются и расслабляются, чтобы перекачивать кровь по телу, а какие-то хранят воспоминания в нервной системе; единственное, что различает клетки иммунной системы, волокна сердечной мышцы и клетки головного мозга, – это паттерны экспрессии генов, сформировавшиеся при образовании этих клеток из их предшественников. Более того, генетические мутации, вызывающие рак и прочие заболевания, так губительно действуют на организм не потому, что они полностью дезактивируют определенные гены, а потому, что из-за этих мутаций гены неправильно экспрессируются.
Возможность активировать экспрессию генов или тормозить открывает почти столько же перспектив, как и само их редактирование. Представьте себе, что клетка – это сложнейшая в мире симфония, написанная для более чем двадцати тысяч инструментов. В здоровой, нормально функционирующей клетке голоса этих инструментов точно сбалансированы; в клетках, которые инфицированы или переродились в раковые, этот баланс нарушен: некоторые инструменты звучат слишком громко, а некоторые – слишком тихо. Некоторые способы редактирования генома слишком грубы и недостаточно точны для возвращения симфонии к нормальному звучанию: вместо того чтобы настроить тот или иной инструмент, они его выкинут или заменят на другие. Дезактивированная система CRISPR дает возможность настроить любой инструмент оркестра – то есть генома – с большей чувствительностью.
Вооруженные полным набором инструментов CRISPR, ученые теперь могут практически полностью контролировать и состав генома, и работу отдельных его генов. Независимо от того, каким способом это делать – грубым ли соединением концов или точной гомологичной рекомбинацией, делать один надрез, несколько или вообще обойтись без них, – спектр возможностей невероятен. Причем скорость, с которой совершенствуется этот инструмент, не падает. Специалисты в области генной инженерии создали флуоресцентные версии CRISPR, позволяющие увидеть трехмерную организацию генома в клетках; варианты, мишенью которых служат мРНК вместо ДНК, что открывает доступ к особому способу контроля генов; версии, вводящие в геном опознавательные метки – “штрихкоды”, дающие исследователям возможность записывать историю событий в клетке прямо в ДНК на ее языке; и так далее и тому подобное. Нередко кажется, что спектр применения CRISPR в качестве инструмента генной инженерии ограничен только коллективным воображением человечества. В свете невероятной гибкости CRISPR не побоюсь предположить, что эта система станет основным инструментом работы для всех биологов независимо от их специализации.
Сказать, что мне было приятно видеть все эти невероятные технические возможности, плод работы сначала нескольких десятков, потом нескольких сотен, а затем и тысяч ученых, – значит ничего не сказать. Любой изобретатель и инноватор знает, что ощущение удовлетворения от того, что твою разработку стали использовать другие, ни с чем не сравнится. Кроме того, повсеместное использование технологии – это наилучший и самый быстрый способ отточить и переосмыслить ее.
Неожиданный взрывной рост числа исследований с применением CRISPR частично был следствием широчайших возможностей механизма, а частично – фантастическим количеством доступных его вариантов. После того как инструментарий CRISPR был расширен, ни одна “буква” ДНК в геноме, ни один ген или группа генов не остались недоступными для этой системы. Как я покажу в следующих главах, использование инструментов CRISPR в приложении к человеческому организму обещает революцию в лечении рака и генетических заболеваний, а его применение к растениям и животным дает возможности усовершенствовать производство пищи, уничтожить возбудителей различных заболеваний и даже возродить вымершие виды. Неудивительно, что всего через несколько месяцев после публикации первых сообщений о редактировании генома с помощью CRISPR журнал Forbes прогнозировал, что эта технология изменит индустрию биотехнологий навсегда.
Но настоящая причина, по которой CRISPR ворвался на биотехнологическую сцену с такой огромной скоростью, снося все на своем пути, – это низкая стоимость и простота технологии. CRISPR наконец сделал редактирование генома доступным для всех ученых. Более ранние инструменты в этой области – главным образом ZFN и TALEN – было трудно проектировать, да и большинству исследователей они были не по карману. По этой причине многие лаборатории, включая мою собственную, не слишком стремились подключаться к исследованиям на тему редактирования генома и разбираться со всеми сопутствующими трудностями. А в случае CRISPR, напротив, лаборатория может легко спроектировать такую его версию, чтобы мишенями для нее служили конкретные гены, подготовить требуемый белок Cas9 и направляющую РНК и провести эксперименты самостоятельно по стандартным методикам, и все это в течение считанных дней и безо всякой посторонней помощи. Единственное, что понадобится на старте, – копия изначальной искусственной хромосомы (плазмиды), содержащей CRISPR. Но эту потребность с лихвой удовлетворила некоммерческая организация Addgene – весьма успешное и непрерывно расширяющееся хранилище плазмид и одновременно площадка для их покупки и продажи.
Addgene – это как Netflix, только для плазмид. Как только Мартин и я разослали нашу статью о CRISPR по научным журналам, мы отправили его плазмиды на хранение в Addgene – подобным образом киностудии выдают Netflix лицензию на прокат своей продукции. Многие научные лаборатории, производящие плазмиды с CRISPR, поступают так же. Addgene ведет тщательный учет плазмид, которые хранит, размещает информацию о них и их характеристиках у себя на сайте и синтезирует тысячи копий, чтобы все нуждающиеся могли их купить. Стоимость для исследовательских лабораторий в 2016 году – всего шестьдесят пять долларов за плазмиду. Снизив нагрузку на производителей плазмид и удовлетворив запросы всех нуждающихся, Addgene помог обеспечить ситуацию, в которой все лаборатории в мире, и исследовательские, и некоммерческие, могут получить нужные для их конкретных исследований материалы, включая необходимые для работы с системой CRISPR. Только за 2015 год Addgene отправил примерно шестьдесят тысяч посылок с ассоциированными с CRISPR плазмидами ученым более чем из восьмидесяти стран.
Компьютеры тоже способствовали тому, что редактирование генома стало легким как никогда. Разнообразные пакеты программ используют продвинутые алгоритмы, включающие все подходящие принципы проектирования, в том числе эмпирические данные из научной литературы о том, какие направляющие последовательности работают в данном случае лучше остальных. У исследователя появился доступ к автоматизированному одностадийному методу сборки именно той версии CRISPR, которая наиболее всего подходит для редактирования того или иного конкретного гена. Эти алгоритмы не сделали ученых более ленивыми; напротив, они обеспечили возможность проведения технически наиболее сложных экспериментов по редактированию генома – проведения полногеномных скринингов, в которых CRISPR используют для редактирования каждого гена в составе генома.
Сегодня благодаря этим свойствам CRISPR начинающий ученый с самыми базовыми навыками может полностью провести исследование, которое всего несколько лет назад было невозможно даже представить. Это уже стало общим местом нашей молодой области науки: то, что еще не так давно требовало долгих лет работы в лаборатории с современным оборудованием, теперь может за несколько дней выполнить ученик старших классов. Некоторые эксперты посчитали, что с доступными в настоящее время инструментами любой может организовать собственную CRISPR-лабораторию всего за две тысячи долларов. Другие специалисты прогнозируют расцвет биохакерства – пришествие любителей, исповедующих философию “сделай сам”, увлеченных энтузиастов биотехнологий, которые будут экспериментировать с CRISPR-редактированием генома у себя дома. CRISPR даже стал звездой краудфандинговой кампании, в ходе которой стартап, намеревавшийся производить и распространять наборы для самостоятельного редактирования генома, собрал существенно больше 50 000 долларов. Теперь инвесторы проекта за 130 долларов получают “все, что нужно для проведения точного редактирования генома бактерий в домашних условиях”.
CRISPR сделал редактирование генома доступным массам: он в состоянии перевести это полумагическое занятие в разряд хобби или занимательного ремесла, нечто вроде домашней пивоварни (кстати, редактирование генома дрожжей для получения пива с новыми вкусами – одно из крайне интересных и неожиданных применений CRISPR, о котором мне стало известно). Во многих смыслах это здорово – но вместе с тем стремительное распространение настолько мощного инструмента отчего-то тревожит.
Повышение доступности CRISPR ускорит процесс исследований и разработок, который я описала в этой главе, но эта же доступность приведет к таким применениям этой технологии, к которым люди пока не готовы, – и эти применения не ограничатся стенами лабораторий. Ученые по всему миру уже используют CRISPR в клетках самых разных организмов таким образом, какого никто себе и представить не мог; не за горами аналогичные манипуляции с геномом человека.
Как нам вообще сопоставить минусы и плюсы от взлома нашего собственного генетического кода? Сможем ли мы договориться между собой, в каких случаях уместно использовать CRISPR, и сумеем ли мы предотвратить злоупотребления этим инструментом?
Доступный нам сегодня уровень технологий изменения генома предполагает уровень ответственности, к которому мы, к сожалению, абсолютно не готовы. В следующей части книги я опишу несколько дилемм, возникших вследствие CRISPR-революции, а также невероятных возможностей, источником которых она послужила. Точная оценка опасностей, которые неизбежно возникнут в процессе применения такой технологии, как CRISPR, а также степени ответственности, которая потребуется, чтобы использовать ее возможности во благо человечества и планеты, – это будет сложнейший экзамен. Но мы обязаны его сдать: иного варианта у нас просто нет.
Назад: Глава 3 Взламывая код
Дальше: Часть II Задача

