Книга: Загадки сна
Назад: 3 Теории сна. Зачем терять время на сон?
Дальше: 5 Сон и биоритмы. Товарищ ли «сова» «жаворонку»?
4
Механизмы сна. Можно ли выспаться впрок?
Можно ли заснуть летаргическим сном? Сети мозга. Что качается на качелях Сейпера? Мозговые педали газа и тормоза. Почему орексин называют гипокретином? Внутренние часы мозга. Как замедлить быстрый сон? Почему академический час составляет 45 минут? Гипнотоксин, или «сонный яд». Как выспаться после ночного дежурства?
Головной мозг человека и высших животных делится на три части – передний, средний и задний. К переднему мозгу относятся большие полушария – наиболее развитый у млекопитающих отдел мозга, а также межуточный (промежуточный) мозг. Сами нервные клетки (нейроны) сосредоточены преимущественно на поверхности полушарий (это так называемая кора мозга), но также присутствуют и в глубинных отделах (полосатом теле). Большая часть объема полушарий представлена не нейронами, а их отростками, имеющими более светлый оттенок, чем сами нейроны. Поэтому говорят о сером веществе (скоплениях тел нейронов) и белом веществе (отростках нейронов, образующих проводящие пути). В полушариях головного мозга выделяют доли (лобные, височные, теменные, затылочные). Нейроны лобных долей мозга отвечают за организацию движений (первичная двигательная кора), обеспечивают когнитивные функции, такие как планирование и память, формирование потребностей (влечений), участвуют в организации речи. В теменных долях находится центр чувственного восприятия (первичный центр чувствительности) и центр практической деятельности (обеспечивает способность к выполнению целенаправленных двигательных актов). Височные доли мозга отвечают за слух и восприятие речи. В глубинных отделах височной доли расположены гиппокамп, обеспечивающий процессы запоминания, и миндалина – центр формирования эмоций. В затылочных долях полушарий мозга расположен зрительный центр.
Межуточный мозг находится в глубине полушарий переднего мозга и представлен таламусом и гипоталамусом. Таламус, или зрительный бугор, является местом переключения чувствительных путей (можно сказать, что это релейная станция, где импульсы «перескакивают» с одного чувствительного нейрона на другой), он также участвует в процессах психической деятельности и сна. Гипоталамус представляет собой небольшую область мозгового вещества в нижней части 3-го желудочка (он образует его дно и стенки). Несмотря на очень скромные размеры, гипоталамус регулирует почти все жизненно важные функции организма – температуру тела, кислотно-щелочной баланс, пищевое поведение, репродукцию, чередование биологических ритмов, в том числе и сна; также он участвует в процессах запоминания и эмоциональных реакциях.
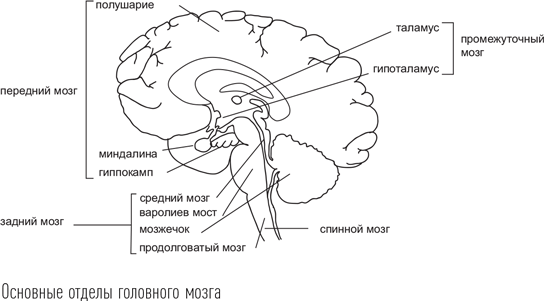
Задний мозг представлен мозжечком и стволом мозга. Мозжечок обеспечивает регуляцию двигательной активности, синхронизирует импульсы, идущие к различным мышцам между собой, для того чтобы результатом стало целенаправленное действие. К заднему мозгу относится и ствол мозга. В стволе проходят пути от всех отделов мозга к нижележащим органам и мышцам. Кроме этого в нем расположены ядра всех нервов головы (черепно-мозговые нервы), некоторые центры сна, дыхательный, сосудодвигательный и рвотный центры.
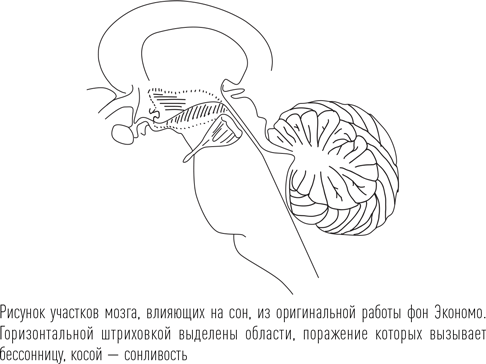
Первые исследования локализации мозговых центров, относящихся к состоянию сна, были проведены австрийским ученым Константином фон Экономо. В 1915–1926 гг. в Европе свирепствовала эпидемия летаргического энцефалита. Это заболевание проявлялось высокой температурой, головной болью, двоением в глазах, сонливостью или, наоборот, отсутствием сна. До половины людей, заболевших этим энцефалитом, погибали, почти у всех оставшихся в живых (80 %) в дальнейшем развивалась болезнь Паркинсона. Возбудитель этого заболевания так и не был выявлен, до настоящего времени отдельные случаи эпидемического энцефалита встречаются, но очень редко. Константин фон Экономо подробно описал клиническую картину этого заболевания и изучил мозг людей, погибших от него. Он обратил внимание на то, что у людей, в клинической картине которых доминировала бессонница и умерших в итоге от энцефалита, была поражена определенная область переднего гипоталамуса. Те же из больных, кто, наоборот, в разгар болезни все время спал (находился в летаргическом состоянии), имели поражение в области места соединения ствола мозга с полушариями. У пациентов со вторым типом клинической картины заболевания почти всегда нарушались и движения глаз, поэтому ученый назвал эту форму сомнолентно-офтальмоплегической (по-гречески офтальмо – глазной, плегия – поражение). Фон Экономо предположил, что сон вызывается работой мозгового центра, который находится в области переднего гипоталамуса, а в верхней области ствола мозга расположен центр, препятствующий засыпанию. Там же расположены и центры, управляющие движениями глаз.
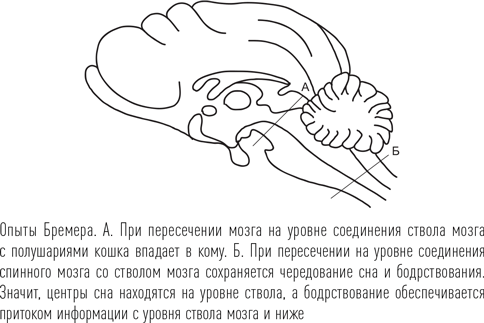
Опираясь на наблюдения Константина фон Экономо, ученые провели серии опытов на животных, чтобы подтвердить существование центра сна. В 1924 г. швейцарский физиолог Вальтер Гесс осуществлял стимуляцию таламуса и гипоталамуса кошек электрическим током: раздражение таламуса слабым током вызывало у них сон, а сильным – возбуждение. Кроме того, исследователи активно искали подтверждение существования центра бодрствования в верхней части мозгового ствола. В 1935 г. бельгийский нейрофизиолог Фредерик Бремер впервые представил экспериментальное доказательство существования системы активации мозга, организованной по восходящему типу (т. е. электрические сигналы в ней направляются с нижних отделов мозга к верхним), продемонстрировав, что рассечение ствола мозга на уровне соединения полушарий мозга со стволом у наркотизированной кошки вызывает кому. Бремер предположил, что возникающее при этом снижение «мозгового тонуса» происходит из-за прерывания восходящего сенсорного притока, т. е. результаты его исследования подтвердили не столько существование центра бодрствования, сколько наличие целой системы, которая доносит до мозга информацию о состоянии организма и таким образом поддерживает мозг в активном состоянии. Перерезав у животного мозг еще ниже, между стволом мозга и спинным мозгом, Бремер обнаружил, что кошка продолжала сохранять периоды сна и бодрствования: это означало, что система, регулирующая сон, расположена в пределах ствола мозга.
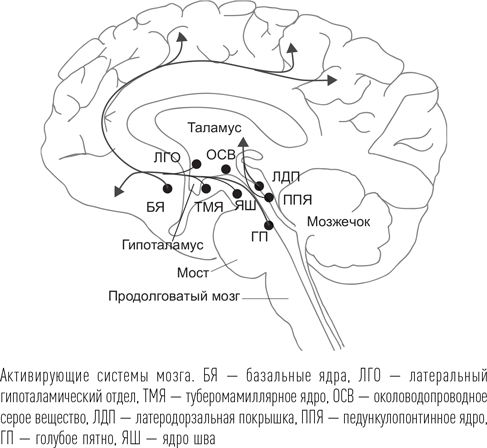
В 1949 г. американский исследователь Гораций Мэгун и итальянский ученый Джузеппе Моруцци показали, что неполное повреждение в верхних отделах ствола приводит к возникновению сонного состояния, в то время как электрическая стимуляция этой области сопровождается пробуждением животного и появлением на ЭЭГ характерной картины бодрствования. Речь шла уже о существовании не одного центра бодрствования, а целой группы центров в пределах ствола мозга, обладающих активирующим воздействием на мозг. Ученые назвали обнаруженные скопления нейронов «ретикулярной активирующей системой» (ретикулярной – потому что на анатомических препаратах после окрашивания в этой зоне обнаруживался похожий на сеть (по-латыни rete) рисунок, образованный проходящими как в продольном, так и в поперечном направлении отростками нейронов).
Французский ученый Мишель Жуве продолжил поиски центров сна в пределах ствола мозга и в 1960-е гг. провел серию блестящих экспериментов на животных, позволивших обнаружить отдельный центр парадоксального сна в верхних отделах ствола мозга и расположенное ниже скопление нейронов, ответственное за выключение мышечной активности в этот период. Кошка с поврежденной областью «мышечного торможения» во время парадоксального сна начала демонстрировать свои сновидения: сначала она спокойно лежала, затем подняла голову, встала и начала ходить, затем стала совершать лапой движение, как будто что-то трогала. При этом глаза ее были полузакрытыми, а на ЭЭГ отчетливо выявлялась активность, присущая парадоксальному сну.
В наше время в лаборатории Клиффорда Сейпера в Бостоне было показано, каким образом центр медленного сна, расположенный в переднем гипоталамусе, «запускает» сон, как этот центр сна взаимодействует с другими нейронами, обеспечивающими жизненные функции организма, и как происходит переключение с медленного сна на быстрый (так называемая модель качелей Сейпера). Согласно этой теории, наступление сна или бодрствования определяется сложным взаимодействием нескольких центров в головном мозге, одни из которых относятся к системе поддержания бодрствования (ретикулярная активирующая система), другие – к системе генерации сна (центры гипоталамуса, ствола мозга и прочие, всего их насчитывается восемь).
Состояние бодрствования обеспечивается постоянным притоком электрических импульсов к нейронам коры головного мозга. Это помогает им поддерживать достаточный для генерации электрической активности уровень деполяризации (в норме для того, чтобы нейрон сохранял электрическую активность, разность потенциалов на его внутренней и внешней мембранах должна составлять 70 мВ – потенциал покоя). Благодаря постоянному притоку возбуждения со стороны центров активирующей системы на мембране большинства нейронов поддерживается потенциал на 5–10 мВ ниже потенциала покоя, что облегчает им достижение порога, при котором происходит электрический разряд – потенциал действия (обычно этот порог составляет –55 мВ). В состоянии сна нейроны коры мозга тоже работают, также достигают порога возбуждения, после которого следует электрический разряд, но сделать это им оказывается значительно труднее.
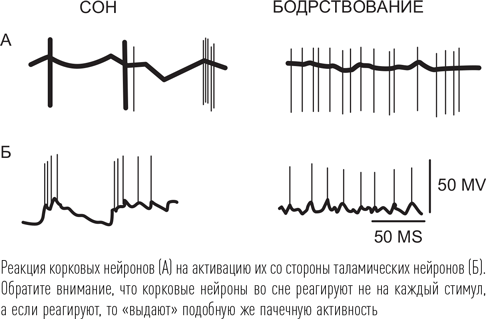
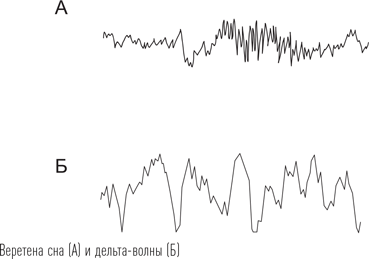
Готовность нейронов коры к генерации потенциала действия обеспечивается трехнейронной сетью, открытой канадским нейрофизиологом Мирчей Стериаде. Согласно его теории, с наступлением сна изменяется потенциал покоя не только у нейронов коры, но и у стимулирующих их нейронов таламуса – таламокортикальных нейронов. Также во сне изменяется активность и регулирующих их действие ретикулярных нейронов, расположенных там же, в таламусе. Эти изменения приводят к тому, что характерная для бодрствования «правильная» спайковая (пиковая) электрическая активность корковых нейронов (грубо говоря, один стимул – один ответ) после засыпания сменяется другими видами активности. В неглубоком медленном сне корковые нейроны реагируют не на все стимулы, поступающие со стороны таламокортикальных нейронов, при этом происходит своего рода фильтрация сигнала. Наконец, когда корковые нейроны реагируют на стимул, то происходит сразу несколько разрядов подряд, формируя на ЭЭГ картину «веретена сна» – вспышки более быстрой, чем фоновая, активности в диапазоне 12–14 Гц характерной веретенообразной формы. При дальнейшем углублении сна нейроны коры начинают работать слаженными ансамблями, практически не зависящими от внешних стимулов, порождая гигантские медленные волны, частота которых составляет 0,5–4 Гц, так называемые дельта-волны. Поэтому глубокий медленный сон также называют дельта-сном.
Стимуляция коры мозга нейронами активирующих зон осуществляется при участии медиаторов – биологически активных веществ различной химической структуры, которые выделяются в синаптическую щель, а затем, соединяясь с рецепторами следующего (постсинаптического) нейрона на другой стороне синапса, вызывают изменение электрической возбудимости последнего. Нейроны различных активирующих систем обладают собственными медиаторами. Нейроны, вырабатывающие медиатор определенного типа, обычно располагаются рядом, скоплениями по несколько десятков тысяч клеток, образуя уже упомянутые центры бодрствования.
Наиболее важными медиаторами бодрствования признаны ацетилхолин и норадреналин. Это универсальные передатчики информации, обеспечивающие множество нервных процессов в организме. Нейроны, содержащие норадреналин и обеспечивающие поддержание бодрствования, расположены в области голубого пятна (ГП) (иногда этот центр называют также синим пятном, locus coeruleus на латыни) в верхних отделах ствола мозга. Норадреналинергические нейроны голубого пятна максимально активны в период бодрствования. Частота их импульсации снижается во время медленного сна, а во время быстрого (для животных – парадоксального) сна они практически полностью «замолкают». Фармакологическое подавление активности этих нейронов ведет к снижению активации и появлению на ЭЭГ паттерна, характерного для сна. Наоборот, введение в ЦНС агонистов норадреналиновых рецепторов (т. е. не самого норадреналина, а веществ, которые, соединяясь с рецепторами, имитируют функцию этого медиатора) вызывает увеличение времени бодрствования.
Источником ацетилхолина, участвующего в поддержании бодрствования, является базальное ядро (БЯ) переднего мозга, его называют также ядром Мейнерта. Это скопление ацетилхолинпродуцирующих нейронов находится в нижних отделах переднего мозга, под таламусом. БЯ рассматривается как ключевой экстраталамический переключатель информации, идущей от ретикулярной активирующей системы ствола мозга к коре больших полушарий (другой путь активации). Кроме активирующей роли ядро Мейнерта играет большую роль в организации понимания того, что мы видим (сопоставляет зрительную информацию с ее внутренней оценкой). Другими частями ацетилхолинергической активирующей системы мозга являются педункулопонтинное ядро (ППЯ) и латеродорзальное ядро покрышки (ЛДЯ) – область в верхних отделах ствола мозга, также участвующая в процессах поддержания внимания и двигательной активности.
Химическим родственником норадреналина является нейромедиатор серотонин. Оба этих вещества относятся к катехоламинам – производным аммиака. Серотонин известен как «гормон радости», поскольку показано его участие в процессах возникновения эмоций. С недостатком серотонина и норадреналина связывают развитие депрессии. Функции этого вещества многообразны. В качестве активирующего агента он выступает, когда серотонинсодержащие нейроны ядра шва (ЯШ) воздействуют на корковые нейроны напрямую или же через торможение центра сна в гипоталамусе.
Важным веществом для поддержания уровня бодрствования является глутаминовая кислота – глутамат. Эту аминокислоту называют универсальным возбуждающим медиатором, поскольку она участвует практически во всех процессах, происходящих в ЦНС. Глутаматергическая активирующая система включает в себя медиальное и латеральное парабрахиальное ядро и скопление нейронов, известное как прецерулеус (около голубого пятна), расположенное в задней части (дорзальной покрышке) моста. У человека аналогом этих ядер является сублатеродорзальное ядро (СЛДЯ). Отсюда отростки нейронов устремляются к базальным ядрам переднего мозга (БЯ) и затем – к коре больших полушарий. Глутаматергическая система играет роль в поддержании бодрствования и в некоторых процессах быстрого сна. Она осуществляет свою активирующую деятельность посредством стимуляции холинергических структур переднего мозга, которые, в свою очередь, уже активируют новую и древнюю кору мозга. Согласно одной из концепций, именно глутаматергическая система вызывает реакцию пробуждения и поддерживает кору в состоянии тонической деполяризации в бодрствовании и быстром сне, в то время как активность всех прочих центров бодрствования является лишь следствием активации коры больших полушарий. Неудивительно, что средства, подавляющие активность этой системы (блокаторы глутаматных рецепторов), являются сильными средствами для наркоза (например, кетамин и закись азота).
Биогенный амин гистамин, известный медиатор аллергии, в ЦНС выступает также в роли нейромедиатора, поддерживающего бодрствование. Практически весь мозговой гистамин содержится в парных туберомамиллярных ядрах (ТМЯ), расположенных в задней трети гипоталамуса. Гистаминергические нейроны проецируются непосредственно на клетки коры мозга и поддерживают уровень их активности в бодрствовании. Прием антигистаминных препаратов первых поколений, в связи с тем что они легко преодолевают гематоэнцефалический барьер (т. е. переходят из крови в ткань мозга), сопровождается развитием сонливости, поэтому некоторые из них (доксиламин) используются в медицинской практике в качестве снотворных.
Окончательно не ясно, участвует ли третий из катехоламинов, нейромедиатор дофамин, в поддержании бодрствования. Дофамин известен как вещество, при нехватке которого развивается болезнь Паркинсона. Большое количество дофаминовых нейронов содержится в покрышке (лат. ventral tegmentum) среднего мозга в верхних отделах ствола и в околоводопроводном сером веществе (ОСВ) (водопровод – это часть ликворной системы мозга, соединяющая полости третьего и четвертого желудочков). Активность этих нейронов повышается во время бодрствования, поэтому предполагают, что через проекции на кору мозга они оказывают возбуждающее действие. Также было показано, что разрушение ОСВ приводит к увеличению времени сна у крыс на 20 %. Большинство легальных и нелегальных психостимуляторов, таких как амфетамины и модафинил, действуют посредством стимуляции дофаминовых рецепторов. При их приеме значительно возрастает возможность поддерживать бодрствование в течение продолжительного времени, что используется, например, в условиях боевых действий. Тем не менее прием препаратов дофамина при лечении синдрома беспокойных ног не приводит к уменьшению времени сна, а при болезни Паркинсона активация постсинаптических дофаминовых рецепторов, наоборот, может вызывать сонливость и даже приступы внезапных засыпаний. Поэтому активирующая роль дофамина как нейромедиатора ставится под сомнение. Несомненно, он участвует в поддержании эмоциональных проявлений бодрствования и быстрого сна. С увеличением уровня дофамина связывают процессы эмоционального подкрепления при выполнении заданий (система вознаграждения) и переживания сновидений.
Особую роль в поддержании уровня бодрствования и организации смены фаз сна с медленного сна на быстрый играет орексиновая/гипокретиновая система мозга. Двойное название она получила в связи с тем, что вещество, которое вырабатывается в соответствующих клетках, было обнаружено одновременно двумя группами ученых в 1998 г. Исследователи из США Луис Деличи и Томас Килдаф назвали его гипокретином (гипоталамическим секретином), поскольку он был выделен из гипоталамуса подопытных мышей и по структуре, как тогда казалось (но в дальнейшем не подтвердилось), похож на кишечный пептид секретин. Одновременно и независимо от них японские ученые Кусаки Оно и Такеши Сакураи выделили и назвали обнаруженное ими вещество орексином, поскольку оно влияло на пищевое поведение (орексис по-гречески – «аппетит»). До сих пор разные группы ученых в публикациях называют этот нейромедиатор то орексином, то гипокретином, не отдавая предпочтения ни одному из названий.
Нейроны, содержащие орексин, расположены в области среднего гипоталамуса. Функция их уникальна, поскольку, с одной стороны, они непосредственно активируют корковые нейроны, не позволяя им «засыпать», с другой – воздействуют на нейроны иных активирующих систем (норадреналиновой, ацетилхолиновой, дофаминовой, серотониновой, гистаминовой, глутаматной), являясь «активаторами активаторов». Орексины получили большую известность, когда было доказано, что развитие такой болезни, как нарколепсия, связано с почти тотальной гибелью продуцирующих этот медиатор нейронов.
Кроме активации корковых нейронов для поддержания их работоспособности важной функцией активирующих систем мозга является подавление активности центров сна. Общим для центров сна является то, что в них выделяется не активирующий медиатор, а, наоборот, тормозящий – гамма-аминомасляная кислота (ГАМК). Сон наступает тогда, когда это подавляющее действие активирующих систем уменьшается и центры сна «вырываются из-под контроля» и сами начинают подавлять центры бодрствования.
Известно три мозговых центра, связанных с медленноволновым сном: это вентролатеральная преоптическая область гипоталамуса (ВЛПО), медиальная преоптическая область гипоталамуса (МПО) и парафациальная зона вблизи ядра одиночного пути в продолговатом мозге. Нейроны этих областей содержат тормозной медиатор ГАМК. Преоптическая область гипоталамуса получила свое название, поскольку находится рядом с перекрестом зрительных нервов. При разрушении этой области количество медленного и быстрого сна уменьшается более чем в два раза. ВЛПО является центром, инициирующим сон, – это именно та область, которая разрушается при летаргическом энцефалите, что было замечено Константином фон Экономо. Случаи этого энцефалита регистрируются очень редко, с 1940 г. описано только 40 больных. Термин «летаргический сон» в настоящее время используется для обозначения длительного, продолжительностью не менее нескольких суток, периода сна. При рассмотрении случаев, называемых в быту «летаргическим сном», это состояние почти всегда оказывается проявлением истерии.
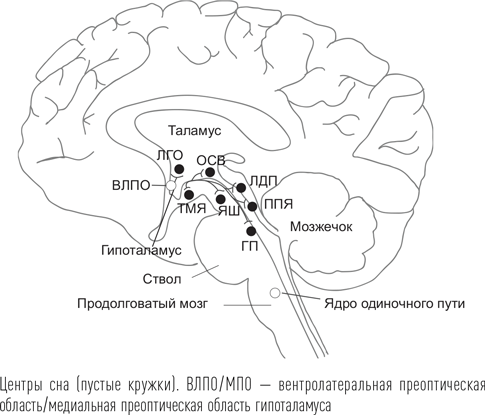
Нейроны ВЛПО становятся активны при переходе от бодрствования ко сну и усиливают свою деятельность по мере углубления сна. Клетки другого центра сна – МПО – начинают активно разряжаться еще до засыпания, а затем остаются активными в течение всего периода медленного сна и усиливают свою деятельность в период быстрого сна. Существует еще один центр в стволе мозга (точнее, в области продолговатого мозга), открытый Джузеппе Моруцци с коллегами в 1961 г., при раздражении которого электрическим током также наступает сон. В эксперименте на животных при отделении этого центра от остального мозга сон не исчезает, но сокращается на треть. Стволовой центр сна тесно связан с каротидным синусом – образованием, расположенным в месте разветвления общей сонной артерии на наружную и внутреннюю. Каротидный синус имеет барорецепторы, которые регистрируют и посылают в мозг информацию об артериальном давлении и химических показателях крови. Раздражение каротидного синуса активирует стволовой центр Моруцци, т. е. провоцирует засыпание, не зря эти артерии называют «сонными».
Существует еще одна популяция нейронов, которая активна в глубоком медленном сне, – это нейроны префронтальной области коры мозга. Активность этих нервных клеток увеличивается по мере углубления сна и увеличения числа дельта-волн. Представленность нейронов, связанных с медленным сном, в коре мозга невелика, и их роль в возникновении или поддержании состояния сна изучена недостаточно.
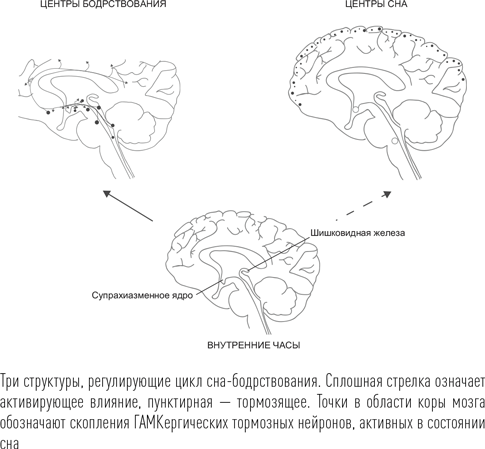
К двучленной композиции из активирующих и тормозящих систем, которые борются за право погрузить в сон кору головного мозга, присоединяется еще один участник – внутренние часы организма. «Внутренние часы» – не просто красивое словосочетание. Это парные скопления нейронов в супрахиазменной области гипоталамуса. Супрахиазменной областью это место было названо, поскольку оно расположено прямо над перекрестом зрительных нервов («хиазма» на латыни – перекрест). В супрахиазменных ядрах находятся специальные нейроны, роль которых сводится к поддержанию постоянной ритмической активности. Химические реакции в них «закольцованы» и повторяются с периодом, близким к 24-часовому – времени вращения Земли вокруг своей оси, но не равны ему. О независимости периода внутренних часов от внешних факторов свидетельствуют результаты эксперимента с пересадкой сухпрахиазменных ядер от крыс с режимом «12 часов свет / 12 часов темнота» к крысам с противоположным режимом. Такая манипуляция привела к тому, что крысы-реципиенты перешли в суточный режим доноров!
За подстройку индивидуальной периодичности цикла химических реакций к астрономическому времени в супрахиазменных ядрах отвечает отдельная популяция нейронов, которая получает информацию об уровне освещенности непосредственно из глаз с помощью тонкой нервной веточки – ретиногипоталамического тракта. Сигналы от супрахиазменных ядер посредством переключения через своеобразные усилители сигнала – другие гипоталамические ядра – в итоге стимулируют важное дорзомедиальное ядро гипоталамуса, которое, в свою очередь, влияет на пищевое поведение, терморегуляцию, выделение гормонов стресса и, что наиболее важно, на торможение главного центра сна – ВЛПО. Пока вокруг достаточно света, супрахиазменные ядра получают интенсивную стимуляцию от рецепторов сетчатки глаза, воспринимающих световой поток. При этом обеспечивается торможение ВЛПО и стимуляция орексиновой и других активирующих систем.
Каким же образом мозг из состояния бодрствования переходит в состояние сна? Ключевую роль в этом играет высвобождение ВЛПО и МПО из-под «прессинга» активирующих структур мозга (активирующими они являются друг для друга и для нейронов коры мозга). В течение периода бодрствования происходит увеличение содержания аденозина в клетках мозга и в межклеточном пространстве. Это сопровождается усилением стимуляции рецепторов типа А1, которые расположены на теле некоторых нейронов. Активация аденозиновых рецепторов приводит к торможению как нейронов коры мозга, так и холинергической активирующей системы (ядра Мейнерта), которое должно подавлять активность гипоталамического центра сна – ВЛПО. Кроме этого аденозин непосредственно стимулирует нейроны ВЛПО путем воздействия на другой тип рецепторов (А2), относящихся к возбуждающему типу. В итоге, с одной стороны, снимается блокирующее воздействие на ВЛПО активирующих мозговых центров, а с другой – активность нейронов самого ВЛПО усиливается, что позволяет ему начать тормозить деятельность активирующих систем.
Определенную роль в процессе засыпания также играет активация ГАМКергических тормозных нейронов в коре полушарий мозга (1-й и 2-й корковые слои). Внутренние часы также принимают участие в процессе засыпания. При уменьшении уровня освещенности в вечернее время супрахиазменные ядра ослабляют контроль над ВЛПО и снижают уровень активации орексиновой системы. В отсутствие изменений освещенности, например в условиях белых ночей, активность супрахиазменных ядер вечером все равно снижается, поскольку эти образования сами по себе являются молекулярными часами, отмеряющими время.
Электрофизиологически момент засыпания, т. е. наступления фазы медленного сна, проявляется тем, что обычная активность корковых нейронов с характерным для бодрствования альфа-ритмом 8–13 Гц изменяется, на смену ему приходит менее высокий и упорядоченный тета-ритм засыпания частотой 4–8 Гц. Эти изменения отражают снижение таламических влияний на кору мозга, поскольку ВЛПО подавляет и активность основного источника активации таламических нейронов – холинергического педункулопонтинного/латеродорзального ядер.
Лишившись источника активации, таламические нейроны перестают пропускать дальше сигналы от органов чувств и начинают генерировать собственный ритм, который передается на корковые нейроны и заставляет их попеременно то гиперполяризовываться до значений –75 –90 мВ (когда генерация потенциала действия практически невозможна), то деполяризовываться до величины –61 мВ, когда, наоборот, разряд генерируется очень легко (порог потенциала действия составляет –55 мВ). Есть предположение, что таким образом осуществляется «прочистка» ионных каналов нервной клетки, что позволяет улучшить возможности генерации разряда в дальнейшем (гипотеза назначения медленного сна, иронически называемая «вантузной»).
Нехарактерная для бодрствования электрическая активность нейронов таламуса, управляющих корковыми нейронами, приводит к тому, что во время сна мы наблюдаем и совсем иные, не похожие на ЭЭГ бодрствования, формы активности. После засыпания на ЭЭГ сначала появляются так называемые «веретена сна» – короткие разряды нейронов, объединенные в пачки, затем корковые нейроны начинают работать синхронно, разряжаясь и замолкая огромными группами, что проявляется медленными и очень высокоамплитудными волнами (дельта-волны) в глубоком медленном сне.
Загадкой для ученых остается необходимость для мозга через определенное время переходить из состояния медленного сна в быстрый (парадоксальный) сон. Цикл сна здорового взрослого человека составляет около 90 минут – в течение ночи фазы сна сменяют друг друга 4–6 раз. Почему мозговой механизм взрослого человека отмеривает 90-минутные интервалы чередования фаз сна, непонятно. Ведь если необходимость в двух отдельных состояниях сна существует, то почему бы людям и животным не спать, например, три четверти ночи медленным сном, а оставшуюся четверть – быстрым? Тем не менее, несмотря на непонятную до сих пор обязательность регулярной смены фаз сна, сам механизм переключения из медленного сна в быстрый изучен неплохо.
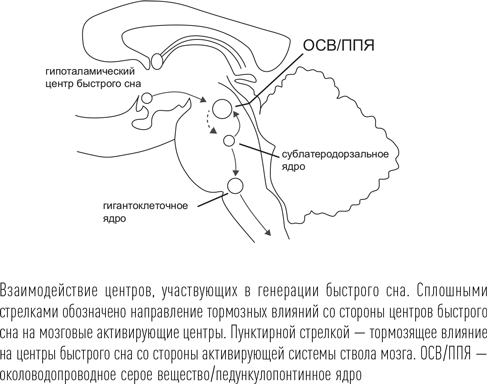
С генерацией быстрого сна связаны две группы ядер, относящихся, как это ни странно, к активирующей системе мозга. Это ацетилхолинергические педункулопонтинное ядро (ППЯ) и латеродорзальное ядро (ЛДЯ). Нейроны в этих ядрах демонстрируют высокую активность как в состоянии бодрствования, так и в состоянии быстрого сна. Кроме того, в быстром сне активируется еще одна область ствола мозга, расположенная спереди и ниже, – сублатеродорзальная глутаматергическая зона, отвечающая за выключение мышечного тонуса в период быстрого сна.
Но главным инициатором быстрого сна является другая группа нейронов, расположенная в заднем гипоталамусе рядом с центром медленного сна ВЛПО. Эти нейроны также выделяют ГАМК. Гипоталамический центр быстрого сна является тормозным по отношению к двум расположенным в верхних отделах ствола ядрам – ГАМКергическому околопроводному серому веществу (ОСВ) и ацетилхолинергическому педункулопонтинному/латеродорзальному ядрам покрышки (ППЯ/ЛДЯ). Эти ядра подавляют активность центров быстрого сна в стволе мозга – упомянутых двух парагигантоклеточных ядер и сублатеродорзального ядра. Когда активность ППЯ/ЛДЯ тормозится, то происходит «выключение выключателей» и стволовые центры быстрого сна высвобождаются от их тормозящего влияния и начинают обеспечивать процессы, связанные с фазой быстрого сна. Сублатеродорзальное ядро (СЛДЯ) с участием латерального гигантоклеточного ядра обеспечивает характерное для быстрого сна подавление мышечного тонуса, поэтому при переживании содержания сновидений, даже эмоционально активных, у здорового человека соответствующая двигательная активность не возникает. Период быстрого сна обычно заканчивается полным или неполным (это называется ЭЭГ-активацией) пробуждением, после которого происходит возобновление сна уже с медленной его фазы.
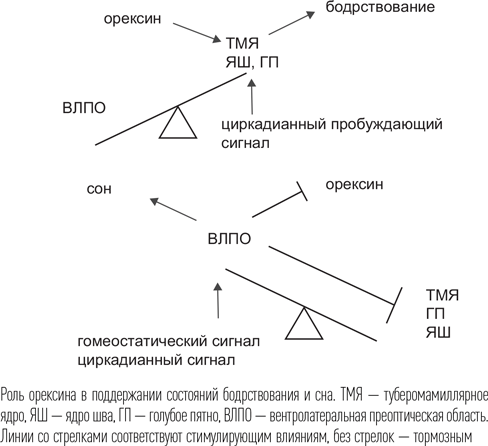
Модель, объясняющая переключение с бодрствования на сон и с медленного сна на быстрый, была предложена исследователем из Гарвардского университета Клиффордом Сейпером в 2005 г. В этой модели очень важная роль отводится системе орексина/гипокретина, которая известна как активирующая система. Сейпер описывает орексиновую систему еще и как «пружину», поддерживающую переключатель «сон-бодрствование» в одном из двух фиксированных положений. В концепции взаимодействия систем, обеспечивающих сон и бодрствование, орексиновая система рассматривается как «активатор активаторов». В бодрствовании она помогает другим активирующим системам подавлять гипоталамический центр медленного сна. Наступление темного времени суток и накопление избытка аденозина приводит к повышению активности ВЛПО. Этот центр высвобождается из-под контроля и сам начинает тормозить орексиновую систему, в еще большей степени подавляя и другие связанные с ней активирующие системы, что обеспечивает стабилизацию состояния сна.
В том случае, когда орексиновая система перестает работать, например при нарколепсии, когда большинство нейронов, выделяющих этот нейромедиатор, погибает, то качели, на разных концах которых «сидят» активирующие и тормозящие системы, начинают непредсказуемо склоняться то в одну, то в другую сторону. Это объясняет, почему у больных нарколепсией случаются внезапные засыпания днем и, наоборот, нарушения сна ночью. Дополнение к этой модели, показывающее роль орексиновой системы как стабилизатора переключения медленного и быстрого сна, было опубликовано в 2006 г. той же группой исследователей из Гарварда. Они показали, что орексиновые нейроны удерживают в выключенном состоянии нейроны латеральной покрышки моста, что позволяет другой группе нейронов (сублатеродорзального ядра покрышки, СЛДЯ) обеспечивать стабильное состояние быстрого сна.
Орексиновые нейроны гипоталамуса тесно связаны по локализации и по функции с морфологически схожими клетками, которые вырабатывают другой нейромедиатор, называемый меланинконцентрирующим гормоном (МКГ). В отличие от орексиновых нейронов, клетки, вырабатывающие МКГ, активны не в бодрствовании, а в фазе быстрого сна. Считается, что эта система отвечает за торможение пробуждения в фазе быстрого сна.
Нерешенным остается вопрос, какой же внутренний генератор с 90-минутной периодичностью (у человека) запускает центр быстрого сна и почему через несколько десятков минут быстрый сон заканчивается и вновь наступает фаза медленного сна. Предполагают, что эту роль играет гипоталамический центр быстрого сна, поскольку он находится в тесной связи с внутренними часами – супрахиазменными ядрами.
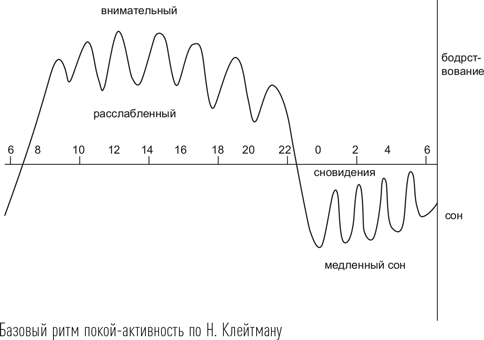
Выдающийся исследователь сна Натаниэль Клейтман из Чикаго сформулировал положение о том, что 90-минутный цикл чередования фаз сна является одним из основных ритмов человеческого организма. Он назвал его «базовый цикл покоя-активности» (basic rest-acticity cycle, BRAC). Ученый предполагал, что, несмотря на универсальность, мы можем наблюдать этот цикл только в состоянии сна, поскольку в дневное время его проявления «зашумляются» другими видами жизненной активности. Социальное взаимодействие, эмоции, физическая активность – все это не позволяет выявить характерные колебания мозговой активности, которые мы наблюдаем в ночное время, когда произвольная регуляция поведения невозможна. Клейтман и его ученики, разрабатывавшие данную идею, обнаружили признаки BRAC у детей и «залеченных» психически больных людей, у которых внешние стимулы и внутренняя умственная деятельность не были столь сильными, чтобы маскировать этот ритм. После смерти Натаниэля Клейтмана исследования в той области на длительное время прекратились, сейчас они проводятся путем изучения двигательной активности человека методом актиграфии.
От идеи BRAC в нашей повседневной жизни осталось понятие «академического часа», который почему-то равен 45 минутам. Если предположить, что 90-минутный цикл мозговой активности действительно существует, то 45 минут этого периода будут соответствовать ее высокому уровню, а 45 – низкому. Оптимальным для обучения будет первый период, а во второй можно отдохнуть, чтобы лучше запомнить материал. К сожалению, синхронизировать этот ритм в группе людей невозможно, у каждого он находится в индивидуальной фазе. Если в одно время собрать группу людей для обучения, то у одних назначенное время совпадет с оптимальным временем усвоения материала, у других совпадет лишь частично, а третьи окажутся в своем худшем периоде. Поэтому использовать концепцию 45-минутного академического часа имеет смысл только в индивидуальном порядке, когда можно определить особенности цикла конкретного человека и подстроить под него график занятий.
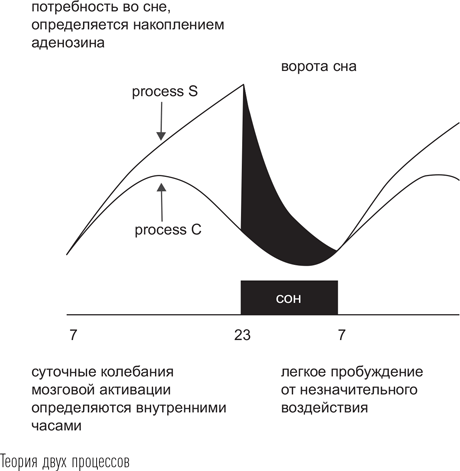
Итак, мы показали, какие мозговые механизмы участвуют в возникновении сна и смене его фаз. Остается непонятным, почему же сон наступает и заканчивается в определенное время суток, у человека обычно приуроченное к периодам темноты. На этот вопрос отвечает теория двух процессов, которая была предложена швейцарским исследователем Александром Борбели в 1982 г. Согласно ей вероятность наступления сна в каждый момент времени зависит от взаимодействия двух процессов. Один из них определяется постепенным накоплением усталости, потребности во сне – это так называемый гомеостатический процесс S (гомео по-гречески «одинаковый»). Действительно, чем дольше мы не спим, тем с большей вероятностью уснем, как только голова коснется подушки. Интенсивность действия этого процесса Борбели назвал «давлением сна». Количественно оценить давление сна можно, проведя спектральный анализ ЭЭГ и выделив из множества ритмов только медленно-волновой компонент (дельта-активность). Дельта-активность выражена только в медленном сне, который, как мы знаем, повторяется периодически 4–6 раз за ночь (циклы сна). В течение ночи с каждым циклом дельта-активность снижается с очень высоких значений в первом цикле до почти полного исчезновения в последнем периоде. Таким образом, мы наблюдаем уменьшение давления сна по мере выполнения его восстановительной функции.
На роль вещества, накопление которого определяет нарастание давления сна, называемого еще гипнотоксином (токсином сна), претендовало довольно много различных субстанций. Выделение такого агента вызвало бы революцию в фармакологии, поскольку удалось бы получить естественное снотворное, вызывающее физиологический сон в нужное нам время. Первые опыты в направлении поиска «вещества сна» проводились еще в начале XX в. Французские физиологи Рене Лежандр и Анри Пьерон в 1907 г. провели опыты на собаках, продемонстрировавшие, что в ходе бодрствования в ЦНС накапливается некая субстанция, вызывающая увеличение склонности ко сну. В течение длительного времени ученые не давали собакам засыпать, затем брали у них спинномозговую жидкость и вливали ее в желудочки мозга другим животным, которые не испытывали потребности в сне. После этого «выспавшиеся» собаки начинали демонстрировать поведенческие признаки сонливости.
В дальнейшем было проведено множество исследований, чтобы идентифицировать эту «сонную» субстанцию. На ее роль претендовали простагландины, интерлейкины, такие мозговые пептиды, как аргинин-вазотоцин, дельта-сон индуцирующий пептид (DSIP), субстанция «П» и многие другие, однако получить стойкое снотворное действие при их приеме в итоге так и не удалось. В настоящее время наиболее подходящим кандидатом на роль «вещества сна» признан нейромедиатор аденозин. Предполагают, что накопление именно этого вещества приводит к стимуляции специфических тормозных А1-рецепторов и нарастанию давления сна. Неудачи применения данного вещества в качестве снотворного объясняются тем, что аденозин не проходит гематоэнцефалический барьер и оказывается крайне нестойким во внеклеточной среде.
Но одним только давлением сна вероятность засыпания не определяется. Это мы знаем и на собственном опыте: ведь даже после бессонной ночи в течение следующего дня случаются состояния, когда сонливость на время отступает. Эти колебания имеют периодический характер. Известно также, что утром после пробуждения большинству людей сначала бывает трудно настроиться на «рабочий лад», к обеду способность выполнять задания становится максимальной, а в позднее послеобеденное время заметно уменьшается. К наступлению темного периода суток производительность труда и желание что-то делать у этих людей снижаются в еще большей степени. Такие колебания работоспособности являются отражением работы другого процесса – ежесуточного изменения мозговой активности, который Александр Борбели назвал «процессом С» (от англ. circadian – околосуточный). Степень выраженности бодрости и сонливости подвержена регулярному изменению в одни и те же периоды суток, поскольку этот процесс контролируется нашими внутренними часами – супрахиазменными ядрами.
В вечернее время, когда большинство людей собирается ложиться спать, у них уже присутствует высокое давление сна как следствие длительного бодрствования. При этом и интенсивность процесса С, отражающая уровень мозговой активности (это условное название, отражающее способность к успешному выполнению различных заданий), тоже идет на спад. Между уровнями двух этих противоположно направленных процессов возникает расхождение, которое получило название «ворот сна». Чем больше это расхождение, тем быстрее человек заснет, если отключится от внешних впечатлений и примет горизонтальное положение. После того как сон наступил, начинаются процессы инактивации свободного аденозина с его разрушением или включением в состав новых молекул АТФ. Инактивация аденозина происходит значительно быстрее, чем его накопление в течение дня: на рисунке видно, что кривая этого процесса более крутая. Через 7–8 часов сна, уже под утро, большая часть аденозина, обеспечивавшего давление сна, оказывается инактивирована. В то же время мозговая активация, отражающая работу процесса С, пройдя в середине ночи свой минимум, начинает идти на подъем и постепенно увеличивается. В утренние часы расхождение между двумя этими процессами исчезает – «ворота сна» закрываются. При этом человек просыпается от незначительного стимула – внешнего или внутреннего – и уже не возвращается обратно в сон в течение по крайней мере нескольких часов.
Модель двух процессов выглядит гипотетической, довольно искусственной. Тем не менее она замечательно отвечает на один из важнейших практических вопросов: почему нельзя получить обратно время сна, потерянное ночью? Рассмотрим его. Ночь без сна, например рабочая смена, сопровождается дальнейшим нарастанием давления сна. В то же время процесс С ведет себя независимо, проходит свой минимум в ночное время, когда приходится активно работать, а в утренние часы идет на подъем. Отработав ночную смену, человек возвращается домой, ложится в постель и пытается восполнить сформировавшийся дефицит сна. Само засыпание, даже в дневное время, для него особенной проблемы не представляет, поскольку давление сна, накопившееся за более чем суточный период бодрствования, велико. Как только этот человек засыпает, давление сна начинает прогрессивно уменьшаться. Но циркадианный процесс изменения мозговой активности в это время находится в фазе нарастания, и достаточно быстро, через 3–4 часа, возникает ситуация, когда разрыв между процессами S и C оказывается минимальным, таким же, какой возникает утром при нормальном режиме сна. «Ворота сна» закрываются. Человек просыпается, при этом не ощущает полного восстановления, у него присутствует выраженный феномен инерции сна (инерция как раз зависит от давления сна, а не от фазы биоритма), и достаточно долго он испытывает затруднение с включением в активную деятельность. Этот эффект называют «синдромом сонного опьянения». Поэтому специалисты не рекомендуют людям, не спавшим ночь, на следующий день выходить работать в вечернюю смену. Это чревато серьезными ошибками на производстве и может угрожать жизни.
Модель двух процессов признается научным сообществом, поскольку позволяет объяснить ряд других изменений сна, наблюдаемых на практике, например при старении и при депрессии. Также эта модель дает объяснение, почему людям с нарушением ночного сна не стоит спать днем – таким образом они уменьшают давление сна и к вечеру приходят с меньшим его значением, что еще больше затрудняет засыпание.
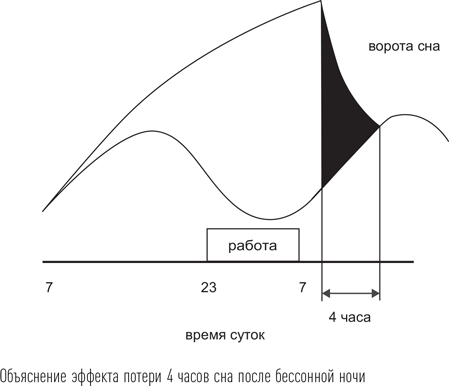
В заключение повторим наиболее важные положения современной нейрохимической теории сна. Во-первых, вхождение в сон, его окончание, а также смена фаз зависят от сложного взаимодействия мозговых центров, которые находятся в составе активирующей, синхронизирующей системы или внутренних часов. Нарастание сонливости в течение дня обеспечивается накоплением аденозина, источником которого являются метаболические процессы в клетках головного мозга. Приуроченность сна и бодрствования к определенному времени определяется взаимодействием двух процессов – гомеостатического и циркадианного – и зависит от того, насколько велика окажется разница между ними – так называемые «ворота сна».
Назад: 3 Теории сна. Зачем терять время на сон?
Дальше: 5 Сон и биоритмы. Товарищ ли «сова» «жаворонку»?

