Как важно поставить метку
Разработанную методику решено было использовать для введения металлокомплексов непосредственно в полипептиды (белки), важно лишь, чтобы в выбранном полипептиде находились фрагменты ароматических (содержащих бензольное ядро) аминокислот.
Здесь будет уместно вспомнить симпатичный рассказ Натальи Романовой «Муравей Красная Точка» для детей дошкольного возраста. Любознательный герой рассказа пометил красной краской одного из муравьев и благодаря этому мог следить за всеми его перемещениями и действиями. Это позволило понять, как организована жизнь муравейника, что практически было невозможно сделать, наблюдая за всей массой копошащихся насекомых.
Возвращаясь к проблемам биохимии онкологических заболеваний, упомянем одну из важных и трудно решаемых. Все применяемые противораковые препараты разрушают не только патологические, но и здоровые клетки. Для того чтобы доставить металлокомплекс, связанный с «путеводителем» – аминокислотой или белком – «по нужному адресу», т. е. в больную клетку, необходимо знать, какие именно аминокислоты и полипептиды избирательно накапливаются в патологических клетках. Такие исследования проводят постоянно и в большом количестве: например, добавляют в полипептид радиоактивную метку (соединение, содержащее технеций) и затем ведут радиометрический контроль либо вводят в белок флуоресцентную метку и далее проводят наблюдения визуально, под микроскопом.
Введение рутениевых комплексов по существу представляет собой удобный новый способ создания метки в полипептиде, за перемещением которого в организме можно следить с помощью спектральных методов.
Преимущества нового метода были обнаружены при введении рутениевых комплексов в состав полипептида – мелиттина. Это основной компонент пчелиного яда, он обладает биологической активностью и, кроме того, оказывает противораковое действие. Мелиттин содержит остаток аминокислоты триптофана, в состав которого входит бензольное ядро, что и позволило ввести рутениевую метку: Тестирование препарата проводили на мышах – незаменимых биологических объектах для подобных испытаний (молекула белка мелиттина показана на рис. 8.9 в виде спирали).
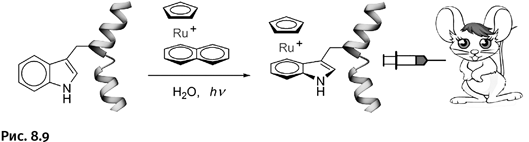
Метка позволила наблюдать за перемещением введенного мелиттина в различные органы животного. У исходного мелиттина помимо лечебного действия есть недостаток: он заметно разрушает эритроциты – красные кровяные тельца, входящие в состав крови. Оказалось, что введение рутениевых комплексов более чем в десять раз снижает это нежелательное побочное действие мелиттина. Дополнительное достоинство состоит в том, что при необходимости метку можно удалить: автору работы удалось разработать соответствующую методику извлечения рутениевого комплекса из полипептида.
Подводя итог, признаем, что описанные поиски далеки от завершения, поскольку сражение идет с очень «сильным противником» – онкологическими заболеваниями. Автор работы заметно приблизился к некоторым уязвимым точкам неприятеля. Как говорят, из малых шагов складываются километры пути к вершине. В заключение отметим, что мы вновь имеем приятную возможность показать портрет не старца, убеленного сединами, а молодого российского химика, ведущего исследования, результаты которых так нужны людям.
Лекарство-снайпер
Предупредительный выстрел в воздух может снять снайпера прямо с дерева.
ЛЕОНИД СУХОРУКОВ
Борьба с заболеваниями возможна не только терапевтическая, т. е. с помощью лекарств, но и иными методами, например с помощью облучения.
В 1898 г. супруги Пьер и Мари Кюри открыли радий – химический элемент с исключительно мощным радиоактивным излучением. Уже через год они стали изучать действие радиоактивного излучения на живые ткани, а затем ввели в медицинскую практику облучение препаратами радия для борьбы с опухолевыми клетками. Радий также определил название нового метода лечения, появилась новая область медицины – радиотерапия.
Одновременное действие трех видов радиоактивного излучения (α-, β- и γ-лучи), испускаемого радием, разрушало не только опухолевые, но и здоровые клетки, поэтому использование радиевых препаратов в медицинских целях требовало исключительно аккуратной дозировки, которую находили опытным путем, иного подхода в то время не существовало. Все это напоминало, по словам современников, ремонт часового механизма с помощью слесарных инструментов.
Современные радиологические методы лечения онкологических заболеваний (называемых в быту облучением) также вызывают большое беспокойство и у больных, и у лечащих врачей, поскольку все прекрасно понимают, что радиация, поражая здоровые ткани, может в конечном итоге привести к лучевой болезни.
От грубых инструментов к утонченным
Научный подход к поиску новых способов лечения формировался постепенно. Основное направление помогли указать интенсивные исследования в ядерной физике. В 1934 г. американский физик Д. Ли обнаружил, что ядра некоторых элементов способны захватывать нейтроны, что сопровождалось испусканием γ-квантов (гамма-излучение). Дальнейшее изучение этого процесса с участием различных ядер и их последующих превращений привело в 1936 г. другого американского биофизика, Г. Лочера, к оригинальной идее лечения онкологических заболеваний. Вначале следует ввести в раковые клетки препарат, содержащий нерадиоактивный изотоп бора 10В, а затем обработать его потоком нейтронов невысокой энергии (так называемых тепловых). При этом атом бора, захватывая нейтрон, превращается в радиоактивный изотоп, который распадается с образованием абсолютно безвредного лития, выбрасывая при этом гамма-квант и альфа-частицу (ядро гелия, содержащее два протона и два нейтрона) (рис. 8.10).
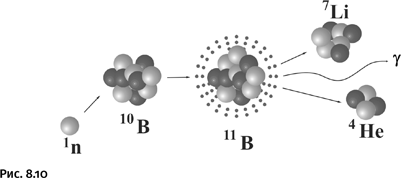
Из показанной схемы видно, что суммарное количество частиц (протонов и нейтронов) остается неизменным, правила написания ядерных реакций те же, что и в обычных химических уравнениях. Верхний числовой индекс у символа химического элемента – массовое число, т. е. сумма протонов и нейтронов в ядре.
Энергия выделяющихся гамма-квантов невелика, и они не оказывают ни лечебного, ни разрушающего действия, основной «лечебный инструмент» – именно a-частицы. Это настоящие «боевые» снаряды, обладающие одним достоинством: у них крайне низкая длина пробега, соизмеримая с размером клетки. В результате α-частица, возникшая за счет ядерной реакции в опухолевой клетке, не выйдет за ее пределы, поскольку обязательно с чем-нибудь столкнется, и потому не затронет здоровые ткани.
Другая сторона вопроса не менее важна. Для того чтобы возникли α-частицы, необходимо облучить организм нейтронами, но не затронут ли они также здоровые клетки? В данном случае использование атомов бора как потенциальных «захватчиков» нейтронов неслучайно. Дело в том, что способность атомов бора захватывать нейтроны на 4–7 порядков превышает аналогичные свойства атомов, входящих в состав тканей живых организмов, – C, H, O, N (именно поэтому соединения бора применяют в ядерных реакторах в качестве поглотителей нейтронов). Таким образом, нейтронное излучение не будет оказывать на организм разрушающего действия. Практически все поступающие нейтроны будут захвачены бором. Осталось решить важную часть задачи – ввести в раковые клетки борсодержащее соединение.

