На сцену выходят π-комплексы металлов
Поскольку у цисплатина есть недостатки, начали поиск более эффективных соединений. В первую очередь исследователи обратились к циклопентадиенильным комплексам металлов, наиболее подробно были изучены в качестве лекарственных препаратов производные дихлорида титаноцена (С5Н5)2TiCl2, а также производные ферроцена (C5H5)2Fe. Это так называемые π-комплексы, в которых атом переходного металла координационно связан с циклическими молекулами (лигандами), обычно расположенными в двух параллельных плоскостях, между которыми находится атом металла.
Оказалось, что многие соединения такого типа заметно тормозят рост опухолевых клеток, однако они так и не были рекомендованы для клинического использования из-за малой растворимости в водных средах и неустойчивости к гидролизу.
В начале 1990-х гг. была обнаружена высокая противоопухолевая активность комплексов рутения с бензольными лигандами и атомами хлора. Вновь напомним, что лигандами называют нейтральные молекулы или ионы, которые координационно связаны с центральным атомом металла (рис. 8.3).
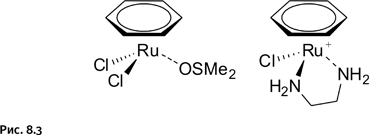
Такие соединения в зависимости от природы лигандов способны избирательно связываться с ДНК или белками опухолевых клеток. Взаимодействие происходит так же, как и в случае платины: атомы Cl или другие реакционные группы комплекса замещаются на активные группы биологических молекул – белков или ДНК. Кроме того, оказалось, что соединения рутения способны подавлять распространение раковых клеток по организму (метастазы).
Многочисленные исследования комплексов рутения и обнаруженная их эффективность постепенно привели к тому, что некоторые авторы стали рассматривать эти соединения в качестве будущей замены препаратов на основе платины. К сожалению, противоопухолевая активность большинства рутениевых комплексов изучена лишь в лабораторных опытах на колониях клеток и потому оценить их реальное фармакологическое действие и эффективность в борьбе с метастазами пока затруднительно.
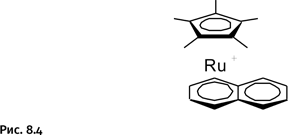
В 2012 г. группой австралийских ученых было обнаружено, что комплекс рутения, содержащий циклопентадиенильный и нафталиновый лиганд [(C5Me5)Ru(C10H8)]+, обладает заметной антираковой активностью (рис. 8.4). Факт несколько неожиданный, поскольку такой комплекс не содержит групп, которые способны связываться с группами ДНК и белков. Положительный заряд этого комплекса является преимуществом, поскольку, в отличие от здоровых клеток, липидная оболочка опухолевых клеток имеет повышенный отрицательный заряд, который должен притягивать катионный комплекс. Кроме того, комплекс имеет ионное строение, это обеспечивает растворимость соединения в воде – основной «реакционной среде» всех живых организмов.
Соединить металлокомплекс с аминокислотой
Итак, нафталиновый комплекс рутения не содержит групп, которые способны связываться с группами ДНК и белков. Этот недостаток решил устранить российский химик Д.С. Перекалин (рис. 8.5), причем он поставил перед собой более трудную задачу – не только ввести функциональные группы, но и облегчить проникновение будущего лекарства во внутриклеточное пространство.

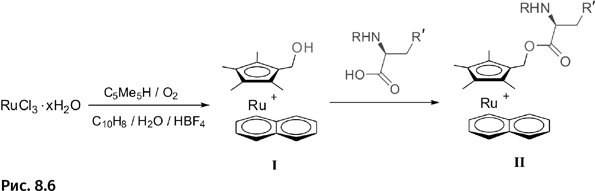
С этой целью он запланировал присоединять к комплексу различные аминокислоты, т. е. составные части белковых молекул. С помощью трехстадийного синтеза ему это удалось, но, поскольку заранее не было известно, какая именно аминокислота окажется наиболее эффективной, он получил набор из четырех комплексов, содержащих различные аминокислоты, причем только те, которые встречаются в живых организмах, – аланин, метионин, фенилаланин и триптофан.
Вначале он синтезировал катионный π-комплекс из RuCl3, нафталина и замещенного циклопентадиена (рис. 8.6, соединение I). Затем окислял циклопентадиенильный лиганд, при этом в нем образуется ОН-группа. Она представляет собой реакционную точку и позволяет на последующих стадиях присоединить аминокислоту (соединение II). К этой реакционной точке присоединяли поочередно одну из четырех аминокислот: аланин, метионин, фенилаланин и триптофан.
Затем была проверена антираковая активность полученных соединений. Кратко упомянем методику испытаний. Были использованы классические индикаторные тесты, они основаны на способности специального индикатора изменять цвет от светло-желтого до фиолетового при действии живых клеток. За изменением окраски следили с помощью спектрофотометра, который позволяет количественно оценить интенсивность окрашенного раствора. При действии вводимого антиракового препарата часть клеток погибает и интенсивность фиолетовой окраски снижается, что количественно характеризует долю разрушенных клеток.
Полученные результаты показали, что противоопухолевая активность полученных рутенийсодержащих соединений в некоторых случаях превосходит цисплатин, но это был лишь первый шаг в работе.
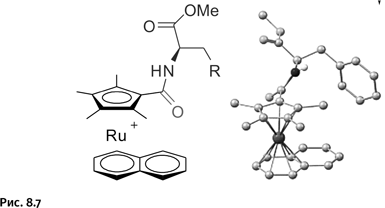
Современный аппарат органической химии дал возможность несколько скорректировать строение полученных соединений для улучшения их фармакологических свойств. Автор сосредоточил внимание на важном параметре – стабильности получаемых препаратов в биологических средах. Дело в том, что все показанные выше соединения имеют «слабое место» – атом О. Именно в этом месте начинается гидролиз соединения, введенного в клетку, в результате «целебная» часть – рутениевый комплекс – отщепляется от «путеводителя» – аминокислоты. Поэтому автор работы решил заменить сложноэфирную группировку – C–O–C(O)–, которая связывает комплекс с аминокислотой, амидным фрагментом – С(О) – N–, более устойчивым к гидролизу. Задача оказалась непростой, однако знание органической химии, находчивость и настойчивость позволили ее решить, это удалось осуществить с помощью четырехстадийного синтеза. Естественно, автор работы вновь получил не одно, а четыре соединения, содержащих остатки различных аминокислот. На рисунке 8.7 показано одно из четырех полученных соединений, структура которого подтверждена рентгеноструктурным анализом (он позволяет буквально «увидеть» молекулу).
Полученные препараты успешно прошли лабораторные испытания, но автор работы на этом не остановился и наметил еще один путь, ведущий к получению новых лекарственных соединений.
Поиск эффективных препаратов неизбежно связан с различными изменениями изучаемых молекул. Автор решил, что аминокислота, используемая в качестве «проводника» при введении металлокомплекса в клетку, может находиться не только в боковой ветви у лиганда, но и сама играть роль π-лиганда, т. е. занимать то место, где располагается молекула нафталина в показанных ранее структурах. Для этой цели пригодны ароматические (содержащие бензольный цикл) аминокислоты, в этом случае бензольное ядро обеспечит связь с металлом.
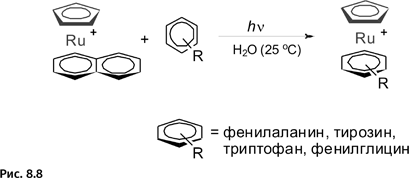
Была разработана методика, которая позволяет заменить молекулу нафталина в рутениевом комплексе на фенилсодержащие аминокислоты: фенилаланин, тирозин, триптофан, фенилглицин, причем автор сумел провести реакцию в биологически благоприятных условиях: водный раствор при комнатной температуре и облучении видимым светом (рис. 8.8).
Итак, удалось ввести в состав комплексов ароматические аминокислоты в качестве π-связанных лигандов. Далее последовал переход к следующему этапу работы, замысел которого теперь уже лежал буквально на поверхности.

