Монооксид углерода в органической химии
При повышенных температурах СО реагирует с щелочами, образуя формиаты (рис. 7.25).
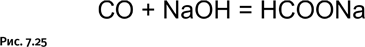
В присутствии платинового катализатора СО реагирует с NH3, давая цианат аммония NH4NCO, который изомеризуется в мочевину (рис. 7.26).
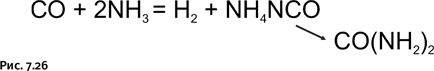
Под действием света СО реагирует с Cl2, образуя фосген COCl2. Широко известна способность СО реагировать с металлами, образуя летучие соединения – карбонилы металлов, например Ni(CO)4 (tкип. = 43 °С), что используют для высокой очистки никеля. С галогенидами некоторых металлов он образует комплексные соединения, такие как OsCl2(CO)3 и PtCl2(CO).
Монооксид углерода широко используют для промышленного получения метанола (рис. 7.27), а также насыщенных и ненасыщенных углеводородов в присутствии различных катализаторов (синтез Фишера – Тропша) (рис. 7.28).
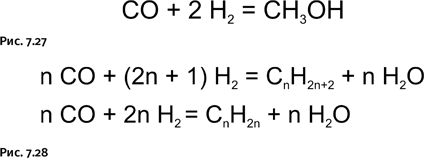
Каталитическое взаимодействие СО с ароматическими углеводородами приводит к соответствующим альдегидам (рис. 7.29).

Современный способ получения уксусной кислоты – присоединение СО к метанолу в присутствии катализаторов – солей кобальта, родия или иридия (рис. 7.30).

Подведем итог. Монооксид углерода необычайно широко применяют в органической химии, однако он выступает только в качестве присоединяющегося реагента, и мы не видим случаев, когда бы он проявил себя как восстановитель, который, уходя, уносит с собой атом кислорода.
Реакции восстановления в органической химии
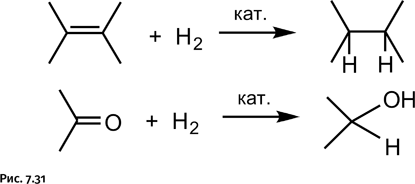
Посмотрим далее, как проводят химики-органики реакции восстановления. Наиболее широко используют процесс гидрирования – присоединение молекулы водорода к кратным связям в молекуле (рис. 7.31).
Вот перечень некоторых реакций восстановления водородом, используемых в органической химии:
● алкены превращаются в алканы (R2C=CR2 → R2CH – CHR2);
● алкины → в алкены (RC≡CR → RCH=CHR);
● альдегиды → в первичные спирты (RCHO → RCH2OH);
● кетоны → во вторичные спирты (RCOR’ → RR’CHOH);
● карбоновые кислоты → в первичные спирты (RCOOH → RCH2OH);
● сложные эфиры → в два спирта (RCOOR’ → RCH2OH, R’OH);
● имины → в амины (R2C=NR’ → R2CH – NHR’);
● амиды → в амины (RC(O)NR’2 → RCH2NR’2);
● нитрилы → в амины или имины (RCN → RCH-NH2, RCH=NH);
● нитросоединения → в амины (RNO2 → RNH2).
Гидрирование широко применяют для получения органических веществ как в лаборатории, так и в промышленном масштабе. Его также используют для удаления следов ацетилена из этилена или примесей кислорода из различных систем.
Весь мощный аппарат реакций восстановления в органической химии в основном использует молекулярный водород или водородсодержащие соединения, например гидриды металлов. Можно ли проводить восстановление, не «насыщая» вещество водородом, а «забирая» атом О с помощью СО? Именно такой простой и неожиданный вопрос поставил перед собой старший научный сотрудник лаборатории асимметрического катализа ИНЭОС РАН кандидат химических наук Д.А. Чусов (рис. 7.32).

Решение найдено!
Очевидно, что для решения такой задачи пригодно не каждое органическое превращение. Автору удалось найти нужную последовательность реакций, которую оказалось возможным усовершенствовать с помощью новой методики. Это широко известный способ получения вторичных аминов R2NH из первичных RNH2. Обычно взаимодействием альдегида и первичного амина получают основание Шиффа, называемое также имином, – это соединение, содержащее фрагмент – HC=NR (рис. 7.33).
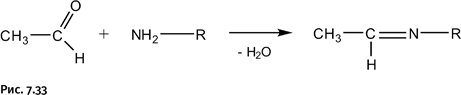
В третий раз мы упоминаем имины: удивительно «плодотворными» оказались эти соединения.
В имине, полученном по показанной на рисунке 7.33 схеме, гидрируют двойную связь (присоединение молекулярного водорода) и в результате получают вторичный амин (рис. 7.34).
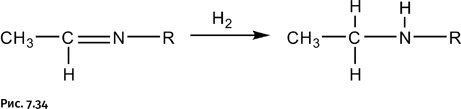
Обратите внимание на некоторую нелогичность схемы. На первой стадии «забирают» два атома водорода (в виде молекулы Н2О), а затем вновь присоединяют два атома водорода. Логичнее было бы «забрать» только атом кислорода и завершить все в одну стадию. Именно это и решил осуществить автор работы, используя монооксид углерода, который успешно справляется с такой задачей в доменном процессе.
Естественно, высокие температуры в этом случае были неприемлемы, следовательно, необходимо было найти такой катализатор, который позволил бы осуществить реакцию при невысокой температуре. Поиск катализатора – это всегда сочетание терпения, интуиции и, разумеется, результата знакомства с предшествующими исследованиями. Автор работы, естественно, знал, какие именно катализаторы используют в органических реакциях восстановления – это соединения платины, палладия, рутения и родия. В описываемой нами работе были испытаны галогениды и карбонилы этих металлов, их комплексы с фосфинами, а также палладий и платина, нанесенные на угольную подложку. Среди 13 исследованных соединений был найден оптимальный катализатор, которым оказался димер ацетата родия Rh2(OAc)4.
Попутно отметим, что немецкому химику Фрицу Габеру (лауреату Нобелевской премии по химии 1918 г.) потребовалось испытать несколько тысяч (!) соединений, чтобы найти катализатор, позволяющий присоединить водород к азоту. В те далекие годы опыт, накопленный предшественниками Габера, был все же маловат.
Вот как выглядит новый процесс восстановления с использованием СО в роли восстановителя. При взаимодействии бензальдегида с замещенным анилином атом кислорода в карбонильной группе С=О «забирается» монооксидом углерода и «уносится» в виде СО2, а оставшиеся реагенты соединяются (рис. 7.35).
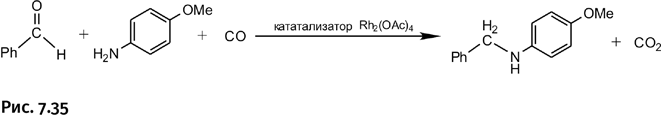
Реакция проходит подобным образом не только с альдегидами, но и с кетонами (рис. 7.36).

Метод оказался достаточно универсальным и в то же время весьма деликатным. Он не только позволяет вовлекать в процесс очень широкий круг карбонильных соединений, но и использовать такие, которые содержат нитро- (-NO2) или циангруппы (-C≡N). В предложенном процессе эти группы сохраняются, а при использовании молекулярного водорода они неизбежно восстановились бы. Метод позволяет получать из первичных аминов (RNH2) как вторичные (R2NH), так и третичные (R3N) амины, причем все реакции проходят с высоким выходом.
Автор назвал эти процессы восстановительным аминированием без внешнего источника водорода.
Активность катализатора в изученных реакциях весьма высока: в некоторых случаях одна молекула катализатора позволяет провести свыше 500 элементарных актов восстановления.
Естественно, предлагаемый новый метод восстановления автор сравнил с традиционным. В строго одинаковых условиях было изучено взаимодействии бензальдегида с анилином в присутствии восстановителя СО, а также при действии молекулярного водорода (традиционное гидрирование). Выход продукта по новой методике в пять раз превышает выход того же продукта при обычном гидрировании, которое сопровождалось к тому же образованием побочных соединений. Итак, преимущества нового метода восстановления убедительно показаны, процесс отчетливо претендует на промышленное использование.
Описанную работу, несмотря на простоту замысла, можно считать в буквальном смысле фундаментальной. Детально разработанная на сегодня органическая химия дает «ветвистые побеги» во многих смежных дисциплинах, и прежде всего в биохимии, но появление крупной ветви почти у основания «ствола» казалось почти невероятным. Не побоимся торжественных слов: фактически мы присутствуем при появлении нового класса реакций восстановления в органической химии.
В нашем рассказе содержится еще одна интересная деталь. Просматривая предыдущие главы, вы могли видеть портреты многих известных ученых, в подавляющем большинстве случаев это почтенные солидные мужи, а часто седовласые старцы. Однако те работы, которые сделали их известными, были выполнены далеко не в преклонном возрасте. Вот краткий список, подтверждающий это:
● Д.И. Менделеев создал свою таблицу в 35 лет.
● Я. Ван-Гофф в 22 года указал, как располагаются в пространстве атомы в молекулах.
● А.М. Бутлеров сформулировал теорию строения органических соединений в 32 года.
● А. Кекуле установил строение бензола в 28 лет.
Наш отечественный химик Н.Н. Семенов, лауреат Нобелевской премии, разработал теорию цепных реакций в 34 года.
К сожалению, во многих случаях история не сохранила нам портреты этих ученых в возрасте их творческого расцвета, но при обсуждении работы, о которой идет речь в этой главе, мы имеем приятную возможность показать автора в том возрасте, когда было выполнено это замечательное исследование.

