Истинное кросс-сочетание
Почти через 100 лет после открытия Гриньяра очередная Нобелевская премия подтвердила, что проблему удалось решить. В 2010 г. за разработку реакций кросс-сочетания, катализируемых палладием, Нобелевскую премию получили американские ученые Ричард Хек и Эйити Нэгиси и японский ученый Акира Судзуки. Как это обычно бывает, премия была вручена спустя много лет после того, как были проведены исследования, которые определили содержание премированной работы.
Первый из лауреатов – Ричард Хек – в 70-е гг. XX в. разработал способ сборки крупных органических фрагментов с помощью палладиевого катализатора. Палладий был выбран не случайно, к этому времени он зарекомендовал себя как катализатор многих органических реакций: например, с его участием был осуществлен промышленный процесс окисления этилена Н2С=СН2 до ацетальдегида Н3СС(О)Н. Именно палладий в руках Хека позволил осуществить чистое (без побочных продуктов) кросс-сочетание. Ниже показан пример одной из реакций. На первой стадии (рис. 5.37) бромбензол реагирует с металлическим палладием, образуется палладийорганическое соединение – палладий встраивается между С и Br. Внешне это напоминает реакцию Гриньяра, только вместо Mg участвует Pd.
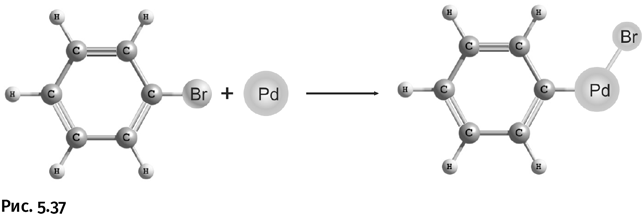
Затем к этому соединению приближается второй компонент реакции – этилен, возникает координационное взаимодействие между атомом палладия и молекулой этилена, иными словами, палладий «подтягивает» к себе этилен. Двойная связь этилена раскрывается, к одному концу присоединяется бензольное ядро, к другому – PdBr. Возникает переходный комплекс (вторая структура на рис. 5.38), в котором образуется связь между атомами углерода в бензольном цикле и в этилене. Затем атом водорода у этилена и атом брома отрываются от комплекса в виде HBr, который удаляется из сферы реакции (показано пунктирными линиями и стрелками), кроме того, освобождается и атом палладия. В результате бензольное ядро оказывается соединенным с молекулой этилена, получается молекула стирола PhCH=CH2 (его используют, например, для производства широко распространенного полимера – полистирола).
Обратите внимание, весьма реакционноспособная двойная связь в этиленовом фрагменте сохранилась, соединились бензольное ядро и этилен. Первый компонент такой реакции – всегда органогалогенид RHal, где R – алкил, арил, винил. В роли второго компонента этой реакции непременно должен быть олефин – углеводород, содержащий двойную связь RCH=CH2.
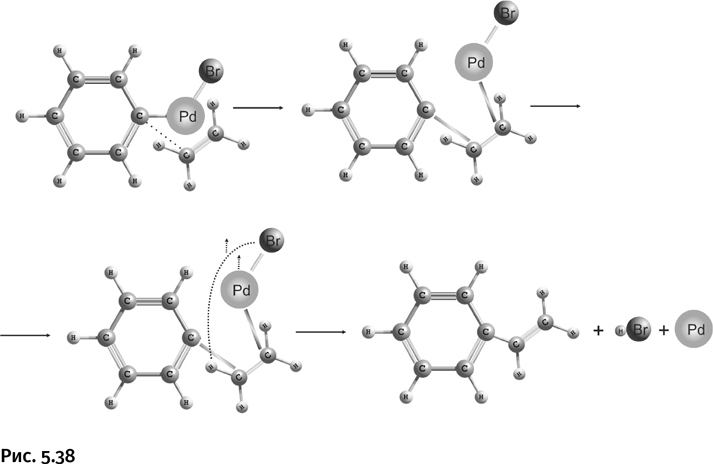
Важное отличие от реакции Гриньяра состоит в том, что атом палладия становится вновь доступным и может принимать участие в последующих таких же превращениях, т. е. играет роль истинного катализатора, а в реакции Гриньяра магний расходуется необратимо, превращаясь в галогенид магния. Достоинство реакции кросс-сочетания состоит в том, что процесс проходит при комнатной температуре, что позволяет получать различные термически нестойкие соединения.
Спустя некоторое время Ричард Хек довел открытую им реакцию до такого уровня, что ее стали использовать в крупнотоннажных производствах, а сам процесс стали называть по имени создателя реакцией Хека.
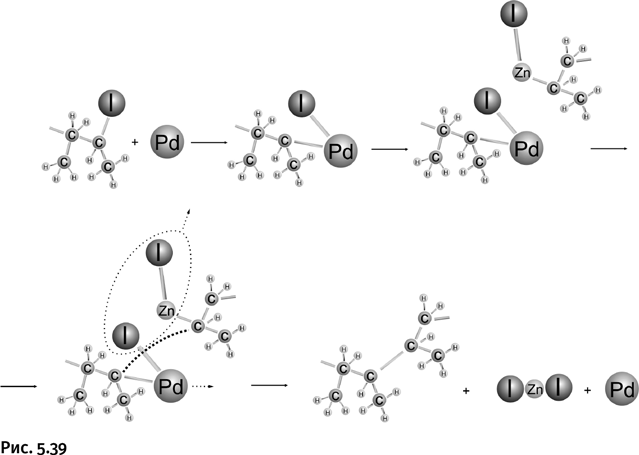
Второй из нобелевских лауреатов – Эйити Нэгиси – также занимался изучением каталитических реакций на палладии. В 1977 г. он предложил в реакции кросс-сочетания на роль второго компонента (вместо олефина) необычайно эффективный и удобный реагент – цинкорганическое соединение, т. е. содержащее связь Zn – C. Ниже показан пример такой реакции. Все начинается, как и в реакции Хека, со стадии взаимодействия галогеналкила (на рис. 5.39 показан алкилиодид) с палладием. В результате Pd встраивается между углеродом и иодом. Второй вводимый компонент – цинкорганическое соединение. Практически это тот же реактив Гриньяра, только магний заменен цинком. Цинковый аналог реактива Гриньяра в этой схеме играет не основную, а побочную роль.
В результате два атома углерода из двух разных молекул встречаются на атоме палладия и между ними возникает связь (на рис. 5.39 показано утолщенной пунктирной линией). Затем цинк и иод уходят в виде иодида цинка (показано пунктирным овалом и стрелкой), а освободившийся палладий готов к участию в следующем таком же цикле превращений.
Такой тип кросс-сочетания стали именовать реакцией Нэгиси, она проходит исключительно гладко и не приводит к образованию побочных продуктов.
Третий из лауреатов Нобелевской премии 2010 г. по химии – Акира Судзуки – в 1979 г. обнаружил, что роль второго компонента в реакции кросс-сочетания помимо рассмотренных олефинов и цинкорганических соединений могут играть борорганические соединения (содержащие связь С – В). Общая схема процесса близка к реакции Нэгиси. Процесс, названный реакцией Судзуки, еще больше расширил набор соединяемых органических групп, поскольку он проходит гладко даже в тех случаях, когда в R или R′ содержатся различные реакционноспособные функциональные группы. Кроме того, органические соединения бора не токсичны, что сделало эту реакцию популярной в фармацевтической промышленности.
Лесные и морские аптеки
Прежде чем мы разберем применение реакции кросс-сочетания, посмотрим, какие задачи ставит жизнь перед органической химией.
Не следует думать, что химики, разрабатывающие, например, новые лекарственные препараты, заняты только тем, что получают различные соединения и испытывают их биологическую активность на бактериях и мышах. С не меньшей энергией они ищут в окружающем животном и растительном мире вещества, которые могли бы помочь при лечении различных заболеваний.
До сих пор используют различные смеси целебных трав или снадобий в качестве лекарства. Однако, если наблюдается целительный эффект, химики первым делом пытаются выяснить, какой именно компонент вызывает лечебное действие, затем стараются выделить его в виде индивидуального соединения. После этого наступает этап направленного синтеза соединения, и лишь затем начинается получение похожих соединений с несколько измененной структурой для того, чтобы понять, какая часть молекулы оказывает лечебное действие и можно ли его усилить, направленно меняя структуру вещества.
В истории органической химии много ярких достижений, особенно заметны те, которые позволили спасти какой-либо живой организм. Речь идет не только о новых лекарствах, бывают и иные события, тоже по-своему драматические.
Наиболее показательна история с таксолом – эффективным препаратом для лечения рака молочной железы. В 1963 г. группа ученых из американского Института исследования онкологических заболеваний изучила более 300 000 (!) образцов различных растений, в результате из коры редкой породы дерева – тихоокеанского тиса (рис. 5.40) – было выделено вещество, позже названное таксолом, с высокой антираковой активностью.

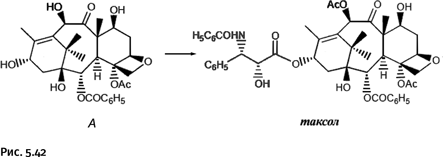
Оказалось, что тихоокеанский тис – очень редкое растение, одно из самых медленнорастущих на Земле. Чтобы выделить количество таксола, достаточное для лечения одного человека, нужно несколько столетних стволов этого дерева! Газеты тут же запестрели заголовками «Стоит ли дерево человеческой жизни?». Органическая химия в очередной раз блеснула мастерством, таксол удалось синтезировать и тем самым спасти редкий вид деревьев. Решение нашел в 1994 г. Роберт Холтон (рис. 5.41). Он разработал способ получения таксола из природного соединения А, которое в достаточном количестве содержится в легко возобновляемом источнике – хвое широко распространенного европейского тиса Taxus baccata (отсюда и название соединения «таксол»). Следует особо отметить, что эта работа была исключительно масштабной, поскольку Холтон вначале провел полный многостадийный синтез соединения А, оно оказалось удобной заготовкой для получения таксола. Сравнение структуры исходного соединения А и таксола показывает, что необходимо было заменить группу ОН на остаток уксусной кислоты и еще присоединить боковую цепь (рис. 5.42).
Получение таксола
В 1994 г. было начато производство этого лекарственного препарата (рис. 5.43). Затем удалось отказаться от хвои европейского тиса и производить таксол, не используя в качестве заготовки природное соединение. Полный синтез столь сложной молекулы удалось провести, используя на узловой стадии реакцию Хека.
«Зеленая аптека» постоянно предлагает настойчивым искателям новые лекарства: например, в мадагаскарском растении катарантусе и распространенном в Европе барвинке содержится эффективный противораковый препарат винкристин.
В последние годы исследователи все чаще проводят поиск в «морской аптеке», где необычные условия обитания и борьба за выживание сформировали некоторые виды растений и животных, обладающих мощными защитными механизмами.

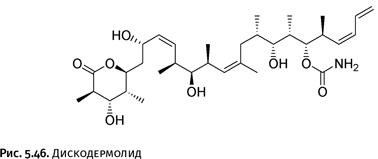
В начале 80-х гг. ХХ в. на дне Карибского моря была обнаружена морская губка Discodermia dissoluta (рис. 5.45). Это примитивное создание не имеет ни глаз, ни желудка, ни скелета, однако оно сохранило способность к выживанию благодаря тому, что умеет синтезировать ядовитое вещество дискодермолид (названо по имени самой губки), защищающее от нападения других существ. Оказалось, что дискодермолид – антираковый препарат, близкий по действию к описанному таксолу. Добывать губки не имело смысла, поскольку этот вид весьма немногочисленный и он, скорее всего, был бы просто уничтожен. На помощь пришла органическая химия, которая позволила осуществить синтез дискодермолида (его структура показана на рис. 5.46), причем некоторые наиболее важные стадии была проведены с помощью реакции Нэгиси.

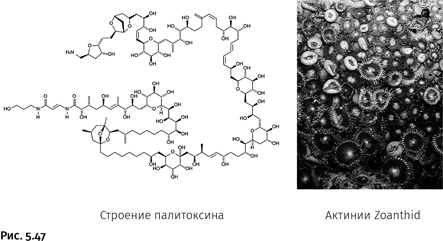
Пожалуй, самый эффектный результат использования кросс-сочетания (вариант реакции Судзуки) – это синтез палитоксина, ядовитого вещества, выделенного из кораллов Zoanthid, обитающих в районе Гавайских островов. Соединение, поражающее сложностью строения, представляет собой один из сильнейших ядов (рис. 5.47).
После того как оно было получено, стало возможным менять отдельные детали его структуры, чтобы выяснить, какая часть молекулы оказывает биологическое действие, а затем найти способ изменять активность вещества.
Реакции кросс-сочетания проложили дорогу для получения многих лекарственных препаратов сложного строения. Помимо таксола синтезированы морфин, дименицин, драгамацидин (впервые был обнаружен в морских губках, обитающих у берегов Италии), просульфурон, различные противовоспалительные лекарства, препараты от астмы и антигрибковые препараты для защиты сельскохозяйственных культур. Кроме того, эти реакции используют для получения новых полимеров, а также веществ, входящих в состав органических светодиодов, которые в перспективе позволят создать сверхтонкие дисплеи.

