Сноп валентных связей
Отдельные мысли похожи на лучи света,
но они утомляют, когда собраны в сноп.
ПЬЕР БУАСТ
Сколько может быть связей между двумя атомами? Атомы углерода могут быть связаны одной простой связью CH3-СН3, но существуют также двоесвязность (в этилене CH2=СН2) и три связи в ацетилене СН≡СН, кроме того, тройная связь присутствует в молекуле азота N≡N и в нитрильной группе – C≡N. Мы рисуем различное количество валентных черточек, но в тени остается вопрос: а как же это было доказано? Доказательствами занимаются не только математики, разбирающие теоремы, у химиков много сил уходит на то, чтобы подтвердить строение полученного вещества или схему пути, по которому протекает реакция, зато полученный результат становится твердо установленным фактом.
Металлы заявляют о себе
Сегодня мы знаем, что кратные связи не так уж редки среди соединений металлов, но так было не всегда. До 70-х гг. ХХ в. химики даже не подозревали о том, что возможны соединения, которые содержат фрагмент М=М (М – металл). Химикам была известна комплексная соль хлоридов цезия и рения CsCl·ReCl3; точнее будет ее изобразить по правилам координационной химии, где непосредственно вокруг рения, иначе говоря в его координационной сфере, находятся четыре иона Cl–, а катион Cs+ расположен вне этой сферы Cs+[ReCl4]– (координационную сферу принято обозначать квадратными скобками).

В 1963 г. американский химик Ф.А. Коттон из Массачусетского технологического института (рис. 2.43), изучив эту соль с помощью рентгеноструктурного анализа, установил, что истинный ее состав соответствует утроенной формуле Cs3+[Re3Cl12]3–. Самое главное – атомы рения расположены в вершинах треугольника и связаны между собой двойными связями (ионы Cl–, поставляемые хлоридом цезия, присоединены пунктирными линиями) (рис. 2.44).
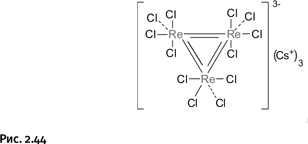
Возникает естественный вопрос: как Коттон установил, что связи между атомами рения двойные? Структурные исследования показали, что расстояние Re – Re заметно меньше, нежели в соединениях рения с одинарной связью, и даже короче, чем расстояния между атомами в металлическом рении. Кроме того, с помощью квантовохимических расчетов удалось определить кратность связи, которая оказалась равной 2 (т. е. связь двойная).
С этого соединения начался новый раздел химии, изучающий кратные связи между атомами металлов, затем появились подобные структуры с ниобием, танталом, молибденом, вольфрамом (рис. 2.45).
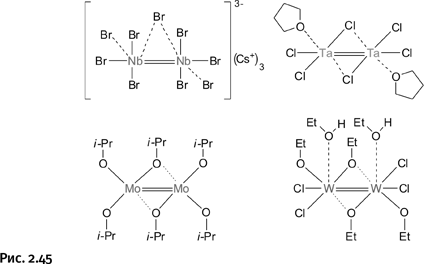
Показанные структуры заметно отличаются друг от друга, в некоторых присутствуют мостиковые лиганды, связывающие одновременно два атома металла. В роли связывающих групп выступают не только ионы (Br– или Cl–), но и алкоксигруппы R – O–. Общее у показанных молекул – двойная связь между атомами металлов.
Глядя на показанные выше структурные формулы, можно легко определить степень окисления металла в соединении, т. е. сколько электронов он отдал на образование связей. Для этого надо пересчитать количество валентных палочек, отходящих от атома, двойную связь, естественно, надо считать как две палочки (пунктирные координационные связи не учитываются). Таким образом, для всех показанных структур мы получим Re(VII), Nb(V), Ta(V), Mo(V), W(VI). Знание этого оказалось важным при получении последующих соединений.
Из уважения к органической химии, где двойная связь между атомами углерода давно была известна, такие соединения называли некоторое время этиленоподобными.
Тройная связь тоже возможна
Если углерод и азот образуют тройные связи, то, может быть, это возможно и для металлов? Предположение оказалось правильным, и вновь лидером стал рений, который в руках Коттона сумел опять удивить химиков (рис. 2.46).
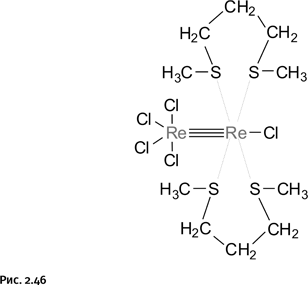
Соединение весьма необычно тем, что в нем атомы рения имеют различную степень окисления – VII и IV. Удалось получить это соединение благодаря использованию координирующего лиганда – дитиогептана Me-S-(CH2)3-S-Me. Сейчас даже трудно предположить, что побудило автора к его использованию, по-видимому напряженный поиск плюс удача привели к очередной победе. Вслед за этим другие авторы получили «троесвязанные металлы» Mo, W, Os и др. Обычно так и бывает: если кому-то удается показать, что это возможно, то сразу оказывается, что подобное могут сделать и другие (рис. 2.47).
Как видим, единого способа получения таких соединений нет, каждый металл предпочитает свое индивидуальное окружение, поэтому синтез любого из них – это терпеливый поиск и экспериментальное мастерство. В соединении, содержащем осмий, находятся четыре лиганда – оксипиридина, расположенные наподобие четырехлопастной турбинки. Интересно, что эта турбинка может свободно вращаться вокруг оси Cl – Os≡Os – Cl как своеобразный нановентилятор.
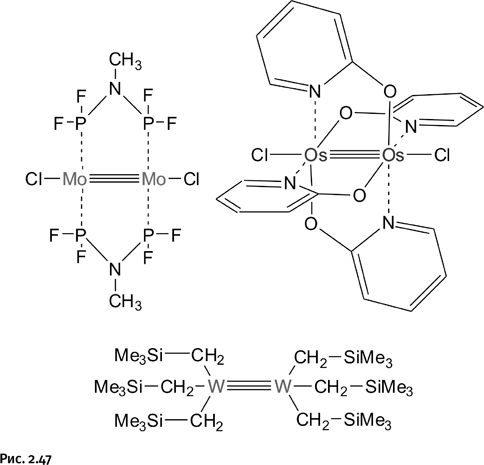
Может быть, следует вновь отдать дань уважения органической химии и назвать такие соединения ацетиленоподобными? Такой термин не утвердился, возможно, потому, что это было не так важно: основные усилия были направлены на поиск новых, еще более неожиданных соединений.
Возможна ли четверная связь?
Возлагать надежды на углерод и азот не приходится, поскольку в соединениях с тройной связью использованы все имеющиеся у них s- и p-электроны и им сделать еще одну связь просто не из чего. Зато такая возможность есть у переходных металлов, которые отличаются от непереходных тем, что они дополнительно содержат неспаренные d-электроны. Читатель ожидает вновь увидеть слова «рений» и «Коттон». Так оно и есть! Коттону не пришлось даже подбирать хитроумные лиганды, необходимо было лишь правильно расшифровать структуру давно известной комплексной соли K2Re2Cl8 (рис. 2.48).
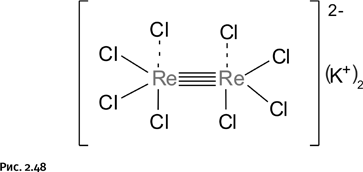
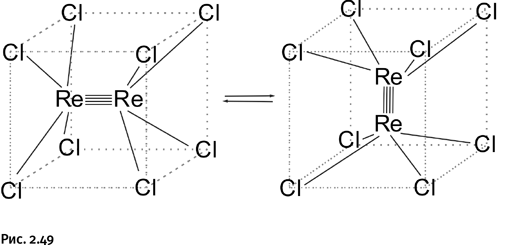
Были получены аналогичные соединения с другими катионами (Na+, Cs+) и различными анионами: сульфатными, изоцианатными, карбоксилатными и др. Группировку [Re2Cl8]2– Коттон назвал классическим образцом четырехкратной связи, где атомы хлора расположены в вершинах мысленного куба. У этого аниона есть одно необычное свойство: атомы рения, оставаясь связанными между собой, могут повернуться и занять положение, перпендикулярное исходному, а атомы хлора, расположенные в вершинах куба, при этом остаются неподвижными (рис. 2.49).
Таким образом, два соединенных атома рения вращаются внутри кубической емкости, и все это несколько напоминает кувыркающуюся рыбку в аквариуме:
Среди других «четырехсвязных» примеров упомянем ацетаты хрома, молибдена и вольфрама, напоминающие строением осмиевый «нановентилятор», о котором говорилось выше (рис. 2.50).
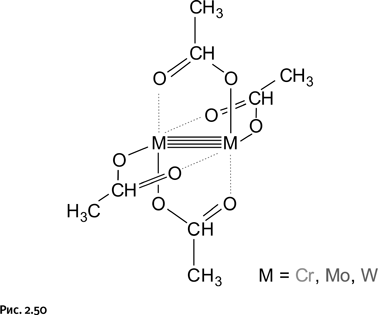
В данном случае также не потребовалось затевать сложный синтез: это обычные, давно известные ацетаты металлов, просто раньше никто не мог предположить, что в них существует четырехсвязность; новое понимание пришло благодаря работам Коттона.
Интересно, что соединений с четырехсвязным фрагментом металл – металл получено гораздо больше, чем с двойной и тройной связью вместе взятых: например, молекул с четырехсвязными атомами Мо получено свыше 100. Природа как будто бы хочет нам показать, что ничего необычного в четырехсвязности нет, и это ей в какой-то степени удалось: сегодня такие соединения стали вполне привычными и никого не удивляют, однако химия всегда умеет порадовать сюрпризом.
Рекорд!
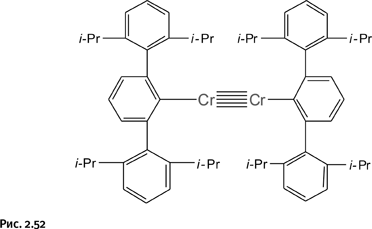
Получена пятикратная связь между двумя атомами металла, только на этот раз металл не рений и имя первооткрывателя иное. В 2005 г. американский химик Ф.П. Пауэр из Калифорнийского университета в г. Дэвисе (рис. 2.51) сообщил о синтезе молекулы, содержащей два пятикратно связанных хрома (рис. 2.52).

Согласитесь, что внешний вид такого солидного снопа из пяти валентных связей с непривычки режет глаз. Полученное соединение представляет собой темно-красное кристаллическое вещество, стабильное на воздухе, не разлагающееся до 200 °С, но не устойчивое к действию влаги. Окружающие объемистые группы введены для того, чтобы затруднить возможное взаимодействие соседних молекул и придать веществу стабильность. Наличие пятикратной связи доказано комплексом исследований: рентгеноструктурным анализом, спектральными исследованиями, квантовохимическими расчетами и магнитными измерениями, которые могут показать количество неспаренных электронов в молекуле. Поскольку таковых не оказалось, то, следовательно, все электроны атомов хрома участвуют в образовании связей.
Пауэр, прекрасно понимая, чьим преемником оказался, в начале своей статьи отдает дань уважения Коттону, который удивил химический мир открытием кратных связей металл – металл, после чего, по словам Пауэра, вся неорганическая химия стала несколько иной. Свою заслугу он оценивает скромно, полагая, что полученная пятикратная связь не столь неожиданна, нежели открытая Коттоном четырехкратная связь. В завершение он выражает надежду, что за полученным соединением последуют другие, ему подобные, и заканчивает статью, цитируя слова Коттона: «Это красивая, очаровательная химия».
Соединения с кратными связями металл – металл уже заняли свое заметное место в химической науке, подобно тому как кратные связи углерод – углерод буквально заполнили всю органическую химию.

