Книга: 0,05. Доказательная медицина от магии до поисков бессмертия
Назад: Глава 14 Золотой стандарт
Дальше: Часть шестая Врачи, маркетологи… и снова маги
Глава 15
Доказательная медицина
Еще один шотландец
Арчи Кокрейн родился в 1909 году в шотландском городке к югу от Эдинбурга в образованной и обеспеченной семье. Он получил естественнонаучное образование в Кембриджском университете, где некоторое время занимался исследованиями, но работа, оторванная от реальной жизни, его разочаровала. Не настроенный посвятить свою жизнь фундаментальной науке, Кокрейн уехал в Вену, где начал изучать медицину, а затем в Лондон, чтобы продолжить образование. Однако разнообразные интересы и беспокойный характер никак не позволяли его завершить. Интерес к политике привел его в 1936 году в Ассоциацию врачей-социалистов, отправлявшую медсестер и врачей добровольцами в Испанию, где шла гражданская война. Вернувшись, Кокрейн наконец закончил обучение, однако медицинская практика была недолгой: началась Вторая мировая.
Кокрейн присоединился к Медицинскому корпусу Королевской армии и оказался на Крите, а после вторжения немецкой армии на Крит – в числе 17 тысяч военнопленных. Его отправили в лагерь в Салониках. Как единственный врач, говоривший по-немецки, Кокрейн был, “невзирая на отсутствие желания и квалификации”, назначен лагерной администрацией руководить больницей для заключенных.
Больница представляла собой барак на двести коек, где из лекарств были только аспирин и неэффективный антисептик. В условиях полной антисанитарии и скопления огромного количества ослабленных людей одна эпидемия сменяла другую. И как будто дифтерии, тифозной лихорадки, малярии и гепатита было недостаточно, охранявшие лагерь солдаты развлекали себя стрельбой по больнице. Двух санитаров застрелили, один потерял руку, а особо забавным охране казалось кидать гранату в переполненный людьми туалет барака.
Вскоре Кокрейн столкнулся с новой бедой – болезнью, на которую жаловалось все больше людей и которую он не мог объяснить. У пленных, в том числе у него самого, появились сильные отеки в области локтей и коленей. Порывшись в памяти, он решил, что это симптомы бери-бери – заболевания, вызванного недостатком витамина B1. Объяснение казалось правдоподобным: малосъедобный лагерный рацион, содержавший всего 400–500 калорий, не мог обеспечить витаминами, военнопленные были сильно истощены. Когда попытки убедить немецких врачей увеличить рацион ни к чему не привели, Кокрейн вспомнил своего героя и земляка Джеймса Линда.
Он раздобыл на черном рынке лагеря немного дрожжей и, на случай если имеет дело с симптомами цинги, несколько таблеток витамина С. Утром он отобрал двадцать молодых военнопленных с выраженными симптомами болезни и произнес перед ними пламенную речь о Джеймсе Линде. Заручившись их согласием на участие в эксперименте, он освободил две палаты, пронумеровал пациентов и поместил четных в одну палату, а нечетных в другую. Пациенты первой палаты получили дрожи, вторая выполняла роль контрольной. Помогавшие Кокрейну санитары измеряли количество выпитой жидкости и частоту мочеиспускания. Поскольку не было ни одной лишней емкости для измерения объема мочи, такой примерный способ оценки количества выделяемой жидкости был единственным доступным.
В первые два дня никакой разницы между палатами не наблюдалось, но на третий забрезжила надежда, а на четвертый разница стала очевидна. Улучшение наступило у тех, кто получал содержащие витамин B1 дрожи, и это подтверждало бери-бери. Не питая никаких надежд, Кокрейн сообщил о результатах эксперимента руководству лагеря, и, к его немалому удивлению, щедрые порции дрожжей стали через некоторое время частью рациона узников. Загадочные отеки постепенно сошли на нет и больше не давали о себе знать.
Как ни гордился Кокрейн этой маленькой победой, после войны его ждало разочарование. Зарывшись в медицинские книги, он выяснил, что отеки были не симптомами бери-бери, а признаками гипопротеинемии – вызванного голодом сильного снижения содержания белка в крови. Он так и не смог объяснить, почему помогли дрожжи. Возможно, даже небольшое количество дополнительных калорий и минимальное количество белка, которое они внесли в рацион военнопленных, переломили ситуацию. Впоследствии он написал об этом эксперименте статью, которую назвал “Болезнь в Салониках: мое первое, худшее, но самое успешное клиническое испытание”, где честно описал все недостатки исследования и признал, что успехом был обязан исключительно везению.
После войны Кокрейн продолжил изучать медицину. Его профессором статистики был тот самый Остин Брэдфорд Хилл, который планировал знаменитый стрептомициновый эксперимент и доказал связь курения с раком легких. По признанию Кокрейна, лекции Хилла произвели на него огромное впечатление и определили область его интересов на всю жизнь. По окончании обучения он некоторое время проработал в США, где заинтересовался рентгеновской диагностикой, в частности субъективностью этого метода и ошибками при интерпретации снимков.
Когда Кокрейн вернулся в Великобританию, его пригласили в Совет по медицинским исследованиям. Там он проводил наблюдательные исследования, а затем участвовал в разработке рандомизированных клинических испытаний, среди которых известное РКИ, показавшее, что аспирин можно использовать для профилактики сердечно-сосудистых заболеваний.
В начале 1970-х Кокрейна попросили подготовить лекцию по оценке работы Национальной службы здравоохранения Великобритании. Итогом была изданная в 1972 году книга “Результативность и эффективность: случайные размышления о медицинской службе”. Этой небольшой книге суждено было стать одним из самых важных медицинских текстов XX века.
Кокрейн обратил внимание на то, что первые пятнадцать лет существования этой отвечающей за здравоохранение организации в ней в принципе отсутствовала оценка отдачи от потраченных средств. И правительство, и общество исходили из принципа “чем больше медицины, тем лучше”. Затраты на здравоохранение, количество трудоустроенных в нем людей, выписанных рецептов и проведенных обследований увеличились за это время в полтора раза. Но ни один человек не мог сказать, оправданы ли эти затраты, возвращаются ли инвестиции в виде спасенных человеческих жизней или сокращения сроков стационарного лечения. Кокрейн стал первым, кто смог ответить на этот вопрос. Увы, он пришел к выводу, что огромная махина системы здравоохранения работала почти вхолостую. Причину он видел в том, что прилагаемые усилия – методы лечения, принципы диагностики, подходы к принятию решения о госпитализации, – как правило, не опирались на качественные доказательства их эффективности и применялись потому, что “это должно работать”.
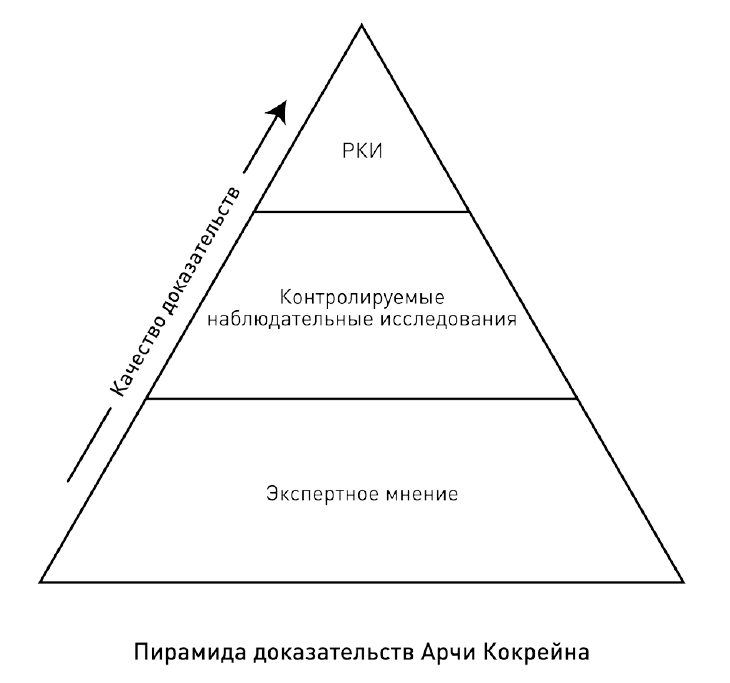
Разные доказательства, подчеркивал Кокрейн, имеют разную силу. Он ввел представление об их иерархии. В самом низу пирамиды доказательств Кокрейн разместил экспертное мнение. Частное мнение со ссылкой на личный опыт или сложившуюся практику – худшее из доказательств. Однако оно доминирует в медицине и становится основой значительной части клинических решений. Оно опасно непрозрачностью, мешающей его проверить, и тем, что статус и авторитет человека, от которого оно исходит, помогают даже ошибочному мнению звучать убедительно.
Выше экспертного мнения в пирамиде доказательств Кокрейн расположил контролируемые наблюдательные исследования. Сравнение двух групп и использование измеряемых данных уже само по себе более надежно. Однако нельзя забывать про главный недостаток наблюдательных исследований – невозможность исключить спутывающие переменные. Кокрейн приводит в пример забавное исследование, проведенное его коллегой. Тот изучил частоту курения среди школьников и повторил опрос через год, чтобы оценить, стали ли они курить больше. Он обнаружил удивительную закономерность: те школьники, кого наказывали за курение, стали курить больше. Вероятно, вопреки его выводам причина была не в порке. Группы поротых и непоротых могли сильно отличаться: те, кто изначально много курил, чаще попадались и чаще бывали наказаны, чем те, кто лишь изредка притрагивался к сигаретам.
Однако Кокрейн считал, что в тех случаях, когда эффект незамедлителен и ярко выражен, наблюдательные исследования можно принимать в качестве доказательств. В пример он приводил лечение диабета I типа инсулином. Впадающий в диабетическую кому больной неизбежно погибает, и только благодаря введению инсулина он может остаться в живых. Это настолько наглядно, что рандомизированный эксперимент в такой ситуации избыточен.
Мы редко имеем дело с таким мощным и немедленным эффектом, поэтому выше всего в иерархии доказательств Кокрейн разместил рандомизированные клинические испытания. Только они позволяют исключить спутывающие переменные и по-настоящему оценить эффективность и безопасность лекарства. Доказательная сила РКИ сильно зависит от его качества. Оно тем убедительнее, чем больше приложено усилий, чтобы исключить осознанные искажения или невольные ошибки в ходе эксперимента и статистического анализа – они могут полностью свести убедительность рандомизированного клинического эксперимента на нет.
Кокрейн выделил в здравоохранении несколько проблемных областей. В первую очередь он обратил внимание на то, что эффективность большинства применяемых методов лечения ничем не подтверждена. Хотя рандомизированные клинические испытания уже вовсю проводились, лишь немногие лекарства и процедуры были проверены с их помощью. Это не значило, что они неэффективны: они могли быть полезны, бесполезны или даже вредны. Но лечение наугад было недопустимо ни с точки зрения заботы о пациенте, ни с точки зрения разумного использования ограниченных средств налогоплательщиков.
Не только выбор лечения – любое решение, касающееся пациента, должно быть обосновано. Например, решение о госпитализации. Рандомизированное исследование показало, что лечение пациентов с неосложненным инфарктом миокарда в больнице на тот момент не давало никаких преимуществ по сравнению с лечением на дому: ни выживаемость, ни сроки выздоровления не менялись. Из этого следовало, что правильнее оставлять таких пациентов дома, освобождая нужные другим больничные койки и медицинский персонал. Да и пациенту часто комфортнее находиться в привычной обстановке, с близкими. До эксперимента никто не считал нужным проверять полезность госпитализации. Считалось очевидным, что она полезна – слишком много медицины не бывает.
Еще одна проблема, которую обозначил Кокрейн, – недоказанность пользы диагностических скринингов. Скринингом называют массовое обследование не имеющих симптомов людей для раннего выявления какой-либо болезни. В качестве примера Кокрейн привел цитологический мазок с шейки матки, или, как его еще называют по имени создавшего метод греческого ученого, мазок Папаниколау, помогающий находить изменения, предшествующие раку. Кокрейн настаивал на том, что полезность и безопасность диагностического скрининга тоже нужно обосновывать, больше диагностики – не значит лучше. Но не все были готовы это принять: стоило Кокрейну на одной из выездных лекций произнести: “Сейчас я не знаю надежных доказательств того, что цитологические мазки эффективны”, – как местную прессу завалили анонимными письмами, в которых его называли “опасным еретиком”. Хотя эффективность мазка Папаниколау была позже подтверждена, Кокрейн оказался прав: не все методы диагностического скрининга полезны для пациентов – мы поговорим об этом в следующей части.
Арчи Кокрейна принято называть основателем доказательной медицины. Однако впервые этот термин употребил в девяностые годы прошлого века, уже после смерти Кокрейна, канадский эпидемиолог Дэвид Сакетт. Он определил доказательную медицину как систематическое использование при выборе лечения лучших из существующих сейчас доказательств. Росту ее влиятельности помогла компьютеризация, повлекшая за собой создание баз медицинских публикаций, таких как PubMed. Они распространялись среди врачей сначала на твердых носителях, например компакт-дисках, а затем, по мере распространения интернета, стали доступны онлайн.
Основной принцип доказательной медицины – прозрачность. Любое клиническое решение должно иметь под собой убедительное обоснование, которое может быть проверено другими людьми. Недостаточно сослаться на опыт или на тайны врачебного искусства. Нужно быть готовым объяснить, почему из возможных альтернатив выбрана именно эта.
Из прозрачности следует второй принцип – равноправие. На протяжении тысячелетий авторитет и статус врача играли решающую роль. Стаж, звания и традиции сами по себе служили лучшими доказательствами. Фраза “так подсказывает мой клинический опыт” была главным аргументом в любом споре. Но для доказательной медицины решение интерна, может быть лучше мнения умудренного опытом профессора, если за первым стоят высококачественные доказательства полезности для пациента.
Прозрачность создает возможность критической оценки доказательств. Если Арчи Кокрейн в свое время писал, что необходимо проводить больше РКИ, сейчас, когда базы медицинских исследований содержат миллионы работ, мы столкнулись с другой проблемой – необходимостью интерпретировать противоречивые результаты и оценивать сами исследования. Вместо проблемы количества нужно решать проблему качества и применимости.
28 миллионов исследований
Именно столько содержит крупнейшая база научных публикаций PubMed, и большая часть из них касается медицины и здоровья. Не удивительно, что в PubMed можно найти исследование, посвященное практически любому вопросу. Мой личный топ включает эксперимент по изучению влияния кокаина на танец пчел, двойное слепое рандомизированное испытание, сравнивающее изменение уровня счастья после приема темного и молочного шоколада, а также эссе о пользе глупости в научных исследованиях. Но вне конкуренции исследование влияния ткани, из которой сделано нижнее белье, на сексуальную активность. По каким-то причинам автор не смог организовать эксперимент на людях и был вынужден использовать лабораторных крыс. Абстракт – краткое резюме исследования – стоит того, чтобы быть процитированным.
Эффекты ношения тканей разных типов на сексуальную активность были изучены на 75 крысах, которых разделили на пять равных групп: четыре экспериментальных и одну контрольную. Каждая из четырех экспериментальных групп была одета в трусы из одного из следующих типов ткани: 100% полиэстер, смесь полиэстер/хлопок 50/50, 100% хлопок и 100% шерсть. Сексуальная активность была оценена до, а также через 6 и 12 месяцев ношения трусов, а также через 6 месяцев после того, как трусы были сняты. Было посчитано соотношение (I/M) количества половых актов (I) к их попыткам (M). С помощью статического киловольтметра был замерен электростатический потенциал, генерируемый на пенисе и мошонке. Через 6 и 12 месяцев ношения трусов из полиэстера и полиэстер-хлопковой смеси значение I/M заметно снизилось по сравнению со значениями до ношения и с контрольной группой (p < 0,0001)… Значение I/M в группе хлопка и шерсти показало статистически незначимое изменение (p > 0,05) на 6-й месяц и значимое (p < 0,01) на 12-й месяц. Через 6 месяцев после того, как трусы были сняты, значения I/M вернулись во всех группах к уровню начала эксперимента. Трусы, содержащие полиэстер, генерировали, в отличие от остальных, электростатические потенциалы. Судя по всему, они могли создавать “электростатические поля” во внутрипенисных структурах, чем, возможно, и объяснялось снижение сексуальной активности крыс.
Впрочем, не спешите покупать шерстяное белье. Если вы внимательно читали предыдущие главы, то уже знаете, почему делать далеко идущие выводы из этого абстракта преждевременно.
Конечно, основная проблема огромного количества накопленных данных не в странных работах, а в том, что поднимающие серьезные вопросы клинические испытания и наблюдательные исследования приходят к взаимоисключающим выводам. Или имеют другие недостатки, которые мешают использовать их для принятия клинических решений. Увы, большого количества РКИ оказалось недостаточно. Поэтому понадобился еще один этаж пирамиды доказательств – работы, которые подверглись критическому анализу со стороны незаинтересованных специалистов.
Одной из первых попыток систематического критического анализа было введение большинством научных, в том числе медицинских, журналов механизма научного рецензирования. Его суть в том, что несколько независимых специалистов читают статью перед публикацией и пишут на нее отзыв. Если он негативен, например, рецензент считает, что исследование не очень ценно или плохого качества, статья не будет опубликована.
Идея хороша, но на практике работает не всегда. Существенным недостатком научного рецензирования является его непрозрачность: никто, кроме самого журнала, не видит рецензию и даже не знает, кто ее автор. Как следствие, качество рецензий бывает низким, они не всегда объективны. В худших случаях рецензирование может превратиться в полную имитацию. Качество многих публикаций наводит на мысль о том, что либо рецензенты их не читали, либо никаких рецензентов не было. В большей степени это касается журналов, которые берут с авторов деньги за публикацию.
Замечательный эксперимент провели три студента Массачусетского технологического института, создавшие SCIgen – программу, генерирующую случайные наукообразные тексты. Написанная программой статья Rooter: A Methodology for the Typical Unification of Access Points and Redundancy была принята в качестве материала компьютерной конференции, а авторы получили приглашение на ней выступить. Когда мистификация вскрылась, организаторы конференции отозвали приглашение, однако это не помешало создателям SCIgen снять помещение в здании напротив и выступать там с лекциями столь же случайного содержания. В России эксперимент повторил биоинформатик Михаил Гельфанд, который перевел статью на русский и отправил ее в якобы рецензируемый “Журнал научных публикаций аспирантов и докторов”. Заведомая бессмысленность не помешала статье “Корчеватель: алгоритм типичной унификации точек доступа и избыточности” получить положительную рецензию и быть опубликованной. Рецензент, если он существовал, не заметил даже встроенную в текст благодарность автора “профессору М. С. Гельфанду, привлекшему мое внимание к проблеме публикации случайных текстов”. Судя по всему, у пасхальных яиц, запрятанных глубже – в списке использованной литературы фигурировала статья автора по фамилии Софтпорн (от англ. soft porn, “мягкое порно”), – не было вообще никаких шансов привлечь внимание. Всего не менее ста рецензируемых журналов по всему миру опубликовали созданные с помощью SCIgen статьи.
Причины закрытости рецензирования понятны: никто не хочет нажить себе врагов среди коллег. Единственный способ обойти проблему – распределить оценку на очень большое количество экспертов. Поскольку журналы не могут себе позволить платить за рецензии сотням или даже тысячам специалистов, приходится полагаться на волонтеров. Внедрить такой подход пытается, например, система EvidenceAlerts, поддерживаемая канадским Университетом Макмастера. Она предлагает подписчикам отобранные статьи, прошедшие оценку панели из более чем пяти тысяч экспертов, выставляющих публикациям рейтинг доказательности.
Другой подход пыталась внедрить система PubMed. Экспериментальный сервис PubMed Commons давал возможность всем зарегистрированным пользователям оставлять комментарии к опубликованным статьям и обсуждать их. К сожалению, эксперимент провалился: за пять лет существования PubMed Commons к 20 миллионам содержащихся в базе работ было оставлено всего 6 тысяч комментариев, и проект закрылся. Критический анализ медицинских научных публикаций – процесс трудоемкий, и лишь у немногих хватает мотивации заниматься этим на общественных началах.
Единственным распространенным и эффективным инструментом анализа публикаций пока остаются вторичные исследования, по праву занимающие место на вершине современной версии пирамиды доказательств. В первую очередь это систематические обзоры. Обзор литературы – распространенный жанр, но систематическим он может называться, только если содержит детальное описание методики поиска и критериев включения публикаций в обзор. Это нужно, чтобы любой мог оценить его объективность и при желании повторить. Доказательность систематических обзоров выше, чем у отдельных РКИ, поскольку они суммируют выводы всех исследований надлежащего качества на эту тему.
Качество систематических обзоров зависит от использованной методики. Среди самых высококачественных – обзоры Кокрейна (ранее – Кокрейновское сотрудничество), названной в честь Арчи Кокрейна некоммерческой организации. Она создана в 1993 году, чтобы помогать врачам, пациентам, законодателям и управляющим медицинской помощью организациям принимать основанные на доказательствах решения. Она объединяет несколько десятков экспертных групп и более 30 тысяч добровольцев по всему миру. Репутация Кокрейна столь серьезна, что он является официальным партнером ВОЗ, имеет право назначать своего представителя для участия в заседаниях ВОЗ и выступать на них с заявлениями.
Систематический обзор часто включает метаанализ – статистическую процедуру, которая суммирует данные из нескольких исследований и делает на их основании общий статистический вывод. Результаты метаанализа представляют в виде лесной диаграммы. Вот как она выглядит.

Этот метаанализ был сделан для того, чтобы понять, применять ли кортикостероиды в случае риска досрочных родов. В конце 1970-х несколько исследований показали, что применение кортикостероидов увеличивает шансы ребенка выжить, поскольку снижает вероятность острого респираторного дистресс-синдрома (ОРДС) – воспалительного заболевания легких, часто приводящего к гибели новорожденного. Но выводы были неоднозначны, не все исследования продемонстрировали статистически значимый эффект.
Метаанализ суммировал их результаты. В каждом из семи экспериментов кортикостероиды сравнили с плацебо. Исследования подписаны именами авторов и годом публикации. Связанная с исследованием горизонтальная линия обозначает полученное отношение шансов (ОШ, англ. odds ratio) – отношение вероятностей исхода (в этом случае ОРДС) в группах. Если отношение шансов равно единице, то вероятность развития ОРДС одинакова с кортикостероидами и без них. Если меньше единицы, то кортикостероиды ее снижают, а значит, полезны. Если больше единицы, то повышают.
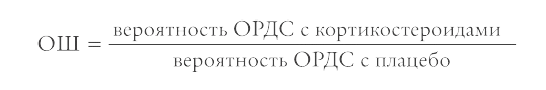
Длина отрезка обозначает доверительный интервал. Он отражает связанную с силой эффекта неопределенность: чем шире доверительный интервал, тем менее точно мы знаем, в какой точке расположено истинное значение ОШ. Точка на доверительном интервале – наиболее вероятное значение. Вертикальную линию под единицей называют линией отсутствия различий. Если доверительный интервал не пересекает линию отсутствия различий, между кортикостероидами и плацебо есть разница. Если пересекает или прикасается к ней, то мы не можем однозначно утверждать, существует разница между группами или нет. В нашем примере доверительные интервалы трех исследований из семи пересекают линию отсутствия различий, то есть статистически незначимы.
В результате специальной статистической процедуры данные отдельных исследований суммируют и получают общий вывод, показанный ромбом в самом низу лесной диаграммы. Видно, что общий доверительный интервал не пересекает линию отсутствия различий, его максимальное значение меньше единицы, а значит, мы можем говорить о том, что применение кортикостероидов статистически значимо снижает риск ОРДС. Этот метаанализ помог внедрить кортикостероиды в акушерскую практику и спасти жизни тысяч новорожденных. А лесную диаграмму его самой первой версии можно теперь увидеть на логотипе Кокрейна – для организации этот обзор стал одним из первых важных успехов.
Метаанализ решает сразу несколько проблем. Во-первых, он помогает сделать общий вывод на основе нескольких исследований, давших разные и даже противоречивые результаты. Во-вторых, метаанализ может обнаружить эффект, который отдельные эксперименты не обнаружили, поскольку количество участников в каждом из них по отдельности было слишком мало – им не хватало статистической мощности. Напомню, статистическая мощность характеризует вероятность, что эксперимент обнаружит существующий эффект.
Вовремя сделанный метаанализ может сберечь и ресурсы исследователей, и жизни. Авторы метаанализа экспериментов по уменьшению кровотечения во время операций на сердце с помощью апротинина обнаружили, что статистически значимый положительный результат мог быть получен еще в 1992 году. Для этого достаточно было сделать метаанализ после первых двенадцати исследований, в которых суммарно участвовало 2400 пациентов. Однако за ними последовало еще пятьдесят два клинических эксперимента, а общее количество пациентов достигло 8 тысяч. Сделанный раньше метаанализ мог не только сберечь ресурсы, но и предотвратить неэтичные исследования, в которых половина пациентов получала вместо эффективной терапии плацебо.
Увы, этот случай не уникален. Клинические испытания часто проводят без учета суммированных результатов более ранних. В 2005 году было подсчитано, что это происходит примерно в половине случаев. А если их и учитывают, то обычно не делают повторный метаанализ по окончании исследования, включив в него только что полученные результаты. Обзоры, которые обновляют свой вывод после каждой новой публикации, называют кумулятивными. Их использование помогает вовремя обнаружить, что данных накоплено достаточно, вывод подкреплен убедительными доказательствами и дальнейшие исследования нерациональны, неэтичны или вредны.
Таким образом, современная пирамида медицинских доказательств дополнена вторичными исследованиями – систематическими обзорами с метаанализом – и выглядит вот так.
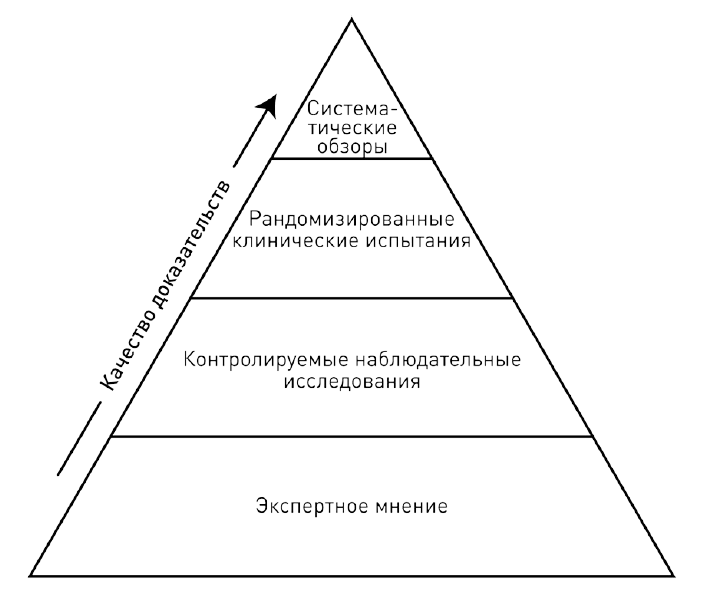
Находящиеся выше в иерархии виды доказательств не всегда и не безусловно лучше тех, что ниже. Каждый тип исследований оптимален именно для своих задач. Даже низко расположенные отчеты об отдельных случаях могут быть незаменимы. Они идеально подходят для того, чтобы быстро оповестить о возможной проблеме, например рассказать о подозрении на опасное побочное действие лекарства, как в случае публикации Макбрайда о возможной связи талидомида и фокомелии. А контролируемые наблюдательные исследования – когортные и случай-контроль – незаменимы для изучения факторов риска. Они потенциально полезны и для выявления отдаленных последствий применения лекарственных препаратов, поскольку могут охватить гораздо больший период, чем РКИ.
При всех уже названных преимуществах систематических обзоров нельзя абсолютизировать и их. Большое высококачественное РКИ более надежно, чем метаанализ нескольких маленьких. Увы, вторичные исследования хороши ровно настолько, насколько хороши работы, которые они суммируют. Нередко крупное РКИ хорошего качества приходит к иному выводу, чем предшествовавший ему метаанализ с небольшой выборкой.
В течение тридцати лет внутривенное введение кортикостероидов было стандартной практикой при оказании неотложной помощи больным с травмой головы. В 1997 году по результатам метаанализа 13 РКИ с общим числом участников около 2 тысяч было высказано предположение, что кортикостероиды несколько снижают смертность. За ним последовало плацебо-контролируемое клиническое испытание CRASH с 20 тысячами участников, которое показало, что смертность в получавшей кортикостероиды группе, наоборот, выше. Практика их применения при травме головы ежегодно приводила к 5 тысячам смертей.
Важно также помнить, что результаты не всех исследований публикуются. Поскольку неопубликованными остаются в основном исследования с отрицательным результатом, метаанализы могут переоценивать усредненный эффект. Обязательная регистрация клинических исследований помогает отследить те, что не завершились публикацией, запросить недостающие данные и учесть проблему в выводах.
Переход на личности
Как вы уже заметили, доказательная медицина опирается на средние показатели для некоторой популяции. Возникает резонный вопрос: насколько они касаются конкретного человека, имеют ли отношение лично ко мне, не описывает ли доказательная медицина лечение “сферического коня в вакууме”?
Действительно, очень немногие будут реагировать на лечение в точном соответствии со средним значением, полученным в ходе клинических испытаний: кто-то будет реагировать чуть лучше, кто-то чуть хуже. Не каждый испытает побочные эффекты, а те, кто испытает, будут переносить их по-разному. И дело не только в физиологических особенностях организма: они будут по-разному влиять на человека в зависимости от того, как он живет и какие у него ценности. Так, нарушение эрекции, иногда сопровождающее прием антидепрессантов, мужчина, состоящий в романтических отношениях, перенесет хуже, чем одинокий. А сонливость будет больше мешать человеку, ежедневно занятому интенсивным умственным трудом, и меньше пенсионеру.
Пародийный образ доказательной медицины, придуманный ее критиками, предполагает слепое принятие решений на основе цифр, без оглядки на здравый смысл и нужды конкретного пациента. Врач и правда может испытывать соблазн решить, будто он лучше пациента знает, что тому нужно. Но если он действительно практикует доказательную медицину, то помнит: лучшее лечение – то, что уменьшает страдания конкретного человека, а не то, что улучшает статистику или снижает количество койко-дней.
Учитывать в результатах РКИ качество жизни пациентов помогает относительно недавнее нововведение – заполняемые пациентами опросники PROM (англ. Patient Reported Outcome Measures). Хотя с помощью PROM по-прежнему определяют среднее значение для популяции, они помогают понять, как лечение влияет на те исходы, которые важны для пациента, но ранее игнорировались в ходе клинических экспериментов. Так, например, опросник EPIC-26, призванный определить качество жизни пациентов с раком простаты, содержит вопросы о непроизвольном мочеиспускании и сексуальной жизни.
В сочетании с данными о смертности и побочных эффектах оцененные с помощью PROM исходы помогают выбрать лечение, учитывающее потребности конкретного пациента. Полученные в ходе РКИ данные превращаются в индивидуальное назначение в процессе совместного принятия решения пациентом и врачом. Роль врача – дать пациенту основанную на лучших доказательствах информацию о существующих альтернативах и их возможных последствиях.
Интересной попыткой индивидуализации посредством эксперимента на конкретном пациенте стали исследования n-of-1 (англ. “с количеством участников, равным одному”). В ходе такого эксперимента каждый участник получает в случайном порядке разные лекарства.
Этот дизайн был опробован при подборе обезболивающих пациентам с остеоартритом. Некоторым хорошо помогал дешевый и имеющий немного побочных эффектов парацетамол. Другие же испытали достаточное облегчение лишь при приеме нестероидных противовоспалительных препаратов (НПВП), в среднем более эффективных, но более дорогих и имеющих больше побочных эффектов. Исследователи предположили, что, если просто чередовать разные лекарства, эффект парацетамола может маскироваться эффектом ноцебо – более дешевое лекарство будет воспринято как менее эффективное. Поэтому препараты приготовили в виде одинаковых таблеток, подписанных как А и Б. Каждый пациент получал их в случайной последовательности, не зная, что именно принимает. Хотя в среднем НПВП более эффективны, исследование помогло выделить пациентов, которым парацетамол помогал не хуже.
Какое-то время исследованиям n-of-1 прочили роль универсального решения проблемы персонализации. Однако на практике они не прижились. Во-первых, сказалась исключительная трудоемкость: организовать такой подбор лекарств в условиях клиники сложно и дорого. Во-вторых, слишком много больных отказывалось от участия: попробовав первое лекарство, они уже не хотели менять его на другое. В-третьих, последовательное сравнение ненадежно: на эффект второго лекарства может накладываться недавний прием первого. И эту проблему нельзя решить длительными паузами между эпизодами приема: оставлять пациента без лечения неэтично, к тому же это еще больше увеличивает отток пациентов. В конечном счете исследования n-of-1 так и не смогли продемонстрировать преимуществ.
☛ В онкологии делаются попытки экспериментально подбирать лечение для конкретного пациента путем проб чувствительности к химиотерапии (англ. сhemotherapy resistance/sensitivity assays, CSRA, анализ на устойчивость и ответ к химиотерапии). У пациента берут образец опухолевой ткани, выращивают клеточную культуру и проводят сравнительный эксперимент на ее чувствительность к разным комбинациям противоопухолевых препаратов. Пока убедительных данных за эффективность метода нет. Судя по всему, поведение опухолевой ткани в пробирке очень отличается от ее же поведения в организме. Кроме того, опухоль неоднородна, и разные ее участки могут по-разному отвечать на химиотерапию, поэтому сделанные на основе отдельных проб тесты не гарантируют такой же ответ всей опухоли и метастазов в теле пациента. С учетом этих ограничений врачам не рекомендовано опираться на результаты CSRA. Исследования продолжаются.Похожий подход – использование мышиных аватаров. Но в этом случае опухолевую ткань пациента не культивируют в пробирке, а пересаживают лабораторным животным с подавленным иммунитетом, что позволяет опухоли прижиться. Затем животным дают разные противоопухолевые препараты и смотрят, какой эффективнее. Таким образом, мы получаем сравнительный эксперимент с опухолевой тканью конкретного пациента в целом организме. Этому методу пока тоже не удалось продемонстрировать эффективность. Обычные опасения в связи с тем, что эксперименты на животных редко воспроизводятся на людях, справедливы и для данного случая: иммунные системы человека и других видов сильно различаются. Более того, недавно было показано, что после пересадки из организма человека животным опухолевые клетки претерпевают серьезные изменения. И есть еще одна проблема: подбор терапии на аватарах занимает очень много времени, а у пациентов с агрессивными видами рака часто нет времени ждать результатов.
С конца XX века развитие и удешевление технологий секвенирования генома, расшифровка и публикация полных геномов сначала вирусов и одноклеточных, а затем млекопитающих и человека порождали все больше надежд. Казалось, очень скоро развитие генетики, клеточной биологии и компьютерных технологий, помогающих анализировать лавинообразно нарастающие объемы информации, доведут понимание механизмов болезней до уровня, который позволит вылечить что угодно. Человеческий геном виделся ключом к решению всех проблем. Эксперты обещали, что в ближайшем будущем будет обнаружена связь между определенными его вариантами и самыми распространенными болезнями, в результате чего медицинская помощь станет глубоко персонализированной: мы сможем предсказывать и предотвращать болезни либо лечить их с помощью генной терапии. Эти надежды воплотились в невероятно популярном сегодня термине персонализированная медицина.
Реальность, как это часто бывает, оказалась несколько скромнее ожиданий. Чуда пока не произошло. Даже такое хорошо изученное генетическое заболевание, как серповидно-клеточная анемия, пока лечится только пересадкой костного мозга. Скоро будет семьдесят лет, как известны его причины: единственная неверная аминокислота в генном коде приводит к синтезу дефектного гемоглобина, что вызывает снижение эластичности эритроцитов и, как следствие, нарушение кровообращения. Но это точечное изменение запускает столь сложные биологические процессы, что лекарства пока найти не удалось. Попытки влиять на разные звенья в цепи патологии не дали результата. Сейчас надежды возлагают на редактирование дефектного кода с помощью технологии CRISPR, но пока ни один препарат не прошел клинических испытаний и не зарегистрирован.
Тем не менее термин “персонализированная медицина” уже зажил своей жизнью, хотя и получил иное содержание. Сейчас под ним понимают деление пациентов на группы на основе геномных данных для более эффективного подбора лечения. Самые заметные результаты этот подход демонстрирует в онкологии. Анализ генома опухолей позволяет отнести их, в зависимости от найденных мутаций, к той или иной подгруппе. И иногда какая-то из подгрупп оказывается чувствительной к препарату, в то время как опухоли, не имеющие этой мутации, на него не реагируют. В результате в среднем бесполезный для всех пациентов с раком определенного типа, например молочной железы, препарат может оказаться эффективным для небольшой части больных.
Один из первых успехов такого рода – препарат трастузумаб. Он представляет собой антитело, направленное на белок HER2, иногда участвующий в процессе опухолевого роста. Создатели трастузумаба подтвердили его эффективность только для тех раковых опухолей молочной железы, в которых выявлена амплификация гена, кодирующего этот белок, что наблюдается у 20–30% пациентов. Для остальных пациентов с данной болезнью трастузумаб не только бесполезен, но и может причинить вред, поэтому его назначают только после теста, подтверждающего эту особенность. Долго трастузумаб был единственным, но в последнее десятилетие появилось еще несколько препаратов, эффективных лишь при определенных мутациях опухолей.
Некоторые специалисты полагают, что мы стоим на пороге изменения подхода к классификации рака. До сих пор определяющими считались расположение опухоли и особенности ее клеток. Диагноз звучит, например, так: немелкоклеточный рак легкого. Именно в соответствии с этим диагнозом пациентов отбирают для клинических испытаний. Именно такой диагноз в случае успеха войдет в показания к применению нового препарата. При этом не исключено, что практичнее классифицировать опухоли не по месту расположения, а по определяющим их рост и метастазирование мутациям. Тогда у пациентов с немелкоклеточным раком легкого окажутся совсем разные болезни: опухоли с мутациями генов EGFR (рецептора эпидермального фактора роста), HER2 и другими. Такие же мутации встречаются у опухолей и в других органах. Возможно, отбор пациентов по мутациям, а не по месту расположению опухоли позволит найти новые препараты, которые в рамках традиционной классификации выглядели бы неэффективными.
Впрочем, пока мы не знаем, есть ли у этого направления будущее. Сейчас в США идет масштабное клиническое испытание NCI – MATCH, которое покажет, дает ли подбор лечения на основе генетических особенностей опухоли преимущества. Опубликованные в 2015 году результаты исследования SHIVA были неутешительны: этот подход никак не улучшал прогноз больных. Нельзя исключать, что сложность и изменчивость злокачественных опухолей обрекает любое простое решение на провал.
Попытки использовать данные о геноме самого пациента пока не приносят особых результатов. Немногочисленные успехи лежат в области фармакогеномики, исследующей влияние генетических особенностей человека на действие принимаемых им лекарств. Например, метаболизм некоторых лекарственных препаратов зависит от цитохрома CYP2D6. Так, лекарство от рака тамоксифен становится активным лишь после того, как с помощью этого фермента превращается в эндоксифен. Соответственно, у людей с разными вариантами кодирующего CYP2D6 гена могут наблюдаться как более выраженные побочные эффекты, из-за чего они отказываются от лечения, так и меньшая эффективность тамоксифена. Другой пример связан с препаратом абакавир. Это лекарство против ВИЧ может вызывать очень серьезные побочные эффекты, но лишь у небольшого процента пациентов. Исследования показали, что этому риску подвержены люди с вариантом гена (HLA) – B 5701. Поэтому заблаговременно сделанный генетический тест может предотвратить негативные последствия – пациенту назначат другой препарат. Важно добавить, что оба примера теоретические. На практике перед назначением этих лекарств генетическое тестирование, как правило, не делают.
Таким образом, персонализированная медицина не подразумевает абсолютно индивидуальную терапию для конкретного пациента. Мы по-прежнему опираемся на средние данные о некоторой популяции. Но в ряде случаев эти группы становятся меньше благодаря новым данным о механизмах болезни или о метаболизме лекарственных веществ. Поэтому все чаще используется более точный термин прецизионная медицина (от англ. precision – “точность”).
Прецизионная медицина – одна из самых модных тем медицинских исследований. Наряду с такими не менее распиаренными областями, как стволовые клетки и регенеративная медицина, фундаментальные исследования, так или иначе связанные с генетикой, получили в 2016 году больше половины многомиллиардного исследовательского бюджета Национальных институтов здравоохранения США. Хотя пока успехи скромны, в перспективе это направление действительно может улучшить жизнь многих больных. Но станет ли оно панацеей? Некоторые специалисты обращают внимание на то, что количество групп пациентов, выделение которых ощутимо влияло бы на качество и продолжительность жизни, невелико. Поэтому возможности такой “персонализации” весьма ограниченны. Другие указывают на несоответствие эффекта и потраченных на его получение сумм. Возможно, дорогостоящая разработка препаратов, которые будут лишь чуть-чуть эффективнее у очередной небольшой подгруппы, – не лучший вектор приложения усилий. Не стоит ли вместо этого сосредоточиться на других вещах? Ведь отказ от курения, правильное питание и изменение образа жизни куда радикальнее снижают смертность от рака.
Один из неприятных побочных эффектов моды на персонализацию: под флагом прецизионной медицины продвигается идея, будто бы рандомизированные клинические испытания устарели. Все чаще можно слышать, что доказательная медицина теряет актуальность и прецизионная идет ей на смену. Якобы со временем экспериментальные доказательства эффективности препарата можно будет заменить правильными рассуждениями о механизме его действия, которые не придется подтверждать на практике. Если вы внимательно читали эту книгу, то уже знаете, что это стало бы движением в обратную сторону и вернуло бы медицинские исследования туда, где они были сотни лет назад.
Выбор терапии без экспериментальных доказательств эффективности чреват как серьезными побочными эффектами, которые нельзя предсказать теоретически, так и неоправданными надеждами на действенность препарата. Да, в исключительных ситуациях регистрирующие организации соглашаются выпустить на рынок препарат без РКИ. Это возможно, если лекарство предназначено для лечения редких и смертельно опасных болезней. Так, кризотиниб был зарегистрирован в 2011 году для лечения одного из вариантов немелкоклеточного рака легкого на основе клинических испытаний первой фазы на 119 пациентах без контрольной группы: использование контроля сочли неэтичным. Препарат показал эффективность для лечения опухолей, имеющих редкую мутацию, которая встречается лишь в 4% случаев. Однако за ускоренной регистрацией последовали РКИ, которые, с одной стороны, показали, что кризатиниб более эффективен, чем стандартная терапия, а с другой – что он менее эффективен, чем препарат алектиниб, действующий на опухоли этого типа. Сравнительное испытание пришлось прекратить досрочно, поскольку выживаемость без прогрессирования в группе алектиниба была в два с половиной больше, чем в группе кризатиниба. Без РКИ мы никогда не узнали бы, насколько эти два лекарства неравноценны.
Итак, хотя учитывать при выборе лечения индивидуальные особенности пациента и его заболевания необходимо, успехи в этом направлении пока скромны. Но уже сейчас можно сделать в сторону персонализации большой шаг, который не потребует многомиллиардных вложений. Для этого достаточно прислушиваться к пациенту и стремиться к результатам, важным для него, а не для врача или управляющих здравоохранением организаций.

