Книга: Нестареющий мозг
Назад: Глава пятая На грани отчаяния: из лаборатории в клинику и обратно
Дальше: Часть третья Диагностика и индивидуальный терапевтический подход
Глава шестая
Ген Бога и три типа болезни Альцгеймера
«Человек носит в своем физическом строении неизгладимую печать низкого происхождения».ЧАРЛЬЗ ДАРВИН
Что ж, пора вздохнуть с облегчением! Двадцать восемь лет исследований клеток-самоубийц, забывчивых фруктовых мух и трансгенных мышей позади. Впервые в истории нам удалось составить внутреннюю картину болезни Альцгеймера. Теперь давайте протестируем ее. Чтобы оценить любую научную теорию, нужно посмотреть, насколько она соотносится с фактами. В нашем случае непоколебимая истина гласит, что самым мощным генетическим фактором риска развития болезни Альцгеймера является носительство аллели ApoE4. Учитываем ли мы это обстоятельство? Ответ – да.
Как я уже рассказывал в главе 5, болезнь Альцгеймера возникает, когда рецепторы зависимости, связывающиеся с гормонами, витамином D, мозговыми нейротрофическими факторами, и многие другие укрепляющие нейроны и синапсы молекулы остаются пустыми (или активизируются не так часто, как нужно), а затем сообщают о дефиците APP.
Рис. 8. Носительство ApoE4 повышает риск развития болезни Альцгеймера. Но как именно? Какой процесс скрывается за знаком вопроса между аллелью ApoE4 и болезнью Альцгеймера?
Получив такую информацию, APP дает сигнал к сокращению штатов и высылает четырех агентов – молекулярный квартет, уничтожающий синапсы и нейроны. Оказывается, что ApoE4 увеличивает частоту расщепления APP на четыре части (а не на две, которые, наоборот, способствуют укреплению синапсов и нейронов).
Вы спросите, как именно ApoE4 способствует образованию разрушительного квартета и подавлению полезного для здоровья дуэта? Прежде чем ученые выявили связь ApoE4 с болезнью Альцгеймера, они знали, что аполипопротеины переносят жиры. Затем на свет появилась догма, согласно которой ApoE4 препятствует удалению пептидов бета-амилоида. Как вы помните, бета-амилоид является частью прионной петли. Чем больше его в головном мозге (т. е. чем меньше очистка), тем чаще APP разрезается на четыре части (и вырабатывает бета-амилоид).
Нам удалось выяснить, что ApoE 4 не только замедляет очистку мозга от бета-амилоидных пептидов, но и совершает нечто более важное. Согласно исследованиям, проведенным талантливым ученым и врачом Аюрведы Раммоханом Рао, генетиком Виной Финдакарой и биофизиком Клэр Петерс-Либо, ApoE 4 проникает в ядро и связывается с ДНК. Это равносильно открытию, что твой знакомый мясник – парень, который таскает жир – еще и сенатор, участвующий в создании государственных законов. Более того, ApoE 4 может связываться с так называемыми промоутерами любого из 1700 генов, сокращая выработку ассоциированных белков. Если учесть, что в человеческом геноме, а значит, и в каждой клетке, примерно 20 000 генов, 1700 – довольно внушительная цифра. Неудивительно, что ApoE4 связан с развитием сердечно-сосудистых заболеваний, воспалительных и многих других заболеваний через влияние на множество генов, тем самым перепрограммируя клетки!
И это еще не все «таланты» ApoE4. Отмечу лишь те, которые имеют непосредственное отношение к болезни Альцгеймера.
• Он отключает ген сиртуина-1 (SitT1), «молекулы долголетия», которая препятствует развитию болезни Альцгеймера. (Ресвератрол, вещество в составе красного вина, активирует белок SitT1).
• Он активирует NF-κB (ядерного фактора «каппа-би»), который стимулирует воспаление.
Вот почему ApoE4 связан с повышенным воспалительным ответом: он выключает несколько различных генов, ограничивающих воспаление, и запускает сигнальный путь NF-κB, провоцирующий его.
А теперь давайте подведем итоги. Мы выяснили следующее.
1. Какова первопричина болезни Альцгеймера и как выглядит ранняя стадия. Все начинается с защитной реакции на воспалительное повреждение (например, инфекции или трансжиры), недостаточности питательных веществ, трофических факторов и/или уровня гормонов или на токсическое воздействие (включая биотоксины, такие как плесень и бактерии). APP-рецептор – длинная молекула, которая выступает из нейронов, режется на четыре части, в результате чего получается разрушающий синапсы и нейроны бета-амилоид. А как вы помните, для укрепления синапсов APP должен быть разрезан на два фрагмента.
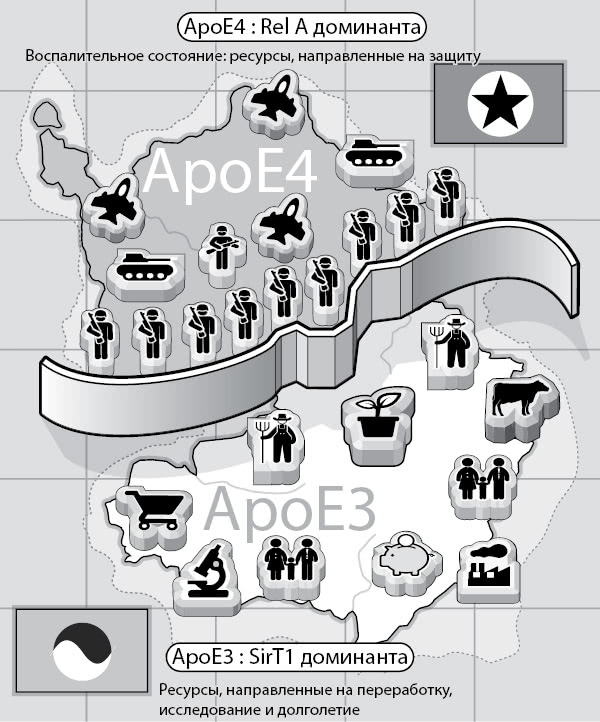
Рис. 9. ApoE4 оказывает воспалительное действие, так как активирует фактор NF-κB и заставляет клеточные ресурсы защищать клетки от нападения. С другой стороны, при наличии ApoE3 воспалительный ответ слабее, чем при наличии ApoE4, в системе доминирует SirT1, а не NF-κB.
2. Внутренняя картина. Болезнь Альцгеймера – это дисбаланс между реорганизацией синапсов, которые изжили себя и чья утрата не принесет вреда головному мозгу (т. е. здоровое разрушение) и укреплением существующих и формированием новых синапсов, необходимых для сохранения старых и образования новых воспоминаний (а также выполнения других когнитивных функций). Причиной дисбаланса служит избыточное расщепление APP на квартет молекул, способствующих «сокращению штатов» в синаптической сети, и нехватка поддерживающего дуэта – sAPPα и αCTF.
3. Как вызвать у себя болезнь Альцгеймера? Жить так, чтобы спровоцировать возникновение максимального количества факторов (из имеющихся тридцати шести), от которых зависит, будет ли APP разрезана на четыре плохих фрагмента или на два хороших.
4. Как предотвратить заболевание? Жить так, чтобы минимизировать количество провоцирующих факторов. Об этом мы поговорим подробнее в главах 8 и 9.
5. Почему более 99 % испытаний экспериментальных препаратов для лечения болезни Альцгеймера оказались неудачными? Потому что они были нацелены на устранение только одного виновника заболевания из имеющихся тридцати шести.
6. Как остановить патологические процессы, которые ведут к развитию болезни Альцгеймера? Оценить свой генетический и биохимический статус, чтобы понять, на какой стадии вы находитесь (см. главу 7), а затем заняться устранением выявленных факторов (см. главы 8 и 9).
7. Как обратить вспять болезнь Альцгеймера при наличии первых симптомов? Оценить свой генетический и биохимический статус, чтобы понять, на какой стадии вы находитесь (см. главу 7), а затем заняться устранением выявленных факторов (см. главы 8 и 9).
Это исследование принесло еще один дивиденд. Нам удалось выяснить, что болезнь Альцгеймера включает в себя три различных синдрома.
Новый взгляд на результат запрограммированного сокращения синапсов и нейронов в ответ на дефицит молекул, которые способствуют расщеплению рецептора зависимости APP на две части (то, что мы называем болезнью Альцгеймера), позволил нам впервые в истории обратить вспять данный процесс. Если просто очистить мозг от амилоидных бляшек, не устранив первопричину их появления, на что, по сути, тратили миллиарды долларов фармацевтические компании, мы не сможет помочь пациенту. Удалить бета-амилоид – то же самое, что удалить один фрагмент из вредоносного квартета. Даунсайзинг замедлится, но при этом три других «агента» APP останутся в мозге и продолжат свою работу. Таким образом, мы не «выкорчевываем» корень проблем, а боремся с симптомами.
Настало время сделать первое, что требует протокол ReCODE: определить ваш тип болезни Альцгеймера или тип, к которому вы наиболее предрасположены. Это позволит адаптировать программу под себя и минимизировать риски, а если вы уже столкнулись с нарушением когнитивных функций, то снова вернуться к нормальной жизни. Всего существует три подтипа болезни Альцгеймера или предшествующих ему состояний: горячий или воспалительный; холодный или атрофический; коварный или токсический.
ТИП 1: воспалительный (горячий). Возникает у людей – носителей одной или двух копий аллели ApoE4, поэтому поражает семьи. На его примере видно, как болезнь Альцгеймера вплетается в нашу жизнь. Пять – семь миллионов лет назад ДНК наших прародителей (общего предка шимпанзе и всего рода Homo) подверглось изменениям или, выражаясь научно, мутациям, в результате которых сформировался современный человек. Как ни странно, но эти мутации затронули ген, ассоциирующийся с воспалением, – тот самый процесс, который лежит в основе сердечно-сосудистых заболеваний, артрита и других проблем со здоровьем, не говоря уже о старении. (Многие из нас пытаются бороться с воспалением при помощи рыбьего жира, детского аспирина или противовоспалительной диеты). Почему так много генов, которые отличают нас от приматов – т. е. делают человека человеком – служат медиаторами воспаления? Хороший вопрос.
Калеб Финч, профессор нейробиологии старения из Университета Южной Калифорнии, знает ответ. Он считает, что, когда наши предки эволюционировали в двуногих – слезли с деревьев и стали ходить по саванне – воспаление позволяло им выжить. Этот процесс, который является реакцией иммунной системы на угрозу, защищал их, когда они наступали на навоз или что-то острое, ели сырое мясо с патогенами, получали раны на охоте или в бою. Иными словами, он помогал их организму справляться с опасными для жизни инфекциями.
Однако по мере старения воспаление приводит к развитию сердечно-сосудистых заболеваний, артрита и других зол, включая болезнь Альцгеймера. Такой компромисс называется антагонистической плейотропией, когда генетические изменения дают преимущество в молодом возрасте, но при этом ведут к сокращению продолжительности жизни. Есть мнение, что главным воспалительным геном, который подвергался мутациям при превращении шимпанзе в человека, был ApoE4. С рассвета человечества и до относительно недавнего времени ApoE4 воспринимался только в одном варианте – аллели под названием эпсилон 4, или ApoE4. Миллионы лет мы носили в себе две копии ApoE4, по одному от каждого родителя – состояние, которое повышает риск развития болезни Альцгеймера. Мозг современного человека отличается от мозга протолюдей, поэтому у ученых нет возможности узнать, страдали ли наши предки болезнью Альцгеймера. Однако это маловероятно, ведь они не доживали до старости и вели образ жизни, позволявший устранять большинство «дыр» из имеющихся тридцати шести – много двигались, переваривали простые углеводы, не ели промышленных продуктов и практически не подвергались токсическому воздействию.

Воспаление – реакция иммунной системы на угрозу – сообщает организму об опасных инфекциях. Когда наши предки-шимпанзе эволюционировали в двуногих, воспаление помогло им выжить.
Но 220 000 лет назад космический луч, химический мутаген или просто случай привел к образованию ApoE3. Если эта мутация была в генах яйцеклетки или сперматозоида, она передалась потомкам, в результате чего совершенно новый ген попал в человеческий генофонд. Следующая мутация произошла 80 000 лет назад. Впервые кто-то – и его/ее потомки – стали счастливыми носителями еще одной аллели ApoE гена под названием ApoE2.
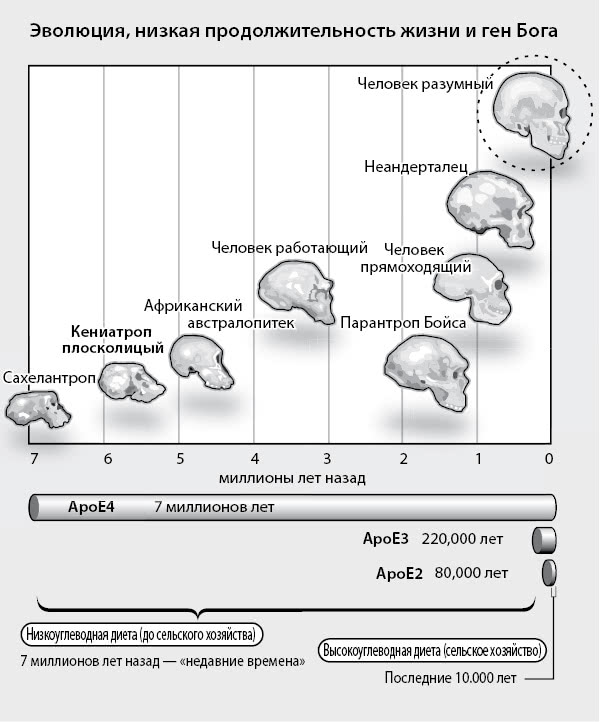
Рис. 10. ApoE4 и эволюция человека. ApoE4 – наш исходный ApoE, ApoE3 появился всего лишь 220 000 лет назад, а ApoE2 – 80 000 лет назад.
Сегодня большинство людей являются носителями двух копий ApoE3. При таком раскладе генетический риск развития болезни Альцгеймера равен 9 %. Двадцать пять процентов американцев, примерно 75 миллионов, являются носителями одной копии ApoE4, и их риск развития страшного заболевания составляет 30 %. Семь миллионов являются носителями двух копий ApoE4, что повышает риск развития болезни до 50 %. У людей, которые унаследовали ApoE4 от обоих родителей, вероятность болезни Альцгеймера крайне высока, и чаще всего (но не всегда) это именно воспалительный тип.
Этот подтип начинается с утраты способности сохранять новую информацию, в то время как долговременная память и способность говорить, считать, произносить слова по буквам, писать сохраняется. У носителей двух копий ApoE4 симптомы заболевания обычно проявляются после 40–50 лет. У людей, которые несут одну копию АроЕ4, симптомы обычно появляются после 50–60 лет. У тех, кто не имеет ни одной копии, болезнь, как правило, начинается в шестом-седьмом десятилетии.
Гиппокамп, который переводит наш опыт в долгосрочную память, сокращается в объеме, при этом большинство участков мозга остаются неизменными, по крайней мере, на ранней стадии заболевания. Теменная и височные доли, которые отвечают за умение говорить, считать, узнавать и писать, начинают потреблять меньше глюкозы, что служит признаком снижения активности. Подробные исследования пациентов, страдающих данной формой болезни Альцгеймера, показали наличие явных биохимических маркеров, для выявления которых используются лабораторные тесты.
1. Увеличение концентрации С-реактивного белка, который вырабатывается печенью в рамках воспалительного ответа на угрозы, подобные инфекциям.
2. Снижение соотношения альбумина (основного белка крови, который выполняет роль «мусорщика». Он удаляет нежелательные молекулы, например амилоид и токсины, делая кровь девственно чистой) и глобулина, всеобъемлющий термин для обозначения примерно шестидесяти белков крови, включая антитела. Снижение альбумин-глобулинового коэффициента происходит при наличии воспалений.
3. Увеличение уровня ИЛ-6 (интерлейкин-6), что также наблюдается при воспалении.
4. Увеличение уровня ФНО (фактор некроза опухоли), еще один белок, концентрация которого повышается в ответ на воспаление.
5. Сопутствующие отклонения обмена веществ и гормонального фона, например инсулинорезистентность.
Воспалительный тип болезни Альцгеймера лучше всего поддается лечению с помощью протокола ReCODE.
ТИП 2 атрофический (холодный). Данный тип болезни Альцгеймера чаще всего поражает носителей одной или двух копий ApoE4, однако его симптомы проявляются на десять лет позже, чем симптомы воспалительного типа. Подобно первому типу, он сопровождается утратой способности головного мозга формировать новую память. При этом пациент может говорить, писать и считать.
Признаков воспаления не наблюдается; в некоторых случаях маркеры его ниже нормы. Вместо этого наблюдается дефицит поддерживающих синапсы факторов.
1. Субоптимальный уровень гормонов, включая гормон щитовидной железы, адреналин, эстрогены, прогестерон, тестостерон и прегненолон.
2. Дефицит витамина D.
3. Инсулинорезистентность или слишком низкий уровень инсулина.
4. Высокий уровень гомоцистеина (хотя при первом типе БА уровень гомоцистеина также может быть повышен).
Данный тип болезни Альцгеймера поддается лечению хуже, чем воспалительный.
75-ЛЕТНЕМУ ВРАЧУ-ПСИХИАТРУ СТАЛО ОЧЕНЬ СЛОЖНО запоминать новую информацию. Ситуация усугублялось более двух лет, при этом женщина не испытывала никаких проблем с речью, решением математических задач и выполнением каждодневных действий. ПЭТ показала наличие типичных признаков болезни Альцгеймера. Объем гиппокампа находился на уровне 16-й процентили, а когнитивные способности (соответствующие ее возрасту) – на 9-й. Тест на ApoE4 – отрицательный (ApoE3/3). Анализ крови показал снижение уровня витамина D, прегненолона, прогестерона, эстрадиола, свободного Т3 (тиреоидный гормон) и витамина B12, а также повышение концентрации гомоцистеина. Диагноз: УКН (англ. MCI) 2-го типа (умеренные когнитивные нарушения, состояние, предшествующее болезни Альцгеймера).Женщина включилась в программу ReCODE и спустя двенадцать месяцев отметила значительные улучшения. Когнитивные способности поднялись с 9-й процентили до 97-й. А родные и близкие сказали, что ее память из «катастрофической» стала сначала «просто плохой», а потом «нормальной». Уровень витамина D, прегненолона, прогестерона, эстрадиола, сводного Т3, витамина В12 и гомоцистеина также приблизился к оптимальной отметке.
У человека могут возникать одновременно первый и второй типы болезни Альцгеймера. В таком случае присутствует воспалительная симптоматика первого типа и дефицит поддерживающих синапсы веществ, свойственный второму типу. Определенное сочетание этих двух типов встречается довольно часто. Думаю, оно заслуживает отдельного названия: тип 1,5 гликотоксичный (сладкий):
1. Уровень глюкозы хронически высокий, что приводит к изменению структуры белков (гликирование) и воспалению, как при типе 1.
2. Высокий уровень инсулина, секретируемого в ответ на высокий уровень глюкозы, приводит к развитию инсулинорезистентности. Инсулин перестает функционировать как нейротрофическая молекула, в результате наблюдается нехватка трофической поддержки, свойственной типу 2.
3. Типы 1, 2 и их сочетание – результат программы даунсайзинга, или дисбаланса между образованием новых синапсов и уничтожением старых. В противоположность данным типам болезни Альцгеймера существует еще один – третий тип.
ТИП 3 токсический (коварный). Этот тип чаще наблюдается у носителей аллели ApoE3, чем у носителей ApoE4. Болезнь Альцгеймера не всегда поражает семьи, если у кого-то из родственников было диагностировано данное заболевание, то его симптомы обычно появлялись уже после 80 лет. Токсический тип развивается в сравнительно молодом возрасте, в конце 40 – начале 60 лет, чаще после сильного стресса. Вместо потери памяти у человека отмечается ухудшение когнитивных функций: проблемы с речью, решением математических задач, организацией. Если тип 1 и 2 – это результат даунсайзинга, когда мозг уничтожает синапсы быстрее, чем формирует их, то третий тип скорее напоминает метание гранат: под угрозой находится все. В результате у больного стираются не только новые воспоминания, но и старые (под воспоминаниями я подразумеваю не только эпизодическую память, т. е. отдельные факты и события из жизни, но и процедурную (сюда относятся сложные навыки, например игра в бридж, или простые, например речь). Люди, страдающие третьим типом болезни Альцгеймера, часто испытывают трудности с чтением, не могут разобраться с чаевыми и счетами, испытывают трудности с подбором слов, произнесением их по буквам и чтением. Психические расстройства, как, например, депрессия и дефицит внимания, – также не редкость.
52-ЛЕТНЯЯ МОЛЛИ УЖЕ ДВА ГОДА БОРОЛАСЬ с деменцией. Вначале женщина испытывала трудности с выполнением математических вычислений. Она не могла посчитать, сколько дать официанту на чай или заплатить по счету, а спустя несколько месяцев оказалась не в состоянии заполнить заявку на грант без посторонней помощи. Еще до возникновения всех этих проблем Молли испытала сильный стресс: ликвидация фирмы, разлад в семье, сложности с работой, четыре эпизода с применением анестезии и начало менопаузы. Ухудшение когнитивных функций происходило стремительно, в поведении появились детские черты. Несмотря на это, она помнила имена всех двадцати восьми детей, игравших с ее сыном на школьном дворе. Ранее ни у кого в роду деменции не наблюдалось. По Монреальской шкале (MoCA) ее когнитивные функции были оценены в 19 баллов из 30, что свидетельствовало о серьезных нарушениях. МРТ показала уменьшение объема коры головного мозга, существенное для ее возраста. Были отмечены гиперинтенсивные участки в перивентикулярных и субкортикальных отделах белого вещества на FLAIR-изображениях (режим подавления сигнала свободной воды). Кроме того, наблюдалась атрофия мозжечка, отдела головного мозга, который болезнь Альцгеймера обычно не затрагивает. Однако анализ спинномозговой жидкости показал увеличение уровня белка фосфо-тау и снижение концентрации Aβ42 и подтвердил диагноз болезни Альцгеймера.Результаты анализов Молли: ApoE3/3, С-реактивный белок выше нормы – 1,4; альбумин-глобулиновый коэффициент низкий – 1,57; гемоглобин А1с норма – 5,3 %; уровень инсулина натощак норма – 4,5; ТТГ чуть выше нормы – 2,14; свободный Т3 норма – 4,2; свободный Т4 норма – 1,0; прогестерон ниже нормы – <0,21; эстрадиол ниже нормы – 3; 17-гидрокиспрегненолон ниже нормы – 14; кортизол в утренних пробах – 9; витамин D ниже нормы – 22, концентрация меди в сыворотке крови норма – 101, цинк сильно ниже нормы – 56, соотношение медь/цинк выше нормы – 1,8:1. Все это свидетельствовало о наличии умеренного воспаления, синдроме надпочечниковой недостаточности, снижении функций щитовидной железы и дефиците витамина D. Кроме того, следует отметить слишком низкий уровень цинка и высокое соотношение медь/цинк.
Первоначальная версия ReCODE была малоэффективна в борьбе с третьим типом болезни Альцгеймера, но мы приложили все усилия, чтобы усовершенствовать лечебную программу. Главным образом нас интересовала причина развития данной формы болезни Альцгеймера и ее нетипичные симптомы (до проведения анализа спинномозговой жидкости и ПЭТ, позволявшие поставить точный диагноз, врачи подозревали у пациентов лобно-височную, сосудистую деменцию и другие заболевания). Разгадать процессы, лежащие в основе этой атипичной болезни Альцгеймера, значило изменить жизнь миллионов людей.
Открыть заветный ларчик позволил развернутый анализ крови, тот самый тест, который страховые компании считают необязательным, а врачи – ненужным. У многих (но не у всех) пациентов, страдающих третьим типом болезни Альцгеймера, была отмечена низкая концентрация цинка в сыворотке крови, диспропорционально низким оказался и уровень триглицеридов по сравнению с уровнем холестерина. Мы установили, что третий тип болезни Альцгеймера имеет свои биомаркеры.
1. Он поражает многие участки головного мозга, не только или преимущественно гиппокамп. МРТ четко показывает атрофию (уменьшение) данных отделов головного мозга.
2. У пациентов очень часто наблюдаются нейровоспаления и сосудистые нарушения, о чем свидетельствуют многочисленные крошечные белые пятна на FLAIR изображениях (режим подавления сигнала свободной воды, МРТ).
3. Низкий уровень цинка и высокий уровень меди в крови и, соответственно, высокое соотношение медь/цинк. В норме концентрация меди и цинка составляет примерно 100 мкг/дл, а их соотношение равно 1. Однако у многих пациентов с третьим типом болезни Альцгеймера содержание цинка в сыворотке крови чуть выше 50 мкг/дл, содержание меди – примерно 170 мкг/дл, соответственно, их соотношение намного больше 1.
4. Очень часто пациентам с третьим типом БА не могут поставить правильный диагноз. Врачи подозревают у них лобно-височную деменцию, депрессию, «атипичный тип болезни Альцгеймера», прояснить ситуацию позволяет ПЭТ и анализ спинномозговой жидкости (пункция).
5. Нарушение гормонального фона, при котором система, реагирующая на стресс, – цепочка из гипоталамуса, гипофиза и надпочечников, расположенных над верхней частью почек (все вместе называется осью ГГН), – не работает. Лабораторные анализы показывают низкий уровень кортизола, высокий уровень реверсивного Т3 (анализ на гормоны щитовидной железы), низкий уровень свободного Т3, низкий уровень прегненолона, эстрадиола, тестостерона и другие гормональные отклонения.
6. Высокое содержание в крови токсичных химических веществ, например ртути или микотоксинов, выделяемых плесенью. Так как ртуть проникает в ткани (кости и мозг), концентрация этого металла в крови – не показатель его присутствия в организме. Для проведения точного анализа необходимо использовать хелатирующий агент, который захватывает и выталкивает металл из тканей. Обычно в течение последующих шести часов уровень ртути в моче ненормально высокий, что свидетельствует о высокой концентрации токсичного металла в тканях.
Многие современные ученые не считают, что причиной болезни Альцгеймера может быть токсическое воздействие. Ассоциация Альцгеймера заявила: «согласно научным данным, нет никакой взаимосвязи между амальгамными пломбами и БА». Однако есть задокументированные случаи улучшения состояния пациентов после удаления амальгамных пломб, которые помимо серебра содержат примерно 50 % ртути и 15 % олова. Еще большую путаницу вносят данные эпидемиологических исследований, одна часть которых опровергает роль амальгамных пломб в развитии болезни Альцгеймера, а другая часть ее подтверждает (1).
Могут ли токсичные вещества, такие как ртуть, провоцировать развитие «атипичной» болезни Альцгеймера, когда нарушения когнитивных функций, т. е. проблемы с речью и выполнение математических операций, предшествуют потере памяти. Каждый из нас слышал о канцерогенах, химикатах, вызывающих рак, но существуют ли дементогены, которые провоцируют деменцию? Я бросился обзванивать друзей, знакомых и пациентов с данной формой болезни Альцгеймера и с удивлением узнал, что все они подвергались токсическому воздействию. Один вырос в Томс Ривер, Нью-Джерси, где вредные химикаты, тайно сливавшиеся местной фабрикой по производству пластмасс и красителей, попали в водозаборные скважины и стали причиной вспышки онкологических заболеваний среди детей. У второго брат болел лейкемией, причиной которой может быть токсичное воздействие, а сам он работал на химическом заводе, где дышал вредными парами. Третьи жили в домах, сильно пораженных плесенью. Четвертый служил слесарем-сантехником по канализации, пятый имел многочисленные амальгамные пломбы.
Услышанное натолкнуло меня на мысль протестировать эту группу пациентов на наличие в организме токсичных веществ, несмотря на то, что обычно при подозрении на болезнь Альцгеймера подобные анализы не проводятся.
КАРЛ, 55 ЛЕТ, УЖЕ ГОД СТРАДАЛ КОГНИТИВНЫМИ НАРУШЕНИЯМИ, и его состояние все более ухудшалось. Цифры были неотъемлемыми спутниками всей его жизни, а теперь он с трудом заполнял чековую книжку. Гений покера, Карл терялся и забывал карты. Он путал имена, слова и порой говорил совсем не то, что хотел. Ему с трудом удавалось сконцентрировать внимание: когда он смотрел по телевизору баскетбол, то забывал, какая команда забросила мяч. Мысли ускользали, и подступала депрессия. Ранее ни у кого в роду болезни Альцгеймера не было.ПЭТ показала типичную для болезни Альцгеймера картину. Карлу поставили диагноз: MCI (умеренные когнитивные нарушения), состояние, предшествующее болезни Альцгеймера. Никаких анализов и лечения ему не назначили, только ежегодный осмотр. Позднее маркер ApoE4 оказался отрицательным (ApoE3/3).Когда Карл позвонил мне, я предложил ему сдать анализы на тяжелые металлы (включая ртуть) и микотоксины (токсины, вырабатываемые плесенью: афлатоксины, охратоксины, глиотоксины и трихотецены). Лаборанты сообщили, что за долгие годы им не приходилось фиксировать столь высокую концентрацию ртути в организме. Карл прошел успешное лечение, направленное на выведение вредного металла. В результате когнитивные функции полностью восстановились, и в его жизнь снова вернулся любимый покер.
Три типа болезни Альцгеймера соотносятся с тремя процессами, которые заставляют APP расщепляться на четыре вредоносных фрагмента: воспаление (тип 1), дефицит трофической поддержки (тип 2) и воздействие токсичных соединений (тип 3). Три образа, которые примеряет на себя талантливая молекула бета-амилоид, «рождающаяся» из APP. Она – противомикробный агент, а значит, часть воспалительного ответа, позволяющего вам бороться с инфекциями. Она – уничтожительница «лишних» синапсов, реагирующая на недостаток гормонов, витаминов и других поддерживающих (трофических) факторов. Она – защитница организма от токсического воздействия, связывающаяся с металлами, такими как ртуть и медь.
Три роли бета-амилоида, ассоциирующиеся с тремя типами болезни Альцгеймера, свидетельствуют о том, что результат удаления этого белка зависит от типа заболевания. Если очистить от бета-амилоидных отложений мозг пациента с воспалительной БА, где причиной воспаления было наличие микробов, его состояние только ухудшится.
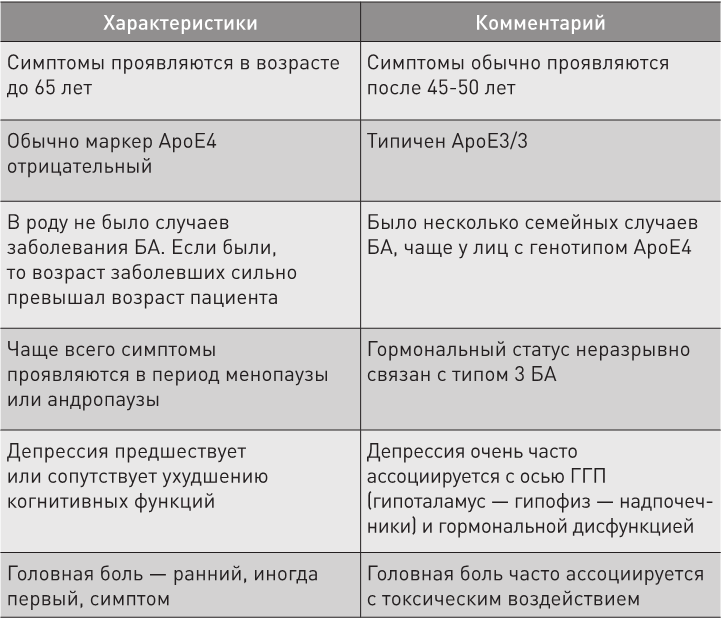
Таблица 1. Характеристики типа 3 болезни Альцгеймера (Бредесен, Aging, 2016, 3)
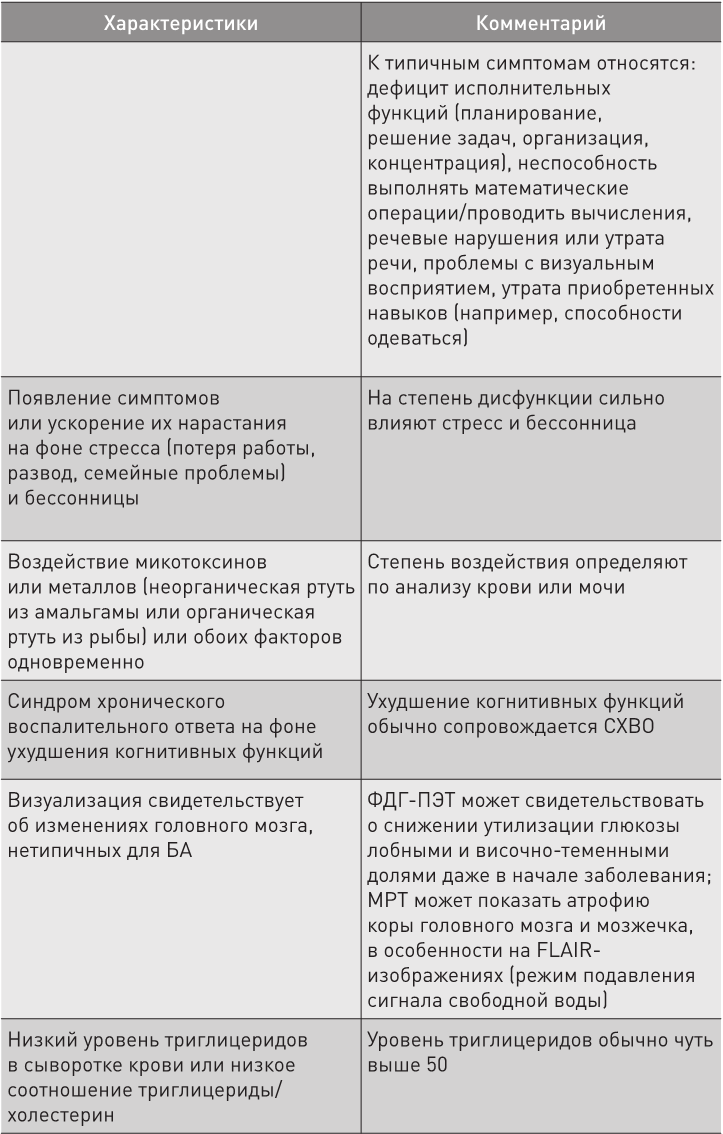

Если удалить амилоиды из мозга пациента с атрофическим типом БА, процесс теоретически может замедлиться (все равно что уволить главного финансового сотрудника и продолжать сорить деньгами), но приведет к менее последовательному даунсайзингу и вследствие этого – к утрате важнейших когнитивных функций. То же самое касается людей с типом 1,5 (гликотоксичным или сладким), ведь, по сути, это сочетание типа 1 и 2. Если очистить от амилоида мозг человека, страдающего токсическим типом, то это спровоцирует ряд проблем, связанных с воздействием вредных химикатов, так как защитная реакция частично утратит свою силу.
Разграничение трех типов болезни Альцгеймера – важная составляющая терапии. Чтобы изменить жизнь людей, столкнувшихся со страшным заболеванием или находящихся на стадии предеменции, или предупредить развитие болезни у лиц группы риска, мы должны знать виновников ухудшения когнитивных функций и бороться с каждым из них в отдельности.
Назад: Глава пятая На грани отчаяния: из лаборатории в клинику и обратно
Дальше: Часть третья Диагностика и индивидуальный терапевтический подход

