Книга: ДНК. История генетической революции
Назад: Глава 6 Буря в миске с кашей: генетически модифицированные продукты
Дальше: Глава 8 Время первых
Глава 7
Геном человека. Сценарий жизни
Человеческий организм очень сложен. Традиционно биологи сосредоточивались на изучении какого-то отдельного органа и старались понять, как он устроен. Такой подход не изменился и в эру молекулярной биологии. Как правило, ученый специализируется на одном гене либо на группе генов, образующих какой-либо биохимический путь. Однако не существует машины, детали которой работали бы независимо друг от друга. Если бы я собрался изучить карбюратор в моторе моего автомобиля, даже в мельчайших деталях, мне все равно нужно представлять себе, как работает весь двигатель, не говоря уже обо всей машине. Чтобы понять, для чего нужен мотор и как он функционирует, мне нужно изучить весь механизм: рассмотреть карбюратор в контексте, рабочий элемент среди множества других. Это же касается и генов. Чтобы понять генетические процессы, лежащие в основе жизни, нужно не просто детально представлять себе, как именно работают те или иные гены в биохимических путях; нужно рассматривать эту информацию в контексте целостной системы – генома.
Геном – это полный набор генетических инструкций, содержащийся в ядре каждой клетки (фактически любая клетка содержит два генома, по одному от каждого родителя; две копии каждой хромосомы, которые мы наследуем, каждая хромосома содержит свою копию гена, как раз поэтому – у нас две копии генома). Размер генома у разных видов различается. Измерив, сколько ДНК содержится в каждой клетке, можно понять, что геном человека включает примерно 3,2 миллиарда пар оснований, или 3 200 000 000 А, Т, Г и Ц.
От генов зависят все наши успехи и горести, включая смерть. В некоторой степени генетически обусловлены все причины смерти, не считая несчастных случаев. Наиболее очевидные примеры – болезни, возникающие непосредственно из-за мутаций, например муковисцидоз или болезнь Тея – Сакса. Многие другие гены действуют столь же смертельно, хоть и менее явно; от них зависит, насколько мы подвержены распространенным смертельным болезням, например насколько велики наши шансы заболеть раком или сердечно-сосудистыми заболеваниями. В обоих случаях прослеживается семейная предрасположенность. Даже реакция на инфекционные заболевания, такие, например, как корь или обычная простуда, часто имеет генетическую составляющую, состояние факторов антимикробной защиты также находится под контролем генов. Старение – также генетически детерминированный феномен; внешние признаки, которые мы ассоциируем со старением, в некоторой степени отражают многолетнее накопление мутаций в наших генах. Следовательно, если мы желаем полностью понять генетические факторы, от которых зависит жизнь и смерть, а затем и научиться справляться с ними, нам нужна полноценная опись всех генетических «игроков» человеческого организма, то есть описание генома.
В человеческом геноме содержится ключ к вопросу, что означает «быть человеком». Свежеоплодотворенные яйцеклетки человека и шимпанзе (по меньшей мере, на первый взгляд) неотличимы друг от друга, но в одной из них содержится геном человека, а в другой – геном шимпанзе. В каждой клетке макроорганизма заложена ДНК, контролирующая онтогенетическое развитие, причем геном шимпанзе приведет к развитию шимпанзе, а геном человека породит человека. Данный процесс невероятно сложен, поскольку в организме взрослого человека примерно 30 триллионов клеток. Геном человека – великолепный свод сборочных инструкций, управляющий развитием каждого из нас. В этих инструкциях записана сама природа человека.
Несмотря на высокие ставки и степень ответственности специалистов по молекулярной биологии, продвижение проекта по секвенированию генома человека – дело бесспорно нужное для всего человечества. Тут даже не о чем спорить, поскольку истина лежит на поверхности. Тем не менее в середине 1980-х годов, когда возможность секвенирования генома только обсуждалась, такая идея многим казалась сомнительной, причем среди скептиков были некоторые выдающиеся ученые. Кому-то она казалась до нелепости амбициозной, например как предложение воздухоплавателю времен королевы Виктории попытаться доставить человека на Луну на воздушном шаре.
Проект «Геном человека» удалось запустить благодаря – подумать только! – телескопу. В начале 1980-х годов астрономы из Калифорнийского университета предложили сконструировать самый крупный и мощный телескоп в мире – смета на проект составила около 75 миллионов долларов. Когда Фонд Макса Хоффмана пожертвовал на это 36 миллионов долларов, благодарный Калифорнийский университет согласился назвать проект в честь щедрого спонсора. К сожалению, такая форма благодарности осложнила получение остальных 39 миллионов, поскольку потенциальные спонсоры не горели желанием жертвовать деньги на телескоп, уже названный в честь кого-то, поэтому проект застопорился. В конце концов другая (значительно более богатая) благотворительная организация из Калифорнии, Фонд У. М. Кека, согласилась выступить поручителем всего проекта. Калифорнийский университет с готовностью согласился: Хоффман, не Хоффман… какая разница, а новый телескоп Кек на вершине Мауна-Кеа на Гавайях должен был выйти на полную проектную мощность к маю 1993 года. Не готовый играть второй скрипкой при Кек, Фонд Хоффмана отозвал свою заявку на участие в проекте, и администрация Калифорнийского университета поняла, что открывается возможность инвестирования теперь уже свободных 36 миллионов долларов. В частности, Роберт Синсхеймер, ректор Калифорнийского университета в городе Санта-Крус, осознал, что деньгами Хоффмана можно профинансировать крупный научный проект, благодаря которому «город Санта-Крус появится на всех картах», то есть приобретет мировую известность.
Синсхеймер имел биологическое образование и был полон решимости вывести свою дисциплину в «высшую лигу» науки, где крутятся большие деньги. У физиков есть дорогие суперколлайдеры, у астрономов – спутники и телескопы по 75 миллионов долларов; почему бы и биологам не реализовать свой высококлассный дорогостоящий проект? Поэтому он предложил организовать в Санта-Крусе институт, который занимался бы строго секвенированием генома человека. В мае 1985 года в Санта-Крусе была организована конференция для обсуждения идеи Синсхеймера. В целом ее расценивали как слишком амбициозную, и все участники конференции сходились во мнении, что на первом этапе следует сосредоточиться на исследовании конкретных участков генома, важных с медицинской точки зрения. Дискуссия эту тему не привела к конкретному результату, поскольку деньги фонда Хоффмана так и не попали на счета Калифорнийского университета, но начало проекту в Санта-Крусе было положено.
Следующий шаг к реализации проекта «Геном человека» также был сделан издалека: помогло Министерство энергетики США. Хотя деятельность министерства, естественно, была сосредоточена на нуждах национальной энергетики, оно занималось решением как минимум одной биологической задачи: оценкой риска влияния ядерной энергетики на здоровье человека. Поэтому Министерство энергетики профинансировало работы по долгосрочному отслеживанию генетических нарушений у людей, выживших при атомных взрывах в Хиросиме и Нагасаки, а также у их потомков. Что могло быть полезнее при изучении мутаций радиационного происхождения, чем полная «справочная» карта человеческого генома? Осенью 1985 года представитель Министерства энергетики Чарльз ДеЛизи созвал совещание, чтобы обсудить вклад геномного проекта в общую стратегию министерства. Биологический истеблишмент воспринял идею работы по министерскому заказу по меньшей мере скептически: генетик из Стэнфорда Дэвид Ботстейн порицал проект как «министерскую программу для безработных бомбоделов», а Джеймс Вингаарден, в ту пору возглавлявший Национальные институты здравоохранения, сравнил идею с «инициативой национального бюро стандартизации по постройке бомбардировщика B-2». Примечательно, что впоследствии Национальные институты здравоохранения стали виднейшим представителем коалиции, реализовавшей проект «Геном человека». Со скепсисом ученых или без него, но необходимо признать, что Министерство энергетики сыграло важную роль в реализации проекта и в конечном итоге обеспечило секвенирование примерно 11 % генома.
К 1986 году шумиха вокруг генома продолжала нарастать. В июне 1986 года я организовал в лаборатории Колд-Спринг-Харбор специальное заседание по поводу этого проекта. На наше совещание собрались крупнейшие специалисты по генетике человека. Уолли Гилберт, годом ранее побывавший на конференции Синсхеймера в Калифорнии, взял слово и представил объем и смету исследований, она была невероятна по всем параметрам. Нужно секвенировать три миллиарда пар оснований, а значит, потребуется не менее трех миллиардов долларов. В самом деле, это было чрезвычайно дорогостоящее научное исследование. Сумма получалась еще более немыслимой, собрать ее было реально лишь с привлечением софинансирования, и некоторые из присутствовавших беспокоились, что такой мегапроект, успех которого отнюдь не гарантирован, в итоге просто отнимет деньги у других, более важных исследований. Многие опасались, что проект «Геном человека» окажется научной «бездонной бочкой». На уровне личных научных амбиций многим казалось, что в этом проекте даже при наилучших раскладах игра едва ли стоит свеч. Проект «Геном человека» сулил массу технических находок, но не мог предложить интеллектуального азарта или славы тем, кому бы пришлось с этим разбираться. Любой уже имеющийся серьезный научный прорыв в молекулярной биологии казался ничтожным по сравнению с той титанической работой, которую предстояло проделать. Кто согласился бы положить всю жизнь на бесконечное секвенирование, секвенирование, секвенирование? Дэвид Ботстейн из Стэнфорда требовал действовать с крайней осторожностью, вот его слова: «…Все это означает, что придется перекроить всю структуру науки, втянуть всех нас, особенно молодых, в этот колоссальный проект, подобный Space Shuttle».
Несмотря на далеко не восторженные мнения, собрание в Колд-Спринг-Харбор убедило меня в том, что в скором времени секвенированию генома человека суждено стать приоритетным международным научным проектом и, когда это произойдет, Национальные институты здравоохранения должны сыграть в нем ведущую роль. Я добился от фонда Джеймса С. Мак-донелла, чтобы организация профинансировала глубокое исследование соответствующих проблем под эгидой Национальной академии наук. Учитывая, что комитет возглавлял Брюс Альбертс из Калифорнийского университета в Сан-Франциско, я не сомневался, что все идеи будут тщательнейшим образом проверяться. Альбертс опубликовал статью, в которой предупреждал, что развитие «большой науки» может поглотить обширный архипелаг разнообразных инновационных наработок, которые поступают из отдельных лабораторий со всего мира, и может задавить уже проводимые исследования. Не зная в точности, что, собственно, мы найдем, я занял место рядом с Уолли Гилбертом, Сиднеем Бреннером и Дэвидом Ботстейном в составе комитета из 15 человек, который в 1987 году в деталях разработал потенциальный геномный проект.

Рождение проекта «Геном человека»: словесная перепалка между Уолли Гилбертом и Дэвидом Ботстейном в лаборатории Колд-Спринг-Харбор, 1986 год
Тогда, на начальном этапе, Гилберт активнее всех продвигал проект «Геном человека». Он правомерно называл его «беспрецедентным инструментом для всестороннего исследования функций человеческого организма». Однако Гилберт уже успел испытать на себе в компании Biogen (которую сам и помог основать) действие пьянящей биотехнологической смеси: наука плюс бизнес. Поэтому-то и в проекте «Геном человека» он видел новую экстраординарную возможность для развития бизнеса. По этой же причине, некоторое время потрудившись в комитете, он уступил свое место Мэйнарду Олсону из Вашингтонского университета. Он сделал это, чтобы в перспективе избежать любого возможного конфликта интересов. Молекулярная биология уже заявила о себе в большом бизнесе, и Гилберт не видел необходимости обращаться за помощью к общественным организациям. Он счел, что частная компания с достаточно мощной лабораторией для секвенирования справится собственными силами, а затем он собирался продавать генетическую информацию производителям фармацевтики и другим заинтересованным лицам. Весной 1987 года Гилберт объявил о планах основать Genome Corporation. Игнорируя жалобы на то, что теперь информация о геномах может попасть в руки частных лиц и, возможно, помешает использовать эти данные для всеобщего блага, Гилберт попытался привлечь капитал венчурных фондов. К сожалению, против него сработал его же собственный далеко не радужный послужной список на посту гендиректора. Как только он оставил в 1982 году работу в Гарварде и встал у руля Biogen, компания разом потеряла 11,6 миллиона долларов в 1983 году и 13 миллионов долларов в 1984 году. В свете происходящих событий Гилберт быстро спрятался за увитые плющом стены, вернувшись в Гарвард в декабре 1984 года, но и после его ухода компания продолжала терять деньги. Едва ли такая история могла стать лакомым кусочком для инвесторов. Однако грандиозные планы Гилберта рухнули по причинам, не связанным с его управленческими просчетами: всему виной оказался крах фондового рынка, случившийся в октябре 1987 года и похоронивший новорожденную под названием Genome Corporation.
Гилберта тут обвинить совершенно не в чем, кроме того что он своими идеями опередил свое время. Его план не слишком отличался от проектов Дж. Крейга Вентера и компании Celera Genomics, которые были с успехом воплощены через десять лет после того, как Genome Corporation оказалась похороненной. За это время дискуссии по поводу частного владения информацией о секвенировании ДНК стали еще острее – ведь проект «Геном человека» уже стал набирать обороты.
План, разработанный нашим академическим комитетом уже без Гилберта, но во главе с Альбертсом, на момент февраля 1988 года казался нам весьма перспективным, проект «Геном человека» выполнялся в более-менее строгом соответствии с нашими рекомендациями. Проведенная нами оценка стоимости и сроков проекта также оказалась весьма близка к реальности. Каждый из нас являлся пользователем потребительской электроники и поэтому знал, что со временем все технологии совершенствуются и удешевляются. Учитывая вышеизложенные обстоятельства, мы рекомендовали отложить основной объем работы по секвенированию ДНК до тех пор, когда технологии не придут к разумному соотношению цена – качество. До наступления этого времени следовало уделить максимум внимания оттачиванию методик секвенирования. Следуя этой логике, мы рекомендовали для начала секвенировать более мелкие геномы простейших организмов. Приобретенные при этом знания были бы ценными как сами по себе (в качестве опорного материала, который можно было бы сравнить с геномом человека), так и в качестве полигона для испытаний наших методов перед тем, как подступиться к главной цели проекта. Первыми «пробными» кандидатами на определение генома стали представители славной старой гвардии генетики: Escherichia coli, мушка дрозофила, пекарские дрожжи, C. elegans (червь-нематода, который приобрел популярность благодаря исследованиям Сиднея Бреннера). Мы приняли решение постараться с максимальной точностью картировать геном с использованием физических и генетических технологий. При генетическом картировании определяют относительные позиции генов, положение «контрольных точек» на хромосоме, именно так изначально работали лаборанты, или, как их называли, «мальчики» Томаса Ханта Моргана с хромосомами дрозофил. Генетическое картирование позволяет, например, определить, что ген 2 находится между генами 1 и 3; физическое картирование сообщает, что ген 2 удален на миллион пар оснований от гена 1, а ген 3 расположен на хромосоме еще на 2 миллиона пар оснований дальше. Генетическое картирование позволяет очертить базовую структуру генома; если же секвенаторы «заблудятся» в геноме, то физическое картирование даст им четкие пространственные метки на хромосомах. В таком случае положение на хромосоме в каждом отдельном фрагменте последовательности можно будет определить, ориентируясь на эти метки.
По нашим оценкам, для осуществления всего проекта требовалось около 15 лет работы и 200 миллионов долларов ежегодных вложений. Мы проводили подсчеты разными способами, но каждый раз возвращались к пророческим цифрам Гилберта: один доллар вложений на каждую пару оснований. Рейс космического корабля шаттл обходился в 470 миллионов долларов, а проект «Геном человека» получился в шесть раз дороже.
Пока комитет Академии наук еще размышлял над необходимостью проведения исследований такого рода, я отправился на встречу с ключевыми представителями Верхней и Нижней палат парламента из подкомитетов по вопросам здравоохранения, которые контролируют бюджет Национальных институтов здравоохранения. Джеймс Вингаарден, глава Национальных институтов здравоохранения, по его словам, «с самого начала» симпатизировал проекту «Геном человека», но его менее дальновидные коллеги были против. Озвучив в своем обращении к членам организации цифру 30 миллионов долларов на геномный проект, я подчеркивал, насколько пригодятся в медицине знания о последовательности генов. Законотворцы тоже были людьми, которые так же, как и все остальные, болели и теряли близких людей от генетически детерминированных заболеваний, например от рака, поэтому смогли реально оценить, как знания о последовательности человеческих генов помогут в борьбе с этими недугами. В итоге мы получили 18 миллионов долларов.
Тем временем Министерство энергетики гарантировало вложение 12 миллионов за свою часть работы – энергетики рассматривали этот проект как технологическое чудо. Тогда, как вы помните, лидером производственных достижений была Япония. Развитие японского автомобилестроения привело к обнищанию Детройта, и многие опасались, что далее Америка «по принципу домино» уступит Японии и в сфере высоких технологий. Ходили слухи, что три гигантских японских техногенных концерна (Matsui, Fuji и Seiko) планируют общими усилиями сконструировать аппарат, позволяющий секвенировать миллион пар оснований в день. Как впоследствии оказалось, тревога была ложной. Но происходящие волнения лишь усилили наш энтузиазм, весьма похожий на подъем, позволивший США опередить СССР в гонке за лунное первенство.
В мае 1988 года Вингаарден предложил мне руководить той частью проекта, за которую ранее отвечали Национальные институты здравоохранения. Когда я попытался уклониться, сказав, что не хочу бросать руководство лабораторией в Колд-Спринг-Харборе, он устроил так, чтобы я занимался работой в Национальных институтах здравоохранения по совместительству. Теперь я уже никак не мог отказаться. Спустя полтора года, когда развитие проекта «Геном человека» приобрело необратимый характер, геномный отдел Национальных институтов здравоохранения был преобразован в Национальный центр по изучению генома человека; я был назначен его первым директором.
Моими основными задачами как директора стали «выбивание» денег у Конгресса и контроль их разумного использования. Для меня было важным, чтобы бюджет проекта «Геном человека» существовал отдельно от общего бюджета Национальных институтов здравоохранения. Также был принципиален вопрос о том, чтобы «Геном человека» не ставил под удар прочие научные разработки. Чего бы стоили все успехи нашего мегапроекта, если бы они были достигнуты ценой закрытия разработок наших коллег? В то же время я чувствовал, что мы, ученые, взявшиеся за такое беспрецедентное предприятие планетарного масштаба, должны каким-то образом обозначить, что понимаем всю его глубину и степень своей ответственности. Проект «Геном человека» – это не просто масштабная инвентаризация А, Т, Г и Ц: я чувствовал, что он ценен как сокровищница знаний, которые рано или поздно окажутся в распоряжении человечества и позволят ответить на фундаментальные философские вопросы и о природе человека, и о смысле добра и зла. Я принял решение, что 3 % нашего бюджета – часть, конечно, небольшая, но сумма весьма солидная – должны пойти на исследование этических, юридических и социальных аспектов проекта «Геном человека». Позже, по настоянию Альберта Гора, который тогда был сенатором, эту долю увеличили до 5 %.
Проект инициировал технологии и механизмы международного сотрудничества. В США мы руководили основными направлениями в проекте и взяли на себя выполнение половины всей запланированной работы. Остальная часть проекта была реализована преимущественно в Великобритании, Франции, Германии и Японии. Вопреки сложившимся традициям в генетике и молекулярной биологии, Совет по медицинским исследованиям Великобритании принимал незначительное участие в данном проекте. Как и вся британская наука, Совет страдал от недальновидной политики Маргарет Тэтчер, скудно финансировавшей такие проекты. К счастью, на помощь пришла Wellcome Trust, частная благотворительная медицинская организация. В 1992 году близ Кембриджа был выстроен специальный научный комплекс для проведения секвенирования – Сенгеровский центр, названный, как вы догадались, в честь Фреда Сенгера. Руководя международным проектом, я старался распределять исследование различных частей генома между представителями разных наций. Я рассудил, что каждая страна будет заниматься конкретным участком работы – скажем, секвенировать определенное плечо хромосомы, а не трудиться над случайным набором безымянных клонов. Например, японцы занимались в основном 21-й хромосомой. К сожалению, работали мы в спешке, и наши стройные порядки смешались. Оказалось, не так просто наложить карту генома на карту мира.
С самого начала я был убежден, что проект «Геном человека» невозможно реализовать в рамках объединения огромного количества мелких лабораторий. Логистика безнадежно бы в них запуталась, и мы бы лишились всех преимуществ такого размаха и автоматизации, который предполагала цельность проекта. Поэтому с самого начала мы организовали центры по картированию генома в Вашингтонском университете Сент-Луиса, в Стэнфорде, в Калифорнийском университете Сан-Франциско, в Мичиганском университете (город Анн-Арбор), а также в Бэйлорском медицинском колледже в Хьюстоне. Министерство энергетики сначала сконцентрировало свои разработки в собственных лабораториях, расположенных в Лос-Аламосе и Ливерморе, но постепенно все они были передислоцированы в Уолнат-Крик, штат Калифорния.
Следующим пунктом «повестки дня» разработчиков проекта стала разработка альтернативных технологий секвенирования, призванных снизить общую стоимость работ до пятидесяти центов на каждую пару оснований, то есть примерно вполовину от запланированной стоимости. Были запущены несколько пилотных проектов. По иронии судьбы, тот метод, который в итоге себя оправдал, – автоматизированное секвенирование с применением флуоресцентных красок – на первом этапе у нас не заладился. Задним числом могу сказать, что пилотную стадию такой машинной обработки следовало доверить Крейгу Вентеру, штатному исследователю из Национальных институтов здравоохранения, который уже доказал, что способен выжать из любой методики максимум пользы. Он сам вызвался заняться решением этой задачи, но мы предпочли кандидатуру Ли Худа, автора этой самой технологии. Позднее мы еще не раз пожалели, что отказали Вентеру.
В конце концов, проект «Геном человека» не требовал разрабатывать с нуля совершенно новые методы анализа ДНК; речь шла, скорее, об оптимизации и автоматизации уже имеющихся методов, что постепенно позволило секвенировать пары оснований сначала сотнями, затем тысячами, а потом миллионами. Ключевую роль в проекте сыграл революционный метод генерации нужных сегментов ДНК в огромных количествах – метод амплификации. Для проведения секвенирования нужно было иметь много экземпляров того гена, который мы собирались изучать. До середины 1980-х годов амплификацию того или иного участка ДНК можно было выполнить лишь молекулярным клонированием по методу Коэна – Бойера: вырезали нужный сегмент, внедряли его в кольцевую плазмиду, затем видоизмененную плазмиду вставляли в бактериальную клетку, которая затем делилась, и при каждом делении у нас появлялся новый экземпляр нужного сегмента ДНК. После того как бактерии размножатся, мы вычленяли нужный сегмент из общей массы ДНК в бактериальной культуре. Со времени первых экспериментов Коэна и Бойера эта процедура была доработана, но все равно оставалась неудобной и затратной по времени. Огромным скачком вперед стало изобретение полимеразной цепной реакции (ПЦР), которая позволяла выполнить селективную амплификацию нужного фрагмента ДНК всего за пару часов, вообще без всякой возни с бактериями.
Полимеразная цепная реакция (ПЦР) была изобретена в 1983 году биохимиком Кэри Муллисом, работавшим в компании Cetus. Открытие этой реакции было весьма примечательным. Позже Муллис вспоминал: «Однажды пятничным вечером в апреле 1983 года меня словно озарило. Я был за рулем, катил по залитой лунным светом извилистой горной дороге в Северную Калифорнию, край секвойных лесов». Впечатляет, что именно в такой ситуации его посетило вдохновение. И дело совсем не в том, что на севере Калифорнии особенные дороги, способствующие озарению; просто его друг однажды видел, как Муллис безрассудно мчался по обледенелой дороге с двусторонним движением и это его совершенно не смущало. Друг рассказал New York Times следующее: «Муллису привиделось, что он погибнет, врезавшись в секвойю. Поэтому он ничего не боится за рулем, если вдоль дороги не растут секвойи». Наличие секвой вдоль дороги заставляло Муллиса сосредоточиться и… вот оно, озарение. За свое изобретение в 1993 году Муллис получил Нобелевскую премию по химии и с тех пор стал еще более странным в своих поступках. Например он является сторонником ревизионистской теории о том, что СПИД не связан с ВИЧ, чем значительно подорвал собственную репутацию и помешал врачам.
ПЦР – довольно простая реакция. Для ее проведения нам требуется два химически синтезированных праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Праймеры – это короткие участки однонитчатой ДНК, каждый примерно по 20 пар оснований в длину. Особенность праймеров такова, что они соответствуют участкам ДНК, которые требуется амплифицировать, то есть ДНК-матрице.

Кэри Муллис, изобретатель ПЦР
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка. Фактически полученная «матрица» представляет собой цельный геном, и наша цель – выделить из нее интересующие нас фрагменты. Для этого двухцепочечную ДНК-матрицу нагревают до 95 °C на несколько минут, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Фермент ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки или примера для копирования. В результате первого цикла получаем многократное последовательное удвоение определенного участка ДНК. Далее мы повторяем эту процедуру. После каждого цикла получаем участок-мишень в двойном количестве. Спустя двадцать пять циклов ПЦР (то есть менее чем через два часа) имеем интересующий нас участок ДНК в количестве, в 225 раза превышающем исходное (то есть мы амплифицировали его примерно в 34 миллиона раз). Фактически на входе у нас получалась смесь из праймеров, матричной ДНК, фермента ДНК-полимеразы и свободных оснований А, Ц, Г и Т, количество специфического продукта реакции(ограниченного праймерами) растет экспоненциально, а количество «длинных» копий ДНК линейно, поэтому в продуктах реакции доминирует.
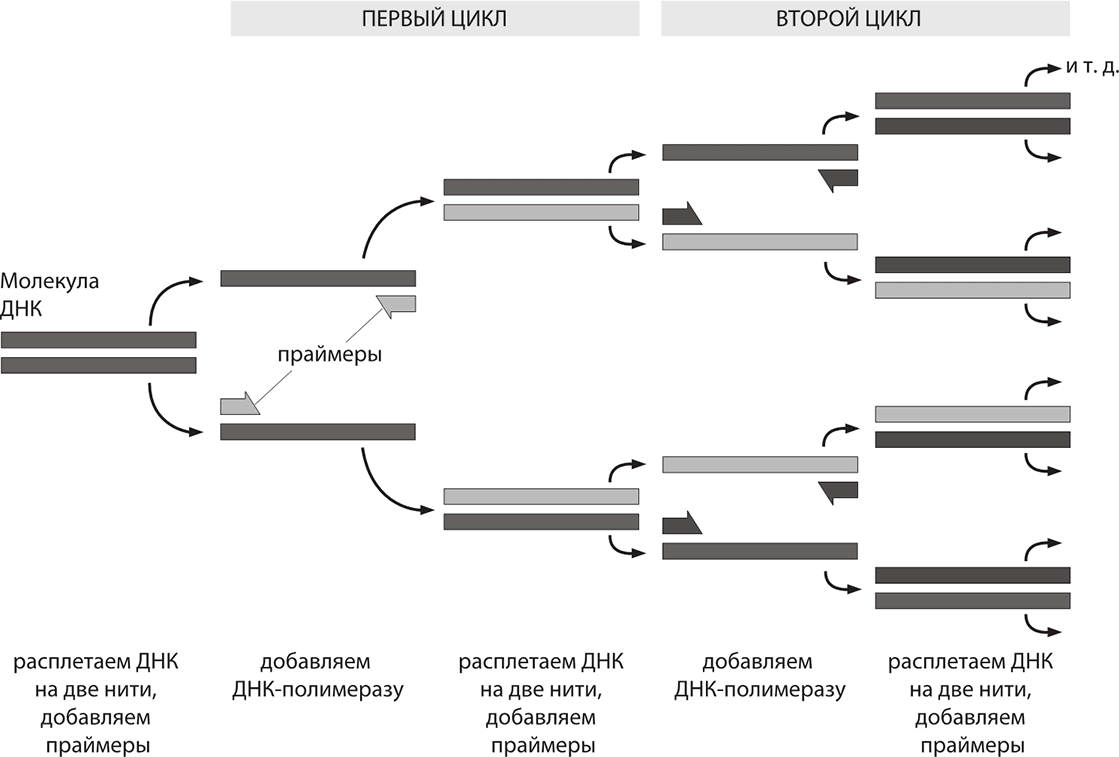
Амплификация нужного участка ДНК: полимеразная цепная реакция
На заре использования ПЦР основная проблема заключалась в следующем: после каждого цикла нагревания-охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она инактивировалась при температуре 95 °C. Поэтому нужно было заново добавлять ее перед каждым из 25 циклов. Процедура проведения реакции была сравнительно неэффективной, требовала много времени и фермента полимеразы, а материал это весьма недешевый. К счастью, на помощь пришла матушка-природа. Многие животные чувствуют себя комфортно при температуре гораздо выше 37 °C. А почему для нас стала важной цифра 37 °C? Это произошло потому, что данная температура является оптимальной для E. coli, из которой исходно получали фермент полимеразу для ПЦР. В природе встречаются микроорганизмы, чьи белки за миллионы лет естественного отбора стали более устойчивыми к действию высоких температур. Было предложено использовать ДНК-полимеразы из термофильных бактерий. Эти ферменты оказались термостабильными и были способны выдерживать множество циклов реакции. Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерии Thermus aquaticus, обитающей в горячих источниках Йеллоустонского национального парка, и названа Taq-полимеразой.
ПЦР быстро превратилась в главную рабочую лошадку проекта «Геном человека». В общем, процесс не отличается от разработанного Муллисом, просто он был автоматизирован. Мы больше не зависели от толпы подслеповатых аспирантов, кропотливо переливающих капельки жидкости в пластиковые пробирки. В современных лабораториях, осуществляющих молекулярно-генетические исследования, эта работа выполняется на роботизированных конвейерах. ПЦР-роботы, занятые в столь масштабном проекте по секвенированию, как «Геном человека», неумолимо трудятся с огромными объемами термостойкой полимеразы. Некоторые ученые, работающие в проекте «Геном человека», были возмущены неоправданно высокими отчислениями, которые добавляет к стоимости расходных материалов владелец патента на ПЦР, европейский индустриально-фармацевтический гигант Hoffmann-LaRoche.
Другим «движущим началом» стал сам метод секвенирования ДНК. Химическая основа этого метода в то время уже не была новинкой: Межгосударственный проект «Геном человека» (HGP) взял на вооружение тот же самый хитроумный метод, что еще в середине 1970-х годов разработал Фред Сенгер. Инновация же заключалась в масштабе и степени автоматизации, которых удалось достичь при секвенировании.
Автоматическое секвенирование исходно разрабатывалось в лаборатории Ли Худа в Калифорнийском технологическом институте. Он заканчивал школу в штате Монтана и играл в американский футбол на позиции нападающего; благодаря Худу команда не раз выигрывала чемпионат штата. Навыки командного взаимодействия пригодились ему и в научной карьере. В лаборатории Худа трудилась пестрая компания химиков, биологов и инженеров, и вскоре его лаборатория вышла в лидеры по части технологических инноваций.
Фактически метод автоматического секвенирования изобрели Ллойд Смит и Майк Хункапиллер. Майк Хункапиллер, который тогда работал в лаборатории Худа, обратился к Ллойду Смиту, предложив ему усовершенствованный метод секвенирования, в котором основания каждого типа окрашивались бы каждый в свой цвет. Такая идея могла в четыре раза повысить эффективность сенгеровского процесса. У Сенгера при секвенировании в каждой из четырех пробирок (по числу оснований) при участии ДНК-полимеразы образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. Далее в пробирки добавляли формамид для расхождения цепей и проводили электрофорез в полиакриламидном геле на четырех дорожках. В варианте Смита и Хункапиллера дидезоксинуклеотиды метят четырьмя разными красителями и проводят ПЦР в одной пробирке. Затем во время электрофореза в полиакриламидном геле луч лазера в определенном месте геля возбуждает активность красителей, и детектор определяет, какой нуклеотид в настоящий момент мигрирует через гель. Сначала Смит был настроен пессимистично – он опасался, что использование сверхмалых доз красителя приведет к тому, что нуклеотидные участки будут неразличимы. Однако, превосходно разбираясь в лазерных технологиях, он вскоре нашел выход из положения, используя специальные флюорохромные красители, которые флуоресцируют под действием лазерного излучения.
В классическом варианте метода Сэнгера одна из цепочек анализируемой ДНК выступает в качестве матрицы для синтеза комплементарной цепочки ферментом ДНК-полимеразой, затем последовательность фрагментов ДНК сортируется в геле по размеру. Каждый фрагмент, который включается в состав ДНК во время синтеза и позволяет впоследствии визуализировать продукты реакции, помечается флуоресцентным красителем, соответствующим терминальному основанию (об этом говорилось на с. 124); следовательно, флюоресценция этого фрагмента будет идентификатором для данного основания. Затем остается лишь провести детекцию и визуализировать продукты реакции. Результаты анализируют с помощью компьютера и представляют в виде последовательности разноцветных пиков, соответствует одно из четырех нуклеотидам. Далее информация передается непосредственно в информационную систему компьютера, что исключает затратный по времени и порой мучительный процесс ввода данных, который весьма осложнял секвенирование.

Мелким шрифтом: последовательность ДНК, расшифрованная с использованием автоматического секвенатора, полученная из аппарата для автоматического секвенирования. Каждому цвету соответствующих четырем оснований.
Майк Хункапиллер покинул лабораторию Худа в 1983 году и поступил на работу в недавно образованную приборостроительную компанию Applied Biosystems Inc., известную под названием ABI. Именно ABI произвела первый коммерческий аппарат для секвенирования по методу Смита – Хункапиллера. По мере того как проект «Геном человека» набирал обороты, резко повысилась эффективность всего процесса секвенирования: от неудобных и вязких гелей было решено отказаться, реакционную смесь стали разделять методом капиллярного электрофореза в растворе, обладающем высокой пропускной способностью, фрагменты ДНК, выходящие из капиллярной колонки, регистрируются детектором флуоресценции. В сравнительном аспекте секвенаторы ABI отличались высокой скоростью; они работали примерно в тысячу раз быстрее сенгеровского прототипа. При минимальном участии человека (примерно пятнадцать минут работы на каждые 24 часа) эти машины успевали отсеквенировать примерно полмиллиона пар оснований в день. Автоматизация значительно ускорила процесс секвенирования и позволила осуществить секвенирование целых геномов, включая геном человека, что и позволило реализовать проект «Геном человека».
На первых этапах проекта «Геном человека» была оптимизирована технология секвенирования ДНК, следующей стала стадия картирования генома. Наша главная цель заключалась в приблизительной оценке всего генома, чтобы всем стало понятно, где именно локализуется каждый участок концевой последовательности ДНК. Геном предстояло разделить на удобоваримые фрагменты, которые затем предстояло картировать. Изначально мы решали эту задачу на материале искусственных хромосом дрожжей (YAC). Этот метод разработал Мэйнард Олсон, внедрявший большие фрагменты человеческой ДНК в клетки дрожжей. После имплантации YAC реплицировались вместе с обычными хромосомами дрожжей. Но при попытке загрузить миллион пар оснований из человеческой ДНК в одну хромосому дрожжей мы столкнулись с методологическими проблемами. Оказалось, что хромосомные сегменты перемешиваются, а поскольку суть картирования – это определение последовательности генов в хромосоме, подобное перемешивание – самое худшее, что могло бы произойти. Вот почему нам так пригодились искусственные бактериальные хромосомы (BAC), разработанные Питером де Йонгом в Буффало, представляющие векторные системы на основе F-плазмиды E. coli. Они мельче, длиной всего по 100 000–200 000 пар оснований, и гораздо менее подвержены перемешиванию. Короткий фрагмент ДНК исследуемого организма вставляется в хромосому, а затем амплифицируется и секвенируется. После этого прочитанные последовательности выравниваются in silico, в результате чего получается полная последовательность генома организма.

Команда, составившая костяк французского геномного проекта: Жан Вессанбаш – третий слева, а Дэниэл Коэн стоит справа. Рядом с Коэном – нобелевский лауреат Жан Доссе, иммунолог-провидец, инициировавший эти работы
Для тех групп, которые взялись за «прицельное» картирование человеческого генома, – это были ученые из Бостона, Айовы, Юты и Франции – на первых и, безусловно, важнейших этапах требовалось найти генетические маркеры, те места, где одни и те же фрагменты ДНК, взятые у двух различных особей, отличались на одну или более пар оснований. Такие различающиеся сайты послужили бы ориентирами и помогли скоординировать работу над геномом. Вскоре французской группе под руководством Дэниэла Коэна и Жана Вессанбаша в Genethon, институте геномных исследований (по объему выполняемых исследований этот институт больше напоминал фабрику) при финансировании Французской ассоциации по борьбе с мышечной дистрофией, удалось построить пробные карты генома. Подобно благотворительной медицинской организации Wellcome Trust, расположенной через Ла-Манш, французская благотворительная организация по борьбе с мышечной дистрофией частично компенсировала недостаточную финансовую поддержку государства.
Когда на последнем этапе потребовалось подробное физическое картирование с использованием векторных систем, основанных на искусственных хромосомах бактерий – BAC (bacterial artificial chromosome), решением этой задачи занималась группа Джона Макферсона из Вашингтонского университета в Сент-Луисе.
По мере того как проект «Геном человека» набирал обороты, продолжались дискуссии о том, каким образом его лучше всего реализовывать дальше. Некоторые ученые указывали, что значительная часть генома человека состоит из так называемой мусорной ДНК – участков, которые, по-видимому, ничего не кодируют. Действительно, на гены, или участки, которые кодируют белки, приходится лишь небольшая часть всей двойной спирали. Почему же тогда, спрашивали критики, мы должны секвенировать весь геном, зачем возиться с этим мусором? В научном мире существовал и другой подход, позволяющий «дешево и сердито» картировать кодирующие гены в геноме с использованием фермента обратной транскриптазы, катализирующей синтез ДНК на матрице РНК в процессе, называемом обратной транскрипцией. Эта технология описана нами в главе 5. Очищаем образец мРНК (кодирующую соответствующий генный продукт: белок, РНК) и проводим с ней в качестве матрицы обратную транскрипцию транспортной РНК из ткани любого типа: так, например, если образец взят из тканей или клеток мозга, мы получим образец РНК со всеми генами, которые экспрессируются в мозге. Затем при помощи обратной транскриптазы делаем копии ДНК (так называемой комплементарной ДНК) этих генов и эту ДНК потом можем секвенировать.
Однако такой подход – «дешево и сердито» – это не всегда способ решения проблемы в целом. Как мы уже знаем (и позже об этом еще поговорим), многие интереснейшие фрагменты генома лежат за пределами генов и образуют управляющие механизмы, которые включают и выключают гены. Например, в только что описанном случае с анализом кДНК из мозговой ткани мы получим обзор генов, включающихся в мозге, но не поймем, как именно они включаются: крайне важные регуляторные области ДНК не транскрибируются в РНК ферментом РНК-полимеразой, копирующим участок ДНК в транспортную РНК.
Сидней Бреннер, работавший в относительно скудно финансируемом Совете по медицинским исследованиям (MRC) в Великобритании, первым применил метод с использованием комплементарной ДНК (кДНК) для обнаружения и клонирования генов эукариот в прокариотных генах. кДНК – это ДНК, синтезированная на матрице зрелой мРНК в реакции, катализируемой обратной транскриптазой. Располагая ограниченным бюджетом на исследования, он выяснил, что секвенирование кДНК – наиболее экономически эффективный вариант расходования имевшейся у него суммы. Совет по медицинским исследованиям, решивший извлечь коммерческую выгоду из отсеквенированных последовательностей, запретил Бреннеру публикацию этой информации, пока британские фармацевтические компании не смогли воспользоваться ею для собственного обогащения.
Крейг Вентер, наведавшись в лабораторию к Сиднею Бреннеру, был впечатлен столь искусной стратегией с применением кДНК. Он не могдождаться, когда наконец сможет вернуться в свою лабораторию Национальных институтов здравоохранения близ Вашингтона, округ Колумбия; там он одним из первых с энтузиазмом продвигал технологии автоматизированного секвенирования ДНК. Поэтому он решил сам опробовать метод Бреннера и создать коллекцию новых генов. Отсеквенировав даже небольшую часть каждого из них, Вентер смог определить наличие новых, еще не описанных генов. В июне 1991 года он опубликовал в журнале Science эпохальную статью, в которой рассказал, что ему предположительно удалось идентифицировать 337 новых генов, основываясь на их сходстве с известными генами из баз данных ДНК. Тогда Вентер впервые оказался в «огнях рампы» на сцене геномики и с тех пор уже никогда ее не покидал. Официальный представитель Национальных институтов здравоохранения убеждал его подать патенты на эти новые гены, хотя механизм их действия Вентеру был неизвестен. Через год, применив технику кДНК на большом объеме материала, Вентер добавил в список еще 2421 последовательность и вот теперь уже отправил свои результаты в патентное бюро.
Я считаю, что сама мысль вслепую патентовать последовательности, даже не зная, как они работают, «не лезет ни в какие ворота». Всегда хочется задать вопрос: что именно ты защищаешь? Поступок Вентера можно расценивать как заблаговременную финансовую претензию на подлинно бессмысленное открытие, которое, возможно, уже успел сделать кто-нибудь еще. Я поделился моими опасениями с ведущими специалистами Национальных институтов здравоохранения, но безрезультатно. При этом упорное стремление агентства потворствовать такой практике – позднее организация от такой политики отказалась – означало, что моя карьера бюрократа на государственной службе постепенно подходит к концу. Я испытывал смешанные чувства, когда Бернадин Хили, глава Национальных институтов здравоохранения, в 1992 году вынудила меня уволиться. Четырех лет в вашингтонском душном пекле бюрократии мне хватило надолго. Однако важнее всего для меня было то, что к моменту моего ухода проект «Геном человека» уже давно набрал крейсерскую скорость.
Тяга Вентера к коммерческим перспективам патентования генома по частям лишь подогрела его аппетит. Однако Вентер хотел усидеть на двух стульях одновременно: остаться членом академического сообщества, где можно было свободно обмениваться информацией, а зарплаты были невысоки, и закрепиться в сфере бизнеса, где открытия можно было скрывать до выправления патента, а уже патент затем – монетизировать. Заручившись помощью своего замечательного патрона, венчурного капиталиста Уоллеса Стейнберга (изобретателя зубной щетки Reach), Крейг Вентер воплотил свою мечту в 1992 году. Стейнберг выделил 70 миллионов долларов на обустройство не одной, а целых двух организаций: некоммерческого Института генетических исследований (The Institute for Genomic Research, TIGR), возглавить который предстояло Вентеру, а также дочерней компании Human Genome Sciences – ею должен был руководить молекулярный биолог Уильям Хэзлтайн, обладавший деловой хваткой. Предполагалось, что система будет работать так: исследовательский центр расположится в Institute for Genomic Research – там будут проводиться большинство исследований по идентификации генов, поточное производство последовательностей кДНК, а Human Genome Sciences останется бизнес-подразделением, которое станет систематизировать данные, полученные в TIGR, в течение полугода и лишь затем их публиковать. Исключение составляли открытия, которые потенциально могли бы стать основой для разработки новых лекарственных средств, – в таком случае HGS получала на рассмотрение таких данных целый год.

Проект «Геном человека» становится коммерческим: Уильям Хэзлтайн и Крейг Вентер
Вентер вырос в Калифорнии, с юных лет отличался темпераментным индивидуализмом, увлекался морскими видами спорта: серфингом и судоплаванием, хотел заниматься виндсерфингом, а не получать высшее образование. Однако ему довелось прослужить медбратом во Вьетнамецелый год. Столкнувшись с ранеными и умирающими военнослужащими, он окончательно решил посвятить свою жизнь медицине и спасению человеческих жизней, что для него должно было закончиться обучением. Вернувшись в США, он вскоре получил высшее образование и степень PhD по физиологии и фармакологии в Калифорнийском университете, Сан-Диего. Его переход из академической сферы в бизнес казался оправданным с финансовой точки зрения: Вентер признавался, что к моменту основания TIGR у него было всего две тысячи долларов на банковском счете. Но он смог быстро приумножить свое состояние: в начале 1993 года британская фармацевтическая компания Smith Kline Beecham, стремившаяся «застолбить себе участок» во время геномной золотой лихорадки, заплатила 125 миллионов долларов за исключительные коммерческие права на постоянно пополнявшийся вентеровский список новых генов. Год спустя газета New York Times написала, что 10 % акций The Institute for Genomic Research, принадлежавшие Вентеру, оцениваются в 13,4 миллиона долларов. Он с готовностью их тратил, выложив четыре миллиона за двадцатипятиметровую гоночную яхту, парус-спинакер которой украсил собственным портретом.
В 1970-е годы Уильям Хэзелтайн был гарвардским аспирантом, учился у меня и у Уолли Гилберта. Затем он руководил инновационным центром по исследованию ВИЧ в медицинской школе Института онкологии Дейни – Фарбера. В 1980 году благодаря браку с Гейл Хейман (миллиардершей, соосновательницей парфюмерной марки Giorgio Beverly Hills, статусного аксессуара 1980-х годов) Уильям Хэзелтайн стал публичной персоной и смог рассчитывать на гораздо более серьезные суммы, чем те две тысячи долларов на счете, которыми располагал на момент основания HGS. Еще до того как Хэзелтайн ушел в большой бизнес, его роскошный образ жизни дал почву для подколок со стороны коллег из лаборатории Гарвардской медицинской школы: «Чем Господь отличается от Билла Хэзелтайна? Господь повсюду, и Хэзелтайн – повсюду, увы, кроме Бостона, где ему положено быть по долгу службы».
Для воплощения стремления Вентера и Хэзелтайна запатентовать все без исключения гены, которые им удалось бы найти при помощи секвенирования кДНК, практически не требовалось ни сноровки, ни изобретательности. Только механически увеличиваемый объем проводимых исследований – метод, безусловно, эффективный. Однако The Institute for Genomic Research и Human Genome Sciences повели себя просто как два ребенка на детской площадке, каждый из которых забрал себе все игрушки и не хотел ими поделиться с остальными детьми. В 1995 году HGS подала патент на ген под названием CCR5. Предварительный анализ последовательностей, проведенный HGS, показывал, что этот ген кодирует белок, относящийся к иммунной системе и расположенный на поверхности клеток-эффекторов иммунитета: лимфоцитов, макрофагов. Соответственно, такой белок стоило «приватизировать», поскольку такого рода белки потенциально могли послужить мишенями для лекарств, воздействующих на иммунную систему. Патент на CCR5 входил в единый пакет со 140 другими патентами на аналогичные гены, которые также подала HGS. Однако в 1996 году исследователи выявили роль CCR5 в биохимическом пути, по которому ВИЧ (вирус, вызывающий СПИД) проникает в Т-клетки иммунной системы, а именно хелперную популяцию лимфоцитов. Также было обнаружено, что мутации в гене CCR5 связаны с устойчивостью к ВИЧ. Выяснилось, что некоторые гомосексуальные мужчины – имевшие мутантный ген CCR5 – не заболевали СПИДом, несмотря на многократный контакт с вирусом. Поэтому ген CCR5 сразу превратился в ключевую мишень в терапевтической борьбе против ВИЧ. При этом HGS, не вложившая ни капли труда, никаких научных разработок в определение ключевой роли CCR5 в борьбе с ВИЧ-инфекцией, изрядно на нем обогатилась, просто потому, что первая добралась до этого гена, обложила «налогом» любые попытки применить эти новые знания на пользу человечеству. Хэзелтайн повел себя эгоистично («Если кто-либо использует ген в программе поиска новых препаратов после того, как ген запатентован, и делает это в коммерческих целях… то нарушает патент») и порой даже возмутительно («….Мы имеем право не только на агрессию, но и на асимметричную агрессию… при попытках нарушить патент»).
Такое спекулятивное патентование генов затормозило медицинские научные исследования и разработки, в долгосрочной перспективе сократив число терапевтических средств и снизив их качество. Фактически при этом патентовались потенциальные мишени для препаратов – белки, на которые эти препараты могли бы воздействовать, причем даже тогда, когда эти препараты еще не были даже изобретены. Для большинства крупных фармацевтических фирм работа с патентованными генами, которые потенциально могли служить мишенями для фармацевтических препаратов, превратилась, образно выражаясь, в «отравленные пилюли». Крупные проценты за использование патентов, взимаемые монополиями, занятыми поиском генов, склоняли экономический баланс не в пользу разработки лекарств: клонировать мишень препарата – это не более одного процента работы на пути к получению и синтезу лекарственного средства. Более того, если компания создала препарат с запатентованной мишенью, у нее теряется стимул к дальнейшему совершенствованию этого препарата. У фармацевтических компаний на тот период времени возникал вполне резонный вопрос: зачем тратить время и деньги на усовершенствование препарата, если ваш патент отсекает любых потенциальных конкурентов, позволяя сделать такую разработку запредельно дорогой либо вообще незаконной?
Перспектива такого развития событий, при котором триумвират TIGR/HGS/Smith Kline Beecham захватит всю коммерческую сферу секвенирования человеческого генома, тревожила как научное, так и коммерческое сообщество молекулярных биологов. В 1994 году компания Merck, один из традиционных крупных соперников Smith Kline Beecham на фармацевтическом рынке, перечислила центру геномики Вашингтонского университета в Сент-Луисе 10 миллионов долларов на секвенирование человеческой кДНК и публикацию результатов в открытом доступе, тем самым парировав выпад HGS.
Примерно в тот же период, когда TIGR и HGS делали первые шаги в деле коммерциализации генома, руководителем программы геномных исследований в Национальных институтах здравоохранения вместо меня назначили Френсиса Коллинза. Коллинз отлично подходил на этот пост. Он зарекомендовал себя первоклассным «охотником за генами», уже успев открыть несколько важных генов, вызывавших тяжелые болезни (в том числе гены муковисцидоза, нейрофиброматоза (так называемой болезни человека-слона), а также – в рамках коллективного проекта – генов болезни Хантингтона). Если бы на ранних этапах реализации проекта «Геном человека» вручались призы – за победу при картировании и описании важных генов, то пальма первенства, безусловно, досталась бы Коллинзу. Сам он вел счет своих побед весьма необычным способом. Каждое новое картирование гена заканчивалось наклейкой на его мотошлеме переводной картинки (Коллинз был большим любителем мотоциклов и сам владел мотоциклом «Хонда Найтхок»). Френсис Коллинз вырос в штате Виргиния в долине Шенандоа на ферме. Это была ферма без водопровода, она занимала девяносто пять акров. Сначала Коллинз получал домашнее образование: его учили родители – отец, профессор драматургии, и мама, автор пьес. В возрасте семи лет он и сам написал сценарий по сказке «Волшебник страны Оз» и осуществил домашнюю постановку. Однако злая ведьма от науки не дала Коллинзу сделать театральную карьеру: получив степень PhD по физической химии в Йельском университете, он отправился в медицинскую школу, закончив которую сделал карьеру в медицинской генетике. Коллинз – представитель редкой породы глубоко религиозных ученых. Он вспоминал, что в колледже был «совершенно беспардонным атеистом», но все изменилось в медицинской школе: «я видел людей с тяжелыми недугами, постоянно боровшихся за жизнь; многие терпели поражение. Я видел, как некоторые люди поддерживают себя верой, какую силу она им дает». Придя в проект «Геном человека», Коллинз принес научное мастерство, а также духовность, которая совершенно отсутствовала у его предшественников.
К середине 1990-х годов, когда было выполнено первичное картирование человеческого генома, а технологии секвенирования быстро развивались, пришло время заглянуть в саму суть взаимодействий А, Ц, Г и Т – приступить к этапу секвенирования. Придерживаясь плана, в самом начале обозначенного комитетом Национальной академии наук, мы первым делом подступились к «тренировочным» организмам – для начала к бактериям, а затем и к более высокоорганизованным существам с более сложными геномами. Примитивный червь-нематода, C. elegans, был первым серьезным небактериальным «пациентом», и секвенирование его генома стало блестящим совместным достижением Джона Салстона из британского Сенгеровского центра и Боба Уотерсона из Вашингтонского университета; это был великолепный образчик международного сотрудничества. Последовательность генома червя была опубликована в декабре 1998 года – все 97 миллионов пар оснований. Такой червь не крупнее запятой на этой странице и состоит из фиксированного числа клеток (959); тем не менее у него примерно 20 тысяч генов.
Сначала казалось, что Джон Салстон плохо подходит на роль руководителя крупного научного проекта. Большую часть профессиональной карьеры он провел, уставившись в микроскоп, чтобы подробнейшим образом, во всех деталях, описать развитие червя – клетка за клеткой. Салстон был бородат и добросердечен, родился в семье англиканского викария и являлся убежденным социалистом: он страстно верил, что между бизнесом и человеческим геномом не может быть ничего общего. Как и Френсис Коллинз, Салстон обожал мотоциклы: он привык курсировать на своем байке с объемом двигателя 550 см³от дома близ Кембриджа до Сенгеровского центра. Так и продолжалось до тех пор, пока проект «Геном человека» не заработал в полную силу, а как раз набирал обороты, и Джон Салстон не попал в серьезное ДТП, где получил тяжелые травмы, а сам мотоцикл, как он выразился, «едва ли можно было собрать по винтику». Представители фонда Wellcome Trust, финансировавшего Сенгеровский центр, в ужасе узнали, что научный руководитель проекта каждое утро рискует жизнью, добираясь на работу. «И это после того, как мы вложили столько денег в этого типа!» – жаловалась Бриджет Огилви, бывшая в ту пору директором фонда.
Боб Уотерсон, американский партнер Салстона, получил диплом инженера в Принстоне и употребил свою инженерную подготовку и сноровку в руководстве крупным центром по секвенированию в Вашингтонском университете в Сент-Луисе. Уотерсон умел экстраполировать – начинать с малого и заканчивать великим. В свое время он любил сопровождать дочь на пробежке, пристрастился к бегу и к настоящему времени уже стал опытным марафонцем. За первый год работы его группа отсеквенировала всего сорок тысяч пар оснований в геноме червя, но всего через пару лет работа пошла «стахановскими темпами», и Уотерсон одним из первых стал призывать ученых к тотальному секвенированию человеческого генома.


Международное сотрудничество. Вверху: британские и американские ученые первыми полностью секвенировали геном многоклеточного организма – червя-нематоды C. elegans. Внизу: руководители проекта Боб Уотерсон и Джон Салстон решили отдохнуть
В то самое время, когда члены международного проекта «Геном человека» начали пробовать секвенировать живые организмы, примериваясь к большому, вся отрасль содрогнулась от настоящего молекулярно-биологического землетрясения.
Дела у Крейга Вентера и TIGR шли нормально. После нескольких лет оттачивания стратегии обнаружения генов на кДНК Вентер заинтересовался секвенированием цельных геномов. Он был убежден, что и на этом поле его подход окажется наилучшим. Сотрудники проекта «Геном человека» тщательно картировали различные фрагменты ДНК на хромосомах, прежде чем их секвенировать. Таким образом, мы уже знали, что фрагмент A прилегает к фрагменту B, могли отыскивать между ними пересекающиеся участки и связывать их в окончательную последовательность. Вентер предпочел «полногеномный метод дробовика» (WGS), при котором первичное картирование не проводилось: просто рубили геном на фрагменты случайной длины, заливали все эти последовательности в секвенатор и дожидались, чтобы машина расставила их в правильном порядке, ориентируясь на перекрывающиеся участки и не располагая никакой исходной информацией об их местоположении. Вентер и его группа в TIGR показали, что такой грубый метод на самом деле работоспособен, как минимум при работе с простыми геномами. В 1995 году они опубликовали первую расшифрованную последовательность бактериального генома, принадлежащего Haemophilus influenzae, полученную именно таким методом.
Однако оставалось невыясненным, применим ли метод WGS в случае крупных и сложных геномов, например генома человека, который примерно в тысячу раз больше бактериального. Проблема заключалась в наличии повторяющихся фрагментов: в разных частях генома попадались идентичные участки, и эта проблема, в принципе, могла оказаться роковой при секвенировании методом дробовика. Такие повторы вполне могли запутать даже самый изощренный компьютерный алгоритм. Так, если повтор встречается во фрагментах A и P, то компьютер может случайно поставить A перед Q, а не перед B – туда, где он на самом деле должен быть. Сотрудники проекта «Геном человека», в свою очередь, обсуждали такой сценарий, размышляя, не прибегнуть ли и им к методу дробовика. Опираясь на тщательные вычисления Фила Грина из Сиэтла, консорциум пришел к выводу о том, что такая работа, вероятно, не увенчается успехом из-за огромного числа длинных дублирующихся последовательностей в мусорной ДНК.
В январе 1998 года Майк Хункапиллер из ABI, создатель машин-секвенаторов, пригласил Вентера опробовать свою новую модель секвенатора PRISM 3700. Аппарат впечатлил Вентера, но он даже вообразить не мог, что последует дальше. Хункапиллер предложил Вентеру сформировать новую компанию, которая бы подчинялась Perkin-Elmer (головной компании ABI) и получала с ее стороны средства на секвенирование генома человека. Вентера ничуть не смущала перспектива забросить TIGR – его отношения с Хэзелтайном из HGS давно испортились. Поэтому он, не теряя времени, основал новую фирму, впоследствии названную Celera Genomics. Девиз компании звучал так: «Скорость прежде всего. Открытия не могут ждать». В планах компании было секвенировать весь геном человека полногеномным методом дробовика, соорудив поточную линию из 300 новых машин Хункапиллера и самого мощного кластера компьютеров за пределами Пентагона. Проект должен был быть реализован за два года и обойтись в 200–500 миллионов долларов.
Сенсационная новость была опубликована в New York Times в мае 1998 года, как раз перед тем, как руководители будущего названного «некоммерческим» (в противовес частному) проекта «Геном человека» собрались в лаборатории Колд-Спринг-Харбор. Мягко говоря, эти новости были восприняты прохладно. На глобальный некоммерческий проект уже потратили примерно 1,9 миллиарда долларов денег налогоплательщиков, а теперь Times пишет, что мы за эти деньги не можем предъявить обществу ничего, кроме мышиного генома, а у Вентера уже вытанцовывается священный грааль – геном человека. В данном случае особенно раздражало, что Вентер надругался над так называемыми бермудскими принципами. В 1996 году прошла конференция участников проекта «Геном человека» на Бермудских островах – Вентер там присутствовал. На конференции было решено, что данные о секвенировании должны выкладываться в открытый доступ сразу же после того, как будут получены. Все мы сошлись во мнении, что последовательность генома должна быть общественным достоянием. Впоследствии Вентер радикально изменил свое мнение: он заявил, что будет придерживать новые данные о секвенировании в течение трех месяцев, продавая лицензии фармацевтическим компаниям и другим организациям, всерьез намеренным купить эти данные для «предпросмотра».
К счастью, Майкл Морган из Wellcome Trust смог активизировать реализацию публичного проекта всего через несколько дней после заявления Вентера, сообщив, что удвоит финансовую поддержку Сенгеровского центра, доведя общую сумму примерно до 350 миллионов долларов. Хотя время для заявления было выбрано так, как будто он стал прямой реакцией на выпад Вентера, на самом деле повышение финансирования к тому моменту уже обсуждалось в течение некоторого времени. Вскоре после этого Конгресс США также внес свой вклад в закрома некоммерческого проекта «Геном человека». Началась гонка за обладание прав на расшифрованный геном. Фактически с самого начала в ней намечались по меньшей мере два победителя. Во-первых, наука: реальная польза могла быть получена лишь путем сравнения полученных в разных лабораториях двух геномных последовательностей. Во-вторых, компания PRISM: ей предстояло продать еще множество секвенаторов, которых не было в большинстве лабораторий, занятых в некоммерческом проекте, и теперь они были вынуждены покупать их, чтобы не отстать от Вентера!
Язвительная перепалка между руководителями двух проектов – частного и некоммерческого – стала постоянной темой научных газетных публикаций в следующие пару лет. Такое препирательство дошло до крайности, так что президент Клинтон даже дал поручение своему научному консультанту: «Исправьте ситуацию… заставьте этих людей сотрудничать». Несмотря на трудности кооперации между двумя параллельными проектами, секвенирование продолжалось. Вентер продемонстрировал, что его «метод дробовика» может быть применен на достаточно крупном геноме, когда в союзе с фракцией ученых – исследователей генома дрозофилы он смог в начале 2000 года объявить о готовности представить черновой вариант генома дрозофилы. Однако в геноме дрозофилы содержится не так много повторяющихся фрагментов мусорной ДНК, и успех Celera в анализе этого генома никоим образом не гарантировал, что полногеномный метод дробовика успешно сработает и на человеческом геноме.
Никто с таким жаром не воспринял вызов, брошенный Celera, как Эрик Ландер. Именно он ратовал за практически полностью автоматизированный процесс секвенирования, где лаборантов заменят роботы, и именно он с таким запалом воплощал эту мечту в реальность. Из резюме Ландера следовало, что этот парень кое-что понимал в научном драйве. Мальчик из Бруклина зарекомендовал себя как математик-вундеркинд в манхэттенской старшей школе Стайвесанта. Он также выиграл первый приз на конкурсе компании Вестингауз по поиску юных талантов. Позже Ландер стал почетным спикером класса на вечере в Принстоне (‘78), после чего получил в Оксфорде степень PhD, куда поступил на стипендию Родса. Макартуровская премия для «гениев», присужденная ему в 1987 году, казалась практически избыточной. Кстати, его мать понятия не имела, как это вышло: «Мне нравится говорить, что это я как мать внесла свою лепту в гениальность сына, но это не так… скорее, это все-таки – удача».
Решив в конечном счете, что чистая математика – «отвлеченная и затворническая дисциплина», Эрик Ландер, уже успевший прослыть по стандартам этой области компанейским парнем, присоединился к гораздо более веселому коллективу Гарвардской школы бизнеса. Однако вскоре он всерьез увлекся биологией и отвлекся на труды своего младшего брата, нейрофизиолога. Вдохновившись, Ландер самостоятельно освоил биологию при свете луны на биофаках Гарварда и Массачусетского технологического института и чуть совсем не бросил свою основную работу в школе бизнеса: «Можно сказать, что я изучал молекулярную биологию на перекрестках, – признавался он, – но в тех краях было очень много хороших перекрестков». В 1990 году он стал профессором биологии и начал работать в здании на одном из этих перекрестков – в Институте Уайтхеда при Массачусетском технологическом институте.
Даже в так называемой большой пятерке, включавшей крупнейшие центры, участвовавшие в некоммерческом проекте по секвенированию генома человека: Сенгеровский центр, Центр секвенирования генома человека при Вашингтонском университете, Бэйлорский медицинский колледж и лабораторию Министерства энергетики в Уолнат-Крик, где именно лаборатория Ландера замыкала список, удалось проделать наибольший объем работы по секвенированию ДНК благодаря группе Ландера в Массачусетском технологическом институте, тем самым радикально ускорить производительность труда на финише и максимально быстро подготовить черновой вариант генома. Семнадцатого ноября 1999 года некоммерческий проект отпраздновал секвенирование миллиардной пары оснований – гуанина. Всего четыре месяца спустя, 9 марта 2000 года, отсеквенировали двухмиллиардное основание – тимин. Большая пятерка работала ударно. Поскольку Celera пользовалась результатами, полученными в ходе реализации некоммерческого проекта, которые немедленно выкладывались в интернет, а теперь лились сплошным потоком, Вентер наконец тоже ускорился – ведь фактически Celera пришлось секвенировать вдвое меньше оснований, чем планировалось изначально.

Секвенирование ДНК в режиме поточного производства: в Институте Уайтхеда при Массачусетском технологическом институте наладили международную альтернативу проекту Вентера и компании Celera
Пока СМИ писали, что гонка между некоммерческим и частным проектом достигла кульминации, за линией «фронта» все больше внимания уделялось вычислительным мощностям: ученые корпели за компьютерами. Именно они должны были извлечь информацию из грубо отсеквенированных последовательностей А, Т, Г и Ц. Перед ними стояли две основные задачи. Во-первых, надо было собрать окончательную и полную последовательность из множества имевшихся у них фрагментов. Многие части генома были отсеквенированы многократно, поэтому требовалось отсортировать объем информации размером в несколько геномов – составить из него единую каноническую последовательность генов. С точки зрения информационных технологий это была колоссальная работа. Во-вторых, нужно было определить, «что есть что» в этой окончательной последовательности и, самое главное, где какие гены находятся. Вычленение компонентов генома, то есть искусство отличать одну последовательность А, Ц, Г и Т, в которой находится молекулярный мусор, от другой, кодирующей белок, требовало исключительно интенсивной вычислительной работы.
За компьютерную обработку в компании Celera отвечал Джин Майерс, ученый-информатик, который всеми руками и ногами ратовал за полногеномный метод дробовика. Вместе с Джеймсом Уэбером из Маршфилдского медицинского исследовательского фонда в Висконсине они предложили задействовать систему полногеномного секвенирования (WGS) в некоммерческом проекте, еще когда Celera Corporation не была создана. Джин Майерс видел в использовании современных молекулярных технологий как повод для личной гордости, так и общественную целесообразность.
При создании генетической карты были установлены последовательности расположения генетических маркеров (в этом качестве использовали различные полиморфные локусы ДНК, то есть наследуемые вариации в структуре ДНК) по длине всех хромосом с определенной плотностью, то есть на достаточно близком расстоянии друг от друга. Наличие таких ориентиров уже не делало задачу по сборке последовательности, поставленную в некоммерческом проекте, столь неподъемной, как вариант Майерса (метод полногеномного секвенирования (WGS) никаких маркеров не предполагал). При окончательном анализе Celera пользовалась данными о картировании, бывшими в доступе в GenBank в рамках некоммерческого проекта. Проблема заключалась в том, что при слепом подсчете маркерных участков была существенно недооценена их роль. Все это говорит о том, насколько сложна была с технической точки зрения задача построения генетической карты. В то время как Celera подключила к проведению исследований компьютерные технологии, некоммерческий проект сосредоточился на ускорении процесса секвенирования. Лишь на самом последнем этапе лидеры некоммерческого проекта осознали, что, хотя у них на тот момент уже имелась карта генов, они все равно были похожи на того папашу из анекдота, который в сочельник, перед Рождеством, таращится на разобранный велосипед и не знает, что и куда прикрутить. Дату готовности (и сборки) «примерного плана» назначили на конец июня. Однако в начале мая некоммерческий проект вообще не располагал никакими реальными инструментами для систематизации всех полученных ими последовательностей. «Deus ex machina» принял весьма странный облик, представ перед ними в виде аспиранта из Калифорнийского университета в Санта-Крусе.
Звали его Джим Кент, и с виду он походил на рокера из Grateful Dead. Он занимался программированием с тех самых пор, как появились компьютеры, разрабатывал код для графических и анимационных программ, но затем решил пойти в аспирантуру и заняться биоинформатикой – новой дисциплиной, посвященной анализу ДНК и белковых последовательностей.

Джим Кент задействовал сотню персональных компьютеров и собрал «рабочий вариант» генома для некоммерческого проекта
Он осознал, что завязывает с коммерческим программированием, когда получил от Microsoft увесистый пакет из 12 CD для разработки программ под Windows 95. Слова самого Джима Кента были такими: «Я подумал, что весь геном человека уместился бы всего на одном диске, причем он не стал бы изменяться каждые три месяца». В мае он уже был уверен, что справится с широко обсуждавшейся на тот момент задачей анализа и систематизации генома, и убедил родной университет, чтобы ему «одолжили» на время сотню компьютеров, закупленных для учебных целей. Затем он на четыре недели погрузился в разработку программного обеспечения для решения задачи. По ночам даже массировал запястья, чтобы их не сводило судорогой от долгой работы на компьютере, а сам день за днем «ваял» генетический код. Крайним сроком было 26 июня – именно на эту дату приходился анонс чернового варианта генома. Дописав программу, Кент запустил в работу всю сотню компьютеров, и 22 июня эта компьютерная «орда» справилась с проблемой построения генома для некоммерческого проекта. Майерс в Celera уложился в еще более сжатые сроки: он завершил свою сборку в ночь на 25 июня.
Затем наступило 26 июня 2000 года. Билл Клинтон в Белом доме и Тони Блэр на Даунинг-стрит, 10, одновременно объявили, что первый черновой вариант человеческого генома готов. Все решили, что результатом соревнования по расшифровке генома стала ничья, и поэтому честь победителя также была разделена пополам. К счастью, соперники смогли преодолеть свои амбиции – по крайней мере на одно утро. Клинтон изрек: «Сегодня мы начинаем понимать язык, на котором Господь написал книгу жизни… Обладая этими глубокими новыми знаниями, человечество вот-вот обретет безграничную, новую силу исцеления». Великие слова о грандиозном событии. Невозможно было не испытывать гордости за достижение, которое в прессе сравнивали с первой посадкой «Аполлона» на Луну, даже несмотря на то что «официальная» дата триумфа казалась немного притянутой. Секвенирование было еще не закончено, и прошло еще почти восемь месяцев, прежде чем одновременно вышли две научные статьи, резюмирующие информацию о геноме. Некоммерческий проект опубликовал свою работу в Nature, а Вентер и его коллеги из Celera – в Science. Было высказано предположение о том, что дату 26 июня назначили, ориентируясь не на готовность проекта «Геном человека», а на рабочий график президента Клинтона и премьера Блэра.
За шиком и блеском приема в Белом доме совершенно потерялся тот факт, что торжество устроили по поводу всего лишь чернового варианта генома человека. Оставалось еще немало работы. В полной мере удалось завершить лишь секвенирование двух самых маленьких хромосом, 21 и 22, – и эту информацию сразу опубликовали. Но даже в случае расшифровки генома этих хромосом невозможно было похвастаться непрерывными последовательностями – «от одного конца молекулы к другому». Что же касается других хромосом – некоторые просто пестрели пробелами. Коллинз с коллегами осознавали, что могут пройти годы, а возможно, и десятилетия, прежде чем будут секвенированы все основания, поэтому проект «Геном человека» даже при всем желании нельзя было назвать завершенным. В апреле 2003 года они заполнили большинство пробелов в геноме и выстроили точную «практически полную» последовательность. Таким образом, геном был отсеквенирован минимум на 95 % с погрешностью не более одной ошибки на 10 тысяч оснований. Неслучайно анонс подгадали к полувековой годовщине с момента выхода нашей с Френсисом Криком статьи о двойной спирали, опубликованной в журнале Nature. Френсис Коллинз гордо отметил, что проект «Геном человека» закончен досрочно и с профицитом бюджета.

26 июня 2000 года. Крейг Вентер (слева) и Френсис Коллинз (справа), получившие черновой вариант генома, заключили перемирие, вместе купаясь в лучах славы рядом с президентом Биллом Клинтоном

На выходе из Белого дома: я с Эриком Ландером (Уайтхед, Массачусетский технологический институт), Ричардом Гиббсом (Бэйлор, Хьюстон), Бобом Уотерсоном и Риком Уилсоном (Вашингтонский университет, Сент-Луис)
Одним из тех, благодаря кому международной команде молекулярных биологов, занимающихся проблемой секвенирования, удалось преодолеть заключительные преграды, был Рик Уилсон, грубоватый добряк со Среднего Запада, сменивший Боба Уотерсона на посту руководителя в центре секвенирования в Вашингтонском университете. Все предприятие зависело от контроля качества, поэтому на каждую хромосому был назначен координатор, который должен был наблюдать за общим ходом работ и гарантировать, что работа в его зоне ответственности соответствует общей специфике проекта. Иногда возникали сбои в работе, например в одну из позиций в базе данных генома человека каким-то образом вкралась часть генома риса. Но проведение процедур менеджмента качества на всех этапах работы помогло надежно избавляться от таких инородных включений.
За десять лет, минувших с того момента, как мы имели честь заявить, что проект «Геном человека» завершен, ученые продолжали изучать тайны генома, образно говоря, «рассматривали его под микроскопом», как археологи, которые каторжно трудятся, просеивая породу и каталогизируя ее шихты в поисках заветных исторических артефактов. Эталонная последовательность, полученная в рамках некоммерческого проекта, остается драгоценной основой всех нынешних и дальнейших разработок. Уже после многолетнего тщательного анализа – завершилось несколько крупных международных проектов, построенных на тех же принципах командной работы и свободного обмена данными, которые были закреплены в проекте «Геном человека», – мы гораздо лучше представляем себе общую генетическую вариативность в различных популяциях. Уже построена трехмерная карта генома, заключенная в клеточном ядре; с каждым годом мы все полнее понимаем функциональные элементы этой последовательности и сопутствующие химические модификации, управляющие включением и отключением генов. Все эти открытия стали возможны благодаря драматичным успехам в технологии секвенирования ДНК, позволившим менее чем за десять лет повысить производительность нашего труда в миллион раз.
Проект «Геном человека» стал эпохальным достижением, но это была всего лишь одна эталонная последовательность – геном-мозаика, собранный из кусочков, взятых примерно от двадцати волонтеров, откликнувшихся на объявление в газете города Буффало, где предлагалось сдать образцы ДНК. Эти образцы стали базовым материалом в заключительной части проекта «Геном человека». Тот факт, что выбор пал на город Буффало, может показаться немного курьезным, но именно там жил Питер де Йонг, молекулярный генетик из Голландии, работающий в институте Росуэлл-Парк и широко признанный как ведущий эксперт по созданию библиотек искусственных бактериальных хромосом; именно его исследования подготовили почву для секвенирования ДНК. Мы так и не узнали, кто именно был волонтером и сдал свой биоматериал для создания эталонного генома, но анализ, проведенный в Институте Броуда Дэвидом Джаффе и его коллегами, показал, что там есть существенная афроамериканская составляющая. Эталонный геном стал основой, своеобразным контуром, как в раскраске «нарисуй картинку по точкам»; отталкиваясь от нее, другие исследователи стали вычерчивать практически бесконечно разнообразные иные последовательности человеческого генома – с севера на юг и с востока на запад.

Объявление из газеты Buffalo News о поиске доноров-волонтеров, которым предлагалось сдать ДНК для проекта «Геном человека»
В рамках проекта HapMap (International Haplotype Mapping, Международный проект «Карта гаплотипа») началось каталогизирование всех этих многочисленных вариантов. Благодаря революции, произошедшей в картировании геномов в 1980-е годы, мы уже видели, как далеко и глубоко смогли продвинуться ученые в обнаружении мутаций, вызывающих наследственные заболевания. Однако для поиска генетических дефектов, из-за которых у человека возникает предрасположенность к диабету, сердечно-сосудистым заболеваниям и раку, требуется систематически изучать генетическую вариабельность. Цель проекта HapMap – разработка карты гаплотипа генома человека, чтобы описать общие закономерности наследственной генетической изменчивости людей. Собирая информацию о местоположении миллионов однонуклеотидных полиморфизмов (сокращенно SNP, произносится «снип»), исследователи накопили обширную базу маркеров, из которых формируются репрезентативные выборки для проведения крупномасштабных исследований GWAS («полногеномный поиск ассоциаций») и идентификации генов, вызывающих распространенные заболевания (см. главу 12).
Для включения в HapMap были выбраны четыре группы населения: 30 взрослых и их оба родителя Йоруба из Ибадана, Нигерия (YRI), 30 резидентных троек жителей штата Юты североевропейского и западноевропейского происхождения (CEU), 44 не связанных между собой японцев из Токио, Япония (JPT), и 45 не родственных между собой китайцев из Пекина, Китай (CHB). Такое государственно-частное сотрудничество началось со скрининга ДНК волонтеров HapMap на наличие трех миллионов снипов (рассматривался весь геном). Основная масса генотипической работы была проделана в Perlegen, дочерней компании Affymetrix. Компания Affymetrix стала одним из первопроходцев в исследовании генных чипов и определила матрицу из более чем трех миллионов равномерно расположенных снипов, служивших своеобразными «верстовыми столбами» – по одному примерно на девятьсот – тысячу оснований. Так была проложена дорога для триумфального шествия GWAS, проводившихся фондом Wellcome Trust и другими организациями. Сегодня в каталоге человеческих снипов более 10 миллионов позиций, в среднем по одному на каждые триста оснований. На смену проекту HapMap пришел новый проект «1000 геномов», который наконец успешно завершился в 2016 году.
Одной из важнейших задач, решавшихся в рамках проекта «Геном человека», была сборка «геномной ведомости» человеческого организма. Каталогизировав примерно 20 тысяч генов – во много-много раз меньше, чем было озвучено в учебниках всего десятью годами ранее, мы все еще не могли справиться с весьма запутанной проблемой: есть ли вообще какое-либо назначение у «мусорной ДНК»? Является ли эта «темная материя» молекулярной генетики всего лишь отбросами, оставшимися после долгих миллионов лет эволюции, следами древних вирусных инфекций и перегруппировки генов, либо у нее все-таки есть какая-то таинственная функция?
Для того чтобы ответить на этот вопрос, был организован еще один международный проект. Он назывался ENCODE («Энциклопедия элементов ДНК») и объединил более четырехсот ученых из тридцати двух стран. Задуманный как продолжение проекта «Геном человека», ENCODE ставит целью проведение полного анализа функциональных элементов генома человека. Все результаты, получаемые в ходе реализации проекта, публикуются в общедоступных базах данных. Ученые погрузились в лабораторные исследования сроком на пять лет (потратив на работу примерно триста лет компьютерного времени), чтобы разгадать тайну «мусорной ДНК». Проект ENCODE позволил взглянуть на геном по-новому и рассмотреть его с высоким разрешением, а не на «зернистой кинопленке», как ранее. В 2012 году сотрудники ENCODE опубликовали полноценную книгу о своей работе – тридцать глав-статей в Nature и нескольких других журналах. Результаты породили не меньше противоречий и дискуссий, чем геномные войны, бушевавшие в конце 1990-х годов. Согласно выводам авторов ENCODE, целых 80 % генома функциональны и характеризуются «особой биохимической активностью». Вот вам и «мусорная ДНК»! Например, там могут находиться сайты связывания (они же «энхансеры» или «промоторы» в терминологии генетиков) для факторов транскрипции или регуляторных генных белков, включающих и отключающих гены. Проект также позволил пролить свет на плохо изученные участки ДНК между генами; именно на этих участках начинается транскрипция РНК. В отличие от транспортной РНК они по какой-то причине не транслируются в белки. Специалисты ENCODE отнюдь не собирались проигнорировать эти участки генома как обычный мусор, но утверждали, что там сосредоточены бесполезные реликвии и старье, как пресловутый «потерянный на чердаке хобот».
Растиражированное заявление сотрудников ENCODE о «80 процентах» яростно оспаривалось. Противоречия открылись уже в том, что считать «функциональным», а что мусорным в составе генома. По словам Юэна Бирни, одного из ключевых архитекторов ENCODE, проблема сводится к следующему: изменяет ли данный элемент генома каким-то образом биохимические процессы в клетке или влияет на фенотип (внешний вид) организма? Иными словами, является ли факт транскрипции достаточным доказательством функциональности? Некоторые исследователи были готовы поспорить на эту тему, хотя к этому времени с учетом накопленных знаний это было непросто. Для 8 % генома имелись бесспорные доказательства физического контакта между ДНК и белками, в частности факторами транскрипции. Признаться, назначение остальных 72 % нашей «функциональной» ДНК пока не совсем ясно. Тем не менее ENCODE представил убедительные доказательства того, что даже те последовательности, которые значительно удалены от кодирующих регионов, регулируют некоторые аспекты экспрессии генов. Бирни указывает, что целых 60 % генома сейчас считается «экзонными» или «интронными» участками, поэтому «нет ничего удивительного, что мы видим дополнительные 20 % сверх этих 60 %».
Проект «Геном человека» навсегда останется выдающимся технологическим достижением. Если бы в 1953 году кто-нибудь предположил, что в ближайшие 50 лет геном человека будет полностью отсеквенирован, то мы с Криком бы просто посмеялись и купили собеседнику еще стаканчик алкоголя. Такой скептицизм казался оправданным даже двадцать пять лет спустя, когда наконец-то были разработаны первые методы секвенирования ДНК. Бесспорно, эти методы стали технологическим прорывом, но процесс секвенирования все равно оставался удручающе медленным – в ту пору казалось титанической работой сгенерировать последовательность даже крошечного гена длиной несколько сотен пар оснований. А затем, еще через двадцать пять лет, мы отпраздновали полное секвенирование 3,2 миллиардов пар оснований. Нам всегда нужно помнить, что описание генома – отнюдь не просто памятник нашей технологической сноровке, каким бы ошеломительным ни показался этот архитектурный шедевр. Какова бы ни была политическая мотивация, представители Белого дома совершенно справедливо прославляли оказавшееся в наших руках новое оружие для борьбы с болезнями. Более того, наш проект стал началом новой эры представлений об устройстве живых организмов и функциональных возможностях и ответил на вопрос: чем мы биологически отличаемся от представителей других видов – словом, что делает нас людьми. Однако, прежде чем перейти к этим темам, давайте обсудим поразительные революционные изменения в секвенировании ДНК и анализе геномов, наступившие после того памятного дня лета 2000 года, когда мы сделали первый маленький шажок в эру геномики.

Кас Крамер с коллегами из Лейчестерского университета полностью распечатали всю последовательность человеческого генома. Каждая стопка книг с одноцветными корешками соответствует одной из хромосом. В каждой клетке человеческого тела зашифрована целая энциклопедия данных
Generation Genome – экспонат с выставки «Разгадывая код жизни», продюсировавшейся при участии Смитсоновского национального института естественной истории и Национального института генома человека
Назад: Глава 6 Буря в миске с кашей: генетически модифицированные продукты
Дальше: Глава 8 Время первых

