Книга: ДНК. История генетической революции
Назад: Глава 13 Что важнее: наследственность или воспитание?
Дальше: Эпилог Наши гены и перспективы на будущее
Глава 14
Рак: война без конца?
Когда я еще жил дома, в Чикаго, и как раз заканчивал Чикагский университет (было это в 1947 году), дяде Стэнли, младшему брату моего отца, отцу двоих сыновей, исполнилось сорок. В тот год у него обнаружили злокачественную меланому. В те времена меланома была абсолютно неизлечимым раком кожи. Вероятно, Стэнли прихватил ее, загорая на песчаных пляжах озера Мичиган. Когда хирург удалил у него с руки черную бородавку, рак уже метастазировал и проник во внутренние органы, куда скальпелю, увы, не добраться. Ужасные воспоминания о том, как на руках и на лице у Стэнли возникали новые опухоли, не покинут меня никогда. Поэтому позднее, работая в Гарварде, я всегда надевал широкополую шляпу, выходя на расположенный неподалеку пляж или прогуливаясь рядом с нашим летним домиком на острове Мартас-Винъярд, несмотря на то что там в изобилии росли тенистые вязы. Даже сегодня, когда мне уже почти девяносто, я так и не играю в теннис на Лонг-Айленде в полуденные часы, даже обмазанный кремом от загара с сильным протективным эффектом. Самая надежная стратегия борьбы с раком, как раньше, так и теперь, это профилактика, поскольку обычно эта жуткая болезнь нападает совершенно внезапно.
При этом каждое утро я по-прежнему принимаю две таблетки детского аспирина, поскольку всерьез отношусь к достоверным эпидемиологическим данным, что это хорошее противовоспалительное средство на 25 % снижает вероятность развития рака. Поскольку я до сих пор поигрываю в теннис, такая физическая нагрузка помогает дополнительно обогащать мышцы реактивными формами кислорода, которые снижают вероятность серьезной онкологии еще на 25 %. Пока неизвестно, помогает ли дополнительно защититься от рака ежедневная доза в 500 мг метформина – это сахароснижающее средство, которое помогает от диабета. Так или иначе, я метаболизирую меньше глюкозы.

Кэролайн Бернарди – ей удалось излечиться от рака
Через шестьдесят лет после того, как рак диагностировали моему дяде Стэнли, женщина по имени Кэролайн Бернарди, сорокачетырехлетний маркетолог из Сиднея, как раз рассылала клиентам рождественские подарки, когда после обеда ее отвлек от работы телефонный звонок с известием, которое ужасает каждого, но которое тем не менее раз в жизни суждено услышать каждому третьему: «У вас рак». Биопсия шейного отдела показала, что у Кэролайн Бернарди немелкоклеточный рак легкого на стадии 3B. Врач сказал, что опухоль неоперабельна, и оценил шансы Бернарди прожить еще 12 месяцев не более чем в 5 %. «Мне показалось, словно я села в скоростной поезд и все вокруг словно расплылось и стремительно понеслось мимо. Однако я просто застыла и пыталась осмыслить тот вихрь, в котором очутилась», – рассказывает Кэролайн. Новость сокрушила всех ее домашних, в том числе двух маленьких детей. Все это казалось чудовищной несправедливостью: Бернарди была физически здорова, в семейном анамнезе у нее не было рака, и она за всю жизнь не выкурила ни единой сигареты.
После того как химиотерапия не помогла, Майкл Бойер, лечащий врач Бернарди из Сиднейского онкологического центра, решил пойти ва-банк. По поручению компании Pfizer он отвечал за клиническое исследование экспериментального противоракового препарата дакомитиниба, проводившегося в Азии и Австралии. Лекарство показывало первые обнадеживающие результаты у тех пациентов, которые не реагировали на иные препараты, например на Tarceva или Iressa, также воздействующие на рецептор эпидермального фактора роста, важный трансмембранный сигнальный белок, с которым связан рост многих типов раковых клеток. Спустя пару месяцев Кэролайн Бернарди присоединилась к исследованию, составив компанию еще двадцати с лишним волонтерам – первопроходцам на неизведанной территории таргетной онкологической медицины. Всего через несколько дней она почувствовала, что опухоли у нее на шее стали размягчаться. Через два месяца компьютерная томография показала, что пять опухолей у нее в легких рассосались, рака не было и в пораженных лимфоузлах. «Это было попросту красиво!» – вспоминает она.
К сожалению, истории о такой поразительной ремиссии, как у Бернарди, остаются исключением, а не правилом. На каждую историю о победе над раком найдется множество пациентов, которым не помогает ни химиотерапия, ни новейшие препараты либо у которых рак на время отступает, а затем возвращается – с еще более худшими клиническими проявлениями, чем прежде. На каждое лекарство, добавляющееся в фармакопею онколога (обычно на разработку лекарства уходит десять лет и более), приходится множество препаратов, которые «сходят с дистанции», поскольку оказываются слишком токсичными, неспецифическими или недостаточно эффективными. Фактически то же самое произошло и с дакомитинибом, пополнившим ряды некогда многообещающих препаратов, которые, однако, не были одобрены регламентирующими органами. Однако при всем при этом случай Кэролайн Бернарди все равно кажется чудом. Именно ее рак удалось полностью вытравить экспериментальным препаратом, тогда как другим участникам исследования не повезло – такой феномен врачи именуют «эффект Лазаря». Бернарди словно уверовала – она продолжает ежедневно принимать дакомитиниб, но считает, что излечиться ей помогли и другие факторы: теперь она медитирует, лучше питается, каждый день делает зарядку, прибегает к иглоукалыванию и другим приемам традиционной китайской медицины. Она на волонтерских началах работает в больницах и написала книгу, чтобы вдохновить других онкобольных и их семьи. Ее врач не смог уверенно ответить, что же именно ей помогло, поэтому разумно, но осторожно посоветовал: «Продолжайте делать все, чем занимаетесь сейчас».

Джон Даймонд, писатель и журналист

Точка слома: определенные мутации в гене BRCA1 коррелируют с развитием рака груди и яичников. Здесь показаны два снимка хвостового региона белка BRCA1. Слева выделена аминокислота метионин 1775, расположенная рядом со щелью, где BRCA1 связывается с другим белком, помогающим находить и чинить поврежденную ДНК. Справа в результате мутации подставляется остаток аргинина, который отключает такое «партнерское» свойство. Считается, что именно такая мутация M1775R вызывает рак груди
Когда в 1997 году британскому журналисту Джону Даймонду (первому мужу знаменитого ресторанного критика Найджелы Лоусон) диагностировали рак пищевода, он стал вести в газете Times регулярную колонку о своей болезни. «Когда вам стукнет сорок, – писал он, – каждая из тридцати с чем-то триллионов ваших клеток успеет поделиться пару тысяч раз. Какова вероятность, что хотя бы некоторые из этих клеток не ударятся в цитологическую анархию, которая вызовет рак и погубит вас?» Даймонд, умерший в 2001 году, даже не будучи ученым, сделал проницательное естественнонаучное наблюдение. Действительно, малейшая ошибка в работе фермента, обеспечивающего рутинную химическую реакцию, мимолетное воздействие инородного химиката или случайный космический луч могут повредить спираль ДНК и спровоцировать необратимый и безудержный рост клеток. Скорее, удивительно не то, как много людей заболевает раком, а то, какому множеству удается этого избежать.
Тот факт, что рак обусловлен, прежде всего или даже исключительно, генетическими изменениями, впервые был отмечен при исследовании семей, в которых прослеживались редкие заболевания, например синдром Линча. При таких расстройствах рак передается из поколения в поколение примерно как наследственное заболевание. Новые случаи рака ожидаемо возникают без какой-либо явной причины, например без участия известных естественных генетических канцерогенов, таких как табачный дым, сажа или асбест. Теперь известно, что многие или все такие семьи предрасположены к раку из-за ошибок в сложнейшей системе репарации нашей ДНК. В нашем геноме действительно есть копировальный механизм, в работе которого неизбежно возникают ошибки, но рак возникает, когда эта первая линия защиты нас подводит.
К наиболее известным относятся случаи таких поломок, связанные с генами BRCA1 и BRCA2. (В главе 12 мы обсуждали, как Мэри-Клэр Кинг героически искала и наконец картировала ген BRCA1. Ее миссия растянулась на двадцать лет и легла в основу фильма «Расшифровка Энни Паркер», где в роли Кинг снялась Хелен Хант. Фильм рассказывает об одной из первых женщин в Северной Америке, прошедших генетический анализ на BRCA1.) У женщин мутации в этих генах провоцируют более половины всех известных случаев рака груди, а также большинство случаев наследственного рака яичников. У мужчин с мутацией в гене BRCA1 в шесть раз повышена частота рака простаты. Очень редко такая мутация (это подтвержденный факт) у мужчин тоже может вызвать рак молочной железы. Оба этих гена кодируют белки, которые играют ключевые роли в обеспечении целостности генома, корректируют несовпадения в парах оснований и проверяют последовательность на наличие неповрежденных, гомологичных нитей ДНК. Остается неясным, почему среди сотен зарегистрированных мутаций конкретные канцерогенные варианты генов BRCA1 и BRCA2 встречаются чаще среди евреев-ашкеназов или среди некоторых групп франкоканадцев.
Идентификация генов BRCA1 и BRCA2 – две примечательные победы в долгой, затяжной войне с раком, но, как правило, исследователям вдобавок требуется превратить генетические находки в осмысленные методы лечения, дающие длительный терапевтический эффект. В декабре 1971 года, более сорока лет тому назад, президент Никсон объявил войну раку. С тех пор на эту войну ежегодно тратятся миллиарды долларов налогоплательщиков, но результаты борьбы неоднозначны. Негативная сторона проблемы такова: с тех пор как началась эта война, смертность от рака в США практически не уменьшилась, особенно если сделать поправку на то, что американцы стали значительно меньше курить. Есть такое заурядное кино про автоугонщиков с Николасом Кейджем в главной роли, называется «Угнать за 60 секунд». Именно каждые 60 секунд в США кто-нибудь умирает от рака. В 2016 году более 550 тысяч американцев умерли от злокачественных новообразований.
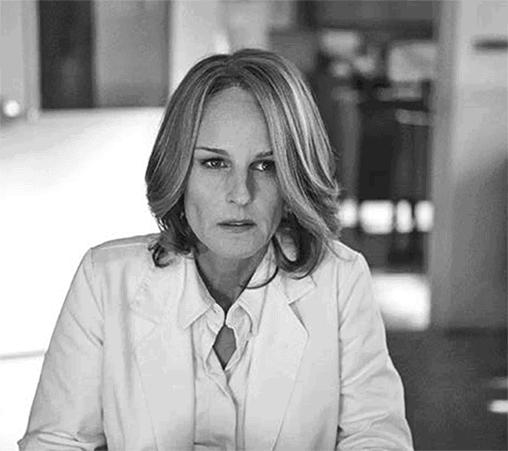
Хелен Хант в роли Мэри Клэр-Кинг, картировавшей ген BRCA1, в фильме «Расшифровка Энни Паркер» (2013)
Положительный аспект состоит в том, что сегодня мы располагаем несколькими новыми действенными средствами против рака. Лучшим противораковым лекарством уже более двадцати лет остается иматиниб. Он регулярно выводит на плато многолетней ремиссии пациентов с хроническим миелоидным лейкозом (ХМЛ). Еще один действенный препарат – герцептин, помогающий бороться с определенными формами метастатического рака молочной железы. Тем не менее большинство видов рака даже после ремиссии, достигаемой в том числе при при помощи геномных препаратов, впоследствии возвращается в гораздо более агрессивной форме, и тогда больному остается жить от нескольких месяцев до одного года. Поэтому, несмотря на все перспективы лекарств, используемых на сегодняшний день и действующих на генетическом уровне, онкологическое заболевание остается источником страха и мучений. Увы, так будет до тех пор, пока не разработают новые методы избирательного уничтожения раковых клеток, в том числе на поздних стадиях болезни.
Этого можно добиться несколькими способами. Во-первых, разрабатывать новые мощные лекарства, блокирующие безусловно опасные канцерогенные вещества, например белки генов RAS и MYC. Сегодня они считаются двумя наиболее приоритетными мишенями, поскольку (как будет рассказано дальше) до сих пор не поддаются большинству современных терапевтических методов. Во-вторых, разрабатывать более качественные иммунотерапевтические лекарства, в частности нацеленные на взаимодействие с белками контрольной точки опухоли, «тормозами» иммунной системы. Иммунотерапия, то есть мобилизация иммунной системы пациента на борьбу с раковыми клетками, кажется очень многообещающей, но требует тонкой настройки, чтобы гарантировать, что иммунные клетки пациента станут бороться с раком, не причиняя чрезмерного сопутствующего вреда, который сейчас остается настоящим бичом при подобном лечении и сводит на нет самые перспективные виды хваленой иммунотерапии. В-третьих, нужно серьезно работать над проблемой побочных эффектов большинства химиотерапевтических препаратов, чтобы их можно было применять подолгу и достигать полноценного лечебного эффекта.
В 2003 году Эндрю фон Эшенбах, в тот период руководивший Национальным институтом онкологии (NCI), поставил задачу «покончить с летальностью и мучениями от рака» к 2015 году. Естественно, эта цель была заведомо недостижима; позже он признал ошибку и уточнил, что имел в виду не победу над раком, а взятие болезни под контроль. Я долгие годы скептически высказываюсь на эту тему в статьях для New York Times и других изданий. Еще в августе 2009 года я заявил, что победа над раком – весьма «реалистичная цель, поскольку в кои-то веки мы знаем его подлинные генетические и химические свойства». После этого заключения пришлось взять тайм-аут. Такие программы, как «Атлас онкологического генома» (последовавшая за проектом «Геном человека»), дали нам массу информации о генетической природе рака, но более чем за десять лет, прошедших от этого заключения, так и не произвели желаемого эффекта в онкологии.
В 2016 году к дискуссии подключился президент Обама, затронувший эту тему в своем последнем послании «О положении страны». «Давайте сделаем Америку страной, в которой рак будет побежден раз и навсегда», – призвал Обама. Руководство такой амбициозной противораковой программой он поручил вице-президенту Джо Байдену, который незадолго до того потерял сорокачетырехлетнего сына Бо, умершего от опухоли мозга. Естественно, для рака авторитетов не существует. Пока Обама выступал в Белом доме, бывший президент Джимми Картер, которому тогда исполнился 91 год, проходил лечение от метатстатической меланомы с помощью экспериментального иммуннотерапевтического препарата Keytruda. Позже Байден сказал, что «президент Никсон объявил раку заведомо проигрышную войну, не имея ни армии, ни орудий, ни информации». Байден сказал, что цель этих противораковых наполеоновских планов – «не развязать новую войну против болезни, а выиграть ту, которую президент Никсон объявил еще в 1971 году». Первая цель программы им. Бо Байдена – «изменить культуру обмена данными, информацией, не припрятывать ее». В основе программы – благие намерения, но меня неизменно разочаровывают все новые «крестовые походы» такого рода, учитывая, сколько раз мы уже пытались их начинать.
Несмотря на весь прогресс, достигнутый за последние десятилетия, многие диагностированные новообразования мы пытаемся лечить традиционными подсечно-огневыми методами: в ход идет скальпель хирурга и ионизирующее излучение. Рентгеновские лучи стали применяться в медицине вскоре после того, как в 1895 году их открыл Вильгельм Рентген – тогда неожиданно выяснилось, что они избирательно уничтожают раковые клетки. Даже сегодня лучевая терапия остается основным орудием в арсенале почти всех онкологических клиник. Однако если рак не удается выявить, пока он мал и локализован, лучевая терапия позволяет лишь уменьшить размеры опухоли. В настоящее время такие методы используются скорее чтобы смягчить страдания, чем чтобы продлить жизнь. К сожалению, слишком часто рак удается обнаружить лишь тогда, когда он уже распространился далеко от первичной опухоли. На таком этапе, именуемом «метастазирование», лишь немногие виды рака поддаются излечению (например, метастатическая карцинома яичка поддается лечению при помощи химиотерапии, препаратом цисплатин). Вот уже более семидесяти лет первоочередной задачей онкологических исследований остается поиск таких противораковых препаратов, которые были бы способны избирательно уничтожать раковые клетки, не затрагивая при этом здоровые.
Попытки лечить рак химиотерапией начались в годы Второй мировой войны. Первоначально для этого использовали алкилирующие аналоги горчичного газа – вещества, напоминающие иприт, один из первых химикатов, который Германия применяла в годы Первой мировой войны при газовых атаках. В годы Второй мировой войны такие жуткие газы на полях сражений в Европе не использовались, однако сотни человек погибли от химического оружия 2 декабря 1943 года, когда немецкая авиация совершила сокрушительный налет на итальянский порт Бари. Среди кораблей, потопленных при этом налете, был и американский транспортный корабль «Джон Харви» типа «либерти», перевозивший секретный груз из двух тысяч бомб, начиненных горчичным газом – якобы для ответных мер на случай, если нацисты решатся применить химическое оружие. В ходе последующего разбирательства военный врач Стюарт Френсис Александер заметил, что в крови у пострадавших и погибших резко снизился уровень лимфоцитов. Из этого он заключил, что производные горчичного газа могут действовать как противораковые препараты, снижая переизбыток лимфоцитов при лимфомах и лейкемии.
К тому моменту двое врачей из Медицинской школы при Йельском университете – Альфред Гилман и Луис Гудман – уже работали над этой проблемой. 27 августа 1942 года польский эмигрант, который остался в истории под псевдонимом Джей-Ди, прошел у них экспериментальную химиотерапию от лимфокарциномы. Поскольку Министерство обороны засекретило эту информацию, препарат из медицинской карты Джей-Ди именовался «вещество Икс», а не «аналог горчичного газа». «При лечении пациента удалось выяснить, что рак реагирует на химические инъекции, а также что химиотерапия чревата потенциально смертельными осложнениями, связанными с угнетением работы костного мозга», – писал Джон Фенн, йельский специалист по сосудистой хирургии. Именно с этого пациента началась терапевтическая онкология. Хотя Джей-Ди умер в год начала его лечения с использованием методов химиотерапии, вскоре затеплилась надежда, что когда-нибудь препараты на основе аналогов горчичного газа позволят лечить людей от всех видов рака. Ремиссии после такого метода терапии регистрировались повсеместно. Первый случай был зафиксирован в Нью-Хейвене, далее такие случаи стали фиксироваться по всем США. Но зарегистрированные ремиссии оказались краткосрочными.
К счастью, в ходе более ранних диетологических исследований зелено-листных овощей удалось выявить вещество, оздоровлявшее костный мозг. Это была фолиевая кислота. При дефиците фолиевой кислоты количество лимфоцитов в костном мозге уменьшается – эффект напоминает воздействие горчичного газа. Вскоре после Второй мировой войны Сидней Фарбер стал сотрудничать с Лабораторией Ледерле при детской больнице Бостона и занялся разработкой ряда ингибиторов фолиевой кислоты, в том числе действенного препарата аметоптерина, сегодня более известного под названием метотрексат. Применив его в 1948 году, Сидней Фарбер впервые добился бесспорной ремиссии при детском остром лимфобластном лейкозе. Постепенно ремиссии становились все более и более длительными. К концу 1960-х годов многих детей удалось полностью излечить от острого лимфобластного лейкоза, комбинируя сразу несколько агрессивных химиотерапевтических средств, в том числе алкалоид винкристин. Столь же удовлетворительных результатов удалось достичь при лечении взрослых пациентов, страдавших обширной онкологией лимфатических узлов – болезнью Ходжкина. Болезнь Ходжкина хорошо излечивалась при помощи еще одного растительного алкалоида – прокарбазина, уничтожающего делящиеся клетки. Прокарбазин применяется при некоторых комбинированных видах химиотерапии. Крепла надежда на то, что удастся найти еще более качественные химиотерапевтические агенты, которые позволят достичь более длительных ремиссий или даже полностью вылечиться. Химиотерапия помогала от многих онкологических заболеваний крови, а также от таких видов рака, как, например, рак груди и легких. Поэтому филантроп Мэри Ласкер, сотрудничавшая с Сиднеем Фарбером в 1960-е годы, смогла пролоббировать в Конгрессе США расширенные программы грантовой поддержки для Национальных институтов здравоохранения, нацеленные на исследования рака, и в частности на подбор комбинаций лекарств для химиотерапевтических режимов.
После того как президент Никсон в конце 1971 года объявил войну против рака, Национальный онкологический институт перешел в непосредственное подчинение президенту, а не главе Национальных институтов здравоохранения. Хотя я был одним их первых членов Консультативного комитета по онкологии при президенте США, вскоре я впал в немилость, и меня выгнали из этого престижного круга, в основном потому что я не питал иллюзий выиграть эту войну всего за десять лет. Именно десятилетний срок в 1961 году озвучил президент Кеннеди, поставив задачу отправить человека на Луну, поэтому такой же срок дали и нам на борьбу с раком. Я считал, что мы слишком мало знаем о раке, как в генетическом, так и в биохимическом отношении, чтобы ответственно планировать устранение большинства видов рака к концу 1970-х годов. По моим наиболее адекватным оценкам, на это могло потребоваться как минимум двадцать, если не тридцать лет.
Естественно, я всерьез обеспокоился, когда в 1979 году моей сорокадевятилетней сестре Бетти диагностировали агрессивный отечно-инфильтративный рак груди. К счастью, она тогда жила в Вашингтоне, округ Колумбия, и могла лечиться в Национальном онкологическом институте – одном из лучших в мире учреждений, занимавшихся инновационной химиотерапией. Более года она еженедельно принимала химиотерапию в почти смертельных дозах. В Национальном онкологическом институте мою сестру вылечили от рака – болезнь так и не вернулась к ней до самой смерти. Однако, как ни прискорбно, впоследствии этот успех практически не удавалось повторить у пациентов, больных этим видом рака, а тем более гораздо более агрессивными его видами: раком легкого, поджелудочной железы, прямой кишки и мозга. Даже сегодня, когда в очень редких случаях и удается добиться полной ремиссии, этот рак почти всегда возвращается в новой и гораздо более агрессивной форме, устойчивой к химиотерапии, и в таком случае болезнь обычно оставляет человеку всего один-два года. Считаю, что Бетти смогла прожить еще более двадцати лет без следа рецидивов болезни именно благодаря той годичной химиотерапии. Она прожила по меньшей мере вдвое дольше, чем обычно прогнозируют на современном этапе пациентам с раком груди. С тех пор эта мысль меня не оставляет, и я думаю, что ее стоит обдумать многим исследователям-онкологам.
Я стал гораздо больше интересоваться исследованиями рака с тех пор, как впервые услышал об опухолевых вирусах, то есть более тридцати лет тому назад. Осенью 1947 года, будучи новоиспеченным аспирантом Университета Индианы, я стал посещать курс по вирусологии, который читал тридцатипятилетний микробиолог Сальвадор Лурия, получивший образование в Италии. Узнавая о вирусах, провоцирующих рак, и в частности о вирусе саркомы Рауса и вирусе папилломы Шоупа, я задумывался над тем, а есть ли у них канцерогенные гены (онкогены). Однако узнать об этом наверняка удалось лишь после того, как в 1953 году мы смоделировали структуру ДНК и поняли, что она напоминает двойную спираль. В результате плодотворных размышлений мы поняли, что, поскольку у вирусов относительно немного нуклеиновых кислот, их хромосомы могут кодировать от силы несколько онкогенов. В начале 1968 года меня назначили директором лаборатории Колд-Спринг-Харбор на Лонг-Айленде, и я поставил себе первоочередную цель: найти, а затем изучить канцерогенные гены на материале человеческого опухолевого вируса SV40, который был открыт незадолго до этого. Мне ни разу не пришлось пожалеть об этом решении, поскольку с тех пор лаборатория в Колд-Спринг-Харборе была центром изучения регуляции генов у эукариот, а также генетических основ рака.
До изобретения технологий планомерного выращивания вирусов в средах для культивирования клеточных культур (эти методологии разработали Гарри Игл из Национальных институтов здравоохранения и Ренато Дульбекко, тогда трудившиеся в Калифорнийском технологическом институте) те впечатляющие наработки 1970-х, показавшие, как именно вирусы вызывают рак, или были бы просто невозможными, или же продвигались бы с черепашьей скоростью. Не менее важную роль для быстрого прогресса в этой сфере сыграла растущая доступность радиоактивных изотопов, которыми помечают основные компоненты вирусных нуклеиновых кислот. Многие талантливейшие интеллектуалы, решившие заняться биологией и медициной после открытия двойной спирали, разумно присоединились к поиску вирусных генов, вызывающих рак.
У многоклеточных животных циклы роста и деления большинства клеток происходят не самопроизвольно, а требуют внешнего сигнала – такой сигнал дают гормоны, поступающие из других органов. Таким образом, клетки делятся лишь тогда, когда организму это требуется. Большинство этих белковых сигналов для запуска/перезапуска клеточного роста либо воздействуют на поверхность клетки (например, эпидермальный фактор роста связывается с соответствующим рецептором), либо опосредуются гормонами роста, поступающими через цитоплазму к ядру, где связываются с рецепторами гормонов, расположенными в ядерном хроматине (таков, например, рецептор эстрогена). Так запускается синтез определенных факторов транскрипции. Многие белки, покрывающие поверхность клеток растущего эмбриона, – это рецепторы факторов роста. Прямо под ними, на внутренней стороне клеточной мембраны, находятся погруженные в цитоплазму другие важные сигнальные белки, например RAS и фосфоинозитид-3-киназа (PI3Ks), которые передают сигналы, стимулирующие рост, на рибосомы – клеточные органеллы, где синтезируются белки для сборки новых клеток.
Механизм репликации вируса саркомы Рауса впервые предсказали в Университете Висконсина в начале 1960-х. Говарда Темина озадачил вопрос, почему размножение этого вируса в мышиных клетках блокируется актиномицином, ингибитором синтеза ДНК. Темин предположил, что первый этап размножения этого вируса заключается в синтезе одноцепочечных нитей ДНК, комплементарных одноцепочечным матрицам РНК, вызывающим инфекцию. Получающиеся в результате двойные спирали, состоящие из ДНК и РНК, затем должны рекомбинироваться в одну или несколько мышиных хромосом, пока возникают провирусы саркомы Рауса, то есть пока вирусные геномы встраиваются в клетки хозяина. При дальнейшей транскрипции этих провирусных последовательностей ДНК генерируются новые цепочки РНК вируса саркомы Рауса. Таким образом, Темин обнаружил вирусы, обладающие активностью обратной транскриптазы и существующие как провирусы в ДНК клеток животных.
Провирусная гипотеза Темина была подтверждена в 1970-е годы, когда он сам и Дейвид Балтимор из Массачусетского технологического института независимо друг от друга открыли, что обработанные детергентом разорванные вирусные частицы встраивают дезоксинуклеозидтрифосфаты в растущую цепочку ДНК. В присутствии фермента рибонуклеазы, расщепляющего РНК, ДНК не образуется – таким образом, шаблоном для ее синтеза служит вирусная РНК. Такой синтез катализирует фермент обратная транскритаза, отвечающая за построение ДНК. Этот фермент кодирует один из четырех генов, линейно расположенных вдоль единственной цепочки ДНК у вируса саркомы Рауса. Длина его ДНК около шести тысяч оснований. Таким образом, способность РНК-содержащих вирусов поражать клетки тканей человека и животных – это следствие так называемой обратной транскрипции, то есть возможности передачи генетической информации не от ДНК к РНК, затем к белку (транскрипция), а наоборот, от молекулы РНК к ферменту ДНК – полимеразе (ревертазе) и уже от него к клетке, которая в результате перерождается в опухолевую. (За открытия, касающиеся взаимодействия между опухолевыми вирусами и генетическим материалом клетки, Темин и Балтимор были совместно удостоены Нобелевской премии в 1975 году). Два из этих генов получили название Gag и Env – они кодируют у вируса саркомы Рауса соответственно внутренние (связывающиеся с РНК) и внешние структурные белки оболочки. В конце генома РНК расположен ген Src – он кодирует фермент, который фосфорилирует тирозиновые остатки и обеспечивает базовый внутриклеточный регуляторный этап в самом начале биохимического пути, по которому внешние сигналы, стимулирующие рост клетки, передаются с мембраны к клеточному ядру.
Следующее важное открытие также было отмечено Нобелевской премией. Его совершили Майк Бишоп и Гарольд Вармус из Калифорнийского университета в Сан-Франциско, определившие, что во всех клетках позвоночных содержится неонкогенный вариант гена Src, очень похожий на тот, что кодирует вирусную саркому Рауса. Они выявили первый человеческий онкоген. Естественно, Бишоп был польщен, когда однажды рано утром в 1989 году его разбудил звонок из Стокгольма, но тем не менее настаивал на более раннем времени своей пресс-конференции, чтобы успеть в тот вечер поболеть за любимую команду «Сан-Франциско Джайентс», вышедшую в плей-офф главной лиги бейсбола. Вскоре исследователи открыли и неканцерогенные варианты других вирусных онкогенов, в частности RAS-онкогенов (они встречаются в трех вариантах: H, K и N). Подобные гены передают сигналы, стимулирующие рост, от многочисленных мембранных рецепторов факторов роста. Такие онкогены, как рецептор HER2 (из семейства эпидермальных факторов роста), часто амплифицируются в раковых клетках; при их наличии соответствующие нисходящие пути роста всегда активны. Напротив, в нормальных клетках ген HER2 почти все время неактивен.
Воздействие мутантных онкогенов, таких как EGFR, HER2, RAS и P13K, можно сравнить с ситуацией, когда педаль газа все время выжата до упора – из-за этого клетка-хозяин неконтролируемо растет и делится. Напротив, при мутациях в генах иного класса, так называемых опухолевых супрессорах, эти гены действуют, скорее, как заклинившие тормоза, отключающие жизненно важные защитные механизмы клетки. Люди, унаследовавшие дефектный опухолевый супрессор, в некотором смысле находятся на краю пропасти: если будет повреждена вторая, последняя копия этого гена, то у них вполне может развиться рак. Среди опухолевых супрессоров можно назвать PTEN, подавляющий метаболизм роста, а также p53 и RB – в нормальной ситуации эти гены препятствуют запуску деления митотических клеток.
Работу этих генов впервые красочно продемонстрировали Берт Фогельштейн (Bert Vogelstein), Кеннет Кинцлер (Kenneth Kinzler) и их коллеги из Университета им. Джона Хопкинса, показавшие, что сбои в работе некоторых онкогенов и опухолевых супрессоров накапливаются до тех пор, пока не спровоцируют возникновение и прогрессирование рака прямой кишки.
Хотя, конечно, есть такие виды рака, которые возникают из-за единственной мутации, гораздо вероятнее, что должно произойти как минимум несколько мутаций, прежде чем начнется рак, представляющий угрозу для жизни. Одна или несколько мутаций включают клеточный рост, опосредованный синтезом белков; очередная мутация запускает неконтролируемый клеточный цикл – например, из-за того что в клетке перестает работать ген p53. Скорее всего, большинство видов рака у человека начинаются после двух-трех мутаций в онкогенах, а затем такого же числа мутаций в опухолевых супрессорах. Однако, возможно, и не требуется свести на нет все эти мутации, чтобы добиться эффективности препаратов, действующих на уровне генов. Есть надежда, что по-настоящему переломить ситуацию удастся после появления эффективных препаратов против RAS и MYC.
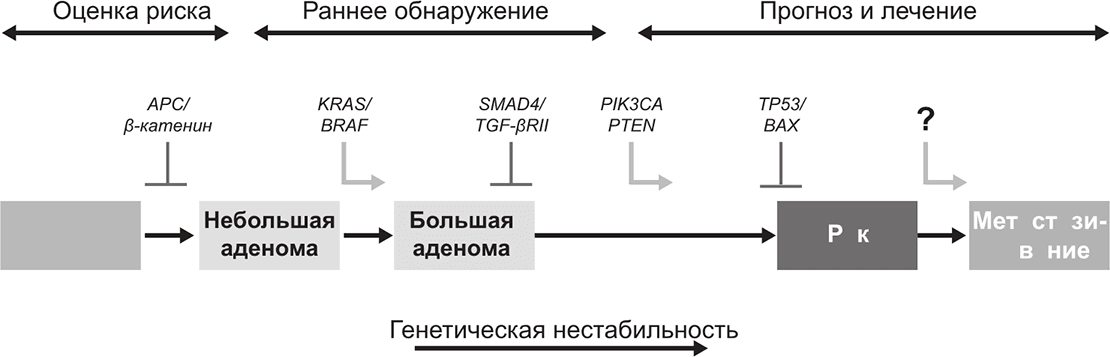
Долгий путь от здоровой ткани к распространению рака. Классические исследования Берта Фогельштейна, Кеннета Кинцлера и их коллег показали, что рак прямой кишки и другие онкологические заболевания возникают из-за накопления последовательных мутаций во множестве генов
Один из важнейших генов опухолевых супрессоров был открыт в 1979 году сэром Дэвидом Лейном и его коллегами из Университета Данди. Оказалось, что белок p53 – один из центральных узлов, где сходится масса нормальных функций и клеточных биохимических путей; в частности, здесь пролегает ключевой этап сложного пути, приводящего к раку прямой кишки. Имена онкологов Фредерика Ли и Джозефа Фраумени увековечены в названии редкого наследственного синдрома, при котором у человека в раннем возрасте развивается сразу множество видов рака, в том числе рак молочной железы, крови и мозга. Наследственные мутации в гене p53 вызывают синдром Ли – Фраумени, а соматические мутации в p53 встречаются более чем в 50 % всех случаев рака. Поэтому ген p53 полностью оправдывает свое пафосное прозвище «страж генома».
Однако шансы на возникновение заболевания для всех организмов, больших и малых, различаются, хотя и в этом случае p53 также оправдывает свою репутацию. Прославленный статистик из Оксфордского университета сэр Ричард Пето однажды сформулировал интересный вопрос: почему повторяемость случаев рака не коррелирует с абсолютными размерами тела и, соответственно, с количеством клеток? Почему рак у человека развивается с той же частотой, что и у мышей, но чаще, чем, скажем, у слонов? Оказывается, разгадка парадокса Пето заключается в следующем. В геноме слона примерно 20 копий гена p53, поэтому слон обладает «системой раннего оповещения» с высокой избыточностью. Поскольку в клетках слона белок p53 синтезируется в огромных количествах, организм не пытается «ремонтировать» ДНК (как делают некоторые человеческие варианты этого гена), а просто провоцирует апоптоз клеток, чтобы «не рисковать». Естественно, у слона множество клеток, способных к самопроизвольному уходу в апоптоз.
После обнаружения важнейших онкогенов, в частности RAS, несколько новоиспеченных биотехнологических компаний, специализирующихся в области онкологии, принялись искать препараты, блокирующие работу этих генов. Еще в 1980-е годы я работал консультантом в одной такой компании на Лонг-Айленде, которую планировалось назвать Oncogene Sciences, однако она приобрела известность под именем OSI Pharmaceuticals. Среди основных онкогенных белков, на которые она нацелилась, был RAS. В те годы сформулировали множество основополагающих описаний работы RAS на генетическом и биохимическом уровнях организации, и в этом была заслуга Майка Уиглера и Линды ван Эльст, работавших всего в нескольких километрах от лаборатории Колд-Спринг-Харбор. Однако как тогда, так и сейчас RAS крайне тяжело поддается лекарственному воздействию. Поэтому OSI переключилась на поиск препаратов против эпидермального фактора роста, чрезмерная экспрессия которого – одна из важнейших причин, вызывающих рак легких. Однако прошло почти десять лет, пока OSI получила от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрение на препарат, блокирующий эпидермальный фактор роста, именуемый Tarceva. К сожалению, с помощью этого препарата редко удается продлить жизнь человека более чем на два года, а большинству пациентов разница «еще полгода» или «еще полтора года» не очень принципиальна. Поэтому у Tarceva был крайне ограниченный коммерческий успех. OSI не имела шансов превратиться в мирового биотехнологического игрока, сравнимого с Genentech, и в 2010 году за четыре миллиарда долларов ее приобрела японская фармацевтическая компания Astellas. Хотя основатели Oncogene и работавшие там ученые так и не стали баснословно богаты, я, по крайней мере, смог употребить свой заработок на существенную филантропическую поддержку для лаборатории Колд-Спринг-Харбор.
Значительно более успешным противораковым средством оказались гуманизированные моноклональные антитела, на основе которых был получен препарат герцептин (о нем я уже упоминал). Этот препарат блокирует рецептор HER2, стимулирующий рост всех потенциально летальных протоковых разновидностей рака груди. Поскольку герцептин довольно часто обеспечивает ремиссии, длящиеся по несколько лет, а не месяцев, как ранее, создание этого препарата – один из крупнейших прорывов в лечении рака за два последних десятилетия. Исходно HER2 был описан в 1980-е годы учеными из Genentech, показавшими, что это продукт одного из первых онкогенов (NEU), идентифицированных в Массачусетском технологическом институте группой Боба Вейнберга. Онколог Деннис Слеймон из Калифорнийского университета в Лос-Анджелесе показал, что амплифицированные гены HER2 – основной фактор развития протокового рака груди. У пациентов с лишними копиями гена HER2 зачастую возникал более агрессивный метастазирующий рак. В течение нескольких следующих лет Слеймон сотрудничал с Genentech, участвуя в разработке моноклонального антитела для блокировки рецептора HER2. Гуманизированную форму этого моноклонального антитела назвали «герцептин» – неологизм составлен из аббревиатуры HER2 и английского слова intercept (перехватывать). К тому времени (в 1998 году) Деннис Слеймон уже представил на крупной конференции по онкологии драматичные результаты третьего этапа своего клинического исследования – поэтому препарат был одобрен без всяких сомнений.
На сегодня наиболее успешным противораковым препаратом, работающим на генетическом уровне, остается иматиниб (Gleevec). Большинство современных препаратов от лейкемии – это по-прежнему адаптированная «побочка» терапии другой онкопатологии, поскольку фармацевтические компании не склонны инвестировать средства в разработку лечения, нацеленного на относительно малую подгруппу пациентов. Однако в 1990 году, когда молодой швейцарский химик-органик Юрг Циммерманн получил в Базеле свою первую серьезную фармацевическую работу в компании Ciba-Geigy (позже она слилась с компанией Sandoz, и вместе они образовали корпорацию Novartis), ему первым делом поставили следующую задачу: синтезировать низкомолекулярные кандидатные препараты для лечения хронического миелоидного лейкоза (ХМЛ). Хотя это и не самая распространенная форма лейкемии, в мире ежегодно диагностируется около 6000 случаев ХМЛ, эта болезнь обычно приводит к смерти максимум за пять лет, и единственное доступное лечение – это трансплантация костного мозга.
Однако основная причина ХМЛ была известна уже несколько десятилетий: в 1960 году двое ученых из Филадельфии описали любопытную аномалию в белых кровяных тельцах у больных. Еще через десять лет Джанет Роули, генетик из Университета Чикаго, точно описала хромосомную аномалию как филадельфийскую хромосому. Воспользовавшись новым методом окрашивания, с которым она ознакомилась во время творческого отпуска в Оксфорде, Джанет Роули смогла сделать микрофотографии хромосом с нанесенными полосками. В 1972 году она раскладывала эти снимки прямо на обеденном столе, вырезала из них изображения отдельных хромосом и аккуратно попарно складывала, уговаривая своих маленьких детей, игравших рядом, чтобы те не чихали. Оказалось, что филадельфийская хромосома – это патологическое слияние двух обычных хромосом, 9 и 22. Джанет Роули написала о своем открытии в журнале Nature. Описав хромосомные транслокации при двух других типах лейкемии, она убедилась, что именно эти аберрации и есть причина рака, а не какой-нибудь побочный эффект другого заболевания. Так появилось первое солидное доказательство, что рак возникает из-за повреждений ДНК.
Аномальная хромосома, образующаяся вследствие переноса части 9-й хромосомы на 22-ю, при ХМЛ синтезирует химерный онкогенный белок BCR-ABL, который кодирует на поверхности клетки киназу, провоцирующую рост и отличающуюся при ХМЛ чрезмерной экспрессией.
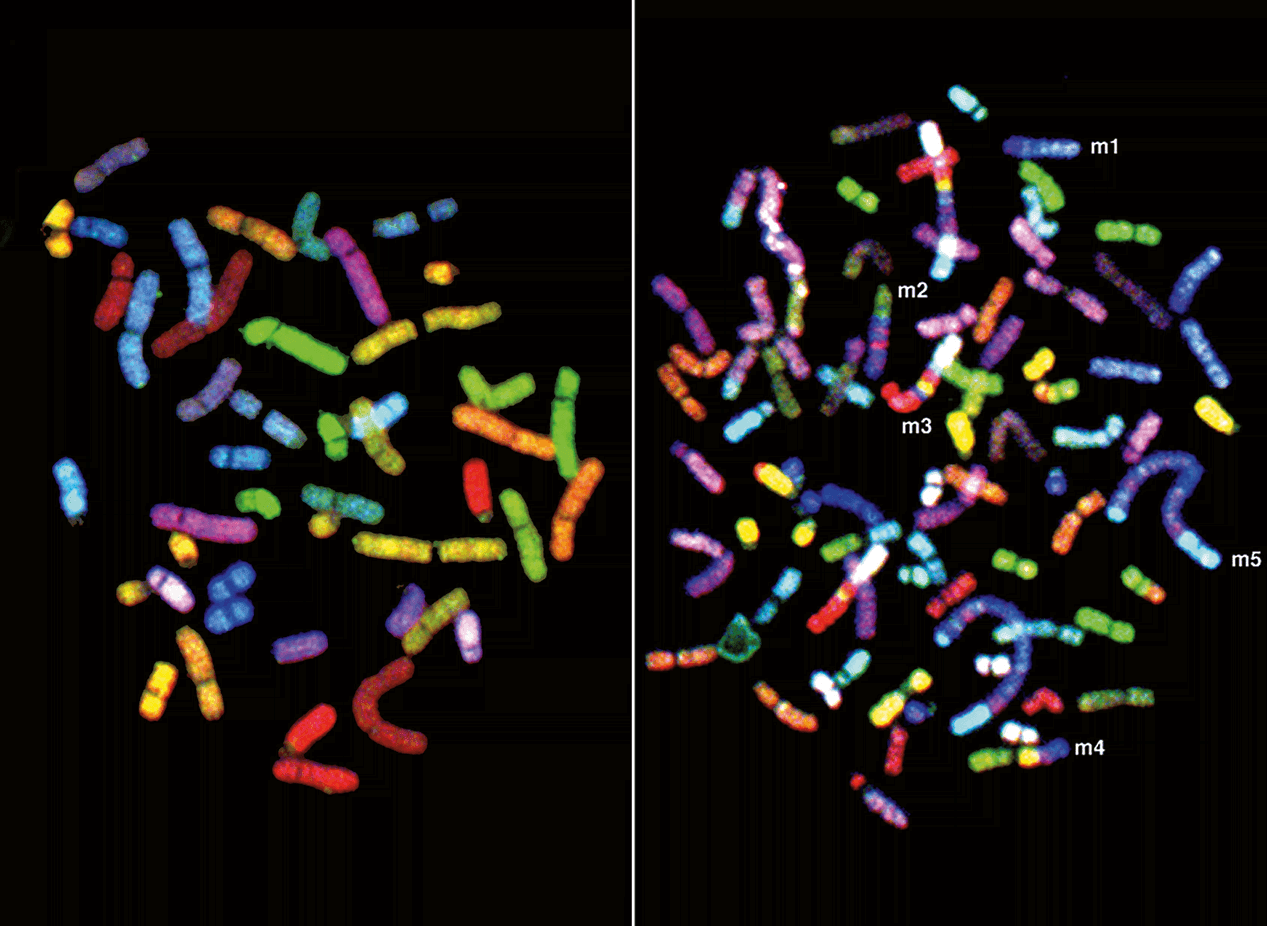
Здоровые неповрежденные хромосомы из обычной клетки (слева) и хромосомы из клеточной линии SKB3, вызывающей рак груди (справа). В сущности, все раковые хромосомы изменены (либо структурно, либо по числу копий). В двух длинных искривленных синих хромосомах содержится множество лишних копий онкогена MYC
Команда Юрга Циммермана взяла «на прицел» четко обозначенную графически трехмерную модель белка-мишени, после чего ученые стали искать маленькое соединение, выстраивающееся в активный сайт гибридного белка и не дающее ему связываться с естественным субстратом (в данном случае с нуклеотидом АТФ). По признанию врача Чарльза Сойерса, позже сотрудничавшего с Novartis, до тех пор пока метод не заработал, «эта идея казалась безумной». Безумные идеи редко бывают по душе тем, кто занимается разработкой лекарств – кропотливым и заоблачно дорогим делом. В среднем на открытие препарата тратится пятнадцать лет и более миллиарда долларов; приходится провести многолетние клинические исследования, и только тогда, когда будет доказана безопасность и эффективность лекарства, наконец получить одобрение.
Тем не менее Юрг Циммерманн не отчаялся и приступил к поиску известных ингибиторов других белковых киназ. Он стал экспериментировать с химической структурой известного химического соединения: добавлять группу атомов там, корректировать тут. Своему чутью он доверял больше, чем компьютерным программам для моделирования молекул. К августу 1992 года он синтезировал молекулу, получившую лабораторное название STI-571 (ингибитор сигнальной трансдукции 571). Поначалу менеджеры компании препаратом не воодушевились, поскольку, как я уже упоминал, у лекарства не было потенциала, чтобы стать «блокбастером» в фармации и давать по миллиарду долларов чистой выручки ежегодно. К счастью, тестировать соединение Циммерманна поручили онкологу Брайану Друкеру. Первые исследования показали, что препарат токсичен для собак, но Друкер смело заявил, что такой результат может и не повториться при испытаниях на людях. Действительно, по итогам первого этапа клинического исследования, запущенного в 1996 году, STI-571 оказался безопасным и удивительно эффективным. Всего за несколько недель повышенные титры белых кровяных телец у пациентов с ХМЛ вернулись к нормальным значениям. Молекула прошла и дальнейшие испытания, после чего в 2001 году FDA за рекордные десять недель одобрило препарат, сегодня известный под названием иматиниб. Это произошло всего через три года после первых клинических испытаний и через девять лет после того, как Юрг Циммерманн синтезировал это соединение. Поскольку иматиниб блокирует не только BCR-ABL, но и другие киназы, Друкер, Сойерс и их коллеги догадались, что потенциально препарат может лечить и другие виды рака, в частности гастроинтестинальную стромальную опухоль (ГИСО). ГИСО возникает из-за мутаций в онкогене c-KIT и на первый взгляд совершенно не похожа на лейкемию. Сходство выявляется лишь на уровне молекулярной генетики.
Однако надежды на то, что иматиниб может полностью излечить пациента от ХМЛ, вскоре рухнули. Любая спонтанная мутация в присутствии иматиниба помогает раковым клеткам ускользать от этого препарата. Уже в ходе клинических испытаний врачи отметили, что у некоторых пациентов развилась резистентность к препарату. Одна мутация даже привела к тому, что сайт раковой клетки, продуцировавший BCR-ABL, вновь заработал на полную мощность. Клетка подставила на этот сайт вместо обычной кислоты другую, более крупную, и стала неуязвима для иматиниба. Пока Друкер и Сойерс рассказывали коллегам-онкологам о резистентности при ХМЛ, исследователи из компании Bristol-Myers Squibb разрабатывали собственный ряд ингибиторов киназ для лечения ХМЛ. Они открыли молекулу, которая, подобно иматинибу, могла блокировать BCR-ABL в его активной конфигурации. Теперь у онкологов было на выбор несколько ингибиторов киназ, в том числе нилотиниб, препарат следующего поколения от Novartis (под названием Tasigna), который случайно (или как раз кстати) поступил на рынок в 2015 году, именно тогда, когда истекал патент на Gleevec. Сейчас ведутся еще несколько исследований, призванных определить, какие комбинации препаратов обеспечивают максимальную вероятность долгосрочной ремиссии при ХМЛ.

Боб Вайнберг (слева) и Дуглас Ханахан (справа) – исследователи, выделившие наиболее характерные признаки рака
Прошло почти двадцать лет с тех пор, как Боб Вайнберг из Института Уайтхеда при Массачусетском технологическом институте и Дуглас Ханахан, на тот момент директор Института экспериментальных онкологических исследований в швейцарской Лозанне, встретившись на конференции на Гавайях (в 1998 году), решили воспользоваться своим свободным временем и вместе спуститься в кратер потухшего вулкана. Этот поход позволил им договориться, что они в соавторстве напишут обзорную статью, где, по словам Вайнберга, «попытаются кодифицировать принципы, по которым здоровая клетка превращается в раковую». Дуглас Ханахан придумал для статьи запоминающееся название: The Hallmarks of Cancer (Рак: характерные особенности), и в январе 2000 года эта статья была опубликована в журнале Cell. По признанию самого Боба Вайнберга, он ожидал, что статья «утонет, как камень в спокойном пруду; мы даже и не думали, что она получит поистине всеобщее признание в широком научном сообществе». Действительно, с тех пор ее цитировали тысячи раз – такой чести удостоились авторы, сумевшие свести к сухому остатку ошеломительно сложную биологию рака и сформулировать стройную систему из считаных фундаментальных признаков.
Никто не удивился, что первые два признака, выделенные Ханаханом и Вайнбергом, уже обсуждались ранее: 1) онкогены, поддерживают в клетке сигнальные механизмы для самодостаточного роста; 2) дефектные опухолевые супрессоры, которые должны реагировать на сигналыроста (ингибировать их), но не работают или блокируются иным образом. Остальные характерные признаки рака: 3) избегание программированной клеточной смерти (апоптоза); 4) способность к неограниченной репликации; 5) постоянное наращивание сетки кровеносных сосудов (ангиогенез); 6) способность к инвазии в другие ткани (метастазирование). Десять лет спустя, как воссоединившиеся рок-звезды онкологии, решившие отправиться в турне с лучшими хитами, Ханахан и Вайнберг вновь объединили усилия и немного дополнили свою классическую схему, добавив в нее еще два признака: 7) избегание уничтожения иммунными механизмами и 8) дерегуляция клеточной энергетики.
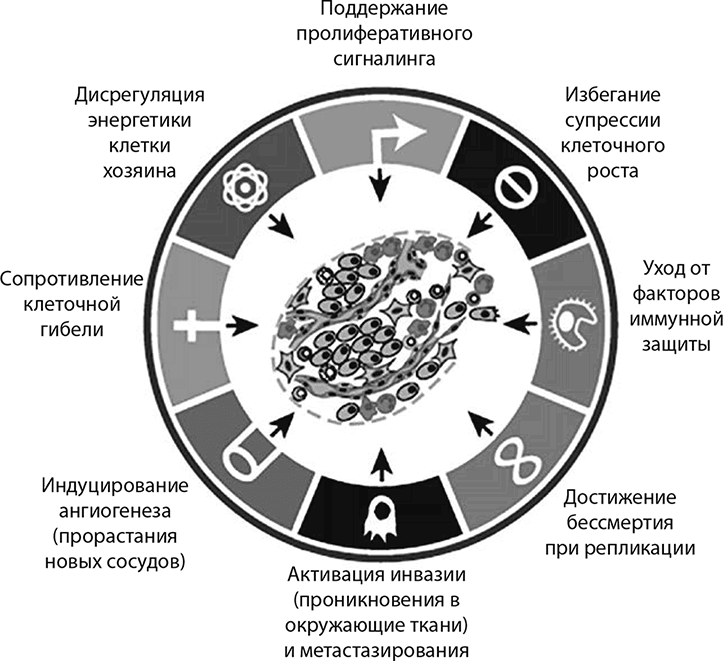
Характерные признаки рака, сформулированные Дугласом Ханаханом и Бобом Вайнбергом. В обновленной версии статьи упоминаются еще два ключевых признака: «избегание уничтожения иммунными механизмами» и «дерегуляция клеточной энергетики»
Долгие годы исследователи зондируют эти фундаментальные свойства рака в поисках новых возможностей лечения. Так, у нормальных клеток в участках ДНК на кончиках хромосом встроен специальный «счетчик», ограничивающий их способность к репликации. Такие защитные структуры называются теломеры и действуют примерно как пластиковые наконечники на шнурках: чем сильнее они изнашиваются, тем сложнее зашнуровать ботинки. Важнейшие фундаментальные исследования, связанные с тело-мерами, выполнила Элизабет Блэкберн, учившаяся у Фреда Сэнгера и взявшаяся за изучение этих структур лишь потому, что эти фрагменты ДНК относительно легко секвенировать. По ее мнению, теломерные участки хромосом характеризуются отсутствием способности к соединению с другими хромосомами или их фрагментами и выполняют защитную функцию. Элизабет Блэкберн менее всего предполагала, что этот путь приведет ее к Нобелевской премии.
Человеческая теломера содержит последовательности из шести пар оснований (ТТАГГГ), и обычно в клетке около двух тысяч копий таких последовательностей. Как правило, после каждого акта деления клетки теломеры укорачиваются, однако их может снова нарастить фермент под названием теломераза. В раковых клетках теломераза активируется гораздо сильнее, поэтому таким клеткам удается преодолеть так называемый предел Хейфлика. Это число актов деления, которые может претерпеть нормальная клетка. Эта величина составляет от сорока до шестидесяти и названа в честь американского биолога Леонарда Хейфлика (Leonard Hayflick), оценившего ее в 1961 году. Таким образом, работа с теломерами представляется терапевтической стратегией широкого профиля для борьбы с раком. Сообщают о некотором прогрессе – уже получается отключить теломеразу, однако здесь предстоит еще много работы.

Джуда Фолкман (Judah Folkman) первым стал выступать за ингибирование ангиогенеза как один из способов борьбы с раком
Ангиогенез – еще один важный характерный признак рака – давно интересует ученых как потенциальная ахиллесова пята этой болезни. Ангиогенез – это образование новых кровеносных сосудов, необходимых раковой опухоли для поддержания роста. Идею о том, что мелкие опухоли становятся опасны лишь после того, как в них прорастают и начнут их подпитывать мелкие кровеносные сосуды, первым начал отстаивать Джуда Фолкман в начале 1960-х годов. В то время он работал в Научно-исследовательском медицинском институте ВМФ близ Вашингтона, округ Колумбия. Джуда Фолкман, талантливый отпрыск раввина из Огайо, уже к моменту перехода в старшие классы успел поработать ассистентом хирурга-ветеринара. Он был первым выпускником Университета штата Огайо, поступившим в Гарвардскую медицинскую школу, а в возрасте 34 лет стал самым молодым профессором хирургии в истории Гарварда. Фолкман хотел лечить рак, а не просто изучать его и был убежден, что опухоли можно сдерживать, обескровливая их. В 1971 году он изложил свои провокационные идеи в Медицинском журнале Новой Англии, где впервые предложил термин «ангиогенез». Исследователи-онкологи дружно порицали его, однако Фолкман как хирург самостоятельно изучил немало опухолей, поэтому не сомневался в своей правоте.
В течение нескольких последующих десятилетий в лаборатории Фолкмана занимались решением задачи, которая состояла в том, чтобы охарактеризовать факторы роста, жизненно важные для роста эндотелиальных клеток, выстилающих кровеносные сосуды лабораторных мышей. Особенно интересными оказались мышиные факторы ангиогенеза ангиостатин и эндостатин – оба в 1990-е годы выделил Майкл О’Рейли. Хотя эти опыты на мышах уже давно казались многообещающими, меня сильно огорчило, когда на передовице New York Times случайно процитировали мои слова: «Джуда собирается победить рак за два года». Это было еще в апреле 1998 года. Мне довелось узнать, что у человека далеко не один биохимический путь, определяющий рост кровеносных сосудов. Однако в 2004 году FDA одобрило антиангиогенный препарат Avastin от Genentech (международное название – бевацизумаб) для лечения метастатического рака прямой кишки. Его противораковая эффективность оказалась минимальной. Однако препарат стал важнейшим средством для лечения распространенной формы слепоты (невозрастная макулярная дегенерация).
Фолкман трагически скоропостижно скончался от сердечного приступа в январе 2008 года; это случилось в аэропорту, когда он направлялся в Денвер на конференцию. Поэтому ему не суждено было увидеть, как его идеи проверяются в клинике. Я чувствовал себя словно заблудшая душа, когда стоял на его похоронах вместе с его женой и дочерями на холодном продуваемом кладбище на севере Бостона. Я потерял своего героя, того, кто вселял в меня надежду, что большинство смертельных видов рака с поздними рецидивами вскоре будут излечимы.
Потеряв Джуду, вселявшего в меня такую уверенность, я вновь стал по несколько часов в день читать научную литературу об уничтожении раковых клеток. Вскоре я понял, что большинство молекул, наиболее эффективно применяемых при химиотерапии, – это оксиданты, которые, реагируя с кислородом, дают активные формы кислорода (ROS), в том числе супероксид (O2–), пероксид водорода (H2O2) и гидроксильный радикал (OH–).
У всех живых организмов химическое уничтожение клеток почти всегда происходит при помощи оксидантов, причем на молекулярном уровне это только улучшает выживаемость клеток, а не мешает ей. Следовательно, химиотерапия убивает раковые клетки точно так же, как и ионизирующее излучение. Тем не менее эффективность химиотерапии быстро понижается, поскольку обрабатываемые клетки развивают сопротивляемость, в частности производят антиоксиданты для борьбы с активными формами кислорода, например глутатион и тиоредоксин, противодействующие окислению.
Устойчивость к химическому воздействию развивается по отношению к активным формам кислорода, не только поступающего извне, но и образующегося внутри организма. Практически все RAS-активируемые клетки генерируют активные формы кислорода, передавая сигналы, которые сначала включают рибосомные механизмы синтеза белков, а затем добавляют молекулярную оснастку для цикла деления митотических клеток. Поэтому уровни активных форм кислорода в растущих клетках, претерпевающих клеточный цикл, неизбежно выше, чем в аналогичных им клетках, которые не делятся. Еще больше активных форм кислорода обнаруживается в раковых клетках, действующих на основе онкогенов (там, где сигнализация, стимулирующая клеточный рост, всегда включена). Серьезную проблему представляют критически высокие уровни активных форм кислорода при раке легких, поджелудочной железы и прямой кишки (управляемых онкогенами KRAS). Соответственно, они генерируют и массу антиоксидантов, активируя фактор транскрипции NRF2; поэтому такие виды рака считаются видами, хуже всего поддающимся химиотерапии.
К счастью, сегодня онкологи все активнее принимают некогда вызывавшую неприятие идею о том, что выборочное уничтожение раковых клеток активными формами кислорода может быть связано с высокими уровнями активных форм кислорода, обусловленных действием онкогенов. Мнение обывателей заключается в том, что рак побеждает человека, потому что «такой здоровый» и на нем удобно создавать собственную среду для размножения клеток. На самом же деле опухолям в нашем организме не хватает многих важнейших питательных веществ, поскольку активные формы кислорода угнетают функцию митохондрий. «Здоровья» раку хватает лишь на то, чтобы как-то существовать. Однако что еслиудастся нарушить этот шаткий баланс, резко снизив в опухоли уровень антиоксидантов (то есть заблокировав синтез тех антиоксидантов, которых в клетках больше всего)?
Хотя наиболее активным антиоксидантом является глутатион, первые клинические испытания, в которых планировалось исследовать ингибирование его синтеза, почти не принесли результатов – возможно, из-за того что не удалось одновременно блокировать биохимический путь синтеза альтернативного антиоксиданта, тиоредоксина. Напротив, если одновременно отключить защитные биохимические пути обоих этих ключевых антиоксидантов, развитие различных патологических процессов быстро замедляется, а сами они протекают не так тяжело (подтверждено на подопытных животных). Лекарства, блокирующие биохимические пути глутатиона и тиоредоксина, применяются при лечении ревматоидного артрита и, возможно, скоро будут опробованы и в онкологических клинических испытаниях на людях. Уже существуют убедительные доказательства того, что регулярные инъекции витамина Е (мощного антиоксиданта) усиливают, а не угнетают рак легких и рак простаты у человека.
С той поры конца 1990-х, когда набирал обороты проект «Геном человека», удалось добиться серьезного прогресса и в описании онкологических процессов на генетическом уровне. Это было связано с появлением ДНК-чипов. Первопроходцами в этой сфере выступили Патрик Браун из Стэнфорда и Дэвид Ботстейн, а коммерческим распространением чипов занималась компания Affymetrix. Одновременно измеряя активность десятков генов в раковых клетках (подсчитывая, сколько фиксируется операций транскрипции РНК от каждого гена) и сравнивая результаты с показателями здоровых клеток, ученые смогли выявить характерные изменения уровня экспрессии генов в тех опухолях, которые под микроскопом казались совершенно идентичными.
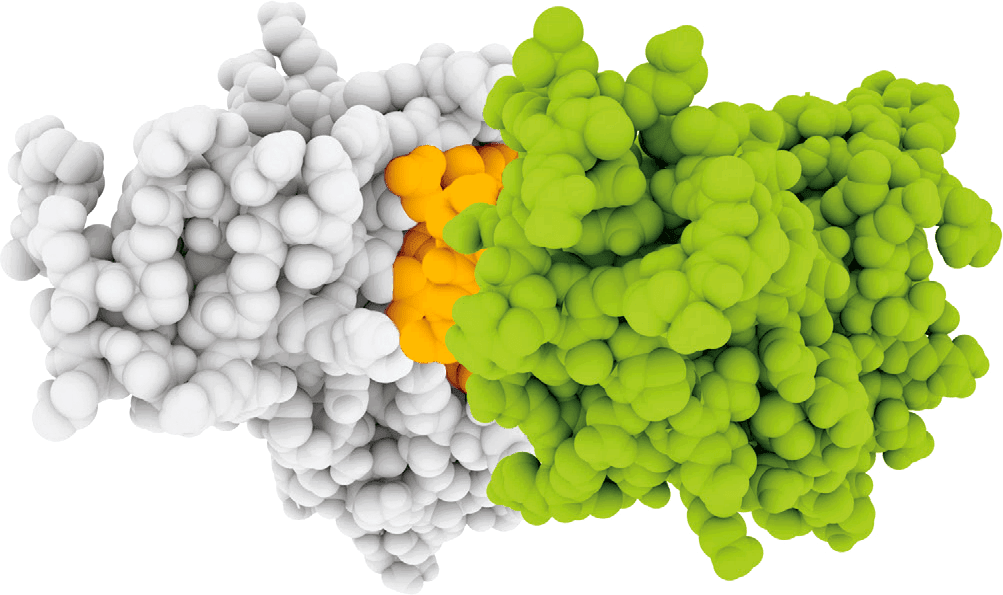
Мутации раковых генов, классифицированные по биологическим функциям и биохимическим путям. В таблице перечислены важные гены, мутирующие в ходе различных клеточных процессов

К 1999 году удалось получить воспроизводимые опытным путем изменения в экспрессии генов и четко отделить клетки острого миелоидного лейкоза от клеток острого лимфобластного миелоидного лейкоза.
После первых исследований в этом направлении потребовалось почти десять лет, чтобы Элен Мардис и Рик Уилсон, тогда работавшие в Институте генома им. Макдоннелла при Вашингтонском университете в Сент-Луисе, сочли, что новые технологии секвенирования ДНК достаточно окрепли и можно взяться за полное секвенирование генома пациента, больного раком. Однако эксперты, оценивавшие заявку Элен Мардис и Рика Уилсона на грант, с ними не согласились. Элен Мардис вспоминала, что рецензенты «откровенно зарубили» ее планы; они подчеркивали, что разумнее было бы сосредоточиться на изучении отдельных генов или участков с активными мутациями, в не заниматься кропотливым секвенированием всего генома, потратив на это немалые деньги. Тем не менее команда из Сент-Луиса не отступилась, и вскоре усилия уже принесли первые плоды. Результаты полногеномного секвенирования первого ракового генома были опубликованы в 2008 году. Прошло более двадцати лет с тех пор, как мой друг, нобелевский лауреат Ренато Дульбекко, небесспорным образом поддержал идею секвенирования ракового генома. «Если мы хотим подробнее изучить рак, то сейчас должны сосредоточиться на свойствах клеточного генома, – писал он в комментарии в журнале Science. – Есть два варианта. Либо по одному выявлять гены, вызывающие злокачественные новообразования… либо в целом секвенировать весь геном».
Со времени эпохального отчета, составленного группой из Сент-Луиса, отсеквенировано уже множество раковых геномов, что помогло лучше определить спектр мутационных механизмов, стимулирующих рост опухолей. Вооружившись материалами программ Национального онкологического института, и в частности «Атласом ракового генома» (TCGA) – исчерпывающими каталогами генетических вариантов и генетической активности в десятках видов опухолей у тысяч пациентов, мы до сих пор обнаруживаем новых генетических персонажей в онкологической трагедии. Среди них множество генов, которые ранее никто и не думал подозревать в связи с раком. Красота систематических полногеномных исследований рака в том, что они дают непредвзятую картину всего спектра раковых мутаций. Мы больше не ограничены лишь тем набором генов, которые осознанно ищем. Уже известно, что при различных онкологических заболеваниях возникают мутации примерно в трех сотнях генов; ученые составили схемы тех процессов и биохимических путей, когда эти пути нарушаются. Гены могут быть связаны с метаболизмом, клеточным циклом, эпигенетикой, модификацией гистонов, генетической регуляцией и обеспечением целостности генома. Наконец-то за деревьями начал просматриваться лес. Пестрое множество мутантных генов постепенно упорядочивается в виде удобоваримого списка путей и процессов, которые нарушаются при раке.

Первооткрыватель лекарств Джей Бреднер (слева) знакомится с исследовательскими данными в компании Novartis
Недаром Джей Бреднер, онколог, ранее работавший в Институте онкологических исследований Даны Фарбер в Гарварде, а теперь возглавляющий отдел НИОКР в кембриджской компании Novartis, называл RAS, MYC и p53 «тремя неуязвимыми всадниками ракового апокалипсиса». Они стали такими знаменитыми мишенями не только потому, что так распространены, но и потому, что десятилетиями стимулировали разработку лекарств, упрямо не давая ни одной подходящей молекулярной канавки, которую мог бы заблокировать мелкомолекулярный препарат. Поэтому химики между собой называют их лекарственно недосягаемыми («undruggable»). В то время как большинство белков услужливо предлагают сколько угодно уголков и закоулков, где может разместиться маленький ген, RAS, например, является совершенно ровным, и там решительно негде закрепиться.
Для того чтобы найти препарат, который мог бы наконец справиться с RAS, Гарольд Вармус, еще будучи директором Национального института онкологии, в 2013 году запустил программу стоимостью 10 миллионов долларов под названием RAS Initiative. «Поиск лекарства для RAS – национальный приоритет», – считает Грег Вердайн, опытный химик из Гарвардского университета. RAS – первоочередная цель для его биотехнологической компании Warp Drive Bio. Возможно, определение приоритетов наконец начало приносить плоды. Кеван Шокат, исследователь из Медицинского института Говарда Хьюза при Калифорнийском университете в Сан-Франциско, недавно разработал новое соединение, которое может необратимо связываться со специфической формой RAS, вызывающей рак легких, но при этом не повреждает нормальную молекулу RAS. «RAS – словно переключатель, запускающий рак, а эта молекула позволяет надежно удерживать его в выключенном состоянии», – поясняет Кеван Шокат.
Наряду с RAS в списке приоритетных целей у разработчиков лекарств значится MYC. Этот белок активируется в семи из десяти случаев рака и вызывает рост и пролиферацию клеток. MYC – важнейшая шестеренка в процессе нормального клеточного деления, но в раковых клетках он напоминает сорванный вентиль. Срочность с разработкой лекарства от MYC объясняется тем, что он играет центральную роль во многих сигнальных путях и сетях. Как и RAS, он также удручающе гладкий. Поэтому многие исследователи пытались приглушить вредоносность MYC, нацеливаясь на другие шестеренки в онкогенной сети, в частности на небольшую группу белков, именуемых BET-активаторами. Первый эффективный ингибитор BET, который удалось разработать, называется JQ1 в честь Цзюнь-Ци, китайского сотрудника из лаборатории Бреднера. Цзюнь-Ци синтезировал соединение JQ1, которое, связываясь с белком BRD4 из группы BET, не позволяет ему соединиться с промоторным участком ДНК, включающим MYC. Становится понятным: чтобы полностью блокировать MYC, потребуются гораздо более эффективные ингибиторы BET.
В поисках кооперации: лекарственное нацеливание – подход, широко применяемый в компании Warp Drive Bio, – обеспечивает связывание мелкомолекулярного препарата (оранжевый) с презентирующим белком (серым), который, в свою очередь, прикрепляется к мишени, например к RAS
Совершенно неудивительно, что среди первых пациентов, пытавшихся излечиться от рака при помощи секвенирования ДНК, были знаменитости первой величины с хорошими связями среди известных деятелей медицины. В 2004 году сооснователь Apple Стив Джобс по электронной почте сообщил коллегам, что ему диагностировали нейроэндокринный рак поджелудочной железы. Сделав ему биопсию опухоли, врачи секвенировали ДНК, но не получили четких результатов, необходимых для идентификации конкретных мутаций или лекарственных мишений, чтобы спасти Джобса. Когда в 2010 году британскому писателю, литературному критику и убежденному атеисту Кристоферу Хитченсу диагностировали рак пищевода – ту самую болезнь, от которой умер его отец, – к нему обратился его знакомый, директор Национальных институтов здравоохранения (и искренний христианин) Френсис Коллинз, иногда выступавший его оппонентом в ходе дебатов. Коллинз предложил Хитченсу провести секвенирование генома. ДНК из опухоли Хитченса (которую Коллинз сравнил со «слепым и бесчувственным монстром») секвенировала группа Мардис и Уилсона в Вашингтонском университете в Сент-Луисе.
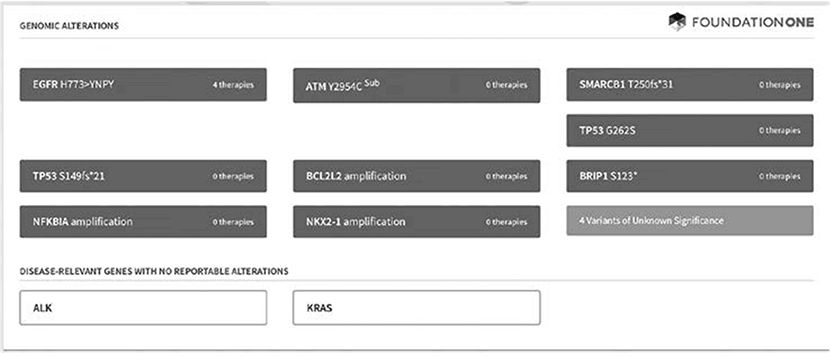
Отчет об анализе генома пациента с аденокарциномой легких. Перечислены гены, в которых кроются потенциально опасные мутации
Результаты оказались удивительными: обнаружилась специфическая мутация, связанная с одной из форм лейкемии, а не с раком пищевода. Поэтому врачи решили не прибегать к традиционной терапии, а прописали Хитченсу Gleevec, нацеленный на борьбу именно с этой мутацией. В таком режиме лечения Хитченс как никогда активно размышлял о проблеме рака – до самой смерти в конце 2011 года (он умер от пневмонии). Хотя ни Джобс, ни Хитченс не излечились от рака, их случаи иллюстрируют фундаментальную перемену в наших представлениях об онкологии, связанную с возможностью геномного анализа. Для принятия наиболее точного и эффективного решения требуется понимать генетику опухоли, а не ее локализацию в организме (как считалось ранее в течение целых десятилетий).
Благодаря постоянному удешевлению секвенирования ДНК эта процедура выдает все больше и больше данных, которые могут подсказать, что делать, а медицинские центры предлагают услуги генетической диагностики, осуществляют скрининг ДНК и персонализированную молекулярную биопсию каждого конкретного ракового генома. Эрик Ландер, будучидиректором обеспеченного Броудовского института, расположенного близ Массачусетского технологического института, сформировал там один из ведущих мировых центров по изучению генетики рака. Хотя Ландер особо не заинтересовался секвенированием собственного генома, он признался: «Если бы у меня обнаружили рак, то я незамедлительно отдал бы мой рак на секвенирование».
Диагностическая компания Foundation Medicine, основанная Ландером, предлагает составление персональных онкологических профилей и терапевтические рекомендации пациентам, больным раком. Онкологи в медицинских центрах или муниципальных больницах со всей страны могут направлять биопсии опухолей (или образцы крови) в Foundation, где ученые извлекают ДНК и секвенируют набор из сотен потенциально канцерогенных генов. Далее они указывают, какие клеточные пути нарушены у пациента, и прогнозируют, какие препараты могут быть наиболее эффективными для его лечения. В их медицинских рекомендациях пациенту могут порекомендовать клинические исследования на предмет его болезни с целью оказания помощи в лечении заболевания. Многим больным, воспользовавшимся таким персонализованным профилированием, действительно стало лучше благодаря подобранным препаратам и участию в клинических испытаниях новейших препаратов. В 2015 году компания Roche приобрела контрольный пакет акций Foundation Medicine за один миллиард долларов.
Потенциально еще более мощный подход, чем профилирование опухолевой биопсии, заключается в отслеживании первых предвестников рака еще до того, как его можно будет диагностировать традиционными методами. Такая технология называется «жидкостная биопсия» (CancerIntercept), это новая эффективная технология детекции опухолевых биомаркеров в крови или других биологических жидкостях. Она чем-то напоминает неинвазивный пренатальный скрининг, о котором мы говорили в главе 8. У каждого из нас в кровотоке есть следовые количества свободно плавающей ДНК. У пациентов с бессимптомным протеканием рака около 0,01 % такой ДНК должно быть опухолевого происхождения. Illumnia основала новое дочернее предприятие под названием GRAIL (проект оценивается в миллиарды долларов), получив на это инвестиции от Билла Гейтса и Джеффа Безоса, основателя Amazon. Потребуется еще серьезно повысить чувствительность и точность этой технологии, но я считаю, что к 2020 году у нас появится возможность пройти безболезненную заблаговременную проверку на рак – не сложнее, чем на уровень холестерина.
Естественно, и я горячо на это надеюсь, некоторые широко рекламируемые сегодня противораковые препараты, связанные с иммунным ответом, а также лечебные процедуры – в совокупности весь этот арсенал называется «иммунотерапия» – действительно окажутся победоносными.
На самом деле, у нас за плечами долгая и изменчивая дорога из несбывшихся надежд на то, что многие онкологические процессы, не поддающиеся химиотерапии, когда-нибудь сможет обуздать иммунная система нашего собственного организма. Известны таинственные случаи, когда изредка раковая опухоль прекращает расти, а затем рассасывается. После Второй мировой войны, когда исследования рака наконец стали хорошо финансироваться, самые прозорливые руководители онкологических центров начали принимать на работу первоклассных иммунологов, надеясь, что те научатся провоцировать у пациентов варианты иммунного ответа, способные спасти им жизнь.
Аминокислотные переключатели, в основном отвечающие за иммуногенность конкретных онкологий у человека, вероятно, совершенно не связаны с мутациями, провоцирующими конкретные виды рака. Напротив, они отражают постоянное возникновение новых аминокислотных последовательностей и нарастание изменчивости из-за случайных ошибок при копировании ДНК во время роста опухоли. Многие такие изменения обусловлены активными мутагенами (например, солнечным светом), воздействующими на растущую опухоль и делящиеся раковые клетки. Все чаще секвенируются неизлечимые раковые опухоли состоятельных обреченных американцев – ведь есть надежда, что именно в данном случае рака найдутся варианты, которые позволят спровоцировать потенциальный иммунный ответ.
Одними из наиболее передовых клинических препаратов современности являются так называемые ингибиторы иммунных контрольных точек, предназначенные для запуска иммунного ответа против многих видов рака – таких, которые нацелены на мишень, выделяя естественные антииммунные вещества. Сейчас практически во всех крупных фармацевтических компаниях наращиваются программы по разработке ингибиторов иммунных контрольных точек, но любые торжества по поводу чудесной ремиссии у пациента быстро омрачаются новостями о клинических задержках и испытаниях, от которых пришлось отказаться. «Наша цель – найти лекарство, – говорит Карл Джун из Пенсильванского университета, один из ведущих пропагандистов иммунотерапии, – но мы не можем произносить этого слова».
Два таких препарата – Keytruda от Merck и Opdivo от Bristol-Myers – уже одобрены FDA, а компании-производители силами своих гениальных маркетологов и пиарщиков уже продвигают их по сетевому телевидению. Однако описания побочных эффектов, которые обязывает приводить FDA, в рекламе озвучиваются вполголоса, хотя некоторые из них ничуть не легче рака. Так, производители Opdivo предупреждают, что их препарат «может спровоцировать аутовоспалительные реакции, направленные на здоровые ткани и органы, что может повлиять на их функционирование. Побочныеэффекты терапии могут произойти в любой момент курса лечения или после него и привести к серьезным осложнениям и к смерти». Неудивительно, что многие из нас в глубине души считают, что война против рака – это самая долгая война, которую наша страна проигрывает.

Точное попадание в мишень: многообещающая иммуннотерапевтическая стратегия, связанная с блокированием рецептора PD-1 на поверхности Т-клетки. Препарат (обозначен зеленым) усиливает противоопухолевые свойства лейкоцитов
Keytruda, многообещающее моноклональное антитело. Препарат известен тем, что его принимал президент Джимми Картер для борьбы с меланомой. Моноклональное антитело состоит из тяжелых (синих) и легких (розовых) цепочек. Здесь показано, как они связываются со своей мишенью, лигандом PD-1
Первый клинический успех, связанный с использованием человеческого ингибитора контрольной точки против рака, резистентного к химиотерапии, достигнут несколько лет назад в Калифорнийском университете города Беркли, где онколог-иммунолог Джим Эллисон (Jim Allison) впервые добился долгосрочных ремиссий при злокачественных меланомах. Сегодня в большинстве крупных клинических центров ингибиторы контрольных точек испытывают на пациентах с неоперабельным процессом. Несмотря на то что эти препараты вызывают бурный и обширный иммунный ответ со множеством нежелательных побочных эффектов, на счету Keytruda от Merck уже, по-видимому, есть одна чистая победа: президент Джимми Картер достиг полной ремиссии после метастатической меланомы, спровоцированной солнечной радиацией. Однако стоимость такого лечения (в случае Keytruda около 150 тысяч долларов в год), к сожалению, позволит применять его лишь в ограниченном объеме, учитывая, что всего в 20 % случаев удается добиться надежной ремиссии. Клинические данные по Opdivo менее полные – препарат примерно такой же дорогой, но, по-видимому, несколько более эффективный. Пока остается только наблюдать, сможет ли иммуннотерапия, широко превозносимая как средство, способное переломить ситуацию, оказаться чем-то большим, нежели одним из многих инструментов в противораковом арсенале. Реализация идеи, столь привлекательной в теории, на практике по-прежнему сталкивается со множеством преград.
Я питаю надежды на то, что очень скоро еще больше запущенных онкологических процессов станут излечимы, поскольку слежу за инновационным препаратом, который разработала биотехническая компания Boston Biomedical, чей опыт работы исчисляется десятилетиями (сегодня она входит в состав японской Dainippon Sumitomo Pharma). После того как я в марте 2015 года прочел о противораковых свойствах BBI608 (напабукасина), я побывал в головном офисе компании в Кембридже, штат Массачусетс, чтобы подробнее узнать, как этот натуральный растительный продукт убивает раковые клетки в насыщенных антиоксидантами запущенных опухолях, не поддающихся химиотерапии. Вскоре после этого я стал научным консультантом в команде разработчиков BBI608. В настоящее время BBI при поддержке Американского общества клинической онкологии опубликовала результаты клинических испытаний, демонстрирующие, что препарат позволяет контролировать или даже устранять многие не излечимые иными средствами опухоли поджелудочной железы и прямой кишки. Противоопухолевое воздействие BBI608 основано на способности препарата активировать выработку активных форм кислорода.
Более того, этот препарат наиболее эффективен в синергии с химиотерапевтическими препаратами, в частности с паклитакселом. Генерируя активные формы кислорода, BBI608 значительно снижает уровень антиоксидантов в клетках и не позволяет раку развить устойчивость к химиотерапии. Первые догадки о том, как именно этот препарат действует на молекулярном уровне, появились после сравнения противораковых свойств BBI со свойствами аналогичного естественного продукта, оксидативного нафтохинона лапашона. Это вещество широкого спектра, воздействующее на самые разные организмы: простейшие, грибы, многие бактерии, а также на раковые клетки. Это вещество много веков применяется в народной медицине амазонских индейцев. Его добывают из коры дерева лапачо. Однако лапашон начинает воздействовать на опухоли, не поддающиеся химиотерапии, лишь после того, как путем катализа его удается превратить в другое вещество, генерирующее активные формы кислорода. Комбинации веществ, генерирующих активные формы кислорода, в частности витамин C и витамин K3 (производная нафтохинона), уже более 15 лет используются в Бельгии для избирательного уничтожения человеческих раковых клеток, выращиваемых в культуре клеток или в организме мышей. К сожалению, попытки задействовать в клинической практике эту потенциально недорогую смесь витаминов тормозятся из-за крайней дороговизны клинических исследований, а также из-за регламентирующего контроля, ограничивающего возможности работы с комбинациями из витаминов. Поскольку такие комбинации демонстрируют успех в доклинических испытаниях по контролю тяжелой трипаносомной паразитарной инфекции, вызывающей болезнь Шагаса, здравый смысл убедительно подсказывает, что следует допустить использование этой комбинации и при лечении рака, хотя бы под строгим надзором лечащего врача. К сожалению, сравнительно низкий потенциал лапашона в отношении генерации активных форм кислорода пока мешает разрабатывать на его основе эффективные противораковые препараты, такие как BBI608.
В коммерческом отношении у BBI608 сейчас есть серьезный конкурент в борьбе с неизлечимыми формами рака – это экспериментальный препарат CPI-613 от компании Cornerstone Pharmaceuticals. Он был впервые получен в лаборатории Пола Бингэма (Paul Bingham) в Стоуни-Бруке на Лонг-Айленде. Поскольку этот препарат снижает количество основных молекул, нарушающих клеточный метаболизм, его широкое использование должно обеспечить излечимость многих устойчивых опухолей при помощи оксидативной химиотерапии. Однако, как и в случае с BBI608, рано говорить о победе, пока гораздо более широкие клинические исследования не продемонстрируют устойчивых ремиссий у пациентов с острым миелоидным лейкозом и другими видами рака, изучаемыми в Cornerstone.
Молекулы естественного происхождения (получаемые из растений, грибов и бактерий), как правило, сдерживают (или даже убивают) опасные патогены, не нанося при этом вреда организму-хозяину. Активные формы кислорода действуют не так «топорно и грубо», как, скажем, синтетические молекулы вроде цисплатина или химические модификации естественных веществ, например паклитаксел. На мой взгляд, перспективным направлением может стать поиск в закромах природы естественных нафтохинонов, генерирующих еще больше активных форм кислорода, чем BBI608. Огромные запасы против раковых хиноновых сокровищ природы пока еще ждут своих первооткрывателей. Принципиально важно как можно скорее выяснить, в каких масштабах высшие животные, а также растения используют нафтохиноны, генерирующие активные формы кислорода, в качестве первой линии защиты против токсичных паразитов.
Еще один интересный факт. В 1890-е годы хирург Уильям Коли, работавший в Мемориальной больнице Нью-Йорка, наблюдал, как у онкологических пациентов иногда наступала ремиссия после того, как им случалось перенести острую бактериальную инфекцию. Естественно, он заинтересовался, нет ли какой-то связи между исчезновением опухолей и этими инфекциями. Чтобы проверить свою догадку, Коли сделал инъекции с живыми бактериями пациенту с неоперабельной опухолью на терминальной стадии. Инфекция поразительным образом вылечила его подопечного: он прожил еще 26 лет, а затем скончался от сердечного приступа. В настоящее время практически повсеместно применяются антибиотики (начиная с пенициллина), поэтому у наших современников почти не бывает серьезных бактериальных инфекций. Даже если догадка Коли была верна и бактериальные инфекции потенциально могут излечивать многие опасные формы рака, современное состояние медицины не позволяет повторить это открытие.
Уильям Коли больше никогда не пытался добиться разрешения сделать живому человеку инъекцию летального патогена. В дальнейшем он продолжал лечить своих раковых пациентов смесью из бактерий, убитых нагреванием (так называемый токсин, или вакцина, Коли»), надеясь мобилизовать «защитные силы» человеческого организма. Хотя он и верил в то, что его «токсины» обеспечивают высокую выживаемость, они так и не дали такого терапевтического эффекта, как лучевая терапия, которая стала практиковаться после открытия рентгеновских лучей и гамма-излучения. Когда после Второй мировой войны появилась химиотерапия, токсины Коли оказались оттеснены на периферию медицины. В 1965 году Американское онкологическое общество внесло токсины Коли в список под названием «Неподтвержденные методы лечения рака».
Однако дочь Уильяма Коли, Хелен Коли Ноутс, полагала, что открытие ее отца оказалось проигнорировано напрасно. Получив в подарок от Нельсона Рокфеллера две тысячи долларов, она стала соосновательницей Института онкологических исследований (CRI) в Нью-Йорке и пригласила в консультативный совет несколько влиятельных иммунологов. К 1971 году институт располагал достаточными финансовыми возможностями, чтобы назначить своим первым директором знаменитого иммунолога Ллойда Олда, ранее работавшего в Институте Слоана Кеттеринга (при Мемориальной больнице). Руководству было известно: Олд также считает, что токсины Коли могли бы продлить жизнь многим жертвам рака. Теперь, почти через пятьдесят лет, я задумываюсь над вопросом, были ли ремиссии, достигнутые Коли, связаны с улучшенным иммунным ответом организма, боровшегося с бактериями. Нет, возможно, все дело было в активации естественных хинонсодержащих веществ, генерирующих активные формы кислорода и имеющихся у всех позвоночных.
От бывшего президента Обамы и далее к директорам Национальных институтов здравоохранения, Национального онкологического института, топ-менеджерам таких компаний, как Foundation Medicine, и ко всему американскому народу сейчас направлено послание о том, что планомерное секвенирование ДНК опухолевых клеток уже привело нас в эпоху персонализированной онкологии. Скоро врачи смогут воспользоваться полученными генетическими знаниями для лечения и даже излечения многих видов рака у человека. Однако всего лишь 5 % известных онкологических изменений, выявленных при секвенировании, излечимы теми противораковыми препаратами, что пока доступны. Более того, среди всех этих препаратов лишь иматиниб – препарат, который подавляет пролиферацию и индуцирует апоптоз Bcr-Abl-позитивных клеточных линий, а также молодых лейкозных клеток с положительной филадельфийской хромосомой при хроническом миелолейкозе, может продлить пациенту жизнь более чем на пару лет.
Для большинства из нас персонализированное лечение рака пока за гранью реальности. Однако я надеюсь, что уже скоро экспериментальные противораковые препараты, в частности BBI608 и CPI-613 (оба предназначены для лечения онкопатологии, резистентной к химиотерапии), войдут в широкую клиническую практику. Их эффективность может в значительной степени зависеть от точного понимания тех генетических мутаций, из-за которых рак получается столь убийственным. Если все произойдет так, как я описываю в этой книге, то менее чем через десять лет персонализированое лечение онкологии станет обычным делом. Мне сейчас всего восемьдесят девять, и я надеюсь дожить до того времени, когда на моих глазах большинство видов рака будет побеждено.
Назад: Глава 13 Что важнее: наследственность или воспитание?
Дальше: Эпилог Наши гены и перспективы на будущее

