Книга: Осязание. Чувство, которое делает нас людьми
Назад: Глава 5 Жгучие перцы чили, прохладная мята и летучие мыши-вампиры
Дальше: Глава 7 Когда зудит и свербит
Глава 6
Боль и эмоции
Один мальчик в свой четырнадцатый день рождения, чтобы удивить друзей, решился на особенно смелый трюк и прыгнул с крыши своего дома в пакистанском Лахоре. Приземлившись, он сразу встал с земли и сказал, что с ним все в порядке, а на следующий день умер от обширного внутреннего кровотечения. Несмотря на серьезные повреждения, он ничем не выказал, что ранен, так что родным и в голову не пришло обратиться к врачу. Неудивительно – ведь это был не обычный мальчик. Его хорошо знали как уличного циркача – он втыкал ножи себе в руку и стоял на горячих углях. Соседи поговаривали, что он не знает страха, потому что вообще не чувствует боли.
Хотя мальчик умер до того, как его успели тщательно осмотреть, последующие исследования Джеффри Вудса, генетика из Адденбрукской больницы в английском Кембридже, выявили еще шесть случаев, когда способность чувствовать боль полностью отсутствовала с самого рождения. Все это были дети из клана Куреши родом из деревень Северного Пакистана. Но поскольку это состояние – результат редкой и случайной генетической мутации, оно может проявиться в любой точке мира. Так, пакистанские семьи, которые изучались Вудсом, эмигрировали в Англию, и во многих из них практиковались близкородственные браки. Никто из этих шести детей за всю жизнь так и не чувствовал боли – ни кожей, ни мышцами, ни в костях, ни во внутренних органах. В детстве они редко плакали. Не то чтобы мужественно переносили боль: судя по всему, они ее вообще не испытывали. Неврологические исследования показали, что у детей было нормальное осязательное восприятие тонких механических стимулов (вибрации, давления, текстуры), незначительного нагревания и охлаждения (но не болезненных температурных экстремумов), они ощущали покалывания и поглаживания. От удара молотком по пальцу они ощутили бы сдавливание, но не боль. А травмированный палец распух бы, но его бы не дергало.
Это свойство удивительным образом ограничивалось именно восприятием боли: у детей были нормальные рефлексы, они полностью контролировали кишечник и мочевой пузырь, не имели очевидных расстройств мышления, настроения или социализации. Когда их просили объяснить значение слова «боль», никто из них не находил подходящего ответа, хотя старшие дети уже знали, какие действия, скорее всего, вызовут боль у других (они даже убедительно симулировали боль после столкновений на футбольном поле, выпрашивая пенальти). Важно, что отсутствие боли физической не сказалось на способности этих детей испытывать боль эмоциональную. Их чувства можно было ранить, в отличие от их тел. Кроме того, они испытывали обычную эмпатию к эмоциональным страданиям других людей.
Кто-то думает, что жизнь без боли – сплошная идиллия. Между тем это не так. Боль появляется в ответ на стимулы, которые вызывают повреждения тканей. Без нее мы не научимся уворачиваться от острых предметов, кипящих жидкостей или разъедающих кожу химикалий. Люди с полной нечувствительностью к боли постоянно получают травмы. Они прикусывают себе язык, ломают кости, перетирают связки и оставляют шрамы на роговице, случайно втирая в глаза мелкий песок. Многие не переживают подросткового возраста. Большинство из них не погибает при таких драматических обстоятельствах, как тот пакистанец, что прыгнул с крыши. Их смерть чаще всего становится результатом обычного повреждения тканей: плохо подобранные туфли натирают ноги, слишком горячая пища разъедает пищевод, слишком плотно сидящие трусы врезаются в промежность. Им постоянно угрожают бактериальные инфекции, неизбежно следующие за такими повреждениями.
Сканирование мозга пакистанских детей, нечувствительных к боли, не выявило никаких нарушений, как и биопсия икроножного нерва. В отличие от пациентов с норрботтенским синдромом, о которых мы говорили в главе 3, у этих детей оказалось обычное количество различных типов сенсорных волокон – от быстрых волокон А-альфа до медлительных С-волокон. Анализ их ДНК показал, что все шестеро – носители мутаций в одном и том же гене SCN9A, который отвечает за продукцию потенциал-зависимых натриевых каналов, что необходимо для распространения электрических сигналов в нейронах. Но функция гена SCN9A почти полностью ограничена теми нейронами, которые передают информацию о боли от кожи и внутренних органов. (За другие нейроны отвечают другие гены натриевых каналов.) Соответственно, нейроны, которые передают сигналы боли в спинной и головной мозг, присутствуют, но являются электрически нейтральными. Вот почему результаты биопсии икроножных нервов детей показали нормальные значения, несмотря на полное отсутствие у этих детей чувства боли. Когда в лабораторных почечных клетках искусственно экспрессировали мутантный вариант гена SCN9A из ДНК этих пациентов, в них не функционировали никакие натриевые каналы – электрический ток на мониторе отображался в виде прямой линии (рис. 6.1). Пока нет способов восстановить эту функцию, а следовательно, и эффективно вылечить врожденную нечувствительность к боли. Эти мутации рецессивны, так что для наследования заболевания у человека должно оказаться две копии гена SCN9A с соответствующей мутацией – по одной от каждого родителя. Именно поэтому синдром чаще всего встречается там, где практикуются близкородственные браки. Другой тип генетической мутации называется мутацией с приобретением функции. В случае с геном SCN9A такие мутации вызывают нарушение свойств потенциал-зависимых натриевых каналов. Достаточно унаследовать всего один такой мутантный ген, чтобы восприятие боли катастрофически изменилось.
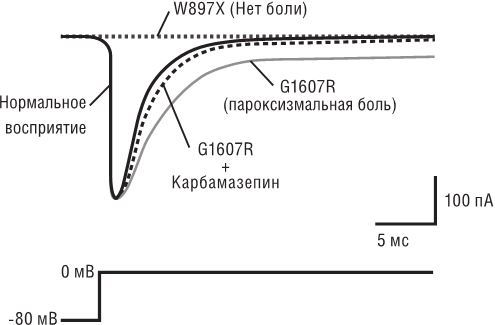
Рис. 6.1. Мутации гена SCN9A вызывают серьезные изменения восприятия боли и потенциал-зависимого натриевого тока. На этом рисунке – результаты работы искусственно введенных в почечные клетки различных мутантных форм гена SCN9A. Электрический ток быстро меняет напряжение клеточной мембраны с –80 милливольт до 0 милливольт, что примерно отражает ситуацию, при которой нейрон посылает электрический сигнал по аксону. Обычный ген SCN9A выдает типичный натриевый ток: краткий приток положительного заряда внутрь, полностью останавливающийся через несколько миллисекунд. Ген SCN9A пациента с врожденной нечувствительностью к боли содержит мутацию W897X, которая полностью прекращает функционирование канала: электрический ток никуда не поступает. Ген SCN9A пациента, страдающего пароксизмальным болевым расстройством, содержит мутацию G1607R. В результате натриевый ток возникает в соответствии с нормой, а деактивируется медленно и не до конца, так что ток идет гораздо дольше обычного. Лекарство карбамазепин частично умеряет этот эффект и полезно при лечении симптомов пароксизмального болевого расстройства. Врожденную невосприимчивость к боли вызывает несколько видов мутаций, но все они в итоге демонстрируют прямую линию на мониторе. Несколько мутаций могут вызывать и синдром пароксизмального болевого расстройства, но все они приводят к неполной деактивации натриевого тока
Все начинается вскоре после рождения, часто с первым сокращением кишечника: ребенок пугается, и на его лице проступает выражение крайнего ужаса. Безутешно рыдая, новорожденный прижимается к взрослому. Тело напрягается и сильно краснеет, а лицо искажает гримаса. Такие приступы могут длиться по нескольку минут и случаться много раз на дню. Часто их вызывает обычное прикосновение ко рту или к анусу: кормление, вытирание рта, установка ректального термометра. Способность новорожденных к общению ограничена, но с возрастом они начинают жаловаться на боль, которая сперва проявляется в области ануса, подбородка или глаз и затем распространяется по всему телу. Эта боль – одновременно жгучая, колющая и разлитая, и, по словам тех, кто ее испытал, ничего мучительнее нельзя и представить. Все матери, страдающие таким расстройством, говорят, что родовые схватки рядом с этой болью – ничто. Большинство из них признаются, что если бы узнали, что их ребенок будет страдать этим синдромом, то прервали бы беременность.
Эта патология получила название пароксизмального болевого расстройства. Его также вызывает мутация с приобретением функции в гене SCN9A. На рис. 6.1 показан натриевый ток от мутантного гена SCN9A, взятого у пациента с этим расстройством. При деполяризации клетки натриевый ток работает нормально, но деактивируется медленно и не до конца. В результате нейроны, отвечающие за восприятие боли, превращаются в автомат со сверхчувствительным спусковым крючком: стимулы, которые побудили бы обычные нейроны к отправке одного-двух электрических сигналов, теперь вызывают настоящую вспышку. Из-за проблем с электрической сигнализацией даже самые невинные стимулы могут привести к приступу очень сильной боли. К счастью, существует лекарство карбамазепин, которое помогает деактивировать потенциал-зависимые натриевые каналы, в том числе и те, что образуются в результате работы гена SCN9A. У некоторых пациентов карбамазепин приводит к полному облегчению, а у многих других снижает частоту и остроту приступов боли.
Но даже без лечения карбамазепином пациенты, страдающие от пароксизмального болевого расстройства, обычно в состоянии жить полной жизнью. У большинства из них есть дети, карьера, нормальная продолжительность жизни. В каком-то отношении это противоречит здравому смыслу: если бы вам предложили выбрать между двумя формами мутации SCN9A – одна сделает вас нечувствительным к боли, но почти гарантированно убьет молодым, а другая будет подвергать приступам дикой боли в течение всей сознательной жизни (достаточно длинной), что бы вы предпочли?
Представьте, что вы ходили по дому босиком и ушибли пальцы ноги о ножку массивного стула. Боль проявляется постепенно. Сначала это резкая боль, локализованная в тех пальцах, которыми вы ударились. Она быстро успокаивается, и вы готовы хоть песни распевать, пока не подступит вторая волна пульсирующей рассеянной боли. Первая болевая волна переносится в спинной мозг покрытыми миелиновой оболочкой волокнами А-дельта среднего диаметра, которые передают электрические сигналы со скоростью примерно 110 километров в час, и волокнами А-бета большого диаметра, которые позволяют развивать скорость до 230 километров в час. Вторую волну боли передают С-волокна малого диаметра, транслирующие сигналы гораздо медленнее – на скорости около 3 километров в час. Все участки кожи (и бо́льшая часть внутренних органов) пронизаны как быстрыми, так и медленными волокнами, отвечающими за болевые ощущения (рис. 6.2). Разница во времени между первой и второй волнами боли особенно заметна для участков, наиболее удаленных от мозга – например, для тех же пальцев ног. А вот, например, у боли в области лица тоже есть быстрый и медленный компоненты, но перерыв между ними гораздо меньше, так что две волны боли часто неразличимы. Конечно, у более крупных животных такой перерыв выражен еще ярче. Так, если тридцатиметровая динозавриха (например, диплодок) прищемляла себе хвост плывущим по реке деревом, то первая волна боли наступала через секунду, а второй требовалась целая минута, чтобы достичь головного мозга и быть воспринятой.
Первая волна боли быстра, точна и несет смыслоразличительную информацию: она снабжает нас данными, относящимися к непосредственной угрозе, и управляет реакциями. Часто мы уже успеваем убрать ногу и пустить крепкое словцо, но тут накатывает вторая волна боли. Представьте себе, что вы схватили горячую ручку кастрюли. Из-за первой волны боли вы сразу же ее отпускаете, начинаете махать рукой в воздухе, чтобы утихомирить ощущения, но тут подступает вторая волна. Она медленно начинается, медленно заканчивается и плохо локализуется. Боль бывает гудящей, жгучей или пульсирующей. Вторичная боль требует постоянного внимания и мотивирует поведение, которое должно минимизировать дальнейшие повреждения и способствовать восстановлению (например, побуждает беречь больную ногу при ходьбе).
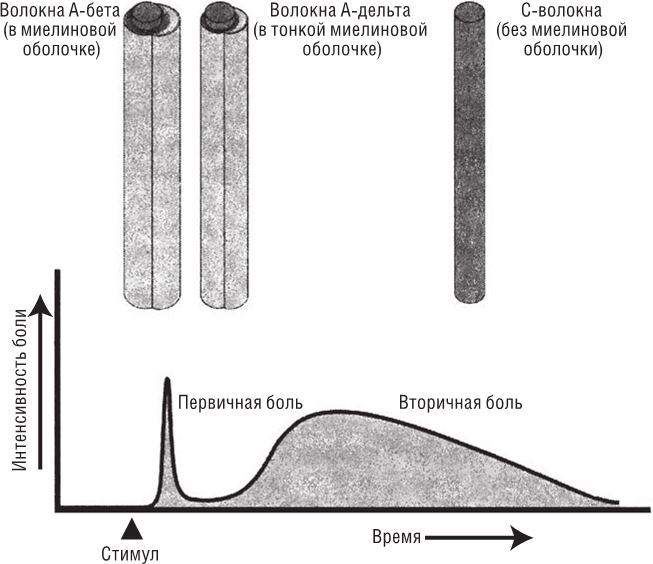
Рис. 6.2. Первичная боль наступает быстро, она хорошо локализована и играет смыслоразличительную роль; вторичная боль рассеяна, имеет эмоциональную нагрузку и большую продолжительность. Первичная боль переносится покрытыми тонкой миелиновой оболочкой волокнами А-дельта среднего диаметра и волокнами А-бета большого диаметра и в плотной миелиновой оболочке, а вторичная – С-волокнами без оболочки. Один из способов это выяснить – перевязка, сжимающая и блокирующая А-волокна, но оставляющая С-волокна свободными. Благодаря ей первичная боль не ощущается, а вторичная остается на своем месте. Если вам интересно, то ген SCN9A работает в болевых нейронах как А-волокон, так и С-волокон, так что у людей с врожденной нечувствительностью к боли отсутствуют и первичная, и вторичная боль, а люди с синдромом пароксизмального болевого расстройства испытывают усиленные болевые ощущения от обеих волн
Боль – это не единичное отчетливое ощущение, даже если вы испытываете ее в определенный момент. Из жизненного опыта мы знаем, что она может обладать различными качествами. Описывая характеристики боли, мы используем такие определения, как резкая, пульсирующая, мерцающая, жгучая, колющая, тупая, гудящая, острая, жалящая (рис. 6.3).
Как возникают эти разные типы болевых ощущений? Есть три основных категории болевых рецепторов: механические, термические и полимодальные. Мы предполагаем (но не знаем точно), что конкретные болевые ощущения определяются как протеканием нервной деятельности, так и сравнительной степенью активации каждого типа рецепторов боли, порой в сочетании или в сравнении с неболевыми осязательными сигналами от того же участка тела.
В отличие от рецепторов давления, колебаний, текстуры и ласки, которые имеют специфическую структуру или обладают сложными связями с волосяными луковицами, болевые нейроны имеют простые и незатейливые свободные нервные окончания. Они находятся в эпидермисе кожи. Механические болевые рецепторы легче всего активируются при интенсивном давлении – например, если вы порежете палец ножом, или собьете палец ноги при ходьбе, или прищемите молнией кожу, механические болевые рецепторы начинают посылать сигналы в ваш мозг. Некоторые из этих молекул находятся в свободных нервных окончаниях волокон А-дельта, так что информация будет передаваться быстро. Термические болевые рецепторы тоже находятся в свободных нервных окончаниях другой группы волокон А-дельта; они реагируют на температуры ниже 5,5 °С и выше 46 °С. Существует также особый набор окончаний С-волокон, которые отвечают за более широкий спектр реакций – откликаются на термическую, механическую или химическую стимуляцию (например, при контакте с сильными кислотами и щелочами). Эти полимодальные рецепторы боли запускают вторую болевую волну, и их большая чувствительность к различным типам боли помогает объяснить, почему эта вторичная волна качественно менее специфична, чем первая.
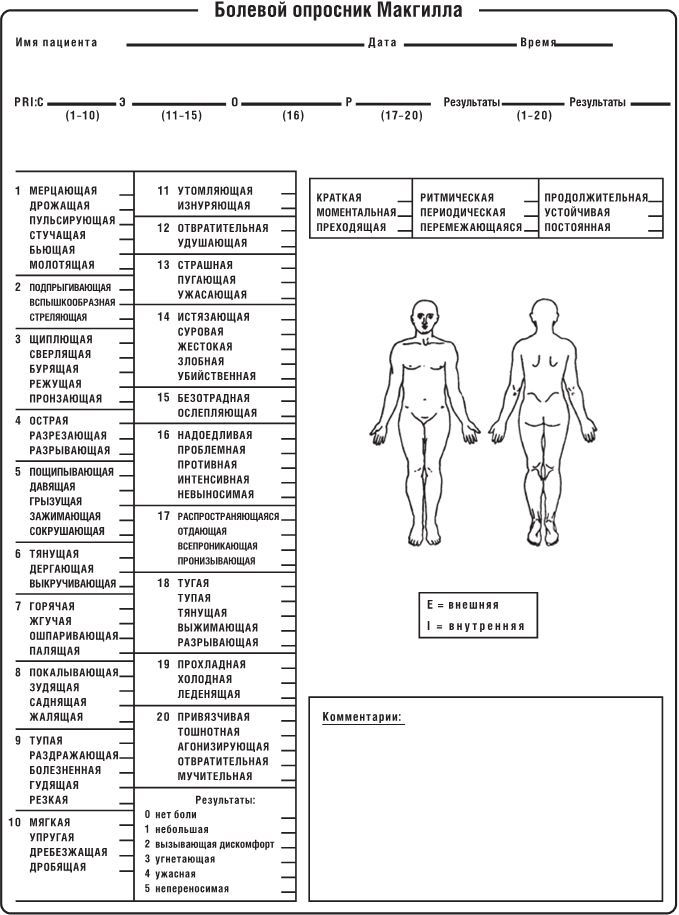
Рис. 6.3. Опросник Макгилла был разработан доктором Рональдом Мельзаком, намеревавшимся описать разнообразие болевых ощущений в клинических условиях. Группы 1–10 – сенсорные описания, группы 11–15 – эмоциональные, группа 16 – оценочные. Группы 17–20 разнообразны и включают аспекты всех трех остальных категорий. Печатается с разрешения © R. Melzack, 1975
Клеточные тела А- и С-волокон, которые переносят болевые сигналы, располагаются в спинномозговых ганглиях и поступают в область спинного мозга, которая называется спинным рогом (рис. 6.4). Это напоминает анатомию сенсорных нервов, ответственных за тонкое осязание и ласку, о чем говорилось в главах 2 и 3. Болевые С-волокна и волокна А-дельта устанавливают возбуждающие связи с нейронами, расположенными в спинном роге. В нем есть несколько слоев, где находятся нейроны, получающие осязательную информацию разного типа: о проприоцепции (ее передают сверхбыстрые волокна А-альфа), о тонких механических ощущениях (быстрые волокна А-бета), о ласках (за нее отвечает другой тип медленных С-волокон) и о боли.
Для наших целей необязательно подробно разбираться в анатомии этих слоев. Однако стоит помнить о важном общем принципе: если потоки различных типов осязательных стимулов (боль, тонкие прикосновения, ласки и т. д.) по большей части отделены друг от друга при следовании от спинного мозга в головной, бывают примечательные случаи смешения сигналов. Например, один из типов нейронов в спинном роге – так называемый нейрон широкого динамического диапазона – объединяет в себе болевую и смыслоразличительную информацию. Такое сочетание боли с неболевыми сигналами в спинном мозге – возможная причина того, почему, если потереть ушибленный локоть, боль иногда на время прекращается.
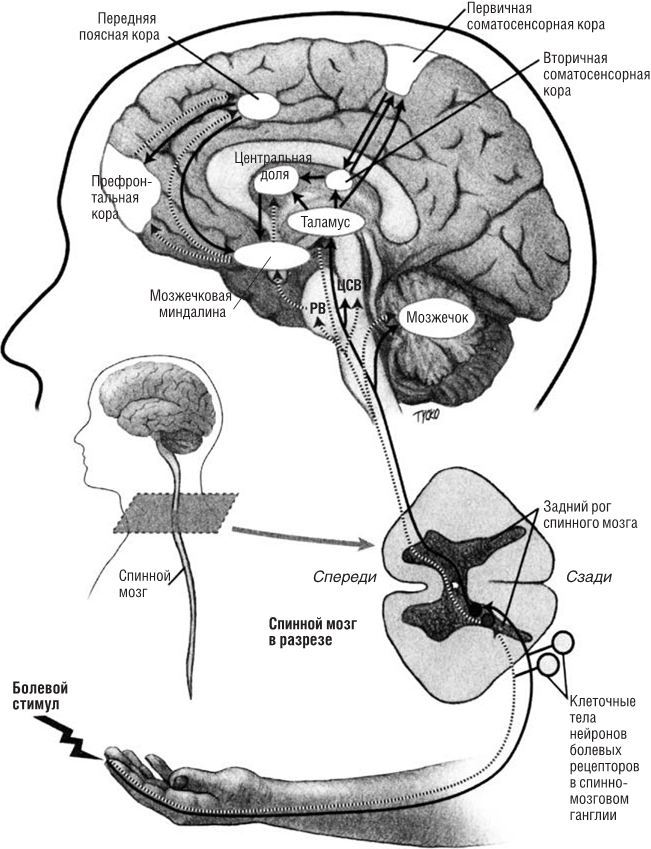
Рис. 6.4. Два основных способа передачи информации о боли в головной мозг. Быстрый путь передачи смыслоразличительных болевых данных (сплошные черные стрелки) по большей части проходит по спинобугорному пути через таламус, задействуя первичную и вторичную соматосенсорную кору. Медленный аффективно-эмоциональный путь (пунктирная линия) частично проходит по спиномезэнцефалическому пути, по ядру Келликера – Фюзе и попадает в мозжечковую миндалину, центральную долю и переднюю поясную кору. © 2013 Джоан Тикко
Интеграция в нейронах широкого динамического диапазона разных типов болевых сигналов со временем способна привести к осязательным иллюзиям. Например, некоторые такие нейроны в спинном роге получают информацию о боли и от кожи, и от внутренних органов. Больные стенокардией (недостаточным притоком крови к сердечной мышце) часто чувствуют боль как будто бы в левой руке, хотя она и не повреждена. Эта рефлекторная боль – яркая иллюстрация общего принципа: мы не всегда способны точно расшифровать сигналы чувственного мира. В данном случае структурная схема спинного мозга такова, что порождает путаницу. Отсюда возникает вопрос: есть ли какие-то преимущества в том, что болевые сигналы перепутываются и порождают двусмысленность? Ответ краток: мы не знаем.
За регистрацию боли не отвечает какой-то определенный участок мозга. Восприятие боли распределено между несколькими зонами, каждая из которых отвечает за свой участок (рис. 6.4). Существует по меньшей мере пять нервных путей, которые переносят информацию от нейронов заднего рога спинного мозга, но мы сосредоточимся лишь на трех. Первый из них – спиногипоталамический путь, который активирует гипоталамус – структуру в основании мозга. Эта структура вносит быстрые подсознательные изменения, вызванные болью, в сердечные ритмы, температуру тела, дыхание, сокращения мышц и выделение гормонов. Волокна второго пути – спинобугорного – тоже начинаются от нейронов заднего рога спинного мозга, пересекают срединную линию, поднимаются по спинному мозгу и формируют синапсы в таламусе. Нейроны таламуса, в свою очередь, образуют волокна, направленные в первичную и вторичную соматосенсорную кору. Если поместить в спинобугорный путь электрод и ненадолго активировать волокна, это вызовет хорошо локализованные, четко определенные болевые ощущения.
Сканирование мозга при болевых стимулах показало, что первая волна боли прежде всего коррелирует с активацией спинобугорного пути и зон, где он кончается, – первичной и вторичной соматосенсорной коры. Вторичная болевая волна наиболее четко ассоциируется с активацией третьего восходящего пути – так называемого спиномезэнцефалического, который активирует ядро Келликера – Фюзе в мозговом стволе, а через другие синаптические передачи – центральную долю, мозжечковую миндалину и переднюю поясную кору. Чем так важны эти анатомические детали? Дело в том, что зоны, к которым ведет спиномезэнцефалический путь, отвечают в мозге за эмоциональные и когнитивные болевые реакции. Их активация не связана с точной локализацией боли или ее качеством, а скорее придает боли характерный для нее негативный эмоциональный фон. Кроме того, болезненные ощущения таким образом интегрируются с другой информацией о ситуации: я в безопасности или под угрозой? Эта боль ожидалась или стала неожиданностью? Каковы ее ближайшие последствия?
Мы считаем боль по определению неприятной. Описывая ее, мы используем такие слова, как жестокая, суровая, невыносимая (см. опросник Макгилла с рис. 6.3). Мы не воспринимаем боль как последовательность сенсорных и эмоционально-аффективных компонентов: для нас это единое неприятное ощущение. Эмоциональная и сенсорная компонента находятся в нерасторжимом единстве. Однако при определенных типах нарушения мозговой деятельности пациенты могут разграничивать разные компоненты боли.
Повреждение боковой части таламуса и первичной и вторичной соматосенсорной коры приводит к синдрому потери смыслоразличительного компонента болевого стимула. Удивительно, но люди с таким расстройством в состоянии описывать неприятную эмоциональную реакцию на болевой стимул, но совершенно не способны рассказать о качествах боли (жгучая или леденящая, острая или тупая) и даже определить место болезненных ощущений в организме. Наоборот, повреждение задней центральной доли или задней части передней поясной коры – основных узлов аффективно-эмоциональной болевой цепочки – может привести к состоянию так называемой болевой асимболии. Эти пациенты способны точно описывать качества и свойства боли, ее интенсивность и локализацию, но у них отсутствует отрицательная эмоциональная реакция на боль, столь естественная для большинства людей. Поскольку болевые асимболики не воспринимают деструктивное значение боли, они медленно избавляются от болезненных стимулов. Они чувствуют боль, но она их, кажется, вообще не беспокоит:
Пациентка, которую укололи в правую ладонь, радостно улыбается, слегка вздрагивает и потом говорит: «Ой, больно». Выражение лица при этом у нее самое что ни на есть спокойное. То же выражение сохраняется и при уколах в области лица и живота. Когда же ее колют в подошвы, она начинает улыбаться, явно испытывая приятные ощущения. Болевые асимболики – не мазохисты; они как раз прямая противоположность мазохистов, для которых боль обладает глубоким эмоциональным значением.
Болевые асимболики не наслаждаются болью и не ищут ее. Нельзя и назвать их рассеянными и невнимательными. Боль просто не вызывает у них никакого эмоционального резонанса – ни положительного, ни отрицательного.
Боль по сути своей эмоциональна и негативна, точно так же, как оргазмы по сути своей эмоциональны и позитивны. И нормальное восприятие оргазма, и нормальное восприятие боли требуют почти одновременной активации нескольких участков мозга, которые вырабатывают ощущения, воспринимаемые нами как единое целое. И в боль, и в оргазм вовлечены как первичная и вторичная соматосенсорная кора, отвечающая за смыслоразличение, так и область, ответственная за эмоционально-аффективную окраску, и задняя центральная доля, передняя поясная кора и связанные с ними области, ответственные за боль, и вентральная область покрышки, и зоны, в которые направляются оттуда дофаминовые нейроны – переносчики удовольствия. Без эмоциональной компоненты и боль, и оргазм станут заурядным опытом, оставляющим нас равнодушными.
В детстве загорание казалось мне магией. Я проводил целый день на пляже, валяясь на солнцепеке и кувыркаясь в волнах. И вечером жар солнечных лучей следовал за мной домой, пойманный моей кожей; он не давал мне заснуть, потому что и прикосновение постельного белья, и струя горячего душа казались невыносимыми. Обгорание вызывает аллодинию – болезненное ощущение в ответ на обычно безобидные осязательные стимулы, как, например, легкое поглаживание обгоревшей кожи. Аллодиния во многом похожа на другую форму устойчивой боли – так называемой спонтанной боли, которая возникает при отсутствии воздействия вообще каких-либо стимулов. Повреждения тканей при аллодинии и спонтанной боли имеют две ключевые особенности. Во-первых, при этих формах устойчивой боли происходит генерализация: повреждение тканей при обгорании, например, вызывает не только усиление чувствительности к нагреванию, но и к механическим стимулам. Если вы при готовке ошпарите подушечку большого пальца и попытаетесь взять ручку и начать что-то писать, этот невинный механический стимул тоже вызовет боль. Во-вторых, воспаление, которое происходит в ответ на повреждение тканей (в том числе распухание, покраснение, ощущение жара), не будет четко ограничено поврежденным участком, а распространится немного сильнее. Например, если вы опять-таки ошпарили подушечку большого пальца, воспалиться на несколько дней рискует весь палец; аллодиния и спонтанная боль могут распространиться даже на ближайшие к нему участки.
Воспаление и устойчивую боль, ассоциирующуюся с ним, вызывает сложный комплекс химических сигналов, получивший название воспалительного супа (рис. 6.5). При повреждении ткани пострадавшие клетки выделяют соединения-простаноиды, которые воздействуют на рецепторы класса TRPV1 на окончаниях болевых С-волокон. Поврежденные ткани также активируют красные кровяные тельца – тучные клетки и макрофаги, выделяющие соединение брадикинин. Оно, как и простаноиды, снижает температурный порог активации TRPV1 с жарких 43 °С до обычно безвредных 30 °С (о чем говорилось в главе 5). Другие соединения, выделяемые макрофагами (белки ФНО-альфа и фактор роста нервной ткани), тоже усиливают чувствительность болевых волокон типа С. Активированные тучные клетки выделяют гистамин, который расширяет кровеносные сосуды и слегка увеличивает их поры, что способствует усиленному оттоку плазмы крови и приводит к повышению температуры, покраснению и распуханию близлежащих тканей.
Изначально считалось, что нервные волокна – это только реципиенты болезненных химических сигналов, сейчас же хорошо известно, что окончания болевых С-волокон тоже посылают сигналы, что приводит к установлению цепи положительной обратной связи. Нервные окончания выделяют молекулу кальцитонин-ген-связанного пептида (SGRP), способствующую расширению кровеносных сосудов и просачиванию плазмы. Выделяется и другая молекула – так называемая субстанция Р, которая активирует тучные клетки. Постоянное протекание химических сигналов по поврежденной ткани, белым кровяным тельцам, кровеносным сосудам и болевым С-волокнам – одна из причин того, что боль и воспаление сохраняются несколько дней и даже недель после травмы. Поскольку химические сигналы могут распространяться в соседние здоровые ткани и запускать там новые сигналы, распухание и повышенная болевая чувствительность способны распространяться, но довольно ограниченно: хотя травма большого пальца может привести к тому, что у вас опухнет и будет болеть кисть, при отсутствии инфекции это состояние едва ли затронет всю руку (рис. 6.5).
Многие наши наиболее эффективные лекарства для снятия боли и воспаления воздействуют на химические сигналы воспалительного супа. Аспирин, ацетаминофен (тайленол) и ибупрофен подавляют выработку простаноидов. Антигистаминные препараты блокируют действие гистамина на рецепторы в нервных окончаниях и кровеносные сосуды. В последние годы появились лекарства, взаимодействующие с сигналами ФНО-альфа, и произвели революцию в области лечения боли при ревматическом артрите. Большие надежды в плане облегчения постоянной боли возлагают на лекарства, препятствующие воздействию фактора роста нервной ткани. Сейчас проводятся их клинические испытания, но, судя по всему, они ускоряют дегенерацию связок, так что не вполне понятно, насколько эффективными они окажутся. Соединения, извлекаемые из ананаса и алоэ, способны подавлять действие брадикинина. Возможно, их удастся использовать для лечения или как образец при разработке лекарств, блокирующих брадикинин: допустим, анализ структуры этих естественных соединений позволит их создать. Разработка лекарств для борьбы с дополнительными компонентами воспалительного супа по-прежнему остается очень важной задачей.
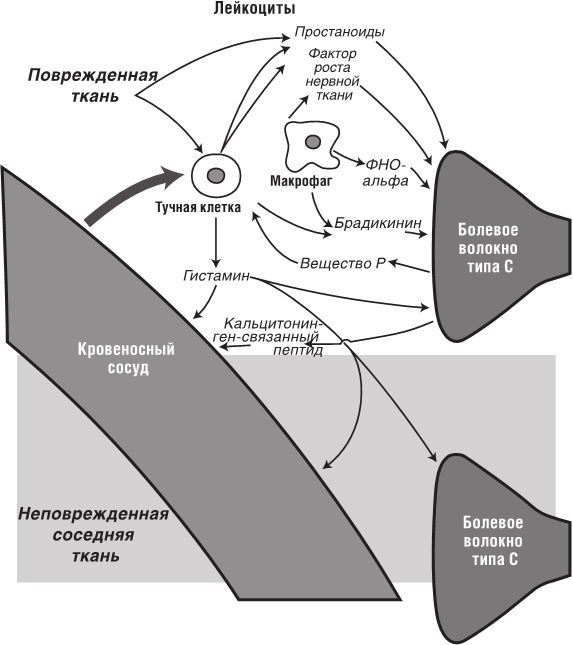
Рис. 6.5. Повреждение ткани приводит к образованию воспалительного супа из химических веществ. Некоторые из них выделяет сама поврежденная ткань (как кератиноцитовые клетки кожи), другие производятся лейкоцитами (макрофагами и тучными клетками), третьи выделяются ответственными за восприятие боли С-волокнами. В результате образуется цикл положительной обратной связи, который поддерживает и усиливает боль и воспаление. Частично это связано с распространением сигнальной молекулы гистамина. Болеутоляющие и противовоспалительные средства часто блокируют определенные части этой сети химических сигналов. Диаграмма кажется сложной – и она действительно сложна, хотя на ней показаны далеко не все дополнительные компоненты воспалительного супа
У Фрэнсиса Макглоуна, знаменитого британского исследователя тактильного восприятия, есть любимый вопрос: «Почему есть хроническая боль, но не существует хронического удовольствия?» Вопрос хороший. Мы уже отмечали, что боль необходима для побуждающего поведения, которое сводит к минимуму повреждения тканей, и что люди, не воспринимающие боль, редко доживают до взрослого возраста. Но боль зачастую длится куда дольше необходимого и продолжает мучать людей даже после заживления поврежденных тканей – порой всю жизнь.
Постоянную боль вызывают не только изменения в окончаниях болевых нервных волокон. Изменения происходят и в синапсах в спинном мозге, где эти волокна вступают в контакт с нейронами заднего рога спинного мозга. Когда в нервные окончания чувствительных к боли С-волокон поступают электрические сигналы, образуется возбуждающий нейромедиатор глутамат. Он проникает сквозь крошечную синаптическую щель между двумя нейронами и поступает в рецепторы глутамата в нейроне заднего рога спинного мозга, тем самым распространяя болевые сигналы по спинному мозгу и в конечном счете в головной мозг. При постоянном стимулировании этого синапса, как в случае постоянной боли, он становится сильнее и эффективнее. Это происходит по ряду причин, в том числе из-за усиления выработки глутамата, увеличения количества рецепторов глутамата в нейронах заднего рога спинного мозга, а также изменений в потенциал-зависимых ионных каналах нейронов заднего рога спинного мозга, способствующих постоянной генерации электросигналов. Эти изменения способны сохраняться очень долго, подобно воспоминаниям. (И действительно, полагают, что некоторые изменения на молекулярном и клеточном уровне, отвечающие за кодирование воспоминаний в мозге, сходны с теми, которые лежат в основе этой формы хронической боли, берущей начало в спинном мозге.) Даже когда воспалительный ответ кожи (или любой другой ткани) полностью прекращается и возвращается нормальная чувствительность нервных окончаний кожи к боли, изменения в спинном мозге могут сохраняться в течение нескольких месяцев или даже лет. Было бы невероятно полезно найти способ избирательного ослабления этих передающих боль синапсов в заднем роге спинного мозга. Неудивительно, что исследования в этой отрасли ведутся весьма активно.
Один из особенно трудно поддающихся лечению случаев устойчивой боли – это фантомные боли конечностей. После ампутации примерно 60 % пациентов испытывают ощущение хронической боли в удаленной конечности. Иногда она кажется гудящей, в других случаях ее описывают как жгучую. Этот феномен чаще всего наблюдается, когда ампутация проводится во взрослом возрасте. Он с равной вероятностью возникает и при хирургическом удалении, и при потере конечности в результате травмы. Изначально считали, что фантомная боль конечности вызывается поврежденными нервными окончаниями в культе, но ни хирургическое вмешательство в этой области, ни местные анестетики не приводили к облегчению.
Вероятно, что по крайней мере частично фантомная боль конечности – результат постоянного усиления деятельности возбуждающих синапсов нейронов болевых волокон и заднего рога спинного мозга. Многие годы ампутационная хирургия проводилась исключительно под общим наркозом. При этом болевые сигналы направляются с периферии в задний рог спинного мозга, но блокируются на более поздних стадиях, не попадая в мозг. Вероятность возникновения фантомной боли слегка уменьшается, когда, помимо общего наркоза, используются местные анестетики, вызывающие онемение ампутируемой области перед ампутацией и во время ее, так что болевые сигналы не достигают и заднего рога спинного мозга. Лекарства для подавления постоянного усиления (долговременной потенциации) синапсов, поступающие в нейроны заднего рога спинного мозга, также, по последним данным, несколько снижают вероятность появления фантомных болей.
Если синапсы, передающие болевую информацию в спинной мозг, постоянно усиливаются, то изменяются и сигналы, которые отправляют в головной мозг нейроны спинного; меняется и состояние самого головного мозга. В каком-то смысле ситуация очень напоминает то, о чем шла речь в главе 2, когда отображение руки, пальцы которой используются при игре на струнных инструментах, у опытных музыкантов со временем значительно увеличивалось. У пациентов, испытывающих боли в фантомной конечности, на осязательной карте в первичной соматосенсорной коре порой увеличивается отображение как соответствующей конечности, так и некоторых других участков. У ампутантов, не страдающих от таких хронических болей, изменений в отображении органов не наблюдается.
13 апреля 2003 года рядовой Дуэйн Тернер, военный медик армии США, вместе с небольшим отрядом подвергся нападению во время разгрузки припасов для временного медицинского центра примерно в 50 километрах к югу от Багдада. Давая через несколько месяцев интервью об этом дне, Тернер вспоминал:
…Кто-то перебросил гранату через стену, а я и еще несколько парней оказались в самом центре взрыва. Я побежал к кабине грузовика, увидел раненых, сел на землю и постарался оценить ситуацию, потому что все было далеко не кончено. Я подумал: «О боже, ребята падают, и уж нет, я их там не оставлю». Надо было делать свое дело, и я приступил… Я знаю этих парней. Я знаю их как облупленных, мы вместе едим, вместе спим, да и вообще не хотите же вы, чтобы кто-то умер у вас на глазах. Они мне почти как братья. На войне все мы – члены одной семьи. А ведь будь там мой родной брат, я бы все сделал, чтобы его спасти.
Шрапнель из гранаты попала Тернеру в правую ногу, бедро и живот, но это его не остановило. Он несколько раз выбегал из укрытия, хватал раненых товарищей и оттаскивал их в безопасное место. Тем временем его ранили еще два раза: одна пуля попала в левую ногу, другая поразила кость в правой руке. Но он словно не замечал, что в него попали.
Кругом свистели пули, но я думал, что все они пролетают мимо, попадают в землю, а в меня летит пыль или камни, поднятые выстрелами, потому что кое-где я чувствовал легкие уколы. Но это все, что я чувствовал, пока кто-то не сказал мне: «Док, док, ты истекаешь кровью». Это был не я – не я, а кто-то другой. Ранили словно бы не меня – и все-таки меня.
Рядовой Тернер в итоге потерял сознание от потери крови, но уже через несколько минут его пришлось удерживать: он собирался вернуться и продолжать вытаскивать солдат из-под огня. Позднее его вместе с другими ранеными эвакуировали на вертолете. Он был награжден за отвагу Серебряной звездой: сообщалось, что своими действиями он спас жизни двенадцати солдат.
Хотя в пылу битвы рядовой Тернер не обращал внимания на боль от шрапнели и даже не сознавал, что ранен, стоит отметить (это никак не приуменьшает его героизма), что способность игнорировать тяжелые раны в ходе битвы не столь уж необычна. Подполковник Генри Бичер собрал статистику о боли у раненых солдат, которых он лечил в ходе высадки союзников в Италии и во Франции во время Второй мировой войны. Он писал, что около 75 % серьезно раненных утверждали, что почти не испытывают боли, и отказывались на поле боя от болеутоляющих. Но через несколько дней, восстанавливаясь в госпитале, те же люди яростно возмущались, если у них неаккуратно брали кровь из пальца, как сделал бы на их месте любой другой. Солдаты – это не сверхлюди с абсурдно высоким болевым порогом. Это обычные люди, оказавшиеся в экстраординарных ситуациях, где когнитивный и эмоциональный стресс от сражения притупляет боль.
Когда меня в пять лет вели к педиатру на обычную прививку, я воспринимал это как смертный приговор. Мое сердце, как у собаки Павлова, билось тем сильнее, чем ближе мамина машина подъезжала к поликлинике. Светлые деревянные панели в больничном коридоре, постукивание маминых каблуков по кафельному полу, запах ваты, пропитанной спиртом, – все напоминало мне о предыдущем ужасном уколе. Во время процедуры я так пристально смотрел на маленький участок кожи на своей левой руке, что глаза вылезали из орбит. Укол воспринимал, как будто бы меня ударили огромным ножом и еще провернули его внутри. Когда я стонал от боли, доктор сухо отмечал: «Ну и артист – Сара Бернар отдыхает».
В детстве у меня было много телесных повреждений, столь же или даже более болезненных, – от ссадин на коленках до сотрясения мозга. Но их я получал неожиданно, и поскольку к ним не готовился, то и заботили они меня мало. А вот краткая и незначительная боль от укола заметно увеличивалась из-за нарастающего ожидания ужаса и воспоминаний о предыдущих болезненных инъекциях.
Истории о героизме в битвах и мелодраме у педиатра показывают, как когнитивные и эмоциональные факторы притупляют или усиливают восприятие боли. Следует ли понимать эти когнитивные и эмоциональные изменения восприятия как результат действия распределенной сети центров обработки боли в головном мозге? В целом ответ скорее положительный, но многое еще предстоит уточнить. Одна из ключевых идей состоит в том, что мозг может посылать сигналы к передающим боль нейронам заднего рога спинного мозга. Эти сигналы либо требуют: «Громче!» – либо предлагают заткнуться и больше информацию о боли не передавать. Поразительно, что мозг осуществляет контроль над информацией, которая в него поступает. Он не просто собирает все данные и затем выбирает подходящие ощущения и реакции на основе текущего эмоционального или когнитивного состояния; благодаря нисходящим нервным волокнам он именно контролирует сенсорную информацию, которую получает из спинного мозга. Это странное и, казалось бы, противоестественное положение вещей. Мозг каждую секунду активно и подсознательно подавляет или усиливает информацию о боли. Можно сказать, что он подает ее под нужным углом. Осознание того, что во многих случаях информация, которую мы получаем, – это результат самоцензуры, способно серьезно обеспокоить тех из нас, кто предпочитает думать, что мы обладаем доступом к подлинной реальности и именно на ее основании принимаем рациональные решения.
Как видно, информация как из смыслоразличительных, так и из аффективно-эмоциональных участков сети обработки боли, существующей в мозге, сходится в нескольких зонах. Это передняя поясная кора, центральная доля, префронтальная кора и мозжечковая миндалина. Затем из этих зон сигналы поступают в структуру мозгового ствола, которая называется центральным серым веществом мозга (рис. 6.6) и, в свою очередь, возбуждает другие структуры мозгового ствола: голубое пятно и продолговатый мозг. Из этих последних участков аксоны направляются в задний рог спинного мозга, где формируются синапсы, которые либо подавляют, либо усиливают сигналы от периферических болевых волокон. В продолговатом мозге имеются особые «включающие» клетки, которые усиливают сигнал, и «выключающие», которые ослабляют болевые сигналы. Повышение активности включающих клеток ускоряет передачу болевых сигналов в спинном роге и усиливает болевые ощущения, а повышение активности выключающих клеток обладает противоположным эффектом. Эта цепь и позволяет мозгу приглушать и усиливать входящую информацию о боли.
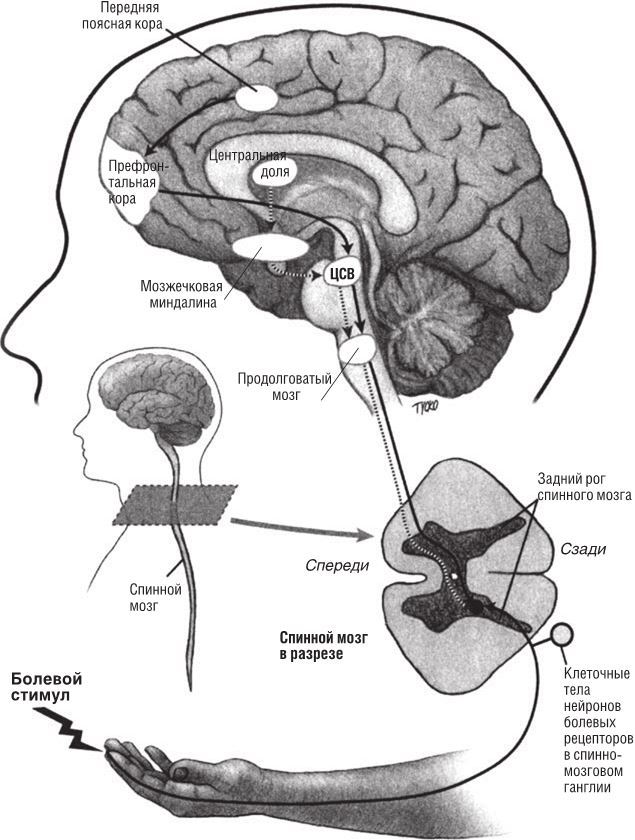
Рис. 6.6. Нисходящие пути, идущие от головного мозга к спинному, играют важную роль в эмоциональных и когнитивных изменениях болевых ощущений. Ключевые остановки на пути нисходящей информации находятся в мозговом стволе: это центральное серое вещество и продолговатый мозг. Диаграмма дает об этом упрощенное представление. Так, например, синаптическое действие разных нейромедиаторов, высвобождаемых в заднем роге спинного мозга нисходящими волокнами, различно. © 2013 Джоан Тикко
Свойства опиумного мака и его производных – например, морфина – контролировать боль известны уже по меньшей мере с 3400 г. до н. э., когда их открыли в Шумере (юг современного Ирака). Шумеры называли мак «хуль гил» – растение радости. Оттуда мак вскоре начали экспортировать в Ассирию и Египет, а уже затем он получил широкое распространение. Морфин симулирует воздействие собственных морфиноподобных молекул мозга – эндорфинов и энкефалинов. Рецепторы, отвечающие за восприятие этих опиатов, расположены по всему телу и нервной системе, но особого типа рецепторы – мю-опиатные рецепторы – сосредоточены именно в нисходящих болевых путях: в центральном сером веществе, продолговатом мозге, поверхностных слоях заднего рога спинного мозга. Достаточно впрыснуть очень небольшое количество морфия в центральное серое вещество, чтобы добиться сильного обезболивания: он стимулирует деятельность включающих клеток продолговатого мозга и замедляет деятельность выключающих. Центральное серое вещество играет в обезболивании настолько большую роль, что тщательно контролируемая электрическая стимуляция этой зоны может заменить химическую анестезию при хирургических операциях. Тем, кто страдает от боли, не умеряемой обезболивающими, порой вживляют в центральное серое вещество электроды, что позволяет им самим проводить электростимуляцию мозга для облегчения боли. Но такому облегчению могут помешать лекарства, направленные на мю-опиатные рецепторы, стимулирующие воздействие эндорфинов и энкефалинов для достижения лечебного эффекта.
Вооружившись этими знаниями о нисходящих болевых каналах, вернемся к нашим примерам – рядовому Тернеру, в бою даже не замечавшему, что он ранен, и вашему рассказчику, плакавшему в детстве от незначительной боли при обычной прививке. Безусловно, в обоих случаях такое поведение обусловлено особенностями концентрации внимания. Рядовой Тернер сосредоточился на том, чтобы вынести своих товарищей из-под огня; он вовсе не думал о собственном организме. В лабораторных условиях интенсивность боли оценивается как более низкая, когда участников исследования отвлекают от ее восприятия – например, задают им какие-то вопросы или просят решить задачу. Эта реакция связана со снижением активности первичной соматосенсорной коры и центральной доли. И наоборот, когда участников просят сосредоточиться на своей боли, уровень ее интенсивности растет, отражая повышение активности тех же участков мозга. Важно отметить, что эмоциональная компонента восприятия боли, выражаемая по шкале неприятных ощущений, при любых колебаниях внимания остается в основном неизменной.
В лабораторных условиях можно поставить эксперименты, которые будут селективно активировать механизмы эмоций и внимания, но в реальном мире разграничить их не так просто. Рядового Тернера отвлекали продолжающаяся стычка и попытки спасти товарищей, но это отвлечение тоже не было эмоционально нейтральным, а, напротив, переполненным эмоциями: страхом, состраданием, гордостью, глубокими эмоциональными связями с павшими. Я же в кабинете врача в ожидании инъекции сосредоточивался на грядущем уколе, что также было глубоко эмоциональным опытом: мой ужас порождали отрицательные воспоминания.
Отрицательные эмоции усиливают восприятие боли, но принципиально иным образом, чем концентрация внимания – как с анатомической, так и с перцептуальной точки зрения. Они провоцируют вспышку вызванной болью деятельности передней поясной коры и увеличивают восприятие боли по шкале ее неприятности, но не по шкале интенсивности. Таким образом, как смыслоразличительный, так и аффективно-эмоциональный аспекты восприятия боли подвержены когнитивным и эмоциональным изменениям. В реальном мире когнитивное и эмоциональное тесно взаимосвязаны. Например, постоянно воспринимаемые неприятные ощущения от боли активируют префронтальную кору – участок, отвечающий за размышления и предположения относительно будущих последствий постоянной боли: долго ли она продлится? Начнется ли опять? Могу я ее контролировать или нет? Насколько это безопасно? Подобные мыслительные процессы внесли значительный вклад в мою панику из-за приближающегося укола. В этом частично были задействованы нисходящие болевые каналы, идущие из головного мозга в спинной. Во многих таких случаях образуется порочный круг – цепь положительной обратной связи, при которой размышления о боли только усиливают неприятные ощущения от нее, а те, в свою очередь, заставляют еще больше нервничать и размышлять по ее поводу. Вот почему транквилизаторы (например, некоторые бензодиазепины) оказываются полезными в качестве обезболивающих, особенно при хронической боли. Хотя эти лекарства не воздействуют на восприятие боли непосредственно, они снимают тревожность и тем самым умеряют неприятные ощущения, разрывая цепь положительной обратной связи. В среднем люди, страдающие от перепадов настроения, чаще страдают и от хронической боли.
Когда боль активирует спиногипоталамический путь, она вызывает сразу несколько реакций типа «бей или беги»: учащается пульс, дыхание, выделяется пот, ускоряются мышечные сокращения и т. д. Эти реакции мы чувствуем и сознательно, и на подсознательном уровне, они во многом и вызывают ощущение тревожности. Когда вы понимаете, что у вас участился пульс, то пугаетесь еще больше. Это очередная цепь положительной обратной связи, которая усиливает хроническую боль. Подсознательные реакции типа «бей или беги», вызванные болью, усиливают тревожность, которая, в свою очередь, усиливает и боль.
Часть болевой цепи мозга, в которую входят центральная доля, передняя поясная кора и префронтальная кора, играет важную роль в сопоставлении ожиданий от боли с реальными болевыми ощущениями, а следовательно, и в предсказании будущих ситуаций. Один из ключевых факторов оценки – внешняя угроза. Боль, идущая изнутри, пугает меньше и расценивается и как менее интенсивная, и как менее неприятная, чем та боль, которая внезапно вторгается в наш организм извне. В лабораторных условиях самопорожденная боль вызывает меньшую активность и первичной соматосенсорной, и передней поясной коры по сравнению с болевым стимулом той же интенсивности, но внешнего происхождения. В одном исследовании это демонстрировалось следующим образом: либо сами участники щипали себя одной рукой за другую, так что сила сжатия была сравнима с уколом заостренным кусочком пластмассы, либо их щипал экспериментатор. Иными словами, хотя попасть себе молотком по пальцам больно, вы, по крайней мере, знаете, как это случилось, и считаете, что в состоянии контролировать ситуацию и уменьшить шансы на ее повторение в будущем. Это знание помогает успокоиться и тем самым успокоить и боль. И наоборот: если вы не знаете, когда болевой стимул возникнет снова, это повысит и интенсивность, и неприятность ощущений в следующий раз.

Рис. 6.7. Джон Хейгарт – первый ученый, систематически исследовавший эффект плацебо и сообщивший о нем. В его книге, опубликованной в 1800 году, рассматривалась эффективность «вытягивателей Перкинса» – особых спиц, которые якобы способны были выводить болезнь из организма. Хейгарт показал, что некоторые люди действительно исцелились после лечения вытягивателями Перкинса, но примерно в той же степени им пошли на пользу и деревянные спицы, лишь имитировавшие эти приборы. Его вывод был таков: вытягиватели Перкинса – надувательство, но «страсти разума обладают замечательным и мощным влиянием на состояние организма при его расстройстве». Эпиграф к книге – Decipimur specie – сокращение известной фразы римского поэта Горация Decipimur specie recti («Мы обманываемся видимостью правильного»). Используется с разрешения Королевского медицинского колледжа, Эдинбург
Когда пациентам дают пилюлю из сахара или какое-то другое плацебо и уверяют, что это лекарство снимет боль, многие действительно испытывают некоторое облегчение (рис. 6.7). Хотя уровень этого облегчения зависит от типа боли и личности пациента, в среднем эффект плацебо дает значительное обезболивание примерно у 30 % пациентов. Механизм его действия довольно сложен и, возможно, включает в себя устранение и тревожности, и неприятных ощущений. Картографирование мозга показывает, что плацебо-обезболивание связано с высвобождением эндорфинов/эндокефалинов в некоторых участках эмоциональной болевой цепи, в том числе передней поясной и префронтальной коры и мозжечковой миндалины, а также центрального серого вещества. Налтрексон – лекарство, блокирующее мю-опиатные рецепторы, – блокирует и плацебо-обезболивание, что дает основание предположить участие эндорфинов/эндокефалинов. Вариант эффекта плацебо – усиление воспринимаемой боли: если пациентам говорят, что им сейчас дадут анальгетик, который едва ли сработает, об облегчении боли заявит меньше людей, даже если на самом деле анальгетик очень эффективный – оксикодон или морфин. Если же пациенты получают препарат без действующего вещества, но им говорят, что от этого боль усилится, обычно они действительно сообщают о том, что боль стала более резкой. Это так называемый эффект ноцебо. Его биологическая основа плохо изучена, но, возможно, он связан с усиленной активацией участков восприятия боли как в спинном, так и в головном мозге.
Когнитивный и эмоциональный аспект восприятия боли хорошо понимают мучители и пользуются этим знанием самым ужасающим и бесчеловечным образом, усиливая страх и боль, чтобы их жертвы чувствовали себя как можно более беспомощными. Поскольку они знают, что ожидание боли значительно увеличивает ее воздействие, они часто заставляют будущих жертв наблюдать пытки других, что усиливает концентрацию их внимания на ожидаемой боли. Кроме того, мучители понимают, что испытываемая боль возрастает при ощущении угрозы. Это достигается унижением жертвы (раздевание, сексуальное насилие, доведение до истерики) и нерегулярной и непредсказуемой сменой сна, пробуждения, кормления и пыток.К счастью, ту же цепь эмоционального и когнитивного контроля, которую так успешно задействуют мучители для усиления боли, можно использовать и для облегчения боли, особенно хронической. Практики, основанные на самосознании – медитация, йога, тайчи, метод Фельденкрайза, – как показывают исследования, способны умерять как хроническую, так и острую боль. Хотя некоторые из этих исследований довольно низкого качества, проводились без должного контроля и привлекали недостаточное для строгого статистического анализа количество участников, некоторые крупные, рандомизированные, хорошо проведенные исследования также свидетельствуют об эффективности этих техник для облегчения некоторых форм хронической боли.
Как основанные на самосознании тренировки помогут умерить боль? Рассмотрим это на примере медитации, которая описана в специальной литературе, посвященной восприятию боли и стоящим за этим биологическим процессам. Один из принятых способов облегчения боли – научиться частично контролировать подсознательные, вызванные болью реакции типа «бей или беги», что поможет умерить тревожность и ощущение угрозы и снизит неприятные ощущения. Так будет разорвана одна из цепей положительной обратной связи, которая поддерживает хроническую боль. Еще один способ – научиться открываться боли. Вместо того чтобы избегать болевого опыта или отвергать его, со временем человек может приучить себя к тому, что постоянная боль – не угроза, и это поможет на нее не реагировать, тем самым снижая неприятные ощущения от боли. И действительно, недавние исследования группы Ричарда Дэвидсона из Университета Висконсина в Мэдисоне показали, что буддистские специалисты по медитации (более 10 тысяч часов практики), занимающиеся «открытой медитацией», под воздействием нагрева лазером отмечали ту же интенсивность боли, что и новички, но гораздо менее неприятные ощущения.
При картографировании мозга выяснилось, что эксперты в медитации демонстрировали пониженную базовую активность, но повышенную вызванную болью начальную активность центральной доли и передней поясной коры, которая затем приглушалась постоянной стимуляцией. Авторы предполагают, что медитативные тренировки развития открытости к боли умеряют эффект ожидания боли и привлекают дополнительные ресурсы, которые способствуют ее затуханию и привыканию к ней. Это привыкание снижает восприятие угрозы, относительную тревожность и не дает возникнуть соответствующим реакциям типа «бей или беги».
Другая форма медитации – это дзен. Вместо того чтобы открываться навстречу опыту, в дзене ищут иную форму саморегуляции. Цель здесь – не достичь привыкания, а отделиться от боли, сводя к минимуму оценочные процессы высшего порядка. Когда группа Пьера Рейнвилля из Монреальского университета изучала реакцию опытных мастеров дзен-медитации на болезненные температурные раздражители, результаты оказались близки к тем, что получила группа Дэвидсона: участники-эксперты отмечали пониженные неприятные ощущения от боли и повышенную активность центральной доли и передней поясной коры по сравнению с теми, кто медитацией не занимался. Однако было продемонстрировано и снижение активности в префронтальной коре, и этот эффект был тем более выражен, чем ниже участник эксперимента оценивал боль по шкале неприятных ощущений. Одна из интерпретаций таких результатов состоит в том, что специалисты по дзен-медитации не привыкают не видеть угрозы в постоянной боли (что, возможно, требовало бы участия префронтальной коры), а просто решают ее игнорировать. Таким образом, для снижения боли, видимо, существует несколько различных когнитивно-эмоциональных стратегий.
Боль и отрицательные эмоции тесно связаны друг с другом. В повседневной речи мы говорим о том, как «больно» быть отвергнутым семьей, друзьями, даже незнакомцами, а неудача в любви нам «разбивает сердце». Как вы помните, это не первый наш экскурс в область тактильных метафор. Мы говорили о том, что осязание по природе своей эмоционально (чувства!), и о том, насколько взаимосвязаны физическая теплота и теплота отношений. В случае с прохладной мятой и жгучим чили мы даже наблюдали, как эта метафора закодирована в сенсорных молекулах TRPM8 и TRPV1.
Мы знаем, что восприятие боли обладает анатомически отчетливым эмоциональным компонентом, который может искажаться из-за повреждений центральной доли или передней поясной доли. Но какова на самом деле связь между физической и эмоциональной болью? Выявлено несколько интересных корреляций. Исследования показывают, что те люди, чувства которых легко задеть, особенно отвергнутые социумом, чаще ставят боли более высокие оценки по шкале неприятных ощущений на лабораторном тестировании. Но даже у людей, чувства которых задеть не так легко, неурядицы в отношениях с обществом способны усилить неприятные ощущения от физической боли. Как ни странно, анальгетики – даже такие мягкие, как ацетаминофен (тайленол), – способны унять и эмоциональную боль. Впрочем, вероятно, наиболее убедительно другое открытие: отверженность обществом и физическая боль активируют перекрывающиеся зоны эмоциональной болевой цепи в головном мозге: например, когда человека не приглашают поиграть в какую-нибудь пустяковую компьютерную игру, даже эта легкая форма общественного остракизма вызывает активацию задней части передней поясной коры и передней части центральной доли. В другом исследовании анализировалась значительно более серьезная форма отверженности обществом: когда люди, которых недавно бросили возлюбленные, смотрели на фотографии бывших партнеров, задействованы были не только эмоциональные болевые центры, но и вторичная соматосенсорная кора, отвечающая за смыслоразличительные аспекты боли.
Снова напомним, что повседневная речь отражает неврологические процессы. Близость эмоциональной и физической боли характерна не только для эмоционального или поэтического языка. Эта метафора вполне реальна, она закодирована в цепи эмоциональной боли головного мозга. Быть отверженными обществом больно.
Назад: Глава 5 Жгучие перцы чили, прохладная мята и летучие мыши-вампиры
Дальше: Глава 7 Когда зудит и свербит

