Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 65 Микобактериозы
Дальше: Глава 67 Патогенные микоплазмы
Глава 66
Риккетсии, ориенции, коксиеллы, эрлихии, бартонеллы, хламидии и вызываемые ими болезни
Общая характеристика риккетсий, ориенций, коксиелл, эрлихий, бартонелл и хламидий
В соответствии с новой классификацией роды Rickettsia, Coxiella, Ehrlichia и Orientia, ранее относимые к одному порядку Rickettsiales, теперь отнесены к типу Proteobacteria, но к разным классам. Роды Rickettsia и Orientia, а также Erlichia и Bartonella отнесены к классу Alphaproteobacteria, а род Coxiella – к классу Gammaproteobacteria. Однако представители перечисленных родов имеют много сходных свойств. Все они адаптированы к существованию в организме членистоногих и способны вызывать заболевания у соответствующих хозяев, включая человека. Большинство из этих микроорганизмов не растут на обычных питательных средах, имеют мелкие размеры, форму палочек, кокковидную, иногда нитевидную (см. цв. вкл., рис. 109). Жизненный цикл риккетсий зависит от жизнедеятельности клетки-хозяина и складывается из 2 стадий – вегетативной и покоящейся. Риккетсии, находящиеся в вегетативной стадии, имеют палочковидную форму, активно размножаются путем бинарного деления и обладают активной подвижностью, обусловленной, очевидно, жгутиковыми структурами. Риккетсии покоящейся стадии имеют сферическую форму и не размножаются. Риккетсии, эрлихии, бартонеллы и хламидии – прокариоты, у них имеется клеточная стенка и, как у всех грамотрицательных бактерий, наружная мембрана, цитоплазматическая мембрана, ядерный аппарат, не отграниченный от цитоплазмы никакими мембранами. Они обладают собственными системами биосинтеза белка и мобилизации энергии, однако их жизнедеятельность каким-то образом тесно связана с метаболизмом клетки-хозяина, они не способны размножаться вне ее. Поэтому для культивирования риккетсий прибегают либо к заражению животных (морские свинки, белые мыши), либо куриных эмбрионов (риккетсии хорошо размножаются в клетках стенки желточного мешка), либо культур клеток, в которых некоторые виды риккетсий образуют, как и вирусы, бляшки.
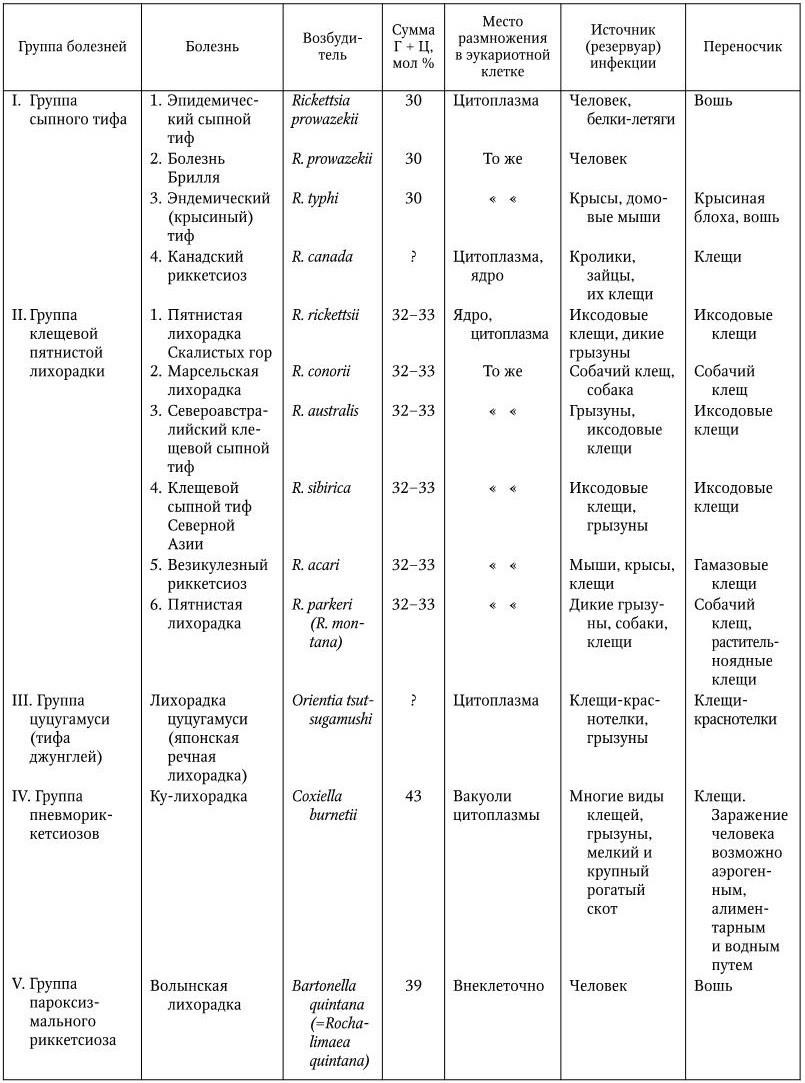
Заболевания, вызываемые риккетсиями, делят на следующие 3 группы: сыпного тифа, клещевой пятнистой лихорадки и тифа джунглей (табл. 50).
Группа сыпного тифа
К ней относятся: эпидемический сыпной тиф и эндемический (крысиный) сыпной тиф и соответственно два вида возбудителей: R. prowazekii и R. typhi. В эту же группу риккетсий включен еще один вид – R. canada, обнаруженный у клещей, паразитирующих на кроликах и зайцах. Серологическими методами были выявлены случаи заболевания людей, вызванные R. canada, клинически не отличимые от лихорадки Скалистых гор, но R. canada не имеет антигенного родства с риккетсиями группы пятнистой лихорадки. Характерной особенностью риккетсий этой группы является то, что они размножаются в цитоплазме эукариотных клеток (см. цв. вкл., рис. 109.4), но не в вакуолях (R. canada также и в ядре) и имеют антигенное родство между собой. Содержание Г + Ц в ДНК ≈ 30 мол %.
Сыпной тиф – острое инфекционное заболевание, характеризующееся глубокой интоксикацией, характерным поражением прекапиллярных разветвлений артерий и сыпью. Возбудитель – R. prowazekii – палочки размером от 0,3 – 0,6 до 0,8 – 2,0 мкм, иногда до 4,0 мкм, располагающиеся одиночно или короткими цепочками. Хорошо размножаются в желточном мешке куриного эмбриона, оптимальная температура для их размножения 35 °C. Эмбрион погибает через 6 – 13 дней после заражения (в зависимости от величины заражающей дозы). Хороший рост наблюдается и в культурах клеток различных линий с образованием через 8 – 10 дней бляшек диаметром ≈ 1 мм. К возбудителю сыпного тифа очень чувствительны морские свинки, которые обычно используются для первичного выделения риккетсий. У свинок приблизительно через неделю появляется лихорадка и у самцов иногда наблюдается скротальный феномен (периорхит – воспаление оболочек яичек). Иногда у морских свинок риккетсиозная инфекция протекает бессимптомно. Риккетсии выделяются из крови, селезенки, надпочечников, почек, но особенно много их в мозге.
Антигенное строение. Возбудитель сыпного тифа имеет термостабильный групповой антиген, общий с антигенами R. typhi и R. canada, и термолабильный видоспецифический антиген, располагающийся в поверхностных структурах возбудителя. Штаммы R. prowazekii, выделенные из разных источников, по антигенной структуре существенно не отличаются друг от друга.
Таблица 50
Заболевания, вызываемые риккетсиями, ориенциями, коксиеллами и бартонеллами
Резистентность. Как и другие представители этого рода, риккетсии сыпного тифа быстро погибают во внешней среде, при повышенной температуре (при 80 °C через 1 мин), под влиянием различных химических дезинфектантов, но они остаются жизнеспособными в течение 2 – 3 мес. в высохших испражнениях вшей при низкой температуре.
Факторы патогенности. Патогенность риккетсий связана с наличием у них пока не идентифицированных факторов адгезии и инвазии, с помощью которых они вначале прикрепляются к клеткам, а затем внедряются в них и размножаются. У риккетсий, как у всех грамотрицательных бактерий, имеется эндотоксин (ЛПС). Кроме того, у них обнаружен в капсулоподобном слое, покрывающем клетки, особый токсический термолабильный белок с м. м. 100 кД. Внутривенное введение взвеси риккетсий белым мышам вызывает их гибель через 4 – 24 ч от острой интоксикации. При интраназальном заражении риккетсиями белых мышей у них развивается смертельная пневмония.
Особенности эпидемиологии. Основным источником эпидемического (вшивого, европейского) сыпного тифа является человек. У него возбудитель находится в крови. Это было установлено опытом самозаражения в 1876 г. О. О. Мочутковским, а Г. Н. Минх еще в 1874 г. высказал предположение, что заражение сыпным и возвратным тифом происходит через укусы вшей и блох. Однако только в 1910 г. Ш. Николь окончательно доказал, что возбудитель сыпного тифа передается от больного человека здоровому через укусы вшей – Pediculus corporis (= Pediculus humanus), причем эту роль выполняют в основном платяные вши. Головная и лобковая вши также могут инфицироваться риккетсиями, но они реже покидают своего хозяина и их роль в эпидемиологии сыпного тифа гораздо меньше. Эта особенность передачи возбудителя делает сыпной тиф способным к широкому распространению всюду, где имеется вшивость. Вошь заражается при сосании крови больного, проявляя при этом одинаково высокую чувствительность к возбудителю во всех фазах своего метаморфоза после яйца. При этом вошь легче всего заражается при повторном сосании крови больного, особенно при тяжелых формах болезни и в первую неделю ее. Во время сосания вошь прокалывает кожу хоботком и потребляет около 1 мг крови сразу. Но для того чтобы ее всосать, она освобождает кишечник – выделяет экскременты. Кровь переваривается, а риккетсии проникают в эпителиальные клетки кишечника и размножаются в них в огромном количестве, так что клетки разрушаются, а риккетсии выделяются с экскрементами. Лишь после этого, через 4 – 5 дней, вошь способна заразить здорового человека. У вшей риккетсии вызывают смертельный риккетсиоз, они погибают через 2 – 2,5 нед. У зараженных вшей риккетсии размножаются только в кишечнике, в слюнных железах их нет. Поэтому сам по себе укус не заразен, но слюна вшей вызывает в месте укуса раздражение, и человек, почесывая, втирает риккетсии в ранку, нанесенную вошью. Являясь однохозяинным паразитом, вошь обитает на белье человека, переходя на его кожу через каждые 5 ч для питания. Оптимальная температура для ее существования – 30 °C, поэтому, когда у зараженного ею человека температура тела повышается до 39 – 41 °C, вошь возбуждается, стремится покинуть хозяина и поселяется на белье другого человека. Таким образом, эпидемиологическая цепь при сыпном тифе такова: больной человек – вошь – здоровый человек. Ликвидация вшивости – главное условие ликвидации эпидемии сыпного тифа.
Патогенез и клиника. Восприимчивость к болезни близка к 100 %. Риккетсии попадают в кровь и разносятся по всему организму, избирательно поражая эндоте-
лиальные клетки прекапиллярных разветвлений артерий различных органов, что проявляется в виде деструктивно-пролиферативного эндопериваскулита. Формирование своеобразных тромбоваскулитов приводит к резкому расстройству периферического кровообращения и глубоким нарушениям тканей; особенно тяжелые последствия наблюдаются при поражении мозговой ткани (продолговатый мозг), а также эндотелия капилляров надпочечников, сердечной мышцы и кожи. К этим нарушениям присоединяется сильная интоксикация, обусловленная эндотоксином и, особенно, токсическим белком с м. м. 100 кД. Инкубационный период составляет в среднем 10 – 12 дней. После небольшого продромального периода болезнь начинается сразу с повышения температуры до 39 – 40 °C и сильной головной боли. Больной может впадать в состояние бреда, иногда развиваются явления менингоэнцефалита и психоза. На 4 – 6-й день на боковых поверхностях груди, на спине и сгибательных поверхностях рук появляется характерная розеолезно-петехиальная сыпь. Лихорадка держится 1,5 – 2 нед., затем температура быстро снижается до нормы. Выздоровление происходит медленно вследствие глубоких нарушений со стороны сердечнососудистой и нервной систем. Летальность в прошлом составляла 20 – 40 %, сейчас, благодаря антибиотикотерапии, не превышает 1 %.
Постинфекционный иммунитет длительный, стойкий, но нестерильный: возбудитель сохраняется в организме в течение длительного времени в виде покоящихся форм. У лиц, перенесших сыпной тиф, нередко наблюдаются его повторные случаи через 10 – 15 – 20 и более лет, которые рассматриваются не как следствие повторного заражения (хотя оно и возможно), а чаще как рецидив, наступающий, очевидно, в результате ослабления иммунитета. Такой повторный сыпной тиф протекает значительно легче, без осложнений, наблюдается в отсутствие источника заражения и вшивости. Повторный сыпной тиф (рецидив сыпного тифа) получил название болезни Брилля – Цинссера.
Лабораторная диагностика. Для диагностики сыпного тифа могут быть применены различные методы: заражение кровью больного животных (морские свинки, белые мыши), куриных эмбрионов или культур клеток, серологические реакции и аллергическая проба. Однако чаще всего используют три серологические реакции – агглютинации, РСК и РПГА. Еще в 1916 г. Э. Вейль и А. Феликс установили, что выделенный ими штамм Proteus vulgaris OX19 (без жгутиков) способен давать положительную реакцию агглютинации, начиная с 10 – 12-го дня болезни, почти у 100 % больных сыпным тифом. Это свойство обусловлено наличием у риккетсий и протея общих полисахаридных антигенов. Поэтому реакция Вейля – Феликса применялась длительное время для диагностики сыпного тифа. Сыворотка больных различными формами клещевой пятнистой лихорадки давала положительную реакцию агглютинации с P. vulgaris OX19 и OX2, а больных тифом джунглей – с OXK. Однако для серологической диагностики сыпного тифа и всех других риккетсиозов ныне используют исключительно риккетсиозные антигены соответствующих видов. Это сделало серологические реакции более специфическими и надежными. Реакция агглютинации при сыпном тифе становится положительной (1: 100) с 4 – 5-го дня болезни, антитела достигают максимального титра к 12 – 16-му дню и держатся на этом уровне до 30-го дня, но через 3 – 5 мес. после болезни они исчезают. Комплементсвязывающие антитела обнаруживаются с 5 – 6-го дня болезни, достигают максимального титра к 14 – 16-му дню. Титр их через 1 – 1,5 мес. начинает снижаться, но эти антитела сохраняются в организме переболевших многие годы. РСК при сыпном тифе строго специфична (даже в разведении 1: 5 имеет диагностическое значение). Поэтому с помощью РСК диагноз сыпного тифа можно с уверенностью ставить ретроспективно у всех переболевших. РПГА при сыпном тифе позволяет отличить активную форму болезни и ближайшую реконвалесценцию, при которых она бывает положительной в разведении 1: 1000 и более, от ранее перенесенного заболевания. Для диагностики сыпного тифа предложены также реакции иммунофлуоресценции, непрямого гемолиза и иммуноферментный метод в модификации «захват» антител класса IgM, а также внутрикожная аллергическая проба, выявляющая аллергическую чувствительность замедленного типа.
Лечение. Наиболее эффективны для лечения сыпного тифа антибиотики – тетрациклины, макролиды, левомицетин и др.
Профилактика. В межэпидемическом периоде риккетсии сохраняются только в организме людей, переболевших сыпным тифом. Они являются главным источником и резервуаром возбудителя сыпного тифа. Существует, по-видимому, единственный природный очаг сыпного тифа в юго-восточном регионе США. Резервуаром риккетсий здесь являются белки-летяги, а переносчиком – их вши. Человек заражается от белок-летяг при переходе их вшей на него. Однако этот очаг существенного значения в эпидемиологии сыпного тифа не имеет. Поскольку заражение людей сыпным тифом происходит через вшей, основным условием успешной борьбы с сыпным тифом является ликвидация вшивости.
Для специфической профилактики, необходимость в которой может возникнуть только по эпидемическим показаниям, предложены различные вакцины: живая сыпнотифозная вакцина из ослабленного штамма риккетсии Провачека Е, живая комбинированная вакцина из штамма Е и антигенов риккетсий, химическая сыпнотифозная вакцина из антигенов клеточной стенки риккетсий.
Эндемический (крысиный) сыпной тиф. Крысиный тиф – относительно легкая лихорадочная болезнь продолжительностью 9 – 15 дней, которая характеризуется головной болью и пятнистой сыпью. Впервые заболевание было описано в 1922 г. Ф. Хоуном, а возбудитель – R. typhi (R. mooseri) – был обнаружен в 1931 г. Р. Диером и независимо от него Х. Музером.
R. typhi по своим размерам и форме очень сходна с R. prowazekii, но обладает меньшим полиморфизмом. По антигенной структуре риккетсии тифа отличаются от риккетсий группы клещевой пятнистой лихорадки, но сходны с R. prowazekii благодаря наличию общего с последними термостабильного антигена. В то же время они имеют свой специфический термолабильный антиген, что позволяет легко дифференцировать их серологически. R. typhi хорошо размножаются в желточных мешках куриных эмбрионов, вызывая их гибель через 6 – 8 дней после заражения. В желточных мешках обнаруживается обильное накопление мелких палочковидных риккетсий. Для этого вида риккетсий вообще характерно чрезвычайно интенсивное размножение их в цитоплазме поражаемых клеток мезотелия грызунов в виде кокковидных или мелких палочковидных форм. Они образуют огромные скопления, почти целиком замещающие цитоплазму разрушенных клеток, такие клетки получили название музеровских.
Подобно возбудителю сыпного тифа, патогенность риккетсии крысиного тифа связана с наличием у нее эндотоксина и своеобразного токсического поверхностного белка. Морские свинки проявляют к R. typhi примерно такую же восприимчивость, как и к риккетсиям сыпного тифа. Лихорадка у свинок появляется через 3 – 7 дней, кривая ее течения часто имеет седловидный характер. Наиболее характерным признаком для экспериментальной инфекции является скротальный феномен. Он воспроизводится только при внутрибрюшинном заражении и обнаруживается уже с первого дня лихорадки. Риккетсии находятся в большом количестве в воспаленных оболочках яичек (в музеровских клетках или внеклеточно), в мозге, почках, крови.
Мыши также очень чувствительны к возбудителю крысиного тифа как при парентеральном, так и при интраназальном заражении. Заражение через нос вызывает у них смертельную пневмонию с обильным накоплением риккетсий в легочной ткани.
Эпидемиология. Заболеваемость людей крысиным тифом связана с наличием эндемических очагов, которые распространены по всему свету, в основном в портовых городах теплых морей. Резервуаром возбудителя являются крысы и другие грызуны, главными переносчиками его – крысиная блоха (Xenopsylla cheopis) и крысиная вошь (Polyplax spinulosus). Крысиная блоха высокочувствительна к R. typhi, хотя инфекция у нее протекает скрытно; она выделяет риккетсии с экскрементами в большом количестве. Заражение человека происходит через укусы крысиной блохи так же, как при сыпном тифе. Блоха и вошь человека тоже высокочувствительны к R. typhi и могут выполнять роль его переносчика от человека к человеку. Заражение человека крысиным тифом возможно также алиментарным путем при употреблении продуктов, загрязненных мочой инфицированных грызунов. Допускается возможность распространения крысиного тифа среди грызунов и людей через укусы крысиного клеща.
Клиника крысиного тифа у человека в общем сходна с таковой при эпидемическом сыпном тифе, но отличается более доброкачественным течением, хотя наблюдались случаи тяжелых форм болезни. Инкубационный период обычно равен 8 – 12 дням. Болезнь, как правило, протекает благоприятно: осложнения, рецидивы и смертность практически отсутствуют.
Постинфекционный иммунитет стойкий, длительный, обусловлен антимикробными антителами и антителами, нейтрализующими токсический белок риккетсий. За счет общего с R. prowazekii антигена возникает перекрестный иммунитет между крысиным и сыпным тифом.
Для лечения крысиного тифа используют те же антибиотики, как и при лечении сыпного тифа.
Лабораторная диагностика. В связи с большим сходством клинической картины крысиного тифа с легкими формами сыпного тифа, основную роль в диагностике этого, как и других риккетсиозов, играют серологические реакции (агглютинации, РСК, РПГА, ИФМ и др.) с применением специфических антигенов риккетсий крысиного тифа.
Профилактика. Для специфической профилактики могут быть использованы вакцины из риккетсий крысиного тифа (убитая вакцина из риккетсий Провачека для этой цели не пригодна), но они применяются лишь по эпидемическим показаниям. Общие меры профилактики этого риккетсиоза сводятся к уничтожению крыс и мышей, охране пищевых продуктов от загрязнения мочой крыс, а также к предупреждению завоза крыс в портовые города прибывающими судами.
Недавно описан риккетсиоз у людей, вызываемый R. felis и протекающий очень сходно с сыпным тифом. Заражение происходит через укусы кошачьей блохи.
Группа клещевой пятнистой лихорадки
Сюда относятся шесть риккетсиозов, возбудителями которых являются разные виды риккетсий. Они объединены в одну группу по следующим признакам: их резервуаром и переносчиками являются иксодовые и гамазовые клещи; риккетсии размножаются в цитоплазме и в кариоплазме (ядре) эукариотных клеток; между риккетсиями, вызывающими эти риккетсиозы, существует антигенное родство, а сыворотки больных и переболевших дают перекрестные серологические реакции и положительную реакцию агглютинации с P. vulgaris OX19 и OX2. Содержание Г + Ц в ДНК риккетсий составляет 32 – 33 мол %.
Пятнистая лихорадка Скалистых гор. Этот риккетсиоз представляет собой заболевание, эндемичное для Северной и Южной Америки, протекающее в виде острой лихорадки, без первичного аффекта, но с появлением сыпи и отличающееся большим разнообразием тяжести течения в различных эндемических очагах. Свое название эта болезнь получила в связи с тем, что была обнаружена в США в районе Скалистых гор. Однако этот риккетсиоз обнаружен почти во всех штатах США, в Канаде, Мексике, Бразилии, Колумбии и других странах Центральной и Южной Америки.
Возбудитель – R. rickettsii – был обнаружен в 1909 г. Г. Риккетсом. Он представляет собой короткие палочки диаметром 0,2 – 0,3 мкм и длиной 1,5 – 2,0 мкм, менее полиморфные, чем R. prowazekii, обычно располагающиеся одиночно. Содержание Г + Ц в ДНК составляет 32,5 мол %. R. rickettsii имеют антигены, общие с антигенами риккетсий группы клещевой пятнистой лихорадки, но не имеют антигенного родства с риккетсиями других видов. Кроме того, они обладают антигенами, родственными полисахаридным антигенам P. vulgaris OX19 и OX2. Помимо указанных групповых антигенов, у риккетсий этого вида имеется и видоспецифический антиген, который позволяет дифференцировать их от всех других видов риккетсий.
Патогенность R. rickettsii связана с наличием у них, помимо эндотоксина, специфического термолабильного токсического белка. Однако штаммы R. rickettsii, выделяемые в разных географических районах Америки, сильно варьируют по своей вирулентности для человека. Для культивирования R. rickettsii используют 4 – 5-дневные куриные эмбрионы. При достаточной заражающей дозе они убивают эмбрионы через 4 – 5 дней. Оптимальная температура для культивирования 33,5 °C, после гибели эмбрионов их сохраняют еще в течение 24 ч при 32 °C. В желточном мешке эмбрионов риккетсий накапливается значительно больше, чем при заражении культур клеток. Размножение риккетсий вначале происходит в цитоплазме, а затем в ядре эукариотных клеток.
R. rickettsii менее устойчивы по сравнению с риккетсиями других видов. Их жизнеспособность выше в микроаэрофильных условиях или в присутствии восстановленного глютатиона или белка.
Морские свинки высокочувствительны к этому виду риккетсий, но вирулентность для них различных штаммов риккетсий сильно варьирует. Наиболее вирулентные штаммы вызывают у морских свинок лихорадку, скротальный феномен, кровоизлияния, некроз и смерть. Вирулентность риккетсий для человека не связана с вирулентностью их для свинок. Токсический белок риккетсий при внутривенном введении белым мышам вызывает их смерть от интоксикации.
Эпидемиология. Основным резервуаром возбудителя служат различные виды иксодовых клещей и их прокормители – дикие грызуны. Зараженные клещи являются основными хранителями риккетсий в природе, так как в их организме риккетсии сохраняются долгое время, и клещи передают их трансовариально своему потомству. В общей сложности круговорот риккетсий этого вида в разных очагах поддерживается примерно 14 видами клещей, из них 13 относятся к иксодовым: Dermacentor andersoni, D. variabilis, Ixodes dentatus и др., а один – к аргасовым (Argasidae). Питание клещей кровью на различных стадиях их развития, как правило, происходит с переменой хозяев: незрелые стадии нападают на мелких диких зверьков, а взрослые клещи – на крупных домашних животных. Человек заражается обычно через укусы взрослых инфицированных клещей на территории их природного обитания. В природных очагах пятнистой лихорадки циркулирует единый в антигенном отношении вид риккетсий, однако по степени вирулентности R. rickettsii подразделен на 4 типа: R, S, T и U, наиболее вирулентен тип R, наименее – U.
Клиника пятнистой лихорадки характеризуется большим разнообразием выраженности отдельных симптомов и различной тяжестью заболеваний. Инкубационный период в среднем 2 – 5 дней, но может варьировать от 3 до 14 дней. Болезнь начинается постепенно, иногда внезапно. Первичный аффект на месте укуса клеща отсутствует (в отличие от других клещевых риккетсиозов). Сыпь появляется на 2 – 4-й день болезни. Летальность варьировала от 5 – 10 до 80 % и выше. Применение антибиотиков для лечения существенно снизило летальность.
Постинфекционный иммунитет продолжительный и относительно стойкий. Поствакцинальный иммунитет сохраняется около года.
Лечение. Наиболее эффективны антибиотики: тетрациклины, хлорамфеникол, эритромицин и другие макролиды.
Лабораторная диагностика. Для выделения риккетсий прибегают к заражению кровью больного морских свинок (самцов), куриных эмбрионов или культур клеток. Однако основным методом диагностики пятнистой лихорадки является серологический. Применяют реакции агглютинации, РСК, РПГА, ИФМ и др. с использованием специфических риккетсиозных антигенов.
Профилактика пятнистой лихорадки Скалистых гор, как и других клещевых риккетсиозов, сводится к мерам личной защиты против нападения и присасывания клещей. Для создания искусственного иммунитета предложены различные вакцины, которые применяют по эпидемическим показаниям в эндемических очагах.
Марсельская лихорадка – одна из доброкачественных форм риккетсиозов из группы клещевых пятнистых лихорадок. Для нее характерно почти постоянное появление пятнистой сыпи на ладонях и подошвах и черных пятен, образующихся обычно на местах укуса клещей. Впервые эту болезнь описали А. Конор и А. Брух в 1910 г.
Возбудитель – R. conorii – был открыт в 1932 г. Дж. Каминопетросом и Е. Брумптом. Морфологически он сходен с R. rickettsii, но иногда наблюдаются нитевидные формы. Содержание Г + Ц в ДНК составляет 32,5 мол %. Характерной особенностью R. conorii является способность к внутриядерному размножению и более скудное размножение в цитоплазме клеток. Возбудитель хорошо размножается в культурах клеток, особенно почечного эпителия. При заражении куриных эмбрионов вызывает их гибель на 4 – 5-е сут. Иммунологически родствен R. rickettsii, R. sibirica и другим возбудителям клещевых пятнистых лихорадок, но серологически легко от них дифференцируется по видоспецифическому антигену. В организме больных индуцирует появление антител к антигенам Proteus vulgaris OX19 и OX2.
При внутрибрюшинном заражении морских свинок R. conorii вызывает у них лихорадку, которая у самцов осложняется скротальным феноменом, появляющимся с первых же дней лихорадки, но с различной степенью выраженности. Риккетсии в большом количестве обнаруживаются в клетках мезотелия влагалищной оболочки яичек.
Эпидемиология. R. conorii – первичный паразит собачьих клещей и собак. Марсельский риккетсиоз является эндемичным для стран, расположенных в бассейне Средиземного, Черного и Каспийского морей, а также для многих африканских стран. Эндемичность болезни связана с наличием в ее природных очагах спонтанно зараженных риккетсиями собачьих клещей Rhipicephalus sanguineus, которые одновременно являются и главными переносчиками возбудителя для человека. У клещей риккетсии вызывают бессимптомную длительную инфекцию и могут передаваться трансовариально. В организме клещей риккетсии обнаруживаются почти во всех тканях, а также в слюнных железах, поэтому заражение происходит и через укус, и при втирании коксальной жидкости. Поскольку основным прокормителем клещей R. sanguineus являются собаки, в эпидемиологии марсельской лихорадки особое значение имеет контакт человека с собаками (на юге Франции этот риккетсиоз называли «собачьей болезнью»). Однако естественными переносчиками R. conorii, помимо собачьего, могут быть и другие виды клещей, например R. simus, Hyalomma aegyptium, Haemaphysalis leachi и пр.
Клиника. Инкубационный период обычно составляет 5 – 7 дней, но может продолжаться до 18 дней. Заболевание начинается с озноба и повышения температуры, часто выше 40 °C. Через 3 – 4 дня после повышения температуры появляется макулопапулезная сыпь, которая быстро распространяется по всему телу, включая ладони, подошвы и лицо. Сыпь спустя некоторое время после снижения температуры исчезает, не оставляя следов, и не сопровождается шелушением. Весьма характерно для марсельской лихорадки появление к началу болезни маленькой язвы диаметром 2 – 5 мм на месте укуса клеща. Язва имеет черный некротический центр, окруженный темно-красной зоной различных размеров. Такой первичный аффект («черное пятно») может быть найден на любой части тела. Он всегда сопровождается увеличением регионарных лимфатических узлов. Общее состояние больного обычно удовлетворительное. Летальность не превышает 3 %.
Лабораторная диагностика. У больных марсельской лихорадкой возбудитель обнаруживается в течение всей болезни в крови, в язвенном поражении кожи («черном пятне») и в пятнах на коже. Для его обнаружения и выделения можно использовать заражение морских свинок, куриных эмбрионов и культур клеток. Возбудителя идентифицируют с помощью реакции нейтрализации риккетсий специфической антисывороткой. Наиболее простой, надежной и специфической является серологическая диагностика с помощью РСК. Для этих целей применяют специфические риккетсиозные антигены. РСК с антигеном из R. conorii всегда бывает положительной в более высоких титрах, чем с антигенами из риккетсий других видов этой группы.
Лечение. Наиболее эффективным является применение антибиотиков (тетрациклины, макролиды).
Профилактика. В эндемических регионах следует уничтожать бродячих собак и брать на учет всех дворовых и охотничьих собак, не реже двух раз в месяц подвергать их обработке для уничтожения клещей, проводить дезинфекцию дворов, где обитают собаки.
Клещевой сыпной тиф Северной Азии (сибирский риккетсиоз). Впервые описание этого заболевания было сделано в 1936 г. под названием «Клещевой лихорадки Приморья» (Е. М. Милль) и независимо – «Дальневосточной сыпной лихорадки» (Н. И. Антонов, А. Г. Найштат). Природа, эпидемиология, клиника и эндемические очаги североазиатского риккетсиоза были изучены в конце 30-х и в 40-х гг. ХХ в. многими отечественными учеными, в особенности П. Ф. Здродовским и М. К. Кронтовской. Эндемические очаги этого риккетсиоза охватывают Восточную, Центральную и Западную Сибирь до Урала; Забайкалье, Среднюю Азию, Армению, они имеются в Австрии, Чехии, Словакии, в Юго-Восточной Украине.
Возбудитель – R. sibirica – был открыт в 1938 г. П. Ф. Здродовским. Из всех видов риккетсий группы клещевой пятнистой лихорадки R. sibirica имеет наибольшее сходство с R. rickettsii, включая антигенное родство, однако они четко различаются с помощью серологических реакций, в частности РСК. Штаммы R. sibirica, выделенные в разных регионах, серологически однородны, но отличаются по степени своей патогенности. В частности, ряд штаммов, лишенных патогенности, был выделен на территории Австрии, Чехии, Словакии и в Юго-Восточной Украине. Их предложено объединить в новый вид – R. slovaca. R. sibirica хорошо размножаются в культурах клеток, особенно почечного эпителия. При заражении куриных эмбрионов вызывают их гибель на 4 – 5-й день, но размножение в желточном мешке относительно скудно. Морские свинки при внутрибрюшинном заражении отвечают развитием лихорадки и скротальным феноменом, который в хорошо выраженном случае сопровождается гиперемией и отеком мошонки. В клетках мезотелия влагалищной оболочки яичек свинки риккетсии обнаруживаются как внутри цитоплазмы, так и внутри ядра, но в умеренном количестве. Заражение свинок всегда разрешается их полным выздоровлением, а переболевшие свинки проявляют иммунитет не только к R. sibirica, но и к R. conorii и R. rickettsii.
Эпидемиология. Природные очаги этого риккетсиоза связаны с различными видами естественно инфицированных иксодовых клещей и их прокормителями: грызунами (для клещей, личинок и нимф), домашними и крупными дикими животными (для взрослых клещей). По крайней мере 9 видов иксодовых клещей являются носителями R. sibirica, и у большинства из них происходит трансовариальная передача возбудителя: Dermacentor nuttalli, D. marginatus, D. pictus, D. silvarum, Haemaphysalis punctata, H. concinna, Rhipicephalus sanguineus. Таким образом, спонтанно заражающиеся клещи, благодаря тому, что риккетсии у них сохраняются в период зимовки и передаются трансовариально, образуют резервуар возбудителя в природных очагах, а заражающиеся от них животные превращаются в его дополнительный резервуар.
Клещевой тиф сам по себе не контагиозен, он всегда связан с укусами инфицированных клещей. Это и определяет две основные особенности эпидемиологии риккетсиоза: обязательную связь заболеваемости людей с природными очагами и их сезонность, которая соответствует периоду активности взрослых клещей (апрель – октябрь). Заболевает преимущественно сельское население.
Клиника. Североазиатский риккетсиоз представляет собой доброкачественное острое лихорадочное заболевание с наличием первичного аффекта и макулопапулезной сыпи. Инкубационный период – от 2 до 7 дней, чаще равен 3 – 6 дням. Болезнь начинается с продромальных явлений (общее недомогание, познабливание), иногда внезапно, с повышением температуры за 3 – 4 дня до 40 °C и выше. Лихорадка держится 8 – 10 дней. Первичный аффект в месте укуса клеща наблюдается постоянно в виде небольшого плотного инфильтрата, который покрыт коричневой корочкой и окружен красноватой зоной. Регионарный лимфатический узел увеличен иногда до размера голубиного яйца. Сыпь розеолезно-папулезного характера с геморрагическими превращениями появляется обычно на 4 – 5-й день болезни, иногда покрывает все туловище и конечности, иногда менее обильна, часто она оставляет пигментацию. Выраженность симптомов варьирует, поэтому различают легкие, средние и тяжелые формы болезни.
Лабораторная диагностика. У больного человека возбудитель обнаруживается в крови. Для его выделения можно заражать морских свинок, куриные эмбрионы или культуру клеток, с последующей идентификацией в реакциях нейтрализации с использованием специфических антисывороток. Однако, как и при других риккетсиозах, наиболее приемлемыми являются серологические реакции (РСК, РПГА, агглютинации) с использованием специфических риккетсиозных антигенов. Титр комплементсвязывающих антител невысокий (1: 20 – 1: 160); РСК, как правило, положительна с 11-го дня болезни; она может быть использована и для ретроспективного диагноза североазиатского риккетсиоза. Положительная РПГА (титр 1: 200 и более) обнаруживается со 2-й нед. болезни и является показателем только свежего заболевания.
Лечение. Эффективно применение антибиотиков (тетрациклины, макролиды, левомицетин).
Профилактика: применение средств индивидуальной защиты от нападения клещей и уничтожение клещей во внешней среде. Специфическая профилактика не разработана.
Везикулезный риккетсиоз – доброкачественное заболевание, характеризующееся наличием первичного аффекта и своеобразной папулезно-везикулезной сыпи. Впервые оно было описано в 1946 г. Л. Суссманом и независимо от него рядом других авторов. Р. Хюбнер, П. Штампс и С. Армстронг предложили назвать эту болезнь (из-за сходства ее с ветряной оспой) риккетсиозной оспой. Аналогичное заболевание под названием везикулезный риккетсиоз было выявлено на юге Украины и подробно изучено в 1948 – 1950 гг. И. Р. Дробинским, С. М. Кулагиным и В. М. Ждановым.
Возбудитель риккетсиозной оспы – R. acari – был обнаружен в 1946 г. Р. Хюбнером, В. Джеллисоном и С. Армстронгом. Штаммы риккетсий, выделенные в 1950 г. В. М. Ждановым и С. М. Кулагиным из крови больных везикулезным риккетсиозом, получили название Dermacentroxenus murinus. Впоследствии оказалось, что риккетсиозная оспа и везикулезный риккетсиоз и соответственно их возбудители по всем своим проявлениям и свойствам тождественны, поэтому болезнь получила название везикулезного риккетсиоза, а возбудитель сохранил название R. acari. По морфологическим, тинкториальным и биологическим свойствам R. acari ничем не отличается от риккетсий других видов. По антигенной структуре очень близка к R. conorii и R. sibirica, но не имеет антигенного родства с R. prowazekii, R. typhi, Coxiella burnetii. Содержание Г + Ц в ДНК около 32,5 мол %. R. acari трудно культивируется в желточном мешке куриного эмбриона, но хорошо размножается в культурах клеток некоторых линий. Риккетсии располагаются преимущественно внутри ядер и менее интенсивно в цитоплазме.
Морские свинки легко восприимчивы к R. acari, заболевание у них проявляется в виде лихорадки длительностью 5 – 12 дней с одновременным скротальным феноменом у самцов. Инфекция у свинок протекает доброкачественно. Риккетсии обнаруживаются в крови, мозге и в мезотелии влагалищной оболочки яичек. К риккетсиям этого вида также высокочувствительны мыши. При интраназальном заражении у мышей развивается смертельная пневмония, при внутрибрюшинном – острого токсического эффекта не наблюдается, мыши погибают через 12 – 18 дней при явлениях перитонита с обильным слизистым или геморрагическим экссудатом.
Эпидемиология. Эндемические очаги везикулезного риккетсиоза связаны с циркуляцией возбудителя среди клещей-переносчиков и грызунов, на которых они паразитируют. Основным резервуаром риккетсий являются гамазовые клещи Allodermanyssus sanguineus, а также их прокормители – домовые мыши (Mus musculus) и крысы. У гамазовых клещей риккетсии сохраняются пожизненно и передаются трансовариально. Заражение человека происходит при нападении на него клещей (через укусы или при раздавливании). Очаги заболевания формируются в городах. На территории бывшего СССР природные очаги везикулезного риккетсиоза обнаружены в Молдавии, Прибалтийских странах, Белоруссии, Казахстане, на Украине и в приграничных с ней областях России.
Клиника. Инкубационный период длится 1 – 2 нед. Заболевание начинается с резкого повышения температуры до 39 – 40 °C. Лихорадка продолжается около недели, для нее характерны утренние ремиссии. Первичный аффект в месте укуса наблюдается постоянно (в виде уплотнения диаметром 1 – 2 см, в центре его – пузырек, затем некроз и образование черного струпа), сопровождается воспалением регионарного лимфатического узла. Первичный аффект появляется за 7 – 10 дней до лихорадки, а по заживлении нередко оставляет небольшой рубчик. Сыпь появляется на 2 – 3-й день болезни и характеризуется разнообразными проявлениями: пятна – папулы – везикулы – отпадающие корочки. Особенность высыпания, связанная с образованием пузырьков, дала основание для названия «везикулезный риккетсиоз». Общее течение болезни благоприятное, выздоровление наступает быстро, рецидивов не отмечено.
Лабораторная диагностика. Наиболее точным методом диагностики служит выделение возбудителя из крови больных. С этой целью заражают морских свинок и белых мышей. Характерным проявлением у мышей инфекции, вызванной R. acari, является своеобразный риккетсиозный перитонит. Для серологической диагностики используется РСК со специфическим риккетсиозным антигеном. Комплементсвязывающие антитела появляются с 6 – 10-го дня болезни у 53 % больных, с 11 – 15-го дня – более чем у 83 %, их титр в течение болезни нарастает, и они могут сохраняться длительное время. Сыворотки крови больных везикулезным риккетсиозом обычно показывают более высокий титр комплементсвязывающих антител, что используется для дифференциации этого риккетсиоза от других.
Лечение. Хороший терапевтический эффект дают тетрациклины, макролиды, левомицетин.
Профилактика должна быть направлена на истребление грызунов и паразитирующих на них гамазовых клещей. Специфическая профилактика не проводится.
Клещевой тиф Северного Квинсленда (Североавстралийский клещевой риккетсиоз). Заболевание было обнаружено в 1946 г. в Северном Квинсленде (Австралия). Протекает в виде доброкачественной лихорадки со средней продолжительностью около недели, сопровождается образованием первичного аффекта в месте укуса клещей, регионарным лимфаденитом и различной по характеру сыпью.
Возбудитель (R. australis) очень похож на R. conorii, но не вызывает острого токсикоза у мышей. Может быть дифференцирован от риккетсий других видов, в том числе от R. rickettsii, R. acari и R. conorii, серологически. Размножается в ядре и цитоплазме эукариотных клеток. У морских свинок при внутрибрюшинном заражении вызывает лихорадку и скротальный феномен. Заражение человека происходит через укусы иксодовых клещей (Ixodes holocylus), паразитирующих на диких зверьках.
К группе клещевой пятнистой лихорадки относится также риккетсиоз доброкачественной формы, вызываемый R. parkeri (R. montana), выделенной из клещей Amblyomma maculatum. R. parkeri могут быть дифференцированы от других риккетсий серологически.
Группа цуцугамуси
Лихорадка цуцугамуси (тиф джунглей, японская речная лихорадка, кустарниковый тиф; тиф, передающийся клещами; сельский тиф) – заболевание, протекающее в виде острой лихорадки, сопровождающейся появлением первичного аффекта и макулопапулезной сыпи. Болезнь известна с древних времен под разными названиями, ее связывали с укусами клещей.
Впервые была описана в Японии в 1810 г. К. Хасимото, который использовал ее народное название цуцугамуси (клещевая болезнь). Заболевание распространено на огромной территории, включающей Японию, Корею, Китай, Тайвань, Вьетнам, Малайзию, Бирму, Индию, Шри-Ланку, Пакистан, Австралию, Сибирь, Дальний Восток России и другие регионы.
Возбудитель болезни – Orientia tsutsugamushi (O. tsutsugamushi) – был обнаружен в 1920 г. Н. Хаяши [и др.] и описан в 1930 г. М. Нагайо [и др.]. Риккетсии имеют форму коротких палочек длиной 1,2 мкм (редко превышают 1,5 мкм), часто форму диплобацилл. По методу Романовского – Гимзы окрашиваются в интенсивный пурпурно-голубой цвет. Другие методы, используемые для окрашивания риккетсий, мало пригодны. Риккетсии хорошо размножаются в желточном мешке куриных эмбрионов при температуре 34 °C и в культурах клеток различных линий, таких как лимфобласты и фибробласты, в эпителиальных клетках почек обезьян и т. п. Размножение происходит предпочтительно в околоядерной области клетки-хозяина, где они скапливаются в большом количестве, но никогда не размножаются в ядре. Находясь во внеклеточном окружении, более термолабильны, чем другие риккетсии: при 37 °C жизнеспособность сильно падает через 2 – 3 ч. В отношении антигенной структуры более разнородны по сравнению с другими риккетсиями. Помимо видоспецифического антигена, у O. tsutsugamushi обнаружено не менее 3 типоспецифических. Инфекция вызывает слабый иммунный ответ к видоспецифическому антигену и более сильный – к типоспецифическим антигенам. У риккетсий цуцугамуси патогенность связана, кроме эндотоксина, также с особым токсическим белком, свойства которого сходны со свойствами аналогичных токсических белков других риккетсий: он способен убивать мышей за несколько часов. Антитела против этого токсина очень специфичны, они отличаются от антитоксинов эпидемического и крысиного сыпного тифа и отсутствуют в сыворотках животных, переболевших инфекциями, вызванными иными штаммами этого вида, даже если в этих сыворотках имеются другие антитела против гомологичных риккетсий.
Белые мыши высокочувствительны к O. tsutsugamushi и поэтому широко используются для первичного выделения возбудителя. Однако штаммы риккетсий различного происхождения сильно различаются по вирулентности для мышей. Более вирулентные штаммы при внутрибрюшинном заражении вызывают смерть мышей через 7 – 14 дней, в увеличенной селезенке и в брюшной полости мышей обнаруживаются риккетсии. У морских свинок заражение риккетсиями не всегда вызывает заболевание и скротальный феномен не наблюдается.
Эпидемиология. Резервуаром возбудителя являются краснотелковые клещи – Trombicula akamushi, T. deliensis. Клещи заражаются в личиночной стадии при нападении на спонтанно болеющих животных (полевки, крысы и другие зверьки) или трансовариально. Для эпидемиологии имеет значение главным образом трансовариальная передача возбудителя у краснотелковых клещей, так как они лишь в стадии личинки и только однократно нуждаются в кровяном питании и нападают на человека и животных, заражая их. Следовательно, эпидемиология этого риккетсиоза определяется исключительно биологией краснотелковых клещей, которые и являются его главными распространителями в эндемических природных очагах.
Клиника. Инкубационный период составляет от 7 – 10 до 12 – 18 дней. Болезнь начинается с озноба и повышения температуры, которая на 3 – 4-й день достигает максимума и держится 2 – 3 нед. На месте укуса клеща образуется первичный аффект в виде язвы диаметром 0,3 – 2,0 см; он сопровождается регионарным лимфаденитом, однако возможно развитие распространенного лимфаденита. В конце 1-й нед. появляется макулезная или макулопапулезная сыпь различной выраженности. Нередко возникает гиперемия слизистой оболочки глаз. Общее течение болезни сильно варьирует в зависимости от степени вирулентности возбудителя в различных эндемических очагах. Возможны латентные формы инфекции с многомесячным (до 16 мес.) сохранением возбудителя. Летальность также сильно варьирует, например в Японии от 15 до 59 %, в зависимости от возраста больных.
Постинфекционный иммунитет связан с образованием антител, нейтрализующих токсин, и антимикробных антител. Сохраняется несколько лет, но только к гомологичному штамму, к гетерогенным – несколько месяцев.
Лабораторная диагностика. Самым надежным методом диагностики является выделение возбудителя от больного. С этой целью мышам внутрибрюшинно вводят 0,1 – 0,2 мл крови больного, взятой на высоте лихорадки. При наличии в ней возбудителя мыши погибают через 13 – 16 дней с явлениями характерного перитонита. Риккетсии обнаруживаются как в клетках брюшного экссудата, так и в соскобах с брюшины. Для выделения возбудителя можно воспользоваться также заражением 5 – 6-дневных куриных эмбрионов или культур клеток. Для серологической диагностики этого риккетсиоза применяют реакцию Вейля – Феликса с Proteus vulgaris ОХК, которая становится положительной на 2-й нед. заболевания. С диагностикумом ОХ19 и ОХ2 эта реакция у больных лихорадкой цуцугамуси отрицательная. Более надежной является РСК со специфическими антигенами, приготовленными из нескольких штаммов O. tsutsugamushi, поскольку эти риккетсии характеризуются антигенной неоднородностью. Перспективны и другие серологические реакции с хорошо очищенными риккетсиозными антигенами.
Лечение. Эффективными терапевтическими средствами являются антибиотики (тетрациклины, макролиды, левомицетин и др.).
Профилактика. Общая борьба с этим риккетсиозом сводится к ликвидации условий для выплода краснотелковых клещей, которая достигается агротехническими мерами в местах их обитания и уничтожением зарослей диких кустарников, а также к мерам личной защиты от нападения личинок клещей.
Проблема специфической профилактики лихорадки цуцугамуси остается пока не разрешенной в связи с тем, что географические варианты возбудителя в антигенном отношении разнородны. Убитые вакцины оказались неэффективными. Перспективны методы изыскания живых вакцин из ослабленных (например, антибиотиками) вариантов возбудителя (антибиовакцина) или создание химических вакцин, содержащих наиболее иммуногенные и общие для разных штаммов этого вида риккетсий антигены. Получена вакцина из инактивированных гамма-облучением риккетсий (США).
Волынская лихорадка
Заболевание было известно давно, но особенно большое распространение получило во время Первой мировой войны, когда им болели тысячи солдат. Тогда оно и получило такие названия, как волынская, пятидневная и окопная (траншейная) лихорадка.
Волынская лихорадка – доброкачественное инфекционное заболевание, характеризующееся короткими лихорадочными приступами (пароксизмальная лихорадка), разнообразием клинической картины и болями различной локализации, чаще в голенях. Впервые описана Х. Вернером и Х. Гисом в 1916 г. Возбудитель был открыт в том же году К. Гепфером, который назвал его Rickettsia wolhynica (quintana). Впоследствии для него был установлен новый род риккетсий, получивший название Rochalimaea. В отличие от всех риккетсий Rochalimaea quintana размножается на поверхности эукариотных клеток и может расти на искусственных питательных средах; кроме того, содержание Г + Ц в его ДНК значительно выше, чем у рода Rickettsia, и составляет 39 мол %, поэтому недавно было предложено исключить его из семейства Rickettsiaceae и включить в род Bartonella семейства Bartonellaceae. Таким образом, возбудитель волынской лихорадки должен называться Bartonella quintana.
B. quintana – короткие палочки диаметром 0,2 – 0,5 мкм и длиной 1,0 – 1,6 мкм, имеют типичные для грамотрицательных бактерий клеточную стенку, цитоплазматическую мембрану, ядерный и рибосомальный аппарат. Жгутиков и капсул не имеют, спор не образуют. Растут на агаре, содержащем 6 % инактивированной лошадиной сыворотки и 4 % лизированных лошадиных эритроцитов; а также на жидкой среде, содержащей вместо гемоглобина сыворотку коровьего эмбриона.
Рост происходит лучше в аэробных условиях с увеличенным содержанием СO2. На плотной среде колонии диаметром 0,07 – 0,20 мм, круглые, линзовидные, полупрозрачные, мукоидные; появляются на 12 – 14-й день инкубации при температуре 37 °C при первичном посеве и через 3 – 5 дней при пересевах. Куриные эмбрионы и культуры клеток менее пригодны для их выращивания. Покоящиеся клетки активно потребляют сукцинат и глутамин, глюкозу не усваивают, обладают глутаматоксалацетат-трансаминазной активностью. Относительно устойчивы к высоким температурам: обработку сухим жаром при 80 °C выдерживают в течение 20 мин. В высохших испражнениях сохраняют жизнеспособность в течение нескольких месяцев.
В антигенном отношении однородны, перекрестного антигенного родства с видами родов Rickettsia и Proteus не обнаружено. Морские свинки и белые мыши к B. quintana не восприимчивы. Экспериментальную инфекцию удается воспроизвести только у обезьян (Macaca rhesus).
Эпидемиология. Основным источником инфекции является человек. Заражение, как и в случае эпидемического сыпного тифа, происходит только через вшей человека (Pediculus corporis). Бартонеллы размножаются в просвете кишечника вшей внеклеточно и выделяются с их испражнениями. Заражение происходит путем втирания бартонелл в ранку на коже, образующуюся при укусе вшей и расчесывании. У вшей инфекция протекает бессимптомно, трансовариальной передачи бартонелл не происходит. Эпидемическое распространение возможно только при наличии завшивленности, скученности населения, что наблюдалось во время войны.
Клиника. Инкубационный период от 9 до 13 дней. Начало болезни острое.
Лихорадка может иметь различную форму:
а) пароксизмальную, при которой лихорадочные приступы сменяются безлихорадочными периодами;
б) тифоидную – высокая температура в течение 2 – 6 нед.;
в) абортивную – кратковременное повышение температуры;
г) смешанную – температурная кривая имеет неопределенный характер.
Иногда заболевание протекает без повышения температуры и бессимптомно. Розеолезная сыпь появляется далеко не у всех больных. Течение болезни в большинстве случаев благоприятное.
Постинфекционный иммунитет изучен недостаточно. Существует мнение, что он либо отсутствует, либо выражен очень слабо и сохраняется только на период носительства, которое довольно непродолжительно.
Лабораторная диагностика. Для диагностики можно использовать метод выделения возбудителя из крови больного путем посева ее на специальные питательные среды. Более простым является серологический метод с использованием бартонеллезных антигенов в реакциях агглютинации, РСК и РПГА. Высказано предположение о том, что B. quintana могут иметь отношение к этиологии некоторых хронических заболеваний (бациллярный ангиоматоз, эндокардиты).
Лечение. Наиболее эффективны антибиотики: тетрациклины, макролиды, левомицетин.
Профилактика. Специфическая – не разработана. Основное средство борьбы – ликвидация вшивости.
Род Coxiella. Ку-лихорадка
Этот род риккетсий также представлен одним видом – Coxiella burnetii, который является возбудителем Ку-лихорадки. Заболевание впервые было выявлено в 1935 г. в Австралии Е. Дерриком, который назвал ее Ку-лихорадкой, отмечая неизвестную этиологию болезни (буква Q – «ку» является первой англ. слова query – вопрос, неясный).
Ку-лихорадка – острое риккетсиозное лихорадочное заболевание, которое часто протекает с явлениями интерстициальной пневмонии (пневмориккетсиоз) и отличается от других риккетсиозов отсутствием сыпи. Ку-лихорадка эндемична для Австралии, Новой Зеландии, многих стран Северной, Центральной и Южной Америки, Азии, Европы и Африки.
Возбудитель болезни открыт в 1937 г. Е. Дерриком, а отождествлен с риккетсиями Ф. Бернетом, в честь которого Е. Деррик и предложил в 1939 г. назвать его Rickettsia burnetii. Впоследствии, в силу ряда биологических особенностей возбудителя, он был выделен в самостоятельный род Coxiella.
Coxiella burnetii отличается от всех других риккетсий по следующим свойствам: содержание Г + Ц в ДНК составляет 43 мол %; риккетсии размножаются в фаголизосомах (вакуолях) эукариотных клеток; в покоящейся стадии образуют эндоспоры; могут иметь настолько малые размеры, что проходят через бактериальные фильтры. Обычно имеют форму палочек диаметром 0,2 – 0,4 мкм и длиной 0,4 – 1,0 мкм; изредка шаровидную 0,3 – 0,4 мкм (фильтрующиеся формы); иногда – диплобактерий 1,0 – 1,6 мкм длиной. Риккетсии не образуют жгутиков и капсул; клеточная структура такая же, как и у других риккетсий; обычно грамотрицательны, иногда могут быть грамположительны. Жизненный цикл складывается из двух стадий – вегетативной и покоящейся. Хорошо размножаются в желточном мешке куриных эмбрионов при температуре 35 °C и в культурах клеток различных типов (куриные фибробласты, мышиные клетки L и др.). Риккетсии, отделенные от клетки-хозяина, способны потреблять пируват, глутамат, некоторые метаболиты цикла лимонной кислоты, но не усваивают глюкозу. Однако разрушенные клетки риккетсий фосфорилируют глюкозу в глюкозо-6-фосфат и окисляют в 6-фосфо-глюконат, способны синтезировать серин, цитруллин, включать аминокислоты в белки, имеют рибосомы, словом, обладают собственными системами биосинтеза белка и мобилизации энергии, но являются, как почти и все риккетсии, строгими внутриклеточными паразитами. По сравнению с другими риккетсиями, проявляют большую устойчивость к физическим и химическим факторам, они даже более устойчивы, чем не образующие спор бактерии. При температуре 4 °C сохраняют жизнеспособность в высохших испражнениях клещей, в шерсти или в нехлорированной воде в течение года и более, в мясе – около месяца. В высохших моче и крови животных сохраняют вирулентность в течение ряда недель. В масле, при хранении в холодильнике, остаются жизнеспособными до 40 дней. Нагревание при температуре 70 – 90 °C инактивирует их неполностью. В зараженном молоке после длительной пастеризации при температуре 60 °C риккетсии погибают частично, а полная их гибель наступает только после кипячения молока через 10 мин. Разрушаются при обработке инфицированного желточного мешка 0,3 %-ным формальдегидом и 1 %-ным фенолом через 24 ч. Однако риккетсии очень чувствительны к действию жирорастворителей (спирт, эфир и др.) – 70-градусный спирт убивает их через 1 мин.
У R. burnetii обнаружена фазовая вариация, аналогичная вариации S→R у других бактерий, которая выявляется с помощью иммунологических тестов. Все свежевыделенные риккетсии обладают антигенной специфичностью I фазы. Повторные пассажи в желточном мешке (8 – 20) вызывают превращение в фазу II, а единичные пассажи через морскую свинку достаточны для возвращения в фазу I. Клетки фазы II, в противоположность фазе I, легко агглютинируются в солевом растворе или нормальной сывороткой и фагоцитируются в отсутствие специфических антител.
Антигены фазы I связаны с поверхностными углеводами, которые отмываются при обработке трихлоруксусной кислотой или другими реагентами. Антигены фазы II этими реагентами не удаляются, их химический состав не известен. Антигены фаз I и II различаются и по иммунологическим свойствам. Антигены фазы II хорошо обнаруживаются в РСК с сыворотками животных и человека, перенесших инфекции, особенно недавно.
Иммунизация клетками фазы II приводит к образованию антител к антигенам фазы II. Антигены фазы I обладают более сильной иммуногенностью и вызывают образование антител к антигенам фаз I и II, причем к последним антитела появляются раньше и сохраняются дольше, чем при воздействии антигеном фазы II. Это позволяет полагать, что антиген фазы I содержит скрытый антиген фазы II и обладает адъювантными свойствами. Предполагается, что фазовая вариация риккетсий определяется плазмидой, которая есть у риккетсий фазы I, но отсутствует у риккетсий фазы II. За исключением фазовой вариации, штаммы C. burnetii в антигенном отношении однородны и мало отличаются друг от друга, не имеют перекрестных антигенов с другими риккетсиями и Proteus vulgaris. Из лабораторных животных к C. burnetii наиболее восприимчивы морские свинки, которые и используются для первичного выделения риккетсий. Хотя штаммы значительно различаются по вирулентности для свинок, их смерть обычно наступает при заражении большими дозами. Меньшие дозы вызывают лихорадку и увеличение селезенки, из которой риккетсии могут быть выделены в большом количестве. Кролики, хомячки и мыши также высокочувствительны, но у мышей острой токсической смерти C. burnetii не вызывают.
Эпидемиология. Ку-лихорадка имеет ряд особенностей. Они заключаются в том, что, помимо природных очагов этого риккетсиоза, обусловленного наличием естественно зараженных возбудителем клещей и их прокормителей, формируются дополнительные очаги среди домашних животных (мелкий и крупный рогатый скот), от которых чаще всего и заражаются люди. Спонтанную зараженность риккетсиями Ф. Бернет обнаружил более чем у 40 видов иксодовых, аргасовых и гамазовых клещей. В организме зараженных клещей риккетсии сохраняются долгое время и передаются трансовариально. Клещи заражают животных через укусы и выделяют риккетсии в огромном количестве во внешнюю среду с испражнениями. В эндемичных районах риккетсиоз обнаруживается у многих видов диких животных, в частности у грызунов и птиц. Нападая на животных и заражая их, клещи создают дополнительный мощный резервуар возбудителя во многих странах мира. Зараженные животные выделяют возбудителя с молоком, носовой слизью, мочой, испражнениями, но особенно много – с плацентой и околоплодной жидкостью. Таким образом, с учетом высокой устойчивости риккетсий во внешней среде и особенностями риккетсиозов у животных, заражение человека Ку-лихорадкой возможно самыми различными способами: аэрогенным, алиментарным (молоко и мясо), водным (при питье и купании в воде, инфицированной мочой больных животных) и через укусы клещей, что бывает значительно реже. Резервуары риккетсий среди мелкого и крупного рогатого скота играют основную роль в эпидемиологии Ку-лихорадки.
Клиника. Инкубационный период длится в среднем 19 дней (варьирует от 10 до 26 дней). Первичный аффект и сыпь, как правило, отсутствуют. Наиболее характерный симптом болезни – лихорадка. За 2 – 3 дня температура повышается до 39 – 40 °C и держится на этом уровне 8 – 10 дней почти с ежедневными ремиссиями. Особенно характерны поражения легких в виде интерстициальной пневмонии, но она развивается лишь при аэрогенном заражении и распознается при помощи рентгенографии. Течение Ку-лихорадки чрезвычайно разнообразно, диагноз клинически поставить бывает иногда очень трудно. В эндемических очагах заболевание людей иногда протекает бессимптомно и выявляется только серологическими методами. Болезнь протекает доброкачественно, летальность незначительная.
Постинфекционный иммунитет прочный, длительный, опосредуется антимикробными антителами. Вместе с тем после перенесенного заболевания к возбудителю возникает гиперчувствительность замедленного типа.
Лабораторная диагностика. Клиническая диагностика Ку-лихорадки затруднена, поэтому решающее значение имеет микробиологическая. Используют 3 метода: выделение и идентификацию возбудителя, серологические реакции со специфическими риккетсиозными антигенами (РСК, РПГА, реакция агглютинации, ИФМ и др.) и аллергическую внутрикожную пробу.
Материалом для выделения возбудителя служит кровь, которой внутрибрюшинно заражают морских свинок. Для обнаружения в биологических субстратах животных и человека C. burnetii и их растворимых антигенов используют тест-системы на основе ИФМ и ЦПР. Серологические реакции (РПГА, РА, РСК) для выявления нарастания титра антител ставят с парными сыворотками.
Лечение проводят с применением антибиотиков (тетрациклины, макролиды и др.).
Профилактика. Общие меры профилактики в эндемических очагах Ку-лихорадки такие же, как и при бруцеллезе. Для специфической профилактики применяют (по эпидемическим показаниям) сухую живую вакцину из ослабленного штамма риккетсий Бернета М-44.
Эрлихиозы
Эрлихиозы – болезни, вызываемые эрлихиями, очевидно, существуют давно, но обнаружили их лишь недавно (проблема «старых» новых болезней). Первый случай эрлихиоза у человека был описан в США в 1987 г., в Европе – в 1991 г., а первые 4 случая в России (в Пермской области) – в 1999 г. Проведенными с тех пор исследованиями переносчиков возбудителя и определениями наличия антител к эрлихиям у людей было установлено, что трансмиссивные эрлихиозы распространены во многих странах мира.
В роде Ehrlichia известны 11 видов, в том числе не менее пяти патогенных для человека: E. chaffeensis, E. muris, E. microti, E. sennetsu; один вид, имеющий сходство с E. equi и E. phagocytophila, пока не получил собственного латинского названия и поэтому обозначается E. equi/phagocytophila.
Патогенные эрлихии локализуются у человека в цитоплазматических вакуолях лейкоцитов. Они вызывают два вида распространенных трансмиссивных заболеваний: моноцитарный эрлихиоз человека (МЭЧ) – возбудитель паразитирует в моноцитах; и гранулоцитарный эрлихиоз человека (ГЭЧ) – возбудитель паразитирует в нейтрофилах.
Возбудители МЭЧ – E. chaffeensis и E. muris, возбудители ГЭЧ – E. microti и E. equi/phagocytophila. Третье, менее распространенное заболевание – лихорадку Сеннетсу (инфекционный ангинозный мононуклеоз), – вызывает E. sennetsu (паразитирует в моноцитах). Это заболевание регистрируется в Японии и Малайзии. Путь заражения – алиментарный, источник заражения – рыба (сырая или недоваренная).
Морфологически разные виды эрлихий очень сходны: мелкие (0,5 – 1,5 мкм) полиморфные кокковидные или эллипсоидной формы грамотрицательные бактерии, неподвижны, спор и капсул не образуют. Культивирование удается пока в культурах клеток гистоцитомы собак и клеток линии HL-60 от больного лейкемией. Это обстоятельство затрудняет диагностику эрлихиозов.
Общие свойства эрлихий – высокая степень адаптации к организму членистоногих и выраженная природная очаговость вызываемых ими заболеваний, строго сопряженная с ареалами переносчиков и их прокормителей.
Переносчики возбудителей МЭЧ в США – клещи Amblyomma americanum, Dermacentor variabilis, Ixodes pacificus, a их прокормители – белохвостые олени, собаки, еноты, лошади. На значительной части Евразии E. muris переносят клещи Ixodes persulcatus, а их прокормители – мышевидные грызуны. Переносчики возбудителей ГЭЧ – клещи Ixodes scapularis, I. pacificus, I. ricinus, I. dammini; их прокормители – белохвостые олени, грызуны, лошади, собаки и жвачные.
Заражение трансмиссивными эрлихиозами происходит через укусы клещей, выделяющих возбудителя со слюной. Патогенез болезни определяется внутриклеточным способом паразитизма эрлихий. Размножаясь в цитоплазме моноцитов и нейтрофилов, они образуют колонии (скопления) в виде морулы (т. е. структуры типа тутовой ягоды). Размножение эрлихий приводит к гибели клеток и воспалительным процессам различного характера во внутренних органах, которые способствуют развитию оппортунистических грибковых и вирусных инфекций. Эрлихиозы у человека протекают по типу острых гриппоподобных лихорадок. Инкубационный период от 1 до 21 дня. Заболевание длится 2 – 3 нед., иногда затягивается до 6 нед. Клинические проявления болезни варьируют от бессимптомных и субклинических форм до тяжелых форм с летальным исходом (3 – 5 % при МЭЧ и 7 – 10 % при ГЭЧ). У больного развивается анемия, лейкопения, тромбоцитопения. Часто повышен уровень АсТ и АлТ (аспартатаминотрансферазы и аланинаминотрансферазы).
Лабораторная диагностика. Диагноз эрлихиозов может быть подтвержден микроскопически (электронно-микроскопически), серологически (непрямая РИФ, реже в иммуноблотинге со специфическими эрлихиозными антигенами) или методом ЦПР, а также прямым выделением возбудителя в культуре клеток.
Лечение МЭЧ и ГЭЧ идентично. Применяют тетрациклин или доксициклин в течение не менее чем 7 дней.
Бартонеллезы
Бартонеллы относятся к семейству Bartonellaceae, которое включает два рода – Bartonella и Grahamella. Подобно риккетсиям и эрлихиям, бартонеллы представляют собой компактную группу микроорганизмов. Они также являются внутриклеточными паразитами, вызывают трансмиссивные инфекции и адаптированы к организму членистоногих. Однако бартонеллы имеют существенное отличие от риккетсий и эрлихий: они способны расти на искусственных питательных средах.
Возбудители бартонеллезов относятся к роду Bartonella, который содержит кроме уже описанного в разделе «Волынская лихорадка» вида B. quintana еще 4 патогенных для человека вида: Bartonella henselae (острая форма – болезнь кошачьих царапин;
хроническая – бациллярный ангиоматоз, эндокардит); B. claridgeae (бациллярный ангиоматоз, доброкачественная лимфаденопатия); B. elizabethae (эндокардит) и B. bacilliformis – возбудитель наиболее тяжелого бартонеллеза – болезни Карриона.
Бартонеллезы, как и эрлихиозы, являются трансмиссивными болезнями; резервуарами их служат москиты, блохи, кошки, мелкие грызуны; а для B. quintana – платяная вошь и, возможно, чесоточные клещи.
Бартонеллы – мелкие грамотрицательные бактерии, паразитирующие в эритроцитах человека и других позвоночных. Их размеры – 0,2 – 0,5 × 0,3 – 3,0 мкм. При окраске препаратов по Романовскому – Гимзе в эритроцитах и на их поверхности имеют форму пурпурно-голубых тонких прямых или изогнутых палочек, располагающихся одиночно или группами. Характерный их признак – расположение в виде цепочек из нескольких сегментированных клеток с полярным утолщением и гранулами на одном или обоих концах. Наблюдаются также округлые или эллипсоидные клетки. Обладают одним полярно расположенным жгутиком или пучком их, но у тканевых форм жгутики не обнаружены. Бартонеллы – строгие аэробы, растут на жидких и полужидких средах с добавлением свежей кроличьей сыворотки и кроличьего гемоглобина или крови человека, лошади, кролика; на агаровых средах, содержащих кровь, сыворотку или плазму; на глюкозо-кровяном агаре с цистином. Оптимальная температура для роста 29 °C, хотя они хорошо растут и при 37 °C. Рост медленный, колонии появляются на 5 – 8-й день инкубации, мелкие, мукоидные, слегка прилипающие к агару. В жидких средах сначала образуются гранулы, а затем – хлопьевидная пленка на поверхности бульона. Культуры при температуре – 70 °C сохраняют жизнеспособность в течение 5 лет. Хорошо размножаются в культурах клеток, в желточном мешке и в хорион-аллантоисной жидкости куриных эмбрионов. Бартонеллы не ферментируют глюкозу, сахарозу и другие сахара. Антигенные связи между бартонеллами разных видов изучены мало.
Болезнь Карриона – острое тяжелое трансмиссивное заболевание. Его возбудитель – Bartonella bacilliformis – был обнаружен в 1905 г. перуанским врачом А. Бартоном, в честь которого эти бактерии и получили свое название.
Эпидемиология. Заболевание эндемичное, наблюдается в Перу, Колумбии, Эквадоре, Боливии. Крупнейшая эпидемия в 1870 г. была описана как лихорадка Оройа (недалеко от г. Оройа). В Южной Америке было описано другое заболевание, которое характеризовалось появлением бородавок (verruga peruana). Однако в 1885 г. Д. А. Каррион опытом самозаражения доказал, что лихорадка Оройа и verruga peruana представляют собой две формы одной и той же болезни – острую и хроническую. Заражение людей происходит через укусы москитов рода Lutzomyia, которые вместе с прокормителями (мелкими грызунами и, возможно, домашними животными) служат резервуаром возбудителя и передают его от больных и переболевших здоровым.
Клиника. Инкубационный период 15 – 40 (чаще 20) дней. Болезнь начинается с повышения температуры до 39 – 40 °C, которая держится несколько недель, затем медленно снижается. Характерны резкие головные боли, боли в костях, суставах, мышцах. Быстро появляется и прогрессирует анемия, число эритроцитов снижается до 1 – 2 млн/мл, понижается содержание гемоглобина. У больных бартонеллы обнаруживаются в эритроцитах, в клетках селезенки, костного мозга, печени, лимфатических узлов, в эндотелиальных клетках сосудов почти всех внутренних органов и кожи. У некоторых больных заболевание протекает только в виде такой лихорадки Оройа. Однако чаще после нескольких недель или месяцев бессимптомного периода появляются кожные высыпания (verruga peruana), которые могут проявляться в одной или нескольких формах (узелковой, милиарной и т. п.). Возбудитель обнаруживается в эндотелиальных клетках сосудов пораженных участков кожи. Эти области похожи на гнойные гранулемы. У некоторых людей болезнь протекает только в форме лихорадки Оройа с гемолитической анемией, в то время как у других – только в форме кожных высыпаний. Первая форма протекает более тяжело, летальность составляет 40 – 48 %. У детей обычно болезнь протекает легко. Наблюдаются атипичные и бессимптомные формы болезни.
Постинфекционный иммунитет прочный, длительный, антимикробный.
Лабораторная диагностика осуществляется путем:
а) бактериоскопии мазков крови, окрашенных по Романовскому – Гимзе;
б) выделения возбудителя (посев крови больного на плотные, полужидкие или жидкие питательные среды);
в) с помощью различных серологических реакций – агглютинации, РСК, РПГА и др. Реакция агглютинации имеет диагностическое значение в титре 1: 20.
Лечение. Эффективны антибиотики: пенициллин (он может индуцировать образование L-форм, так как нарушает синтез клеточной стенки бартонелл), тетрациклины, левомицетин, макролиды.
Профилактика. Специфическая профилактика не разработана, неспецифическая сводится к уничтожению москитов и защите от их нападения.
Хламидии и хламидиозы
Хламидии – уникальная группа мелких патогенных грамотрицательных неподвижных бактерий, являющихся возбудителями различных болезней человека и животных. В 1907 г. С. Провачек обнаружил возбудителя трахомы и назвал его «Chlamydozoa» в связи с тем, что образуемые им внутриклеточные микроколонии (тельца Гальберштедтера – Провачека) представляются окутанными мантией («хламидой»). Хламидии относятся к роду Chlamydia, семейству Chlamydiaсeae, классу Chlamydiaе. Их главная биологическая особенность заключается в том, что они размножаются только в цитоплазме эукариотных клеток по уникальному среди организмов циклу развития. В отличие от вирусов, хламидии содержат как ДНК (ядерный аппарат), так и рибосомы. Они имеют клеточную стенку, химический состав которой сходен с составом таковой у грамотрицательных бактерий, и размножаются путем поперечного деления. Вместе с тем, подобно вирусам и риккетсиям, хламидии – облигатные внутриклеточные паразиты, так как их метаболизм зависит от метаболизма клетки-хозяина. Эта зависимость проявляется в неспособности хламидий синтезировать свои собственные высокоэнергетические соединения, такие как АТФ, и отсутствии цитохромов, т. е. они являются «энергетическими паразитами» и потому не способны размножаться вне живой клетки. Основные стадии жизненного цикла хламидий следующие:
1) элементарные тельца – мелкие (0,2 – 0,5 мкм) электронно-плотные шаровидные структуры, имеющие компактный нуклеоид и ригидную трехслойную клеточную стенку;
2) инициальные (исходные), или ретикулярные, тельца – большие (0,8 – 1,5 мкм в диаметре) сферические образования, имеющие сетчатую структуру с тонкой клеточной стенкой и фибриллярным нуклеоидом;
3) промежуточные тельца – промежуточная стадия между элементарными и ретикулярными тельцами.
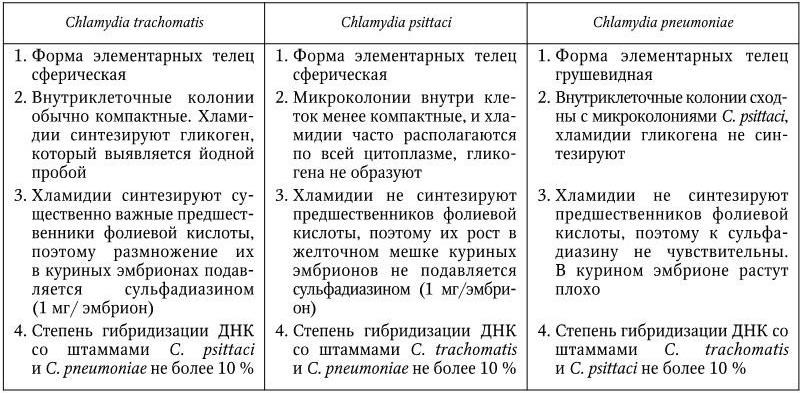
Элементарные тельца являются инфекционной, а ретикулярные – вегетативной формой хламидий. Вегетативные формы размножаются путем бинарного деления внутриклеточно, но не инфекционны, когда выделяются из клетки-хозяина. Жизненный цикл хламидий начинается с того, что элементарные тельца фагоцитируются клеткой-хозяином, а затем в течение нескольких часов реорганизуются, увеличиваются в размерах и превращаются в ретикулярные формы, которые размножаются путем поперечного деления. Образующиеся дочерние формы также размножаются путем бинарного деления. Жизненный цикл заканчивается, когда возникающие промежуточные формы реорганизуются (уплотняются), уменьшаются в размерах и превращаются в элементарные тельца. Размножаясь внутри цитоплазматических везикул, хламидии образуют микроколонии, окруженные мембраной, возникающей из впячивания мембраны клетки при фагоцитозе элементарного тельца. В составе микроколоний обнаруживаются все 3 стадии развития хламидий. В одной клетке может быть несколько микроколоний, образующихся в случае фагоцитоза нескольких элементарных телец. После разрыва стенки везикулы и мембраны клетки-хозяина вновь образовавшиеся хламидии высвобождаются, и элементарные тельца, инфицируя другие клетки, повторяют цикл развития. Для микроскопического обнаружения хламидий в инфицированных клетках (тканях) применяют различные способы окрашивания: Романовского – Гимзы, Кастенады, Маккиавелло и др. При окрашивании по Романовскому – Гимзе они приобретают голубой или фиолетовый цвет. Однако хламидии хорошо видны и в неокрашенном состоянии при микроскопии влажных препаратов под стеклом с помощью фазовоконтрастной оптической системы. В оптимальных условиях роста в эукариотных клетках жизненный цикл хламидий составляет 17 – 40 ч. Хламидии хорошо размножаются в желточном мешке куриных эмбрионов при температуре от 33 до 41 °C (в зависимости от вида), а также в культурах клеток различных позвоночных. Содержание Г+Ц в ДНК хламидий варьирует от 39 до 45 мол %, отношение РНК/ДНК в элементарных тельцах в 2 раза меньше, чем в ретикулярных. У C. trachomatis обнаружено два важных метаболических признака: способность синтезировать гликоген и предшественники фолиевой кислоты, по которым (с учетом других признаков) они легко дифференцируются от других видов – C. psittaci и C. pneumoniae (табл. 51).
Таблица 51
Дифференциальные признаки трех видов Chlamydia
Хламидии имеют сложное антигенное строение. Они содержат общий для рода термостабильный антиген, носителем которого является ЛПС клеточной стенки, и термолабильные видоспецифические и типоспецифические антигены белковой природы. Хламидии – строгие внутриклеточные паразиты позвоночных, но они обнаружены и в (или на) эктопаразитических членистоногих. Многие штаммы вызывают генерализованные инфекции у различных хозяев, некоторые – резко выраженные воспаления в одной или нескольких тканях или органах только определенных видов позвоночных. Штаммы хламидий обнаружены у птиц, млекопитающих (включая приматов) и людей. У людей они вызывают заболевания глаз, мочеполовой и дыхательной систем; у птиц – респираторные болезни и генерализованную инфекцию; у млекопитающих – заболевания дыхательных путей, суставов, плаценты и кишечные болезни. Некоторые штаммы хламидий патогенны и для человека, и для птиц. Описан еще один вид – С. pecorum, его патогенность для людей изучена мало.
Chlamydia trachomatis
Морфологические и основные биологические свойства этого вида хламидий соответствуют характеристике рода. Микроколонии формируются в результате продолжительного размножения в везикулах цитоплазмы, в которых они компактно уложены. Хламидии образуют гликоген, который выявляется окраской раствором Люголя после фиксации клеток в метаноле. Оптимальная температура для их размножения в желточном мешке куриных эмбрионов 35 °C. Размножение в куриных эмбрионах подавляется сульфадиазином (1 мг/эмбрион). Они хорошо размножаются также в культурах клеток, особенно тканей мышей. Многие штаммы размножаются в легких белых мышей и морских свинок при интраназальном заражении их, в коже морских свинок, а также в конъюнктиве приматов. Длительно сохраняются в зараженных желточных мешках при температуре –20 °C или ниже, но легко инактивируются нагреванием до 80 °C, 0,2 %-ным фенолом и другими химическими дезинфектантами. C. trachomatis имеют родовой, видовой и типоспецифические антигены. Предполагается наличие токсического компонента. По типоспецифическим антигенам их подразделяют на 15 серологических типов: A, B, Ba, C, D, E, F, G, H, I, J, K, L1, L2 и L3. Вызывают у человека трахому (A, B, Ba, C); конъюнктивит с включениями, или бленнорею с включениями у новорожденных (D, E, F, G, H, I, J, K); уретриты, цервициты, сальпингиты, фарингиты (B, C, D, E, F, G, H, I, K, L3); венерический лимфогранулематоз, или паховый лимфогранулематоз (L1, L2, L3). Урогенитальный хламидиоз, передающийся половым путем и характеризующийся поражением мочеполовых органов, наиболее широко распространен в мире. В передаче возбудителя большую роль играют женщины, у которых эта инфекция часто протекает бессимптомно. Возбудителями различных форм урогенитального хламидиоза являются 8 серотипов (D, E, F, G, H, J, I и K) C. trachomatis.
Трахома (греч. trachys – шероховатый) – хроническое специфическое заболевание глаз (кератоконъюнктивит), характеризующееся воспалительным утолщением конъюнктивы и последующим образованием рубцовой ткани. Хламидии размножаются в эпителиальных клетках конъюнктивы, образуя в них микроколонии. В основе патогенеза болезни лежит повреждение клеток, наступающее вследствие размножения в них хламидий.
Эпидемиология. Заражение происходит путем передачи возбудителя с больных глаз на здоровые прямым контактом (занос грязными руками) либо через загрязненные (в том числе мухами) предметы: посуда, полотенца, носовые платки и др. Основную роль в распространении трахомы играют социально-бытовые факторы, экономический и культурный уровень и санитарно-гигиенические условия жизни населения. Особое значение в передаче возбудителя имеет пользование общим полотенцем и общими постельными принадлежностями, умывание в общем тазу и т. п. Трахома – «болезнь семьи»: при заражении одного из членов семьи обычно заболевают и другие ее члены. Больше всего трахомой болеет население стран Азии, Африки и Южной Америки (более 400 млн человек). Она является одной из причин слепоты. В России трахома как массовое заболевание ликвидирована.
Клиника. Инкубационный период – 1 – 2 нед. Обычно поражаются оба глаза. В течении болезни различают четыре стадии: I – воспалительная инфильтрация ткани конъюнктивы, появление в ней полупрозрачных фолликулов и слизисто-гнойных выделений; II – нарастание воспалительных явлений и появление первых признаков рубцевания; III – преобладание рубцовых явлений над воспалительными; IV – завершение рубцевания конъюнктивы; фолликулов и инфильтрации ткани нет.
Без лечения болезнь может длиться многие годы. Нередко поражается роговая оболочка (паннус), в результате вторичной инфекции может быть гнойная язва роговицы. Последствия трахомы – завороты или вывороты век, трихиазм, слепота.
Постинфекционный иммунитет слабый, непрочный и непродолжительный. Для лечения трахомы используют антибиотики (тетрациклины, макролиды) и сульфамиды. Лечение урогенитальных хламидиозов должно быть комплексным (этиологическое, патогенетическое и симптоматическое). Применяют совместно антибиотики и амиксин по специальной схеме. Лечение респираторного хламидиоза (непрерывно рецидивирующие фарингиты и трахеобронхиты, при которых в мазках из зева в 30 – 40 % случаев обнаруживают C. trachomatis) также проводят по специальной схеме с использованием амиксина.
Профилактика трахомы сводится к комплексу мероприятий по своевременному выявлению и эффективному лечению больных, улучшению социально-бытовых и санитарно-гигиенических условий жизни населения.
Конъюнктивит новорожденных (бленнорея новорожденных с включениями) – заболевание, вызываемое C. trachomatis и характеризующееся воспалительной инфильтрацией конъюнктивы по преимуществу нижнего века и имеющее тенденцию к спонтанному выздоровлению. Передача инфекции от глаза к глазу чрезвычайно редка. Заражение детей происходит во время родов от матерей, у которых хламидии сохраняются (часто без каких-либо клинических проявлений) в эпителиальных клетках слизистой оболочки мочеполовой системы. Заболевание у детей проявляется в виде доброкачественного фолликулярного конъюнктивита и продолжается около года. Заражение взрослых возможно при купании в бассейнах, вода которых не хлорирована и заражена хламидиями. Инкубационный период длится 5 – 12 дней. Заболевание выражается утолщением конъюнктивы и ярко-красной окраской нижнего свода. Острая стадия болезни продолжается 10 – 15 дней, но инфильтрация может сохраняться 2 – 3 мес., иногда в течение года.
Лечение. Используют антибиотики (тетрациклины, макролиды) и сульфаниламидные препараты.
Венерический лимфогранулематоз (паховый лимфогранулематоз) – болезнь Никола – Фавра – заболевание, передающееся половым путем, характеризующееся разнообразными проявлениями, острыми и хроническими изменениями тканей в области паховых, бедренных или тазовых лимфатических узлов.
Развитие болезни складывается из следующих стадий: 1) заражение; 2) первичная стадия – поражение в области половых органов или прямой кишки; 3) вторичная стадия – поражение лимфатических узлов; 4) поздние осложнения, обусловленные фиброзными изменениями лимфатических узлов и окружающих их тканей. Период между заражением и появлением первичных поражений (папулы, пузырьки, эрозии) длится 10 – 25 дней, иногда дольше. Первичные поражения обычно быстро заживают без лечения.
Вторичный период наступает через 5 – 30 дней, он характеризуется поражением лимфатических (чаще паховых) узлов. В последующем болезнь прогрессирует: наступают третья и четвертая стадии. Болезнь продолжается от 2 – 3 мес. до нескольких лет. Образующиеся рубцы могут стать причиной нарушения лимфообращения в половых органах, промежности, области заднего прохода. Могут появляться папилломатозные разрастания, абсцессы, язвы и другие осложнения.
Лечение – антибиотики (тетрациклины, макролиды), сульфаниламиды.
Chlamydia psittaci
Морфологически и по механизму размножения подобна C. trachomatis. Структура внутриклеточных микроколоний отличается от таковой C. trachomatis тем, что окружающие их мембраны везикул разрушаются раньше и хламидии высвобождаются в цитоплазму клетки-хозяина на различных стадиях развития. Образования гликогена внутри микроколоний при этом не происходит. Хламидии пситтакоза хорошо размножаются в желточном мешке куриных эмбрионов, оптимальная температура для их размножения 39 °C. Размножение в эмбрионах не подавляется ни сульфадиазином (1 мг/эмбрион), ни стрептомицином, ни ванкомицином, ни канамицином в концентрации 1 мг/мл каждого из них. Эти антибиотики используют для подавления роста бактерий в культурах клеток. Хламидии хорошо размножаются в культурах клеток различных линий, особенно мышиных фибробластов, HeLa 229 и др., образуя бляшки. Они долго сохраняют жизнеспособность в гомогенатах желточных мешков при –20 °C и ниже, но инактивируются при 70 °C в течение 10 мин, а при обработке инфекционного материала 0,1 %-ным формалином или 0,5 %-ным фенолом – в течение 24 – 36 ч. 10 %-ный эфир при комнатной температуре убивает их через 30 мин. Содержание Г + Ц в ДНК около 41 мол %. C. psittaci имеет термостабильный родовой антиген с м. м. около 40 кД и типоспецифические термолабильные белковые антигены. Она также содержит токсический компонент: внутривенное введение содержащих его штаммов белым мышам вызывает гибель от интоксикации 50 % их в течение первых 16 ч. Серологическая классификация C. psittaci окончательно еще не разработана. Штаммы, выделяемые из разных источников, обладают перекрестным антигенным родством, но различаются по типоспецифическим антигенам. Хламидии пситтакоза являются паразитами клеток тканей позвоночных, они обнаружены у 170 видов диких и домашних птиц, многих домашних и диких млекопитающих. Обычно они вызывают инфекции у широкого круга хозяев, хотя некоторые штаммы поражают узкий их круг. При инфицировании Chlamydia psittaci развиваются пситтакоз, орнитоз; пневмония крупного рогатого скота, овец, коз, свиней, лошадей, кошек; полиартриты у овец, крупного рогатого скота и свиней; они поражают плаценту и вызывают аборты у крупного рогатого скота и овец; энтерит крупного рогатого скота и зайцев; широко распространенные субклинические кишечные инфекции у крупного рогатого скота и овец и другие болезни. У человека C. psittaci вызывает пситтакоз (орнитоз, болезнь попугаев).
Пситтакоз (орнитоз) (греч. psittakos – попугай) – острая инфекционная болезнь, встречающаяся в виде единичных, групповых заболеваний и эпидемических вспышек в результате заражения от птиц и протекающая с различной клинической картиной и тяжестью, нередко с явлениями атипичной (интерстициальной) пневмонии. Название болезни, возникающей при контакте с попугаями, предложил в 1895 г. А. Моранж. Однако в последующем было установлено, что заражение людей возможно также от птиц других групп. К 1942 г. спонтанная зараженность C. psittaci была установлена у 62 видов птиц. Поэтому К. Мейер предложил называть случаи заболеваний, связанные с заражением от птиц, орнитозом, а пситтакозом – только заболевания, возникающие при контакте с попугаями. Однако в связи с тем, что штаммы возбудителей, выделяемые от больных людей и от различных видов птиц, оказались очень сходными и относятся к одному и тому же виду C. psittaci, понятия «пситтакоз» и «орнитоз» стали синонимами.
Эпидемиология. Источником инфекции для человека служат птицы, больные или бессимптомные носители. Полагают, что человек, больной пситтакозом, мало опасен для окружающих. Однако описаны достоверные случаи передачи возбудителя от больных людей здоровым, в частности заражение медицинских работников в больницах. Наибольшее эпидемическое значение имеют домашние птицы – индейки, утки, гуси, реже куры, голуби и комнатные птицы – попугаи, канарейки.
Природные очаги возникают в местах скопления диких птиц, связанных с водой и обитающих стаями. Заражение среди них происходит алиментарным (загрязненные корм, вода) и аэрогенным путем. Чаще всего передача возбудителя от инфицированных самок птенцам происходит в гнезде при насиживании яиц, выводке и кормлении птенцов. Возможна и трансовариальная передача при заражении яйца в момент прохождения его через яйцепровод. Заболевание у птиц протекает в острой, хронической или бессимптомной форме. При острой форме оно может закончиться гибелью в течение первых суток, однако чаще болезнь затягивается на 8 – 9 дней, иногда дольше, после чего птица выздоравливает или болезнь переходит в хроническую форму. В последнем случае птица становится носителем возбудителя на длительный срок. Хламидии от птиц выделяются с экскрементами и носовой слизью. Заражение человека от птиц (больных и носителей) происходит при уходе за ними, а также при забое и при употреблении в пищу без достаточной термической обработки яиц, инфицированных хламидиями. Входными воротами являются слизистые оболочки глаза, дыхательных путей и пищеварительного тракта.
Клиника. Инкубационный период длится 1 – 2 нед., в среднем – 10 дней. Через входные ворота хламидии проникают в организм, поступают в кровь, бактериемия продолжается в течение недели, иногда дольше. В ретикулоэндотелиальных клетках хламидии проходят характерный цикл размножения, вызывая различной степени нарушения клеточного метаболизма, интоксикацию и сенсибилизацию. В типичных случаях заболевание начинается остро, протекает с высокой температурой, которая держится около 3 нед., сильными головными и мышечными болями, иногда тошнотой, рвотой, потерей аппетита. Уже в первые дни нередко появляются кашель со скудной мокротой, боли в груди, развивается атипичная интерстициальная пневмония, которая лучше распознается рентгенологически. Различают три клинических типа пситтакоза: 1) пневмонический, 2) гриппоподобный и 3) тифоподобный с выраженной интоксикацией и ограниченным процессом в легких. Течение болезни может быть тяжелым, средней тяжести, легким и бессимптомным.
Постинфекционный иммунитет нестойкий, возможны повторные заболевания. У переболевших в крови обнаруживают агглютинины, комплементсвязывающие и нейтрализующие хламидии антитела, повышается активность фагоцитов и формируется гиперчувствительность замедленного типа к возбудителю.
Лечение. Сульфаниламидные препараты не эффективны. Применяют антибиотики: тетрациклины, макролиды, рифампицин, пенициллин (под влиянием последнего могут возникнуть L-формы, служащие причиной рецидивов и бессимптомной инфекции).
Профилактика. Специфическая профилактика мало разработана; были предложены различные убитые вакцины, но они оказались слабо эффективными. Общая профилактика заключается в осуществлении комплекса ветеринарно-санитарных мер, направленных на обезвреживание источников инфекции среди домашних и ввозимых в страну птиц (особенно из семейства попугаев), а также медико-санитарных мероприятий (соблюдение режима в птицеводческих хозяйствах и правил личной гигиены, дезинфекция, ношение работниками специальной одежды, строгий контроль за реализацией птицепродуктов и т. п.).
Chlamydia pneumoniae
Респираторный хламидиоз – инфекционное заболевание, вызываемое хламидиями, проявляющееся в виде пневмонии (хламидийная пневмония), катара верхних дыхательных путей и общей интоксикации.
Возбудитель – Chlamydia pneumoniae – имеет родовой антиген, общий с антигенами других видов, белковый видоспецифический и, возможно, типоспецифические антигены. Жизненный цикл аналогичен циклу других хламидий, но элементарные тельца имеют не сферическую, а грушевидную форму, образующуюся за счет расширенного периплазматического пространства. Кроме того, C. pneumoniae не синтезируют гликоген в своих микроколониях. Хламидии этого вида скудно размножаются в желточных мешках куриных эмбрионов и в культурах клеток HeLa, McCoy и L-929. Обладают выраженным тропизмом к эпителию дыхательных путей.
Болезнь широко распространена. Эпидемические вспышки отмечены во многих странах Западной Европы, Америки и в Австралии. Источником инфекции является больной человек. Возбудитель выделяется с отделяемым носоглотки. Механизм заражения – воздушно-капельный. Восприимчивость людей к возбудителю высокая, у детей и престарелых заболевание протекает в более тяжелой форме; у молодых людей – чаще в виде легких форм. Основная клиническая форма болезни – мелкоочаговая и (или) интерстициальная пневмония, выявляемая рентгенологически.
Лечение. Наиболее эффективны антибиотики: тетрациклины, макролиды, угнетающие размножение возбудителя.
Лабораторная диагностика хламидиозов
Поскольку хламидиозы распространены глобально, а их клинические проявления очень разнообразны, особое значение в диагностике этих заболеваний имеют лабораторные методы. В зависимости от формы болезни материалом для исследования служат: соскобы с конъюнктивы, экссудат из бубонов, смывы из носоглотки, уретры, материал, взятый тампоном со слизистой оболочки дыхательных, мочеполовых путей, мокрота, кровь (во время лихорадки), а также секционный материал (кусочки печени, селезенки, легких и других тканей).
Бактериологическая диагностика состоит из предварительного микроскопического исследования материала, выделения возбудителя и его идентификации. Предварительное исследование заключается в бактериоскопии с целью обнаружения хламидий в инфицированных клетках либо с помощью прямой или непрямой иммунофлуоресценции, либо с использованием фазово-контрастной оптики, либо с применением окраски по Романовскому – Гимзе. Для выделения возбудителя исследуемым материалом заражают культуры клеток (лучше всего L-929, McCoy, HeLa) или куриные эмбрионы. Для подавления роста бактерий исследуемый материал обрабатывают гентамицином, стрептомицином и канамицином. Зараженные культуры клеток инкубируют при 35 – 36 °C в течение 6 дней, а затем микроскопируют с помощью фазового контраста, иммунофлуоресценции, ставят пробу на гликоген и определяют принадлежность к роду Chlamydia с помощью РСК с групповым антигеном. РСК считается положительной в разведении 1: 8. При заражении куриных эмбрионов исследуют желточные мешки эмбрионов, погибших в течение 4 – 10 дней. При отсутствии бактериального загрязнения микроскопируют препараты, окрашенные по Романовскому – Гимзе, и определяют в суспензии из желточного мешка наличие группового антигена в РСК. Выделенную культуру идентифицируют по признакам, указанным в табл. 51. В случае выделения C. trachomatis производят определение серотипа. Для этой цели сыворотку морской свинки, от которой выделен данный штамм, испытывают с прототипными антигенами известных 15 серотипов с помощью метода непрямой иммунофлуоресценции.
Для обнаружения хламидий применяют также биологический метод: исследуемым материалом заражают белых мышей и морских свинок, так как некоторые штаммы C. psittaci патогенны для мышей, но не для свинок, и наоборот, некоторые штаммы C. trachomatis (серотипы А, В и С) не размножаются в организме мышей, но патогенны для свинок.
Новорожденные мыши погибают при внутримозговом их заражении через 5 – 10 дней от геморрагического менингита, при интраназальном – через 5 – 10 дней от пневмонии. У мышей и свинок при внутрибрюшинном заражении увеличиваются печень, селезенка, а в брюшной полости образуется фибринозный экссудат. При микроскопическом исследовании у животных, зараженных разными способами, обнаруживаются микроколонии хламидий в мононуклеарных клетках ликвора (при внутримозговом), легких (при интраназальном), селезенке, печени и в перитонеальном экссудате (при внутрибрюшинном заражении). В связи с тем что C. pneumoniae плохо размножаются в культурах клеток и в куриных эмбрионах, для их обнаружения и идентификации используют моноклональные антитела к видоспецифическому антигену в реакциях иммунофлуоресценции.
Для серологической диагностики пситтакоза (орнитоза) и венерического лимфогранулематоза применяют РСК и непрямую иммунофлуоресценцию. Комплементсвязывающие антитела появляются через 4 – 8 дней в небольшом количестве, затем титр их возрастает. Поэтому РСК лучше ставить с парными сыворотками. В связи с наличием у хламидий родового антигена специфичность и чувствительность серологических реакций может быть повышена на основе использования моноклональных антител и выявленных с их помощью наиболее специфических для каждого вида (и серотипа) антигенов-диагностикумов.
Для диагностики хламидиозов могут быть использованы и внутрикожные аллергические пробы, но степень их специфичности зависит от степени специфичности аллергенов, так как могут быть перекрестные реакции за счет общих групповых антигенов.
Назад: Глава 65 Микобактериозы
Дальше: Глава 67 Патогенные микоплазмы

