Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 60 Возбудители особо опасных инфекций
Дальше: Глава 62 Возбудители капельных инфекций
Глава 61
Возбудители кишечных инфекций
Общая характеристика семейства Enterobacteriaceae
Острые бактериальные кишечные инфекции – диареи – относятся к числу наиболее распространенных болезней. Их возбудителями являются многие виды бактерий, но наиболее часто – представители семейства Enterobacteriaceae. Оно объединяет бактерии, которым присущи следующие признаки:
1) единство морфологии – короткие, не образующие спор палочки с закругленными концами, подвижные (перитрихи) или неподвижные, не образующие или образующие капсулы; 2) отрицательная окраска по Граму; 3) ферментация глюкозы (и ряда других углеводов) с образованием кислоты и газа или только кислоты; 4) отсутствие, как правило, протеолитических свойств; 5) факультативные анаэробы или аэробы; 6) хорошо растут на обычных питательных средах; 7) место обитания – кишечный тракт и дыхательные пути; 8) фекально-оральный (в некоторых случаях – воздушно-капельный) путь заражения; 9) отсутствие цитохромоксидазы; 10) каталазопозитивны; 11) восстанавливают нитраты в нитриты; 12) хемоорганотрофы; 13) сумма Г + Ц в ДНК – 39 – 59 мол %; 14) обладают пиразинамидазой.
Семейство насчитывает более 30 родов и более 100 видов. Наиболее важными для человека являются роды: Escherichia, Citrobacter, Enterobacter, Hafnia, Klebsiella, Salmonella, Erwinia, Serratia, Edwardsiella, Shigella, Yersinia, Proteus, Morganella, Providencia. Для дифференциации родов используют в основном биохимические признаки. Каждый род представляет собой компактную группу бактерий со сходными биохимическими свойствами. В свою очередь деление на виды внутри родов также производят по биохимическим признакам и с учетом степени гомологии ДНК между представителями данного вида и у бактерий, представляющих разные виды. В общей сложности для дифференциации родов и видов семейства используют более 40 различных признаков, в том числе: ферментация глюкозы, маннита, лактозы, сахарозы, рамнозы, образование H2S, индола, рост на голодной среде с цитратом натрия, гидролиз мочевины, декарбоксилирование орнитина, дегидрирование аргинина, дезаминирование фенилаланина, подвижность, образование ацетоина при ферментации глюкозы (реакция Фогеса – Проскауэра), проба с метиловым красным (MR) и др.
Большое значение для классификации внутри родов и видов имеет изучение антигенного строения. В основу серологической классификации энтеробактерий положено изучение их О-, Н– и К-антигенов.
Микробиология эшерихиозов
Основной представитель рода Escherichia – E. coli – был впервые обнаружен в 1885 г. Т. Эшерихом, в честь которого этот род бактерий и получил свое название. Ключевые признаки этого рода: перитрихи (или неподвижные), ферментируют лактозу с образованием кислоты и газа (или лактозонегативны), на голодной среде с цитратом не растут, реакция Фогеса – Проскауэра отрицательна, проба с MR положительна, не имеют фенилаланиндезаминазы, не растут на среде с KCN, содержание Г + Ц в ДНК – 50 – 51 мол %.
Род Escherichia включает не менее 7 видов; особое значение в медицине имеет вид E. coli, в частности те его варианты, которые вызывают заболевания человека. Их подразделяют на 2 основные группы: вызывающие внекишечные заболевания и возбудители острых кишечных заболеваний (ОКЗ). Представители первой подразделяются на три патогруппы: 1) менингеальные (MENEC – meningitis E. coli); 2) септицемические (SEPEC – septicemia E. coli) и 3) уропатогенные (UPEC – uropathogenic E. coli). В свою очередь варианты E. coli, вызывающие ОКЗ, вначале были подразделены на 4 следующие категории: энтеротоксигенные E. coli (ETEC); энтероинвазивные E. coli (EIEC); энтеропатогенные E. coli (EPEC) и энтерогеморрагические E. coli (EHEC). Впоследствии были выделены еще две категории: энтероагрегативные E. coli (EAEC) и диффузноагрегативные E. coli (DAEC).
Кроме того, E. coli используется в международных стандартах как показатель степени фекального загрязнения воды, особенно питьевой, и пищевых продуктов (глава 16, с. 154).
Стандартный штамм E. coli (E. coli K-12) широко используется в лабораториях многих стран мира для изучения генетики бактерий.
Культуральные свойства. E. coli – факультативный анаэроб, хорошо растет на обычных питательных средах – колонии на агаре круглые, выпуклые, полупрозрачные. Рост на бульоне в виде диффузного помутнения. Температурный оптимум для роста 37 °C, растет в диапазоне от 10 до 45 °C, оптимальная рН 7,2 – 7,5. На всех дифференциально-диагностических средах колонии E. coli, разлагающей лактозу, окрашены в цвет индикатора (на среде Эндо – темно-малиновые с металлическим блеском, см. цв. вкл., рис. 99, а).
Биохимические свойства. Кишечная палочка в большинстве случаев способна ферментировать следующие углеводы с образованием кислоты и газа: глюкозу, лактозу, маннит, арабинозу, галактозу, иногда сахарозу и некоторые другие углеводы;
образует индол; как правило, не образует H2S; восстанавливает нитраты в нитриты, не разжижает желатин, не растет на голодной среде с цитратом, дает положительную реакцию с MR и отрицательную – Фогеса – Проскауэра. По этим признакам ее легко можно отличить от возбудителей ряда заболеваний (дизентерии, брюшного тифа, сальмонеллезов и др.). Однако патогенные E. coli ни по культуральным, ни по биохимическим свойствам очень часто не отличаются от непатогенных.
Антигенное строение. E. coli является представителем нормальной микрофлоры кишечного тракта всех млекопитающих, птиц, рептилий и рыб. Поэтому для выяснения вопроса, какие варианты E. coli и почему вызывают эшерихиозы, потребовалось изучить антигенное строение, разработать серологическую классификацию, необходимую для идентификации патогенных серовариантов, и выяснить, какими факторами патогенности они обладают, т. е. почему они способны вызывать различные формы эшерихиозов.
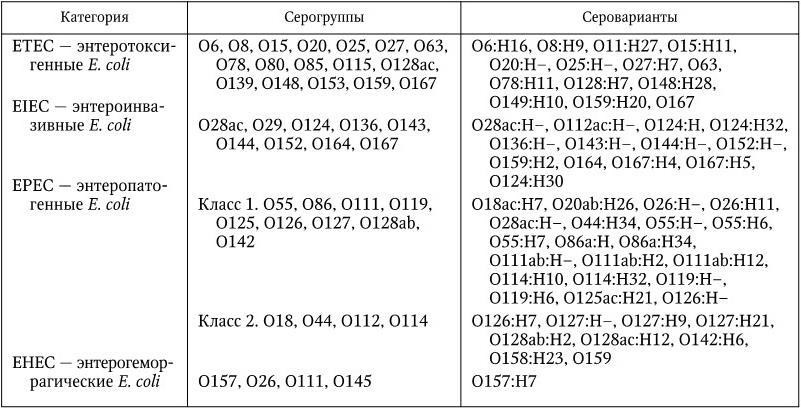
У E. coli обнаружен 171 вариант О-антигенов (О1 – О171), 57 вариантов Н-антигенов (Н1 – Н57) и 90 вариантов поверхностных (капсульных) К-антигенов. Однако в действительности существует 164 группы по О-антигену и 55 серовариантов по Н-антигену, так как некоторые из прежних О: Н-серогрупп были исключены из вида E. coli, но порядковые номера О– и Н-антигенов сохранились неизменными. Антигенная характеристика диареегенных E.coli включает в себя номера О– и Н-антигенов, например, О55:Н6; О157:Н7; О-антиген означает принадлежность к определенной серогруппе, а Н-антиген – ее серовариант. Кроме того, при более углубленном изучении О– и Н-антигенов выявлены так называемые факторные О– и Н-антигены, т. е. их антигенные субварианты, например: H2a, H2b, H2c или O20, O20а, O20ab и т. п. Всего в список диареегенных E. coli включено 43 О-серогруппы и 57 ОН-серовариантов. Список этот (табл. 32) пополняется все новыми серовариантами.
Таблица 32
Классификация диареегенных Escherichia coli
Факторы патогенности E. coli. Способность E. coli вызывать различные заболевания обусловлена наличием у нее следующих факторов патогенности:
1. Факторы адгезии и колонизации. Они необходимы для прикрепления к клеткам ткани и их колонизации. Обнаружено три варианта фактора колонизации: а) CFA/I-CFA/VI (англ. colonization factor) – они имеют фимбриальную структуру; б) EAF (англ. enteropathogenic E. coli adherence factor) – интимин – белок наружной мембраны, кодируется геном eaeA. Обнаружен у EPEC и EHEC, выявляется по способности бактерий прикрепляться к клеткам Hep-2; в) Adhesion Henle-407 – фимбриальные структуры, выявляются по способности бактерий прикрепляться к клеткам Henle-407. Все они кодируются плазмидными генами. Помимо них описаны и другие факторы колонизации, в роли которых могут выступать также бактериальные липополисахариды.
2. Факторы инвазии. С их помощью EIEC и EHEC, например, проникают в эпителиоциты кишечника, размножаются в них и вызывают их разрушение. Роль факторов инвазии выполняют белки наружной мембраны.
3. Экзотоксины. У патогенных E. coli обнаружены экзотоксины, повреждающие мембраны (гемолизин), угнетающие синтез белка (токсин Шига), активизирующие вторичные мессенджеры (англ. messenger – связной) – токсины CNF, ST, CT, CLTD, EAST.
Гемолизины продуцируют разные патогены, в том числе E. coli. Гемолизин – порообразующий токсин. Он вначале связывается с мембраной клетки-мишени, а затем формирует в ней пору, через которую происходит вход и выход небольших молекул и ионов, что ведет к гибели клеток и лизису эритроцитов.
Токсин Шига (STX) был обнаружен вначале у Shigella dysenteriae, а затем сходный токсин (шигаподобный токсин) был обнаружен у EHEC. Токсин (N-гликозидаза) блокирует синтез белка, взаимодействуя с 28S pРНК, в результате чего клетка гибнет (цитотоксин). Различают два типа шигаподобного токсина: STX-1 и STX-2. STX-1 по антигенным свойствам почти идентичен токсину Шига, а STX-2 отличается от токсина Шига по антигенным свойствам и, в отличие от STX-1, не нейтрализуется антисывороткой к нему. Синтез цитотоксинов STX-1 и STX-2 контролируется у E. coli генами умеренных конвертирующих профагов 9331 (STX-1) и 933W (STX-2).
Токсин L (термолабильный токсин) – АДФ-рибозилтрансфераза; связываясь с Gбелком, вызывает диарею.
Токсин ST (термостабильный токсин), взаимодействуя с рецептором гуанилатциклазы, стимулирует ее активность и вызывает диарею.
CNF (цитотоксический некротический фактор) – белок деамидаза, повреждает так называемые RhoG-белки. Этот токсин обнаружен у UPEC, вызывающих инфекции мочевыводящих путей.
CLTD-токсин – цитолетальный разрыхляющий токсин. Механизм действия изучен слабо.
Токсин EAST – термостабильный токсин энтероагрегативных E. coli (EAEC), вероятно, подобен термостабильному токсину (ST).
4. Эндотоксины-липополисахариды. Они определяют антигенную специфичность бактерий (которая детерминируется повторяющейся боковой цепочкой сахаров) и форму колоний (утрата боковых цепочек приводит к превращению S-колоний в R-колонии).
Таким образом, факторы патогенности E. coli контролируются не только хромосомными генами клетки-хозяина, но и генами, привносимыми плазмидами или умеренными конвертирующими фагами. Все это свидетельствует о возможности возникновения патогенных вариантов E. coli в результате распространения среди них плазмид и умеренных фагов. Ниже дана краткая характеристика 4 категорий E. coli, вызывающих ОКЗ; сведений о недавно выделенных категориях DAEC и EAEC в доступных нам источниках не найдено.
ETEC включает 17 серогрупп. Факторы адгезии и колонизации фимбриальной структуры типа CFA и энтеротоксины (LT или ST, или оба) кодируются одной и той же плазмидой (плазмидами). Колонизируют ворсинки без их повреждения. Энтеротоксины вызывают нарушение водно-солевого обмена. Локализация процесса – область тонкой кишки. Заражающая доза 108– 1010 клеток. Заболевание протекает по типу холероподобной диареи. Тип эпидемий – водный, реже пищевой. Болеют дети в возрасте от 1 года до 3 лет и взрослые.
EIEC включает 9 серогрупп, патогенность связана со способностью внедряться в эпителиальные клетки слизистой оболочки кишечника и размножаться внутри них, вызывая их разрушение. Эти свойства кодируются, помимо хромосомных генов, генами плазмиды (140 МД). Плазмида кодирует синтез белков наружной мембраны, которые и определяют инвазию. Как сама плазмида, так и белки, которые она кодирует, родственны таковым у возбудителей дизентерии, чем и объясняется сходство EIEC с шигеллами. Заражающая доза 105 клеток. Локализация процесса – нижний отдел подвздошной и толстая кишка. Заболевание протекает по типу дизентерии: вначале водянистая диарея, затем колитический синдром. Болеют дети 1,5 – 2 лет, подростки и взрослые. Тип вспышек – пищевой, водный.
EPEC. Группа включает 9 серогрупп класса 1 и четыре серогруппы класса 2. У серогрупп класса 1 имеется плазмида (60 МД), которая контролирует синтез фактора адгезии и колонизации типа EAF. Он представлен белком, локализованным в наружной мембране, и выявляется по способности бактерий прикрепляться к клеткам HЕp-2. Белок имеет м. м. 94 кД. У серогрупп класса 2 эта плазмида отсутствует, их патогенность обусловлена какими-то иными факторами. У некоторых штаммов EPEC обоих классов обнаружена способность синтезировать STX. EPEC колонизируют плазмолемму энтероцитов, вызывают повреждение поверхности эпителия с образованием эрозий и умеренного воспаления. Заражающая доза 105– 1011 клеток. Процесс локализуется в области тонкой кишки. Для заболевания характерны водянистая диарея и выраженное обезвоживание. Болеют в основном дети первого года жизни. Способ заражения – контактно-бытовой, реже пищевой.
Серогруппы EIEC и EPEC – наиболее частые виновники внутрибольничных вспышек.
ЕНЕС продуцируют цитотоксины STX-1 и STX-2. Вызывают у людей геморрагический колит с тяжелыми осложнениями в виде гемолитической уремии и тромботической тромбоцитопенической пурпуры. Токсины разрушают клетки эндотелия мелких кровеносных сосудов. Образование сгустков крови и выпадение фибрина приводят к нарушению кровотока, кровотечению, ишемии и некрозу в клеточной стенке. Уремический гемолитический синдром может привести к летальному исходу. ЕНЕС представлены многими серотипами (~150), но главную эпидемиологическую роль играют E. coli O157:H7 и ее безжгутиковый мутант E. coli O157:NM, так как только они образуют STX. Эти штаммы бактерии могут выделять только один из цитотоксинов или оба одновременно. Полагают, что естественным резервуаром сероваров ЕНЕС, в том числе E. coli O157:H7, являются крупный рогатый скот и овцы. Наиболее частый путь заражения – пищевой (мясо, особенно фарш; молоко). E. coli O157:H7 необычайно устойчива к неблагоприятным факторам. Это способствует ее выживанию и размножению в разных продуктах. Возможно заражение контактно-бытовым путем. Начало болезни острое: возникают кишечные спазмы, затем понос, вначале водянистый, потом – с кровью. Болеют дети и взрослые. Больной человек заразен.
Лабораторная диагностика эшерихиозов основана на выделении чистой культуры возбудителя и его идентификации, а также на тестировании токсинов с помощью
ПЦР. Возбудителя эшерихиозов идентифицируют с помощью набора поливалентных OK-сывороток и набора адсорбированных сывороток, содержащих антитела только к определенным антигенам. Для идентификации EIEC можно использовать кератоконъюнктивальную пробу. Некоторые представители EIEC неподвижны, не ферментируют лактозы и салицина. Идентификации E. coli О157:H7 помогает ее неспособность ферментировать сорбит (применяют среду Эндо с сорбитом вместо лактозы). Но лучше всего для идентификации и дифференциации возбудителей ОКЗ (всех категорий) использовать тест-системы ПЦР. При необходимости у выделенных возбудителей определяют чувствительность к антибиотикам.
Лечение. Используют различные антибиотики. Для восстановления нарушенного водно-солевого обмена применяют оральные солевые растворы. Их выпускают в целлофановых пакетах в виде порошков, содержащих NaCl – 3,5 г; NaHCO3 – 2,5 г; KCl – 1,5 г и глюкозы – 20,0 г и растворяемых в 1 литре воды.
Микробиология брюшного тифа
Брюшной тиф – тяжелое острое инфекционное заболевание, характеризующееся глубокой общей интоксикацией, бактериемией и специфическим поражением лимфатического аппарата тонкого кишечника. Интоксикация проявляется сильной головной болью, помрачением сознания, бредом (тиф от греч. typhos – туман). Брюшной тиф как самостоятельную нозологическую единицу впервые попытался выделить русский врач А. Г. Пятницкий еще в 1804 г., но окончательно это сделал в 1822 г. Р. Бретонно, который дифференцировал эту болезнь от туберкулеза кишечника и высказал предположение о контагиозной природе брюшного тифа.
Возбудитель брюшного тифа – Salmonella typhi – был обнаружен в 1880 г. К. Эбертом, а выделен в чистой культуре в 1884 г. К. Гаффки. Вскоре были выделены и изучены возбудители паратифов А и В – S. paratyphi A и S. paratyphi B. Род Salmonella включает в себя большую группу бактерий, но только три из них – S. typhi, S. paratyphi A и S. paratyphi B – вызывают заболевание у человека с клинической картиной брюшного тифа. Морфологически они неразличимы – короткие грамотрицательные палочки с закругленными концами, длиной 1 – 3,5 мкм, диаметром 0,5 – 0,8 мкм (см. цв. вкл., рис. 100.2); спор и капсул не образуют, обладают активной подвижностью (перитрихи). Содержание Г + Ц в ДНК составляет 50 – 52 мол %.
Возбудители брюшного тифа и паратифов – факультативные анаэробы, температурный оптимум для роста 37 °C (но могут расти в диапазоне от 10 до 41 °C), рН 6,8 – 7,2; не требовательны к питательным средам. Рост на бульоне сопровождается помутнением, на МПА образуются нежные круглые, гладкие, полупрозрачные колонии диаметром 2 – 4 мм. Однако колонии S. typhi, имеющие Vi-антиген, мутные. Колонии S. paratyphi B более грубые, через несколько дней у них по периферии формируются своеобразные валики. На средах Эндо колонии всех трех сальмонелл бесцветны (см. цв. вкл., рис. 99б), на висмут-сульфит-агаре – черного цвета. В случае диссоциации на плотных средах вырастают колонии R-формы. Избирательной средой для возбудителей брюшного тифа и паратифов является желчь или желчный бульон.
Биохимические свойства. Возбудители брюшного тифа и паратифов дают положительную реакцию с MR, не образуют индола, не разжижают желатин, восстанавливают нитраты в нитриты, не образуют ацетоина. S. typhi не растет на голодном агаре с цитратом. Основные биохимические различия между возбудителями брюшного тифа и паратифов заключаются в том, что S. typhi ферментирует глюкозу и некоторые другие углеводы с образованием только кислоты, а S. paratyphi A и S. paratyphi B – с образованием и кислоты, и газа (табл. 33).
Таблица 33
Биохимические свойства E. coli, S. typhi, S. paratyphi A и S. paratyphi B
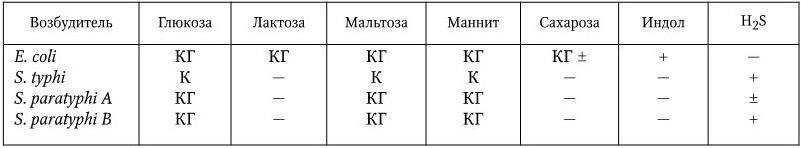
Примечание.К – образование кислоты; КГ – образование кислоты и газа; (+) – признак постоянный; (±) – признак непостоянный; ( – ) – признак отсутствует.
S. typhi по способности ферментировать ксилозу и арабинозу подразделяют на четыре биохимических типа:

Антигенное строение. Сальмонеллы имеют О– и Н-антигены. По О-антигенам они разделяются на большое количество серогрупп, а по Н-антигенам – на серотипы (подробнее о серологической классификации сальмонелл см. в следующем разделе). S. typhi, S. paratyphi A и S. paratyphi B отличаются друг от друга как по О-антигенам (относятся к разным серогруппам), так и по Н-антигенам.
В 1934 г. А. Феликс и Р. Питт установили, что S. typhi помимо О– и Н-антигенов имеет еще один поверхностный антиген, который они назвали антигеном вирулентности (Vi-антигеном). По химической природе Vi-антиген отличается от О– и Н-антигенов, он состоит из трех различных фракций, но его основу составляет сложный полимер N-ацетилгалактозаминоуроновая кислота с м. м. 10 МД. Vi-антиген, как правило, обнаруживается у свежевыделенных культур, но он легко утрачивается под влиянием различных факторов (в частности, при выращивании при температуре выше 40 °C и ниже 20 °C, на средах с карболовой кислотой и т. п.), при длительном хранении культур, разрушается при температуре 100 °C в течение 10 мин. Поскольку он располагается более поверхностно, чем О-антиген, его наличие препятствует агглютинации культуры S. typhi О-специфической сывороткой, поэтому такую культуру обязательно проверяют в реакции агглютинации с Vi-сывороткой. Напротив, утрата Vi-антигена ведет к освобождению О-антигена и восстановлению О-агглютинации, но при этом утрачивается Vi-агглютинация. Количественное содержание Vi-антигена у S. typhi может сильно варьировать, поэтому Ф. Кауффманн предложил классифицировать S. typhi по содержанию Vi-антигена на три группы:
1) чистые v-формы (нем. viel – много);
2) чистые w-формы (нем. wenig – мало);
3) промежуточные vw-формы.
Обнаружены 3 необычных мутанта S. typhi: Vi-I – R-форма, клетки лишены Ни О-антигенов, но стойко сохраняют Vi-антиген; О-901 – лишен Н– и Vi-антигенов; Н-901 – содержит О– и Н-антигены, но лишен Vi-антигена. Все три антигена: О-, Ни Vi– имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Есть 2 типа фагов, лизирующих только те культуры, которые содержат Vi-антиген: Vi-I – универсальный фаг, лизирует большинство Vi-содержащих культур S. typhi; и набор Vi-II-фагов, лизирующих избирательно культуры S. typhi. Впервые это было показано в 1938 г. Дж. Крейджем и К. Иеном. С помощью Vi-фагов II типа они разделили S. typhi на 11 фаготипов. К 1987 г. было выявлено уже 106 различных Vi-фаготипов S. typhi. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi A и S. paratyphi B, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.
Резистентность. Возбудители брюшного тифа и паратифов во внешней среде (вода, почва, пыль) сохраняются, в зависимости от условий, от нескольких дней до нескольких месяцев. В проточной воде могут выживать до 10 дней, в застойной – до 4 нед., на овощах и фруктах – 5 – 10 дней, на посуде – до 2 нед., в масле, сыре – до 3 мес., во льду – до 3 мес. и больше; нагревание при температуре 60 °C убивает через 30 мин, а кипячение – мгновенно. Обычные химические дезинфектанты убивают их через несколько минут. Содержание в водопроводной воде активного хлора в дозе 0,5 – 1,0 мг/л или озонирование воды обеспечивают ее надежное обеззараживание как от сальмонелл, так и от других патогенных кишечных бактерий.
Факторы патогенности. Важнейшей биологической особенностью возбудителей брюшного тифа и паратифов А и В является их способность противостоять фагоцитозу и размножаться в клетках лимфоидной системы. Экзотоксинов они не образуют. Основным фактором патогенности их, помимо Vi-антигена, является эндотоксин, отличающийся необычно высокой токсичностью. Такие факторы патогенности, как фибринолизин, плазмокоагулаза, гиалуронидаза, лецитиназа и т. п., обнаруживаются у возбудителей брюшного тифа и паратифов очень редко. С наибольшей частотой встречается ДНК-аза (у 75 – 85 % изученных культур S. typhi и S. paratyphi B). Установлено, что штаммы S. typhi, имеющие плазмиду с м. м. 6 МД, обладают более высокой вирулентностью. Поэтому вопрос о факторах патогенности этих сальмонелл остается еще мало изученным.
Эпидемиология. Источником брюшного тифа и паратифа А является только человек, больной или бактерионоситель. Источником паратифа В, кроме человека, могут быть и животные, в том числе птицы. Механизм заражения – фекальнооральный. Заражающая доза S. typhi 105 клеток (вызывает заболевание 50 % добровольцев), заражающие дозы сальмонелл паратифов А и В значительно выше. Заражение происходит главным образом в результате прямого или непрямого контакта, а также через воду или пищу, особенно молоко. Наиболее крупные эпидемии вызывало инфицирование возбудителями водопроводной воды (водные эпидемии).
Особенности патогенеза и клиники. Инкубационный период при брюшном тифе 15 дней, но он может варьировать от 7 до 25 дней. Это зависит от заражающей дозы, вирулентности возбудителя и иммунного статуса больного. Патогенез и клиническая картина брюшного тифа и паратифов А и В очень сходны. В развитии болезни четко выявляются следующие стадии:
1) стадия вторжения. Возбудитель через рот проникает в тонкий кишечник;
2) через лимфатические пути сальмонеллы проникают в лимфоидные образования подслизистой оболочки тонкого кишечника (пейеровы бляшки и солитарные фолликулы) и, размножаясь в них, вызывают лимфангоит и лимфаденит (своеобразные брюшно-тифозные гранулы);
3) бактериемия – выход возбудителя в большом количестве в кровь. Стадия бактериемии начинается в конце инкубационного периода и может (в отсутствие эффективного лечения) продолжаться в течение всей болезни;
4) стадия интоксикации наступает вследствие распада бактерий под действием бактерицидных свойств крови и высвобождения эндотоксинов;
5) стадия паренхиматозной диффузии. Из крови сальмонеллы поглощаются макрофагами костного мозга, селезенки, лимфатических узлов, печени и других органов. В большом количестве возбудитель брюшного тифа накапливается в желчных ходах печени и в желчном пузыре, где он находит благоприятные условия для своего размножения и где бактерицидные свойства крови ослаблены влиянием желчи;
6) выделительно-аллергическая стадия. По мере формирования иммунитета начинается процесс освобождения от возбудителя. Этот процесс осуществляют все железы: слюнные, кишечника, потовые, молочные (во время кормления ребенка), мочевыделительная система и особенно активно – печень и желчный пузырь. Выделяющиеся из желчного пузыря сальмонеллы опять поступают в тонкий кишечник, откуда часть их выделяется с испражнениями, а часть вторгается вновь в лимфатические узлы. Вторичное внедрение в уже сенсибилизированные узлы вызывает в них гиперергическую реакцию, которая проявляется в виде некроза и образования язв (см. цв. вкл., рис. 100.1). Эта стадия опасна возможностью прободения стенки кишечника (язв), внутреннего кровотечения и развития перитонита;
7) стадия выздоровления. Процесс заживления язв происходит без возникновения обезображивающих рубцов на местах, очистившихся от некротических налетов. В свою очередь, в клинической картине болезни различают следующие периоды:
I – начальная стадия – stadium incrementi (1-я неделя): постепенное повышение температуры до 40 – 42 °C, нарастание интоксикации и других проявлений болезни.
II – стадия максимального развития всех симптомов – stadium acme (2 – 3-я недели болезни): температура держится на высоком уровне;
III – стадия спада болезни – stadium decrementi (4-я неделя болезни): постепенное снижение температуры и ослабление проявления других симптомов;
IV – стадия выздоровления.
На 8 – 9-й день болезни, а иногда и позднее, у многих больных появляется розеолезная сыпь на коже живота, груди и спины. Появление сыпи (мелких красных пятен) является следствием местных продуктивно-воспалительных процессов аллергической природы в поверхностных слоях кожи около лимфатических сосудов, которые в изобилии содержат возбудителя болезни. Клиническое выздоровление не всегда совпадает с бактериологическим. Примерно 5 % переболевших становятся хроническими носителями сальмонелл тифа или паратифов. Причины, лежащие в основе длительного (более 3 мес., а иногда многие годы) носительства сальмонелл, остаются неясными. Известное значение в формировании носительства играют местные воспалительные процессы в желчевыводящих (иногда в мочевыводящих) путях, которые часто возникают в связи с тифо-паратифозными инфекциями или обостряются в результате этих инфекций. Однако не менее важную роль в формировании длительного носительства сальмонелл брюшного тифа и паратифов А и В играет L-трансформация их. L-формы сальмонелл утрачивают Н-, частично Ои Vi-антигены, располагаются, как правило, внутриклеточно (внутри макрофагов костного мозга), поэтому становятся не доступными ни для химиопрепаратов, ни для антител и могут длительно персистировать в организме переболевшего человека. Возвращаясь в исходные формы и полностью восстанавливая свою антигенную структуру, сальмонеллы вновь становятся вирулентными, вновь проникают в желчные ходы, вызывают обострение процесса бактерионосительства, выделяются с испражнениями, а такой носитель становится источником заражения для окружающих. Не исключено также, что формирование бактерионосительства зависит от какого-то дефицита иммунной системы.
Постинфекционный иммунитет прочный, продолжительный, повторные заболевания брюшным тифом и паратифами бывают редко. Иммунитет обусловлен появлением антител к Vi-, O– и H-антигенам, клеток иммунной памяти и повышением активности фагоцитов. Поствакцинальный иммунитет, в отличие от постинфекционного, непродолжителен (около 12 мес.).
Лабораторная диагностика. Самым ранним и основным методом диагностики брюшного тифа и паратифов является бактериологический – получение гемокультуры или миелокультуры. С этой целью исследуют кровь или пунктат костного мозга. Кровь лучше засевать на среду Рапопорт (желчный бульон с добавлением глюкозы, индикатора и стеклянного поплавка) в соотношении 1: 10 (на 10 мл среды 1 мл крови). Посев следует инкубировать при температуре 37 °C не менее 8 дней, а с учетом возможного наличия L-форм – до 3 – 4 нед. Для идентификации выделенной культуры сальмонелл используют (с учетом их биохимических свойств) диагностические адсорбированные сыворотки, содержащие антитела к антигенам О2 (S. paratyphi A), О4 (S. paratyphi B) и О9 (S. typhi). Если выделенная культура S. typhi не агглютинируется О9-сывороткой, ее необходимо проверить с Vi-сывороткой.
Для выделения S. typhi можно использовать экссудат, полученный путем скарификации розеол – вырастают розеолокультуры.
Бактериологическое исследование испражнений, мочи и желчи проводят для подтверждения диагностики, контроля бактериологического выздоровления при выписке реконвалесцентов и для диагностики бактерионосительства. В этом случае материал предварительно засевают на среды обогащения (среды, содержащие химические вещества, например селенит, которые угнетают рост E. coli и других представителей микрофлоры кишечника, но не угнетают роста сальмонелл), а затем со среды обогащения – на дифференциально-диагностические среды (Эндо, висмут-сульфит-агар) с целью выделения изолированных колоний и получения из них чистых культур, идентифицируемых по указанной выше схеме. Для обнаружения О– и Viантигенов в сыворотке крови и испражнениях больных могут быть использованы РСК, РПГА с антительным диагностикумом, реакции коагглютинации, агрегат-гемагглютинации, ИФМ. Для ускоренной идентификации S. typhi перспективно применение в качестве зонда фрагмента ДНК, несущего ген Vi-антигена (время идентификации 3 – 4 ч).
С конца 1-й недели болезни в сыворотке больных появляются антитела, поэтому для диагностики брюшного тифа в 1896 г. Ф. Видалем была предложена реакция развернутой пробирочной агглютинации. Динамика содержания антител к S. typhi своеобразна: раньше всего появляются антитела к О-антигену, но титр их быстро снижается после выздоровления; Н-антитела появляются позднее, но зато сохраняются после болезни и прививок годами. С учетом этого обстоятельства реакцию Видаля ставят одновременно с раздельными О– и Н-диагностикумами (а также с паратифозными А– и В-диагностикумами) для исключения возможных ошибок, связанных с прививками или ранее перенесенным заболеванием. Однако специфичность реакции Видаля недостаточно высока, поэтому более предпочтительным оказалось применение РПГА, в которой эритроцитарный диагностикум сенсибилизирован либо О– (для обнаружения О-антител), либо Vi-антигеном (для обнаружения Vi-антител). Наиболее надежной и специфической является последняя реакция (Vi-гемагглютинации).
Диагностика бактерионосительства. Единственным доказательством бактерионосительства является выделение от носителя культур S. typhi, S. paratyphi A, S. paratyphi B. Материалом для исследования являются дуоденальное содержимое, испражнения и моча. Сложность проблемы заключается в том, что у носителей возбудитель не всегда выделяется с этими субстратами, бывают паузы, и довольно продолжительные. В качестве вспомогательных методов, которые позволяют сузить круг обследуемых лиц, используют серологические реакции (одновременное обнаружение О-, Н-, Vi– или О-, Vi-антител говорит о возможном присутствии возбудителя в организме) и аллергическую кожную пробу с Vi-тифином. Последний содержит Vi-антиген, который при взаимодействии с Vi-антителами дает местную аллергическую реакцию в виде покраснения и припухлости в течение 20 – 30 мин. Положительная реакция с Vi-тифином свидетельствует о наличии в организме Vi-антител и о возможном присутствии S. typhi. Для идентификации L-форм S. typhi предложены специальные иммунофлуоресцирующие антитела (к антигенам L-форм возбудителя). Оригинальный метод выявления бактерионосителей был предложен В. Муром. Он заключается в исследовании тампонов, одновременно забрасываемых в канализационные люки на всем протяжении канализационной сети населенного пункта.
Лечение. Для лечения больных брюшным тифом применяют различные антибиотики, к которым возбудители проявляют высокую чувствительность (левомицетин, ампициллин, тетрациклины и др.). Антибиотики снижают тяжесть течения болезни и сокращают ее продолжительность. Однако перенос R-плазмид сальмонеллам от E. coli или других энтеробактерий может привести к появлению среди них опасных эпидемических клонов.
Специфическая профилактика. Вместо семи различных брюшно-тифозных вакцин, применявшихся ранее, с 1978 г. в нашей стране выпускается только одна – химическая сорбированная брюшно-тифозная моновакцина. Однако в связи с тем, что брюшной тиф из эпидемического заболевания перешел в разряд спорадических (а это стало возможным, прежде всего, благодаря улучшению систем водоснабжения и канализации и повышению санитарной культуры населения), необходимость массовой иммунизации против него отпала. Поэтому прививки проводят только в случае эпидемических показаний.
Микробиология пищевых токсикоинфекций
Пища нередко является причиной отравлений, природа которых может быть самой различной.
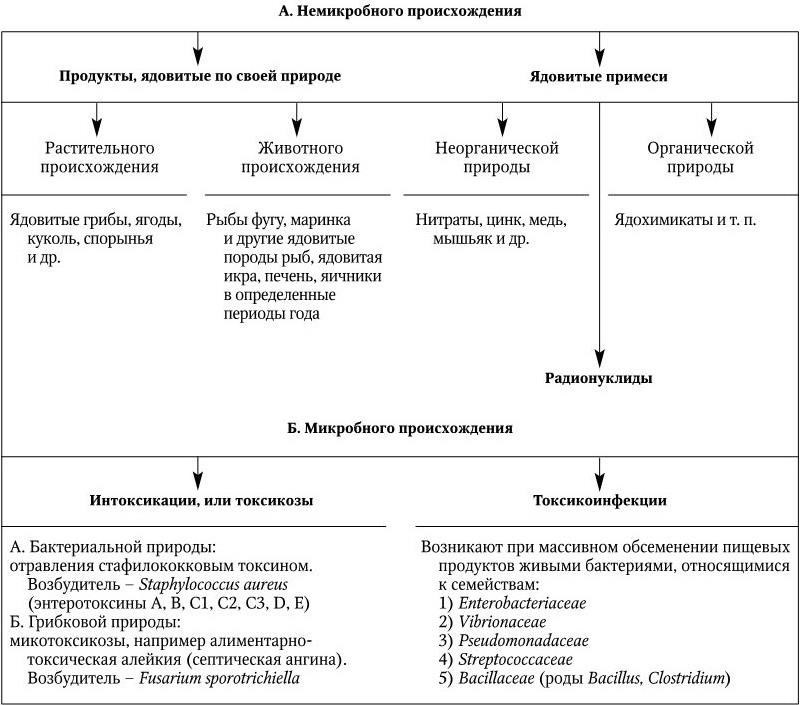
Наиболее простая классификация пищевых отравлений такова: различают пищевые отравления немикробного и микробного происхождения (табл. 34).
Пищевые отравления немикробного происхождения могут быть связаны с употреблением продуктов, ядовитых по своей природе, растительного (грибы, ягоды и т. п.) или животного (например, рыбы фугу, маринка и др.) происхождения, а также при попадании в организм с пищей ядовитых неорганических или органических веществ, ядохимикатов, радионуклидов. Острые отравления этого типа протекают без повышения температуры с разнообразной клинической картиной, инкубационный период отсутствует, заболевание начинается через 1 – 1,5 ч. Однако отравления неорганическими и органическими ядами и радионуклидами могут иметь и хронический характер.
Пищевые отравления микробного происхождения подразделяют на 2 группы: пищевые интоксикации и пищевые токсикоинфекции.
Пищевые интоксикации – отравления, обусловленные исключительно токсинами микроорганизмов. Они могут возникать и в тех случаях, когда живые возбудители в пищевом продукте, подвергнутом термической обработке, отсутствуют.
Пищевые токсикоинфекции возникают только в связи с употреблением в пищу продуктов, обильно зараженных бактериями. Пищевые токсикоинфекции имеют обычно характер групповых заболеваний и отличаются коротким инкубационным периодом, острым непродолжительным течением и отсутствием, как правило, контагиозных случаев заболеваний, так как заражающие дозы их возбудителей велики.
Таблица 34
Классификация пищевых отравлений
Токсикоинфекции являются следствием массивного обсеменения пищевого продукта живыми возбудителями. Через пищу возможно заражение различными возбудителями (брюшного тифа, дизентерии, холеры, бруцеллеза и др.), для которых алиментарный способ заражения не является единственным. Передача возбудителей в этих случаях происходит также контактно-бытовым и другими путями.
Для пищевых токсикоинфекций существует только один путь передачи – через пищу.
Кроме того, пищевые токсикоинфекции отличаются от других инфекций, при которых заражение происходит также через пищу, течением по типу острого токсикоза: на первый план выступают симптомы интоксикации; у разных лиц во время одной и той же вспышки наблюдаются различные клинические проявления, патологоанатомические изменения выражены слабо и не соответствуют тяжести заболевания. Для пищевых инфекций (брюшной тиф, дизентерия и др.) характерными являются относительно продолжительный инкубационный период, отличительные для каждой болезни клинические проявления и типичные патологоанатомические изменения, т. е. на первый план выступают инвазивные (инфекционные) свойства возбудителей, которые также могут сопровождаться сильным токсикозом.
Пищевые токсикоинфекции известны с давних пор. Долгое время их называли «мясными отравлениями», так как связывали с употреблением в пищу мяса. Однако выяснилось, что такие заболевания могут вызывать и другие продукты – рыба, молоко, яйца, птицепродукты, консервы, а природа их – бактериальная.
Своеобразный характер этих заболеваний и дал основание назвать их пищевыми токсикоинфекциями.
Впервые бактериальная природа пищевых токсикоинфекций была установлена в 1888 г. А. Гертнером, который выделил во время большой вспышки мясного отравления из селезенки умершего человека и из мяса вынужденно убитой коровы одну и ту же бактерию – Bacterium enteritidis. В 1893 г. К. Кенте и Ф. Флюгге выделили другого возбудителя пищевой токсикоинфекции – B. typhi murium. Как было установлено позднее, такими же свойствами обладает и B. cholerae suis, которую выделил в 1886 г. Д. Сальмон; в честь него в 1934 г. этому роду бактерий было дано название Salmonella. Пищевые токсикоинфекции могут вызывать представители по крайней мере пяти семейств бактерий: Enterobacteriaceae (роды – Escherichia, Salmonella, Shigella, Proteus, Serratia, Hafnia, Enterobacter, Citrobacter и др.), Vibrionaceae (V. parahaemolyticus), Pseudomonadaceae, Streptococcaceae (протеолитические варианты стрептококков серогруппы D), Bacillaceae – роды Bacillus (B. cereus), Clostridium (C. perfringens, серотипы A, D, F; C. botulinum, серотипы A, B, C, E, F).
Особенности биологии ряда этих возбудителей изложены в соответствующих разделах. Способность вызывать пищевые интоксикации связывают с наличием эндотоксинов (у грамотрицательных бактерий), различных ферментов (в том числе протеолитических у стрептококков) и экзотоксинов у некоторых грамотрицательных и грамположительных бактерий родов Bacillus и Clostridium. В частности, патогенные штаммы B. cereus синтезируют два типа экзотоксинов. Один из них – комплекс из трех белков – вызывает диарею, летальный эффект и нарушает проницаемость сосудов, а другой – цереолизин – обладает летальным и цитолитическим действием и нарушает проницаемость сосудов.
Все пищевые токсикоинфекции возникают, когда в пищевом продукте происходит размножение бактерий в большом количестве. Отравление наступает в результате накопления в пищевом продукте большого количества живых бактерий, образуемых ими токсинов, а также токсаминов, которые возникают за счет катаболизма размножающихся возбудителей. Проникнув в большом количестве в кишечник, бактерии затем попадают в кровь, разрушаются, а освобождающийся в большом количестве эндотоксин (а в ряде случаев и внутриклеточный энтеротоксин) вызывает острый токсикоз, который может усугубляться действием токсаминов.
Клиника пищевых токсикоинфекций, обусловленных токсигенными грамположительными бактериями, определяется биологическими свойствами их токсинов и токсаминов.
Основным методом диагностики пищевых токсикоинфекций является бактериологический. Он применяется с учетом биологии возможного возбудителя (грамотрицательные и грамположительные палочки, стрептококки, бациллы, клостридии). Материалом для исследований служат испражнения, рвотные массы, промывные воды желудка, кровь, продукты, послужившие причиной отравления. Обращают внимание на обнаружение большого количества бактерий в продукте (105– 106 клеток/мл), таких же бактерий в выделениях из кишечника и желудка, в том числе от нескольких человек при групповом отравлении. Подтверждением диагноза является обнаружение в сыворотке крови переболевших людей (через 1 – 2 нед.) антител к возбудителю.
Методы диагностики стафилококковых интоксикаций и ботулизма изложены в соответствующих разделах.
Сальмонеллезы
Сальмонеллы являются не только основными возбудителями пищевых токсикоинфекций, но и часто причиной своеобразных диарей – сальмонеллезов.
Ключевые признаки рода Salmonella следующие: короткие грамотрицательные палочки с закругленными концами, длиной 1,5 – 4,0 мкм, в большинстве случаев подвижные (перитрихи), спор и капсул не имеют, образуют при ферментации глюкозы (и ряда других углеводов) кислоту и газ (за исключением S. typhi и некоторых других серотипов), имеют лизин– и орнитиндекарбоксилазы, не имеют фенилаланиндезаминазы, образуют H2S (некоторые не образуют), дают положительную реакцию с MR, растут на голодном агаре с цитратом (кроме S. typhi), не ферментируют лактозу (кроме S. arizonae и S. diarizonae), не образуют индола, не имеют уреазы и дают отрицательную реакцию Фогеса – Проскауэра. Содержание Г + Ц в ДНК составлят 50 – 52 мол %. Культуральные свойства такие же, как у возбудителей тифа и паратифов А и В.
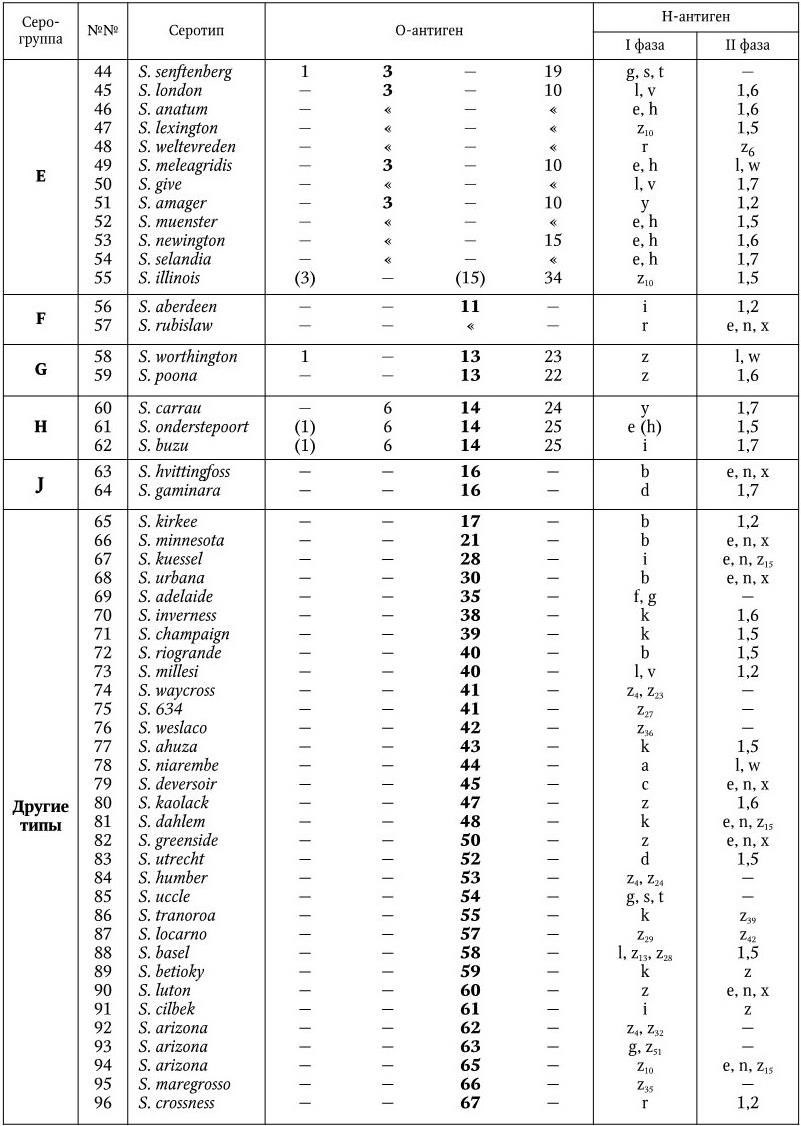
Классификация. Род Salmonella включает единственный вид S. enteritica (ранее – S. choleraesuis) с семью основными подвидами: S. choleraesuis, S. salamae, S. arizonae, S. diarizonae, S. houtenae, S. bongori, S. indica, которые различаются по ряду биохимических признаков (табл. 35).
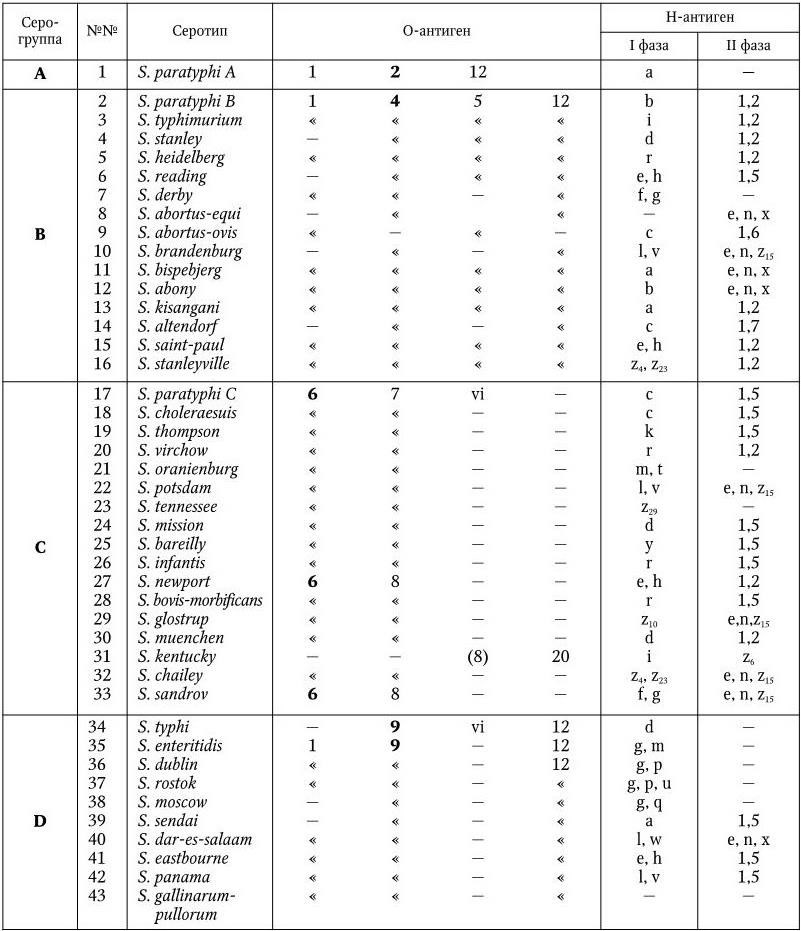
Серологическая классификация сальмонелл по Уайту и Кауффманну.
У сальмонелл имеются О-, Н– и К-антигены. Обнаружено 65 различных О-антигенов. Они обозначаются арабскими цифрами от 1 до 67. По О-антигену сальмонеллы разделены на 50 серологических групп (A – Z, 51 – 65). Некоторые О-антигены встречаются у сальмонелл двух групп (О6, О8); антигены О1 и О12 – у представителей многих серогрупп, но представители каждой серогруппы имеют один главный, общий для всех О-антиген, по которому они и разделяются на серогруппы (в табл. 35 эти антигены выделены жирным шрифтом). Специфичность О-антигенов определяется полисахаридом ЛПС. У всех сальмонелл полисахариды обладают общим внутренним ядром, к которому прикрепляются О-специфические боковые цепи, состоящие из повторяющегося набора олигосахаров. Различия в связях и композициях этих сахаров обеспечивают химическую основу серологической специфичности. Например, специфичность О2-антигена определяется сахаром паратозой, О4 – абеквозой, О9 – тивелозой и т. д.
Таблица 35
Дифференциация подвидов S. enteritica

Примечание. (+) – признак положительный; ( – ) – признак отсутствует; (×) – ферментация поздняя и нерегулярная; (?) – неизвестно.
У сальмонелл различают два типа Н-антигенов: I фаза и II фаза. Обнаружено более 80 вариантов Н-антигенов I фазы. Они обозначаются строчными латинскими буквами (a – z) и арабскими цифрами (z1– z59). Н-антигены I фазы встречаются только у определенных серотипов, иначе говоря, по Н-антигенам серогруппы разделяют на серотипы. Нантигены II фазы имеют в своем составе общие компоненты, они обозначаются арабскими цифрами и встречаются у разных серовариантов. Обнаружено 9 Н-антигенов II фазы.
К-антигены сальмонелл представлены разными вариантами: Vi– (S. typhi, S. paratyphi C, S. dublin), M-, 5-антигены. О значении Vi-антигена сказано выше.
Современная серологическая классификация сальмонелл насчитывает уже свыше 2200 серовариантов. В табл. 36 перечислены сальмонеллы, которые чаще всего вызывают заболевания людей и животных.
Для серологической идентификации сальмонелл выпускают диагностические адсорбированные моно– и поливалентные О– и Н-сыворотки, содержащие агглютинины к О– и Н-антигенам тех серотипов сальмонелл, которые чаще всего вызывают заболевания людей и животных.
Бо́льшая часть сальмонелл (около 98 %) чувствительна к сальмонеллезному фагу О1. Кроме того, разработана схема фаготипирования наиболее частого возбудителя сальмонеллезов – S. typhimurium, она позволяет дифференцировать более 120 его фаготипов.
Резистентность. Устойчивость сальмонелл по отношению к некоторым физическим и химическим факторам довольно высока. Нагревание при температуре 70 °C выдерживают в течение 30 мин. Устойчивость к высокой температуре повышается, когда сальмонеллы находятся в пищевых продуктах, особенно в мясе. При варке в течение 2,5 ч мясо, зараженное сальмонеллами и заложенное в холодную воду, становится стерильным в кусках весом не более 400,0 г при толщине кусков 6 см; а при закладке в кипяток стерильность за тот же срок варки достигается лишь в кусках весом до 200,0 г, при толщине их 5,0 – 5,5 см. Соление и копчение мяса оказывают относительно слабое действие на сальмонеллы. При содержании NaCl 12 – 20 % в соленом и копченом мясе сальмонеллы выживают при комнатной температуре до 1,5 – 2 мес. Обычные химические дезинфектанты убивают сальмонеллы за 10 – 15 мин.
Факторы патогенности. У сальмонелл имеются факторы адгезии и колонизации, факторы инвазии; они имеют эндотоксин и, наконец, они, по крайней мере S. typhimurium и некоторые другие серотипы, могут синтезировать два типа экзотоксинов:
а) термолабильные и термостабильные энтеротоксины типа LT и ST;
б) шигаподобные цитотоксины.
Особенностью токсинов является внутриклеточная локализация и выделение после разрушения бактериальных клеток. LT сальмонелл имеет структурное и функциональное сходство с LT энтеротоксигенных E. coli и с холерогеном. Его м. м. 110 кД, он устойчив в диапазоне рН 2,0 – 10,0. Токсинообразование у сальмонелл сочетается с наличием у них двух факторов кожной проницаемости:
а) быстродействующего – продуцируется многими штаммами сальмонелл, термостабилен (при 100 °C сохраняется в течение 4 ч), действует в течение 1 – 2 ч;
б) замедленного – термолабилен (разрушается при 75 °C в течение 30 мин), вызывает эффект (уплотнение кожи кролика) через 18 – 24 ч после введения.
Молекулярные механизмы диареи, вызываемой LT и ST сальмонелл, по-видимому, также связаны с нарушением функции аденилат– и гуанилатциклазных систем энтероцитов. Цитотоксин, продуцируемый сальмонеллами, термолабилен, его цитотоксическое действие проявляется в угнетении синтеза белка энтероцитами. Обнаружено, что отдельные штаммы сальмонелл могут одновременно синтезировать LT, ST и цитотоксин, другие – только цитотоксин.
Вирулентность сальмонелл зависит также от обнаруженной у них плазмиды с м. м. 60 МД, утрата ее значительно снижает вирулентность бактерий. Предполагается, что появление эпидемических клонов сальмонелл связано с приобретением ими плазмид вирулентности и R-плазмид.
Особенности эпидемиологии. Из числа известных сальмонелл лишь S. typhi и S. paratyphi A вызывают заболевание только у человека – брюшной тиф и паратиф А. Все остальные сальмонеллы патогенны также для животных. Первичным источником сальмонелл являются животные: крупный рогатый скот, свиньи, водоплавающие птицы, куры, синантропные грызуны и большое число других животных. Заболевания животных, вызываемые сальмонеллами, подразделяются на 3 основные группы: первичные сальмонеллезы, вторичные сальмонеллезы и энтерит крупного рогатого скота. Первичные сальмонеллезы (паратиф телят, тиф поросят, тиф кур, дизентерия цыплят и т. д.) вызываются определенными возбудителями и протекают с характерной клиникой. Вторичные сальмонеллезы возникают при условиях, когда организм животного в результате каких-то причин (нередко различных болезней) резко ослаблен; они не связаны с конкретными типами сальмонелл у определенных животных, вызываются различными их серотипами, но чаще всего – S. typhimurium.
Таблица 36
Сокращенная схема серологической классификации сальмонелл
Энтерит крупного рогатого скота характеризуется определенной клинической картиной и в этом отношении сходен с первичным сальмонеллезом. Однако энтерит в данном случае является вторичным проявлением, первичную же роль играют различные предрасполагающие обстоятельства. Возбудителями его чаще всего бывают S. enteritidis и S. typhimurium.
Наиболее опасными источниками пищевых токсикоинфекций являются животные, страдающие вторичным сальмонеллезом и энтеритом крупного рогатого скота. Большую роль в эпидемиологии сальмонеллезов играют водоплавающие птицы и их яйца, а также куры, их яйца и другие птицепродукты. Сальмонеллы могут попасть в яйцо непосредственно во время его развития, но могут легко проникнуть и через неповрежденную скорлупу. Вспышки токсикоинфекций чаще всего связаны с употреблением мяса, инфицированного сальмонеллами, – до 70 – 75 %, в том числе до 30 % мяса скота вынужденного забоя. Вынужденному забою часто подвергают животных, находящихся в агональном состоянии. У ослабленных животных сальмонеллы легко проникают из кишечника в кровь, а через нее – в мышцы, обусловливая прижизненное инфицирование мяса. На долю яиц и птицепродуктов приходится более 10 %, на долю молока и молочных продуктов – около 10 %, и на долю рыбопродуктов – около 3 – 5 % всех вспышек сальмонеллезов.
Современная эпидемиология сальмонеллезов характеризуется постоянным ростом заболеваемости людей и животных и увеличением числа серотипов сальмонелл, вызывающих эти заболевания. С 1984 по 1988 г. в Англии число случаев сальмонеллезов возросло в 6 раз. Однако специалисты ВОЗ полагают, что истинное число случаев сальмонеллезов остается неизвестным. По их мнению, выявляется не более 5 – 10 % инфицированных лиц. Одной из основных причин роста заболеваемости сальмонеллезом является инфицирование пищевых продуктов при их производстве в результате широкого распространения сальмонелл на объектах внешней среды и на обрабатывающих предприятиях, куда поступают животные, у которых сальмонеллез протекает в скрытой форме. Одной из главных причин широкой циркуляции сальмонелл среди животных является применение корма, содержащего переработанные побочные продукты животного происхождения и очень часто зараженного сальмонеллами.
Несмотря на постоянное увеличение числа серотипов сальмонелл, выделяемых от людей и животных, по-прежнему до 98 % всех случаев сальмонеллезов обусловлено сальмонеллами групп A, B, C, D и E, в первую очередь S. typhimurium и S. enteritidis (до 70 – 80 % случаев заболеваний).
Другой немаловажной особенностью современной эпидемиологии сальмонеллезов является установление роли человека как источника заражения сальмонеллами. Заражение человека от больного или бактерионосителя возможно не только через пищу, в которой сальмонеллы находят хорошие условия для размножения, но и контактно-бытовым путем. Этот способ заражения приводит к широкому распространению бессимптомного бактерионосительства.
Крупная водная эпидемия сальмонеллезной инфекции в 1965 г. в Риверсайде (США), обусловленная S. typhimurium (заболело около 16 тыс. человек), показала, что заражение сальмонеллами возможно не только через пищу, но и через воду.
К особенностям эпидемиологии сальмонеллезов за последние годы следует отнести также повышение этиологической роли S. enteritidis, активизацию пищевого пути передачи возбудителей инфекции с преобладанием роли птицы и птицепродуктов, увеличение числа групповых заболеваний, в том числе внутрибольничных, рост заболеваемости среди детей до 14 лет (более 60 % всех случаев заболеваний).
Особенности патогенеза и клиники. Сальмонеллезы могут протекать с различной клинической картиной: в виде пищевой токсикоинфекции, сальмонеллезной диареи и генерализованной (тифозной) формы, – все зависит от величины заражающей дозы, степени вирулентности возбудителей и иммунного статуса организма. Массивное обсеменение сальмонеллами пищевого продукта обусловливает пищевую токсикоинфекцию, при которой основные симптомы связаны с поступлением возбудителя в кровь в большом количестве, его распадом и высвобождением эндотоксина. В основе сальмонеллезной диареи лежит колонизация сальмонеллами энтероцитов. После прикрепления к гликокаликсу тонкого кишечника сальмонеллы внедряются между ворсинками и, прикрепляясь к плазмолемме энтероцитов, колонизируют ее, повреждают микроворсинки, вызывают слущивание энтероцитов и умеренное воспаление слизистой оболочки. Освобождающийся энтеротоксин вызывает диарею, а цитотоксин – гибель клеток. Сальмонеллы размножаются на плазмолемме, но не в энтероцитах, а происходит их инвазия через эпителий в подлежащие ткани слизистой оболочки, они транспортируются через нее в макрофагах, поступают в лимфу и кровь, вызывая бактериемию и генерализацию инфекционного процесса.
Постинфекционный иммунитет изучен недостаточно. Судя по тому, что сальмонеллезом болеют главным образом дети, постинфекционный иммунитет достаточно напряженный, но является, по-видимому, типоспецифическим.
Лабораторная диагностика. Основной метод диагностики сальмонеллезной инфекции – бактериологический. Материалом для исследования служат испражнения, рвотные массы, кровь, промывные воды желудка, моча, послужившие причиной отравления продукты. Особенности бактериологической диагностики сальмонеллезов:
1) использование сред обогащения (селенитовой, магниевой), в особенности при исследовании испражнений;
2) для обнаружения сальмонелл пробы следует брать из последней, более жидкой, части испражнений (верхнего отдела тонкого кишечника);
3) соблюдать соотношение 1: 5 (одна часть испражнений на 5 частей среды);
4) в связи с тем, что S. arizonae и S. diarizonae ферментируют лактозу, использовать в качестве дифференциально-диагностической не только среду Эндо, но и висмут-сульфит-агар, на котором колонии сальмонелл приобретают черный (некоторые – зеленоватый) цвет;
5) для посева крови использовать среду Рапопорт;
6) использование для предварительной идентификации колоний О1-сальмонеллезного фага, к которому чувствительны до 98 % сальмонелл;
7) для окончательной идентификации выделенных культур вначале используют поливалентные адсорбированные О– и Н-сыворотки, а затем – соответствующие моновалентные О– и Н-сыворотки.
Для быстрого обнаружения сальмонелл могут быть использованы поливалентные иммунофлуоресцентные сыворотки. Для выявления антител в сыворотке крови больных и переболевших используется РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп A, B, C, D и E.
Лечение. В случае пищевой токсикоинфекции – промывание желудка, применение антибактериальных препаратов, общеукрепляющих средств. При сальмонеллезных диареях – восстановление нормального водно-солевого обмена, антибиотикотерапия.
Специфическая профилактика не применяется, хотя предложены различные вакцины из убитых и живых (мутантных) штаммов S. typhimurium.
Bacillus cereus
Важную роль в этиологии пищевых отравлений играет Bacillus cereus. B. cereus – грамположительные, не образующие капсулы палочки размером 1,0 – 1,2 × 3 – 5 мкм, подвижные (перитрихи) или неподвижные. Клетки имеют тенденцию располагаться в виде цепочек, от стабильности которых во многом зависит форма колонии, – она сильно варьирует у различных штаммов. Образуют эллипсоидной формы споры, которые располагаются центрально, но не расширяют клетки. Бактерии, выросшие на агаре с глюкозой, на ранней стадии роста содержат липидные включения в виде капель (поли-β-гидроксимасляная кислота), а также часто зерна волютина.
B. cereus хемоорганотрофы, аэробы или факультативные анаэробы, способны расти в столбике анаэробного агара. Содержание Г + Ц в ДНК составляет 32 – 37 мол %. Они обычно каталазопозитивны, восстанавливают нитраты в нитриты; ферментируют глюкозу, мальтозу, часто сахарозу с образованием только кислоты, без газа; не ферментируют маннит; образуют ацетоин (положительная проба Фогеса – Проскауэра), лецитиназу, растут на цитратной среде, а также в присутствии 0,001 % лизоцима. Температурный оптимум для их роста 35 – 45 °C, температурный диапазон роста 10 – 45 °C. Синтезируют и секретируют гемолизин, экзотоксины; ферменты, лизирующие бактериальные клетки, протеолитические ферменты, фосфолипазу С, некоторые штаммы на среде с крахмалом и железом образуют красный пигмент, некоторые – на различных средах флуоресцирующие желтовато-зеленого цвета пигменты. Для роста различные штаммы нуждаются в одной или нескольких аминокислотах. На желточно-солевом агаре с полимиксином B. cereus образует восковидные колонии с изрезанными краями, окруженные радужным венчиком (положительная проба на лецитиназу).
B. cereus очень похожа по своим признакам на B. thuringiensis и отличается от нее отсутствием в клетках кристаллов токсических белков. По O-антигенам в группе B. cereus – B. thuringiensis выделено 13 серотипов, эти два вида бактерий различаются также по своим H-антигенам.
B. cereus – условно-патогенная бактерия, способная вызывать различные заболевания у человека и животных. Помимо пищевых отравлений у людей, она может быть причиной пневмонии, сепсиса, менингита, миокардита, заболеваний почек и мочевыводящих путей, остеомиелита и др. Во многом это зависит от факторов патогенности, которыми обладают различные варианты B. cereus. Места обитания ее – почва, вода, растительные субстраты. Большую роль B. cereus в этиологии пищевых отравлений обусловлена тем, что различные штаммы ее способны продуцировать не менее 5 различных типов энтеротоксинов: термолабильный энтеротоксин (ТЛЭ), обладающий гемолитической активностью; ТЛЭ, не обладающий гемолитической активностью; цитотоксин-К; Т-энтеротоксин и термостабильный энтеротоксин (ТСЭ). Пищевые отравления, вызываемые теми штаммами B. cereus, которые продуцируют 3 типа ТЛЭ и цитотоксин-К, клинически протекают в виде токсикоинфекции, главным проявлением которой выступает диарея (диарейный тип). Они обычно связаны с употреблением мясных продуктов, рыбы, овощей, супов и молочных продуктов и по симптомам напоминают пищевые отравления, вызванные Clostridium perfringens. Пищевые отравления, причиной которых становится ТСЭ, протекают в виде интоксикации, для них характерен рвотный синдром (рвотный тип отравлений). Они напоминают отравления, вызванные энтеротоксинами стафилококка, и связаны в основном с употреблением блюд из риса, макарон и других мучных продуктов.
При бактериологической диагностике таких пищевых отравлений очень важно учитывать количественное содержание B. cereus в исследуемом материале (выделения больных, пищевые продукты и т. п.) – чем больше в нем бактерий, тем вероятнее их роль в отравлении. Для более точного диагноза предложены специальные методы обнаружения ТЛЭ и ТСЭ B. cereus, применение ПЦР и моноклональных антител, а также генотипирование.
Микробиология дизентерии
Дизентерия – инфекционное заболевание, характеризующееся общей интоксикацией организма, поносом и своеобразным поражением слизистой оболочки толстого кишечника. Она является одним из наиболее частых острых кишечных заболеваний в мире. Заболевание известно с давних времен под названием «кровавого поноса», однако природа его оказалась различной. В 1875 г. русский ученый Ф. А. Леш выделил от больного кровавым поносом амебу Entamoeba histolytica, в последующие 15 лет была установлена самостоятельность этой болезни, за которой сохранилось название амебиаза.
Возбудителями собственно дизентерии является большая группа биологически сходных бактерий, объединенных в род Shigella. Впервые возбудитель был обнаружен в 1888 г. А. Шантемесом и Ф. Видалем; в 1891 г. он был описан А. В. Григорьевым, а в 1898 г. К. Шига с помощью полученной им от больного сыворотки идентифицировал возбудителя у 34 больных дизентерией, окончательно доказав этиологическую роль этой бактерии. Однако в последующие годы были обнаружены и другие возбудители дизентерии: в 1900 г. – С. Флекснером, в 1915 г. – К. Зонне, в 1917 г. – К. Штуцером и К. Шмитцем, в 1932 г. – Дж. Бойдом, в 1934 г. – Д. Ларджем, в 1943 г. – А. Саксом. В настоящее время род Shigella включает более 40 серотипов. Все они представляют собой короткие неподвижные грамотрицательные палочки, не образующие спор и капсул, которые хорошо растут на обычных питательных средах, не растут на голодной среде с цитратом или малонатом в качестве единственного источника углерода; не образуют H2S, не имеют уреазы; реакция Фогеса – Проскауэра отрицательна; глюкозу и некоторые другие углеводы ферментируют с образованием кислоты без газа (кроме некоторых биотипов Shigella flexneri: S. manchestеr и S. newcastle); как правило, не ферментируют лактозу (за исключением шигелл Зонне), адонит, салицин и инозит, не разжижают желатин, обычно образуют каталазу, не имеют лизиндекарбоксилазы и фенилаланиндезаминазы. Содержание Г + Ц в ДНК составляет 49 – 53 мол %. Шигеллы – факультативные анаэробы, температурный оптимум для роста 37 °C, при температуре выше 45 °C не растут, оптимальная рН среды 6,7 – 7,2. Колонии на плотных средах – круглые, выпуклые, полупрозрачные, в случае диссоциации образуются шероховатые колонии R-формы. Рост на МПБ в виде равномерного помутнения, шероховатые формы образуют осадок. Свежевыделенные культуры шигелл Зонне обычно образуют колонии двух типов: мелкие круглые выпуклые (I фаза), крупные плоские (II фаза). Характер колонии зависит от наличия (I фаза) или отсутствия (II фаза) плазмиды с м. м. 120 МД, которая определяет также вирулентность шигелл Зонне.
Международная классификация шигелл построена с учетом их биохимических признаков (маннит-неферментирующие, маннит-ферментирующие, медленно ферментирующие лактозу шигеллы) и особенностей антигенной структуры (табл. 37).
У шигелл обнаружены различные по специфичности О-антигены: общие для семейства Enterobacteriaceae, родовые, видовые, групповые и типоспецифические, а также К-антигены; Н-антигенов у них нет.
Таблица 37
Классификация бактерий рода Shigella
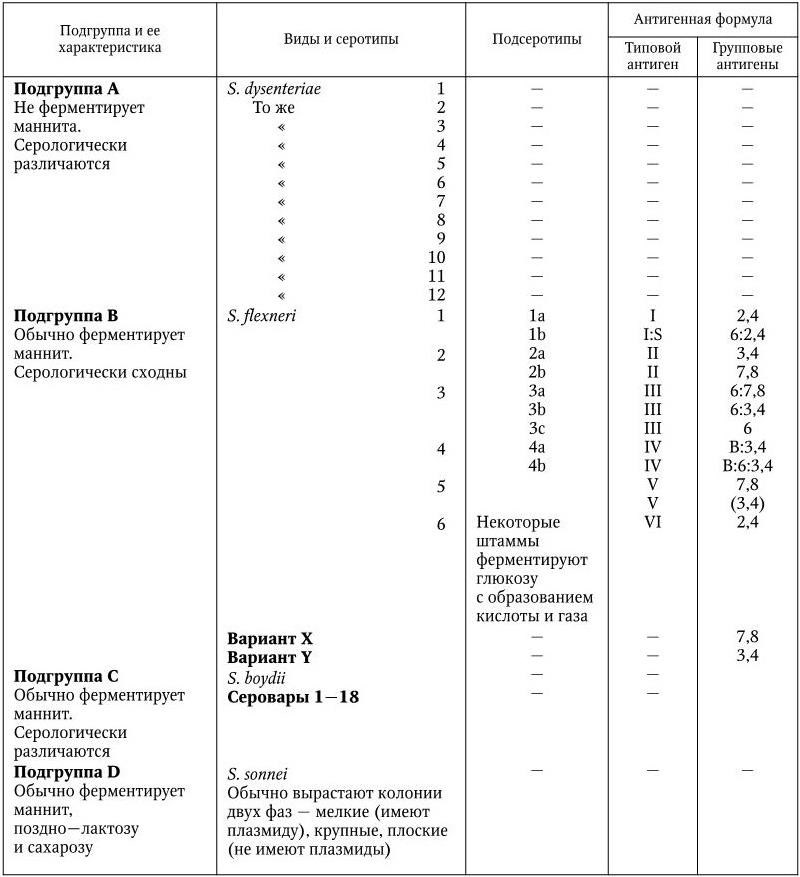
В классификации учитываются только групповые и типоспецифические О-антигены. В соответствии с этими признаками род Shigella подразделяется на 4 подгруппы, или 4 вида, и включает 44 серотипа. В подгруппу А (вид Shigella dysenteriae) включены шигеллы, не ферментирующие маннита. Вид включает в себя 12 серотипов (1 – 12). Каждый серотип имеет свой особый типовой антиген; антигенные связи между серотипами, а также с другими видами шигелл выражены слабо. К подгруппе В (вид Shigella flexneri) относятся шигеллы, обычно ферментирующие маннит. Шигеллы этого вида серологически родственны друг другу: они содержат типоспецифические антигены (I – VI), по которым подразделяются на серотипы (1 – 6), и групповые антигены, которые обнаруживаются в разных составах у каждого серотипа и по которым серотипы подразделяются на подсеротипы. Кроме того, этот вид включает два антигенных варианта – X и Y, у которых нет типовых антигенов, они различаются по наборам групповых антигенов. Серотип S. flexneri 6 не имеет подсеротипов, но его разделяют на 3 биохимических типа по особенностям ферментации глюкозы, маннита и дульцита (табл. 38).
Таблица 38
Биотипы S. flexneri 6
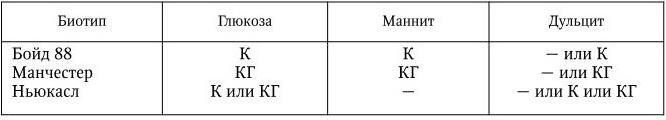
Примечание. К – ферментация с образованием только кислоты; КГ – ферментация с образованием кислоты и газа; ( – ) – ферментация отсутствует.
Липополисахаридный антиген О у всех шигелл Флекснера содержит групповой антиген 3, 4 как главную первичную структуру, его синтез контролируется хромосомным геном, локализованным около his-локуса. Типоспецифические антигены I, II, IV, V и групповые антигены 6, 7, 8 являются результатом модификации антигенов 3, 4 (гликозилирования или ацетилирования) и определяются генами соответствующих конвертирующих профагов, место интеграции которых располагается в районе lac – pro хромосомы шигелл.
Появившийся на территории страны в 80-х гг. ХХ в. и получивший широкое распространение новый подсеротип S. flexneri 4 (IV:7, 8) отличается от подсеротипа 4a (IV:3, 4) и 4b (IV:3, 4, 6), возник из варианта S. flexneri Y (IV:3, 4) вследствие лизогенизации его конвертирующими профагами IV и 7, 8.
К подгруппе С (вид Shigella boydii) относятся шигеллы, обычно ферментирующие маннит. Члены группы серологически отличаются друг от друга. Антигенные связи внутри вида выражены слабо. Вид включает 18 серотипов (1 – 18), каждый из которых имеет свой главный типовой антиген.
В подгруппу D (вид Shigella sonnei) включены шигеллы, обычно ферментирующие маннит и способные медленно (через 24 ч инкубации и позже) ферментировать лактозу и сахарозу. Вид S. sonnei включает один серотип, однако колонии I и II фаз обладают своими типоспецифическими антигенами. Для внутривидовой классификации шигелл Зонне предложено два метода:
1) деление их на 14 биохимических типов и подтипов по способности ферментировать мальтозу, рамнозу и ксилозу; 2) деление на фаготипы по чувствительности к набору соответствующих фагов.
Эти способы типирования имеют главным образом эпидемиологическое значение. Кроме того, шигеллы Зонне и шигеллы Флекснера с этой же целью подвергают типированию по способности синтезировать специфические колицины (колициногенотипирование) и по чувствительности к известным колицинам (колицинотипирование). Для определения типа продуцируемых шигеллами колицинов Дж. Абботом и Р. Шеноном предложены наборы типовых и индикаторных штаммов шигелл, а для определения чувствительности шигелл к известным типам колицинов используют набор эталонных колициногенных штаммов П. Фредерика.
Резистентность. Шигеллы обладают достаточно высокой устойчивостью к факторам внешней среды. Они выживают на хлопчатобумажной ткани и на бумаге до 30 – 36 дней, в высохших испражнениях – до 4 – 5 мес., в почве – до 3 – 4 мес., в воде – от 0,5 до 3 мес., на фруктах и овощах – до 2 нед., в молоке и молочных продуктах – до нескольких недель; при температуре 60 °C погибают через 15 – 20 мин. Чувствительны к растворам хлорамина, активному хлору и другим дезинфектантам.
Факторы патогенности. Важнейшее биологическое свойство шигелл, обусловливающее их патогенность, – способность внедряться в эпителиальные клетки, размножаться в них и вызывать их гибель. Этот эффект может быть обнаружен с помощью кератоконъюнктивальной пробы (введение под нижнее веко морской свинки одной петли культуры шигелл (2 – 3 млрд бактерий) вызывает развитие серозногнойного кератоконъюнктивита), а также путем заражения культур клеток (цитотоксическое действие) или куриных эмбрионов (их гибель), или интраназально белых мышей (развитие пневмонии). Основные факторы патогенности шигелл можно разбить на три группы:
1) факторы, определяющие взаимодействие с эпителием слизистой оболочки;
2) факторы, обеспечивающие устойчивость к гуморальным и клеточным механизмам защиты макроорганизма и способность шигелл размножаться в его клетках;
3) способность продуцировать токсины и токсические продукты, которые обусловливают развитие собственно патологического процесса.
Первая группа включает в себя факторы адгезии и колонизации: их роль выполняют пили, белки наружной мембраны и ЛПС. Адгезии и колонизации способствуют ферменты, разрушающие слизь, – нейраминидаза, гиалуронидаза, муциназа. Вторая группа включает факторы инвазии, которые способствуют проникновению шигелл в энтероциты и их размножению в них и в макрофагах с одновременным проявлением цитотоксического и (или) энтеротоксического эффекта. Эти свойства контролируются генами плазмиды с м. м. 140 МД (она кодирует синтез белков наружной мембраны, обусловливающих инвазию) и хромосомными генами шигелл: kcp A (обусловливает кератоконъюнктивит), cyt (отвечает за разрушение клеток), а также другими генами, еще не идентифицированными. Защита шигелл от фагоцитоза обеспечивается поверхностным К-антигеном, антигенами 3, 4 и липополисахаридом. Кроме того, липид А эндотоксина шигелл обладает иммуносупрессивным действием: подавляет активность клеток иммунной памяти.
К третьей группе факторов патогенности относятся эндотоксин и обнаруженные у шигелл два типа экзотоксинов – экзотоксины Шига и шигаподобные (SLT-I и SLT-II), цитотоксические свойства которых наиболее сильно выражены у S. dysenteriae 1. Шига– и шигаподобные токсины обнаружены и у других серотипов S. dysenteriae, их образуют также S. flexneri, S. sonnei, S. boydii, EНEC и некоторые сальмонеллы. Синтез этих токсинов контролируется tox-генами конвертирующих фагов. Энтеротоксины типа LT обнаружены у шигелл Флекснера, Зонне и Бойда. Синтез LT у них контролируется плазмидными генами. Энтеротоксин стимулирует активность аденилатциклазы и отвечает за развитие диареи. Токсин Шига, или нейротоксин, не реагирует с аденилатциклазной системой, а оказывает прямое цитотоксическое действие. Токсины Шига и шигаподобные (SLT-I и SLT-II) имеют м. м. 70 кД и состоят из субъединиц А и В (последние из 5 одинаковых малых субъединиц). Рецептором для токсинов служит гликолипид мембраны клетки.
Вирулентность шигелл Зонне зависит также от плазмиды с м. м. 120 МД. Она контролирует синтез около 40 полипептидов наружной мембраны, семь из них связаны с вирулентностью. Шигеллы Зонне, имеющие эту плазмиду, образуют колонии I фазы и обладают вирулентностью. Культуры, утратившие плазмиду, образуют колонии II фазы и лишены вирулентности. Плазмиды с м. м. 120 – 140 МД обнаружены у шигелл Флекснера и Бойда. Липополисахарид шигелл является сильным эндотоксином.
Особенности эпидемиологии. Источником инфекции является только человек. Никакие животные в природе дизентерией не болеют. В экспериментальных условиях дизентерию удается воспроизвести только у обезьян. Способ заражения – фекально-оральный. Пути передачи – водный (преобладающий для шигелл Флекснера), пищевой, особенно важная роль принадлежит молоку и молочным продуктам (преобладающий путь заражения для шигелл Зонне), и контактно-бытовой, особенно для вида S. dysenteriae.
Особенностью эпидемиологии дизентерии является смена видового состава возбудителей, а также биотипов Зонне и серотипов Флекснера в определенных регионах. Например, до конца 30-х гг. XX в. на долю S. dysenteriae 1 приходилось до 30 – 40 % всех случаев заболеваний дизентерией, а затем этот серотип стал встречаться все реже и реже и почти исчез. Однако в 1960 – 1980-е гг. S. dysenteriae вновь появилась на исторической арене и вызвала серию эпидемий, которые привели к формированию трех гиперэндемических очагов ее – в Центральной Америке, Центральной Африке и Южной Азии (Индия, Пакистан, Бангладеш и другие страны). Причины смены видового состава возбудителей дизентерии, вероятно, связаны с изменением коллективного иммунитета и с изменением свойств дизентерийных бактерий. В частности, возвращение S. dysenteriae 1 и широкое распространение ее, послужившее причиной формирования гиперэндемических очагов дизентерии, связывают с приобретением ею плазмид, обусловивших множественную лекарственную устойчивость и повышенную вирулентность.
Особенности патогенеза и клиники. Инкубационный период при дизентерии 2 – 5 дней, иногда меньше суток. Формирование инфекционного очага в слизистой оболочке нисходящего отдела толстого кишечника (сигмовидная и прямая кишка), куда проникает возбудитель дизентерии, носит циклический характер: адгезия, колонизация, внедрение шигелл в цитоплазму энтероцитов, их внутриклеточное размножение, разрушение и отторжение эпителиальных клеток, выход возбудителей в просвет кишечника; вслед за этим начинается очередной цикл – адгезия, колонизация и т. д. Интенсивность циклов зависит от концентрации возбудителей в пристеночном слое слизистой оболочки. В результате повторяющихся циклов воспалительный очаг разрастается, образующиеся язвы, соединяясь, увеличивают обнаженность кишечной стенки, вследствие чего в испражнениях появляются кровь, слизисто-гнойные комочки, полиморфноядерные лейкоциты. Цитотоксины (SLT-I и SLT-II) обусловливают разрушение клеток, энтеротоксин – диарею, эндотоксины – общую интоксикацию. Клиника дизентерии во многом определяется тем, какой тип экзотоксинов в большей степени продуцируется возбудителем, степенью его аллергизирующего воздействия и иммунным статусом организма. Однако многие вопросы патогенеза дизентерии остаются еще не выясненными, в частности: особенности течения дизентерии у детей первых двух лет жизни, причины перехода острой дизентерии в хроническую, значение сенсибилизации, механизм местного иммунитета слизистой кишечника и др. Наиболее типичными клиническими проявлениями дизентерии служат понос, частые позывы: в тяжелых случаях до 50 и более раз в сутки, тенезмы (болезненные спазмы прямой кишки) и общая интоксикация. Характер стула определяется степенью поражения толстого кишечника. Наиболее тяжело протекает дизентерия, вызванная S. dysenteriae 1, наиболее легко – дизентерия Зонне.
Постинфекционный иммунитет. Как показали наблюдения над обезьянами, после перенесенной дизентерии остается прочный и достаточно длительный иммунитет. Он обусловлен антимикробными антителами, антитоксинами, повышением активности макрофагов и Т-лимфоцитами. Значительную роль играет местный иммунитет слизистой оболочки кишечника, опосредуемый IgAs. Однако иммунитет носит типоспецифический характер, прочного перекрестного иммунитета не возникает.
Лабораторная диагностика. Основной метод – бактериологический. Материалом для исследования служат испражнения. Схема выделения возбудителя: посев на дифференциально-диагностические среды Эндо и Плоскирева (параллельно на среду обогащения с последующим посевом на среды Эндо, Плоскирева) для выделения изолированных колоний, получение чистой культуры, изучение ее биохимических свойств и, с учетом последних, идентификация при помощи поливалентных и моновалентных диагностических агглютинирующих сывороток. Выпускают следующие коммерческие сыворотки.
1. К шигеллам, не ферментирующим маннит:
к S. dysenteriae 1 и 2 (поливалентные и моновалентные),
к S. dysenteriae 3 – 7 (поливалентные и моновалентные),
к S. dysenteriae 8 – 12 (поливалентные и моновалентные).
2. К шигеллам, ферментирующим маннит:
к типовым антигенам S. flexneri I, II, III, IV, V, VI,
к групповым антигенам S. flexneri 3, 4, 6, 7, 8 – поливалентная,
к антигенам S. boydii 1 – 18 (поливалентная и моновалентные), к антигенам S. sonnei I фазы, II фазы,
к антигенам S. flexneri I – VI + S. sonnei – поливалентная.
Для быстрой идентификации шигелл рекомендуется следующий метод: подозрительную колонию (лактозонегативная на среде Эндо) пересевают на среду TSI (англ. triple sugar iron) – трехсахарный агар (глюкоза, лактоза, сахароза) с железом для определения продукции H2S; или на среду, содержащую глюкозу, лактозу, сахарозу, железо и мочевину. Любой организм, который расщепляет мочевину через 4 – 6 ч инкубирования, вероятнее всего, относится к роду Proteus и может быть исключен. Микроорганизм, образующий H2S или имеющий уреазу, или образующий кислоту на косячке (ферментирует лактозу или сахарозу), может быть исключен, хотя штаммы, образующие H2S, должны быть исследованы как возможные члены рода Salmonella. Во всех других случаях культура, выросшая на этих средах, должна быть исследована и, если ферментирует глюкозу (изменение цвета столбика), выделена в чистом виде. Одновременно она может быть исследована в реакции агглютинации на стекле с соответствующими антисыворотками к роду Shigella. При необходимости проводят другие биохимические тесты, проверяющие принадлежность к роду Shigella, а также изучают подвижность.
Для обнаружения антигенов в крови (в том числе в составе ЦИК), моче и испражнениях могут быть использованы следующие методы: РПГА, РСК, реакция коагглютинации (в моче и испражнениях), ИФМ, РАГА (в сыворотке крови). Эти методы высокоэффективны, специфичны и пригодны для ранней диагностики.
Для серологической диагностики могут быть использованы: РПГА с соответствующими эритроцитарными диагностикумами, иммунофлуоресцентный метод (в непрямой модификации), метод Кумбса (определение титра неполных антител). Диагностическое значение имеет также аллергическая проба с дизентерином (раствор белковых фракций шигелл Флекснера и Зонне). Реакцию учитывают через 24 ч. Она считается положительной при наличии гиперемии и инфильтрата диаметром 10 – 20 мм.
Лечение. Основное внимание уделяется восстановлению нормального водно-солевого обмена, рациональному питанию, дезинтоксикации, рациональной антибиотикотерапии (с учетом чувствительности возбудителя к антибиотикам). Хороший эффект дает раннее применение поливалентного дизентерийного бактериофага, особенно таблетированного с пектиновым покрытием, которое предохраняет фаг от действия HCl желудочного сока; в тонком кишечнике пектин растворяется, фаги освобождаются и проявляют свое действие. С профилактической целью фаг следует давать не реже одного раза в три дня (срок его выживания в кишечнике).
Проблема специфической профилактики. Для создания искусственного иммунитета против дизентерии были использованы различные вакцины: из убитых бактерий, химические, спиртовая, но все они оказались малоэффективными и сняты с производства. Созданы вакцины против дизентерии Флекснера из живых (мутантных, стрептомицинзависимых) шигелл Флекснера; рибосомальные вакцины, но они также не нашли широкого применения. Поэтому проблема специфической профилактики дизентерии остается нерешенной. Основной путь борьбы с дизентерией заключается в улучшении системы водоснабжения и канализации, обеспечении строгих санитарно-гигиенических режимов на предприятиях пищевой, в особенности молочной промышленности, в детских учреждениях, местах общественного пользования и в соблюдении личной гигиены.
Микробиология холеры
По определению ВОЗ, холера – это болезнь, для которой типичен острый тяжелый обезвоживающий понос с испражнениями в виде рисового отвара, являющийся следствием заражения Vibrio cholerae. В связи с тем, что для нее характерны резко выраженная способность к широкому эпидемическому распространению, тяжелое течение и высокая летальность, холера относится к числу особо опасных инфекций.
Исторической родиной холеры является Индия, точнее, дельта рек Ганг и Брахмапутра (ныне Восточная Индия и Бангладеш), где она существует с незапамятных времен (эпидемии холеры в этом районе наблюдали еще за 500 лет до н. э.). Длительное существование здесь эндемического очага холеры объясняется многими причинами. Холерный вибрион может не только долго сохраняться в воде, но и размножаться в ней при благоприятных условиях – температуре выше 12 °C, наличии органических веществ. Все эти условия в Индии налицо: тропический климат (среднегодовая температура от 25 до 29 °C), обилие осадков и заболоченность, высокая плотность населения, особенно в дельте реки Ганг, большое количество органических веществ в воде, непрерывное круглогодичное загрязнение воды сточными водами и испражнениями, низкий материальный уровень жизни и своеобразные религиозно-культовые обряды населения.
В истории холерных эпидемий можно выделить четыре периода.
I период – до 1817 г., когда холера была сосредоточена только в Восточной и Южной Азии, главным образом в Индии, и не выходила за ее пределы.
II период – с 1817 по 1926 г. С установлением широких экономических и иных связей Индии с европейскими и другими странами холера вышла за пределы Индии и, распространяясь по путям экономических и религиозных связей, вызвала 6 пандемий, которые унесли миллионы человеческих жизней. Россия была первой из европейских стран, куда проникла холера. За период с 1823 по 1926 г. Россия пережила 57 холерных лет. За это время переболело холерой более 5,6 млн человек и умерло от нее 2,14 млн человек (≈ 40 %).
III период – с 1926 по 1961 г. Холера вернулась в свой основной эндемический очаг, и наступил период относительного благополучия. Казалось, что с развитием современных систем очистки питьевой воды, выведения и обеззараживания сточных вод и разработки специальных противохолерных мер, включая создание карантинной службы, страны мира будут надежно защищены от очередного нашествия холеры.
IV период начался в 1961 г. и продолжается до сих пор. Седьмая пандемия началась не в Индии, а в Индонезии, быстро охватила Филиппины, Китай, страны Индокитая, а затем другие страны Азии, Африки и Европы. Особенности этой пандемии заключаются в том, что она, во-первых, вызвана особым вариантом холерного вибриона – V. cholerae eltor, который до 1961 г. официально даже не признавали возбудителем холеры; во-вторых, по продолжительности она превзошла все предшествующие пандемии; в-третьих, она протекала в виде двух волн, первая из которых продолжалась до 1990 г., а вторая началась в 1991 г. и охватила многие страны Южной и Северной Америки, включая США, которые не знали холерных эпидемий с 1866 г.
С 1961 по 1996 г. холерой в 146 странах переболело 3 943 239 человек.
Возбудитель холеры Vibrio cholerae был открыт в 1883 г. во время пятой пандемии Р. Кохом, однако впервые вибрион в испражнениях больных диареей был обнаружен еще в 1854 г. Ф. Пацини.
V. cholerae относится к семейству Vibrionaceae, которое включает в себя несколько родов (Vibrio, Aeromonas, Plesiomonas, Photobacterium). Род Vibrio с 1985 г. насчитывает более 25 видов, из которых наибольшее значение для человека имеют V. cholerae, V. parahaemolyticus, V. alginolyticus, V. vulnificus и V. fluvialis.
Ключевые признаки рода Vibrio. Короткие, не образующие спор и капсул, изогнутые или прямые грамотрицательные палочки, диаметром 0,5 мкм, длиной 1,5 – 3,0 мкм (см. цв. вкл., рис. 101.1), подвижные (V. cholerae – монотрих, у некоторых видов два и большее число полярно расположенных жгутиков); хорошо и быстро растут на обычных средах, хемоорганотрофы, ферментируют углеводы с образованием кислоты без газа (глюкозу ферментируют по пути Эмбдена – Мейергофа). Оксидазоположительны, образуют индол, восстанавливают нитраты в нитриты (V. cholerae дает положительную нитрозо-индоловую реакцию), расщепляют желатин, часто дают положительную реакцию Фогеса – Проскауэра (т. е. образуют ацетилметилкарбинол), уреазы не имеют, не образуют H2S, имеют декарбоксилазы лизина и орнитина, но не имеют аргининдигидролазы. Характерным признаком рода Vibrio является чувствительность большинства штаммов к препарату О/129 (2,4-диамино-6,7-диазопропилптеридин), в то время как представители семейств Pseudomonadaceae и Enterobacteriaceae к этому препарату устойчивы. Вибрионы – аэробы и факультативные анаэробы, температурный оптимум для роста 18 – 37 °C, рН 8,6 – 9,0 (растут в диапазоне рН 6,0 – 9,6), некоторые виды (галофилы) не растут в отсутствие NaCl. Содержание Г + Ц в ДНК составляет 40 – 50 мол % (для V. cholerae около 47 мол %). Для дифференциации внутри семейства Vibrionaceae от морфологически сходных родов Aeromonas и Plesiomonas, а также для отличия от семейства Enterobacteriaceae используются биохимические тесты (табл. 39).
Таблица 39
Дифференциация Vibrio cholerae от родственных грамотрицательных палочек
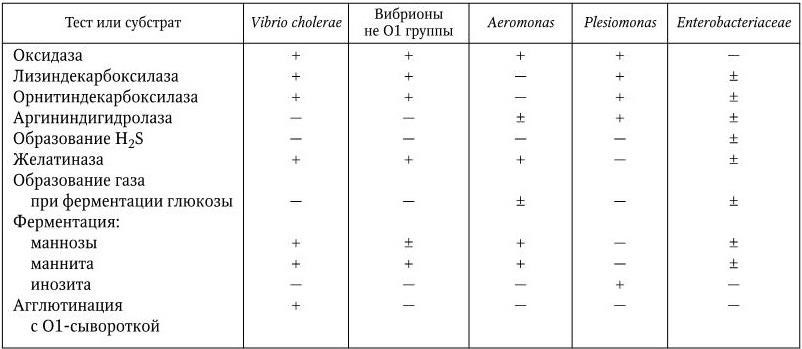
От семейства Pseudomonadaceae холерный вибрион отличается тем, что ферментирует глюкозу только по пути Эмбдена – Мейергофа (без участия О2), в то время как первые потребляют глюкозу только в присутствии О2. Это различие между ними легко выявляется на среде Хью – Лейфсона. Среда содержит питательный агар, глюкозу и индикатор. Посев делают в два столбика со средой Хью – Лейфсона, один из них заливают вазелином (для создания анаэробных условий). В случае роста холерного вибриона цвет среды изменяется в обеих пробирках, в случае роста псевдомонад – только в пробирке без вазелина (аэробные условия роста).
Холерный вибрион очень неприхотлив к питательным средам. Он хорошо и быстро размножается на 1 %-ной щелочной (рН 8,6 – 9,0) пептонной воде (ПВ), содержащей 0,5 – 1,0 % NaCl, обгоняя рост других бактерий. Для подавления роста протея к 1 %-ной ПВ рекомендуется добавлять теллурит калия (в конечном разведении 1: 100 000). 1 %-ная ПВ является наилучшей средой обогащения для холерного вибриона. При росте он образует через 6 – 8 ч на поверхности ПВ нежную рыхлую сероватого цвета пленку, которая при встряхивании легко разрушается и падает на дно в виде хлопьев, ПВ умеренно мутнеет. Для выделения холерного вибриона предложены различные избирательные среды: щелочной агар, желчно-солевой агар, щелочной альбуминат, щелочной агар с кровью, лактозо-сахарозные и другие среды. Наилучшей является среда TCBS (тиосульфатцитрат-бромтимоловый сахарозный агар) и ее модификации. Однако чаще всего используют щелочной МПА, на котором холерный вибрион образует гладкие стекловидно-прозрачные с голубоватым оттенком дисковидные колонии вязкой консистенции.
При посеве уколом в столбик желатина вибрион через 2 сут. при температуре 22 – 23 °C вызывает разжижение с поверхности в виде пузырька, затем воронкообразное и, наконец, послойное.
В молоке вибрион быстро размножается, вызывая через 24 – 48 ч свертывание, а затем наступает пептонизация молока, и через 3 – 4 дня вибрион погибает из-за сдвига рН молока в кислую сторону.
Б. Хейберг по способности ферментировать маннозу, сахарозу и арабинозу распределил все вибрионы (холерные и холероподобные) на ряд групп, количество которых ныне составляет 8 (табл. 40).
Таблица 40
Биохимическая характеристика вибрионов по Хейбергу
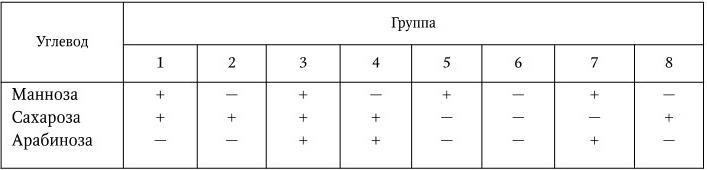
Холерный вибрион относится к первой группе Хейберга.
Вибрионы, сходные по морфологическим, культуральным и биохимическим признакам с холерным, называли и называют по-разному: парахолерными, холероподобными, НАГ-вибрионами (неагглютинирующиеся вибрионы); вибрионами, не относящимися к О1-группе. Последнее название наиболее точно подчеркивает их отношение к холерному вибриону. Как было установлено А. Гарднером и К. Венкатраманом, холерные и холероподобные вибрионы имеют общий Н-антиген, но различаются по О-антигенам. По О-антигену холерные и холероподобные вибрионы к настоящему времени распределяют на 139 О-серогрупп, но их количество все время пополняется. Холерный вибрион относится к О1 группе. Он имеет общий А-антиген и два типоспецифических антигена – В и С, по которым и различают три серотипа V. cholerae – серотип Огава (АВ), серотип Инаба (АС) и серотип Гикошима (АВС). Холерный вибрион в стадии диссоциации имеет OR-антиген. В связи с этим для идентификации V. cholerae используют О-сыворотку, OR-сыворотку и типоспецифические сыворотки Инаба и Огава.
В 1992 – 1993 гг. в Бангладеш, Индии, Китае, Малайзии и других странах началась крупная эпидемия холеры, возбудителем которой оказался новый, ранее не известный серовариант вида Vibrio cholerae. Он отличается от V. cholerae O1 по антигенным признакам: имеет антиген О139 и полисахаридную капсулу и не агглютинируется никакими другими О-сыворотками. Все остальные его морфологические и биологические свойства, включая способность вызывать холеру, т. е. синтезировать экзотоксин-холероген, оказались сходными со свойствами V. cholerae O1. Следовательно, возник, видимо, вследствие мутации, изменившей О-антиген, новый возбудитель холеры – V. cholerae O139. Он получил название V. cholerae O139 bengal.
Вопрос об отношении так называемых холероподобных вибрионов к V. cholerae долгое время был не ясен. Однако сопоставление V. cholerae и холероподобных (НАГ-вибрионов) более чем по 70 признакам выявило их сходство на 90 %, а степень гомологии ДНК V. cholerae и изученных НАГ-вибрионов составляет 70 – 100 %. Поэтому холероподобные вибрионы объединены в один вид с холерным вибрионом, от которого отличаются главным образом по своим О-антигенам, в связи с чем их называют вибрионами не О1-группы – V. cholerae non O1.
Вид V. cholerae подразделяют на 4 биотипа: V. cholerae, V. eltor, V. proteus и V. albensis. В течение многих лет обсуждался вопрос о природе вибриона Эль-Тор. Этот вибрион был выделен в 1906 г. Ф. Готшлихом на карантинной станции Эль-Тор из трупа паломника, погибшего от дизентерии. Ф. Готшлих выделил несколько таких штаммов. По всем свойствам они не отличались от холерного вибриона и агглютинировались холерной О-сывороткой. Но поскольку среди паломников в это время холеры не было, а длительное носительство холерного вибриона считалось мало вероятным, вопрос о возможной этиологической роли V. eltor при холере надолго остался дискуссионным. К тому же вибрион Эль-Тор, в отличие от V. cholerae, обладал гемолитическим действием. Однако в 1937 г. этот вибрион вызвал крупную и тяжелую эпидемию холеры на острове Сулавеси (Индонезия) с летальностью свыше 60 %. Наконец, в 1961 г. он стал виновником 7-й пандемии, и в 1962 г. вопрос о его холерной природе был решен окончательно. Различия между V. cholerae и V. eltor касаются лишь некоторых признаков (табл. 41). По всем другим свойствам V. eltor принципиально не отличается от V. cholerae. Кроме того, теперь уже установлено, что биотип V. proteus (V. finklerpriori) включает в себя всю группу вибрионов, кроме О1-группы (а ныне и О139), называвшихся ранее НАГ-вибрионами. Биотип V. albensis был выделен из реки Эльбы и обладает способностью к фосфоресценции, однако утратив ее, он ничем не отличается от V. proteus. В связи с этими данными в настоящее время вид Vibrio cholerae подразделяют на 4 биотипа: V. cholerae O1 cholerae, V. cholerae eltor, V. cholerae O139 bengal и V. cholerae non О1. Первые три относятся к двум сероварам О1 и О139. По решению ВОЗ, к возбудителям холеры отнесены три группы: 1) Vibrio cholerae О1 (классический и эльтор); 2) Vibrio cholerae О139 и 3) все серогруппы (их теперь 206) так называемых НАГ-вибрионов (вибрионов, не относящихся к группам О1 и О139), а также нетоксигенные О1 и О139 вибрионы. Вибрионы 3-й группы вызывают только одиночные или групповые вспышки, но не вызывают ни эпидемий, ни пандемий.
Таблица 41
Основные различия между V. cholerae и V. eltor
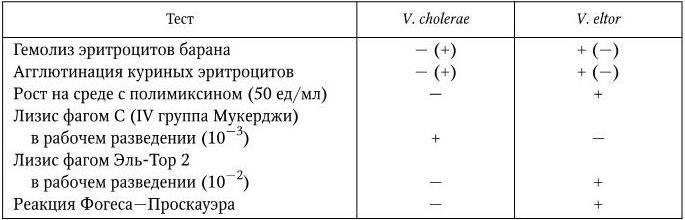
Факторы патогенности V. cholerae.
1. Подвижность. 2. Хемотаксис. С помощью этих свойств вибрион вступает во взаимодействие с эпителиоцитами. У мутантов Che– (утративших способность к хемотаксису) вирулентность значительно снижается, у мутантов Mob– (утративших подвижность) либо полностью исчезает, либо резко снижается. 3. Факторы адгезии и колонизации, с помощью которых вибрион прилипает к микроворсинкам и колонизирует слизистую оболочку тонкого кишечника. К факторам адгезии относятся муциназа, растворимая гемагглютинин/протеаза, нейраминидаза и др. Они способствуют адгезии и колонизации, так как разрушают вещества, входящие в состав слизи. Растворимая гемагглютинин/протеаза способствует отделению вибрионов от рецепторов эпителиоцитов и их выходу из кишечника во внешнюю среду, обеспечивая им эпидемическое распространение. Нейраминидаза укрепляет связь холерогена с эпителиоцитами и облегчает проникновение токсина внутрь клеток, что усиливает тяжесть диареи. 4. Холерный токсин – холероген. 5. Так называемые новые токсины, которые способны вызывать диарею, но не имеют генетического и иммунологического родства с холерогеном. 6. Дермонейротические и геморрагические факторы. Природа этих токсических факторов и их роль в патогенезе холеры изучены недостаточно. 7. Эндотоксин. Липополисахариды V. cholerae обладают сильным эндотоксическим свойством и вызывают общую интоксикацию организма.
Главный из перечисленных факторов патогенности холерного вибриона – экзотоксин холероген (CTX AB), который и обусловливает патогенез этой болезни. Молекула холерогена состоит из двух фрагментов – A и B. Фрагмент A состоит из двух пептидов – A1 и A2, он обладает специфическим свойством холерного токсина и наделяет его качествами суперантигена. Фрагмент B состоит из 5 одинаковых субъединиц. Он выполняет две функции: 1) распознает рецептор (моносиалоганглиозид) энтероцита и связывается с ним; 2) формирует внутримембранный гидрофобный канал для прохождения субъединицы A. Пептид A2 служит для связывания фрагментов A и B. Собственно токсическую функцию выполняет пептид A1 (АДФ-рибозилтрансфераза). Он взаимодействует с НАД, вызывает его гидролиз; образующаяся при этом АДФ-рибоза связывается с регуляторной субъединицей аденилатциклазы. Это ведет к угнетению гидролиза ГТФ. Возникающий комплекс ГТФ + аденилатциклаза вызывает гидролиз АТФ с образованием цАМФ. (Другой путь накопления цАМФ – подавление холерогеном фермента, гидролизующего цАМФ до 5-АМФ). Проявление функции гена ctxAB, кодирующего синтез экзотоксина, зависит от функции ряда других генов патогенности, в частности генов tcp (кодирующих синтез токсин-контролируемых пилей адгезии – ТКПА), регуляторных генов toxR, toxS и toxT, генов hap (растворимой гемагглютенин/протеазы) и neu (нейраминидазы). Поэтому генетический контроль патогенности V. cholerae имеет сложный характер.
Как выяснилось, в хромосоме V. cholerae имеются два острова патогенности. Один из них представляет собой геном нитевидного умеренного конвертирующего фага CTXϕ, а другой – геном тоже нитевидного умеренного конвертирующего фага VPIϕ. Каждый из этих островов патогенности содержит кассеты генов указанных профагов, которые и определяют патогенность возбудителя холеры. Профаг CTXϕ несет гены CTX, гены новых токсинов zot и ace, ген cep (синтез адгезина), ген ortU (синтез продукта с неизвестной функцией). В эту же кассету входят ген neu и область фага RS2, которая кодирует репликацию, а также интеграцию профага в хромосомы. Гены zot, ace и ortU необходимы для формирования фаговых вирионов при исключении профага из хромосомы возбудителя.
Профаг VPIϕ несет гены tcp (кодируют продукцию пилей (белок ТКПА)), гены toxT, toxR, act (дополнительный фактор колонизации, гены мобильности (интегразы и транспозазы)). Транскрипцию генов вирулентности регулируют три гена-регулятора: toxR, toxS и toxT. Эти гены координированно, на уровне транскрипции, изменяют активность более 20 генов вирулентности, включая гены ctxAB, tcp и др. Главным геном-регулятором служит ген toxR. Его повреждение или отсутствие приводят к авирулентности или к снижению продукции холерного токсина CTX и ТКПА более чем в 100 раз. Возможно, таким образом регулируется координированное выражение генов вирулентности в островах патогенности, образуемых умеренными конвертирующими фагами и у других видов бактерий. Установлено, что в хромосоме V. cholerae eltor присутствует еще один профаг К139, но его геном мало изучен.
Ген hap локализован на хромосоме. Таким образом, вирулентность (патогенность) и эпидемическую способность V. cholerae определяют 4 гена: ctxAB, tcp, toxR и hap.
Для обнаружения способности V. cholerae продуцировать холероген можно использовать различные методы.
1. Биологическая проба на кроликах. При внутримышечном введении холерных вибрионов кроликам-сосункам (возраст не более 2 нед.) у них развивается типичный холерный синдром: диарея, обезвоживание и гибель кролика.
2. Непосредственное обнаружение холерогена с помощью ПЦР, ИФМ или реакции пассивного иммунного гемолиза (холероген связывается с Gm1 эритроцитов, и они при добавлении антитоксических антител и комплемента лизируются). Однако обнаружения только способности продуцировать токсин недостаточно для определения эпидемической опасности таких штаммов. Для этого необходимо выявить наличие гена hap, поэтому лучше и надежнее всего дифференцировать токсигенные и эпидемические штаммы холерных вибрионов серогрупп О1 и О139 с помощью ПЦР с применением специфических праймеров для обнаружения всех 4 генов патогенности: ctxAB, tcp, toxR и hap.
Способность V. cholerae, не относящихся к серогруппам О1 или О139, вызывать спорадические или групповые диарейные заболевания у людей может быть связана либо с наличием у них энтеротоксинов типа LT или ST, стимулирующих аденилатили гуанилатциклазные системы соответственно, либо с наличием только генов ctxAB, но отсутствием гена hap.
Во время седьмой пандемии выделялись штаммы V. cholerae с различной степенью вирулентности: холерогенные (вирулентные), слабо холерогенные (маловирулентные) и нехолерогенные (невирулентные). Нехолерогенные V. cholerae, как правило, проявляют гемолитическую активность, не лизируются холерным диагностическим фагом ХДФ(5) и не вызывают заболевания человека.
Для фаготипирования V. cholerae О1 (в том числе и эльтор) С. Мукерджи были предложены наборы фагов, которые затем в России были дополнены другими фагами. Набор таких фагов (1 – 7) позволяет выделить среди V. cholerae О1 16 фаготипов. Для идентифицирования токсигенных и нетоксигенных V. cholerae эльтор вместо ХДФ-3, ХДФ-4 и ХДФ-5 теперь в России предложены фаги CTX+ (лизируют токсигенные вибрионы эльтор) и CTX– (лизируют нетоксигенные вибрионы эльтор).
Резистентность возбудителей холеры. Холерные вибрионы хорошо выживают при низкой температуре; во льду сохраняют жизнеспособность до 1 мес.; в морской воде – до 47 сут., в речной – от 3 – 5 дней до нескольких недель, в кипяченой минеральной воде сохраняются более 1 года, в почве – от 8 дней до 3 мес., в свежих испражнениях – до 3 сут., на вареных продуктах (рис, лапша, мясо, каши и др.) выживают 2 – 5 дней, на сырых овощах – 2 – 4 дня, на фруктах – 1 – 2 дня, в молоке и молочных продуктах – 5 дней; при хранении на холоде срок выживания увеличивается на 1 – 3 дня; на полотняном белье, загрязненном испражнениями, сохраняются до 2 сут., а на влажном материале – неделю. Холерные вибрионы при температуре 80 °C погибают через 5 мин, при 100 °C – моментально; высокочувствительны к кислотам;
под влиянием хлорамина и других дезинфектантов погибают через 5 – 15 мин. Они чувствительны к высушиванию и действию прямых солнечных лучей, но хорошо и долго сохраняются и даже размножаются в открытых водоемах и сточных водах, богатых органическими веществами, имеющих щелочную рН и температуру выше 10 – 12 °C. Высокочувствительны к хлору: доза активного хлора 0,3 – 0,4 мг/л воды за 30 мин вызывает надежное обеззараживание от холерного вибриона.
Особенности эпидемиологии. Основным источником инфекции является только человек – больной холерой или вибриононоситель, а также загрязненная ими вода. Никакие животные в природе холерой не болеют. Способ заражения – фекально-оральный. Пути заражения: а) основной – через воду, используемую для питья, купания и хозяйственно-бытовых нужд; б) контактно-бытовой и в) через пищу. Все крупные эпидемии и пандемии холеры были связаны с водой. Холерные вибрионы обладают такими приспособительными механизмами, которые обеспечивают существование их популяций как в организме человека, так и в определенных экосистемах открытых водоемов. Обильная диарея, которую вызывает холерный вибрион, приводит к очищению кишечника от конкурирующих бактерий и способствует широкому распространению возбудителя в окружающей среде, прежде всего в сточных водах и в открытых водоемах, куда их сбрасывают. Человек, больной холерой, выделяет возбудителя в огромном количестве – от 100 млн до 1 млрд на 1 мл испражнений, вибриононоситель выделяет 100 – 100 000 вибрионов в 1 мл, заражающая доза составляет около 1 млн вибрионов. Продолжительность выделения холерного вибриона у здоровых носителей составляет от 7 до 42 дней и 7 – 10 дней у переболевших. Более продолжительное выделение наблюдается крайне редко.
Особенностью холеры является то, что после нее, как правило, не остается длительного носительства и не формируется стойких эндемических очагов. Однако, как уже указывалось выше, в связи с загрязнением открытых водоемов сточными водами, содержащими в большом количестве органические вещества, моющие средства и поваренную соль, в летнее время холерный вибрион в них не только долго выживает, но даже и размножается.
Важное эпидемиологическое значение имеет тот факт, что холерные вибрионы О1-группы, как нетоксигенные, так и токсигенные, могут длительно сохраняться в различных водных экосистемах в виде некультивируемых форм. С помощью цепной полимеразной реакции при отрицательных бактериологических исследованиях на ряде эндемичных территорий СНГ в различных водоемах были обнаружены vctгены некультивируемых форм V. cholerae.
Эндемическим очагом холерного вибриона Эль-Тор является Индонезия, выход из нее этого виновника седьмой пандемии связан, как полагают, с расширением экономических связей Индонезии с внешним миром после приобретения ею независимости, а на продолжительность и молниеносное развитие пандемии, особенно ее второй волны, решающее влияние оказали отсутствие иммунитета к холере и различные социальные потрясения в странах Азии, Африки и Америки.
При возникновении заболеваний холерой осуществляют комплекс противоэпидемических мероприятий, среди которых ведущим и решающим является активное своевременное выявление и изоляция (госпитализация, лечение) больных в острой и атипичной форме и здоровых вибриононосителей; принимаются меры по пресечению возможных путей распространения инфекции; особое внимание уделяется водоснабжению (хлорирование питьевой воды), соблюдению санитарно-гигиенического режима на пищевых предприятиях, в детских учреждениях, местах общественного пользования; осуществляется строгий контроль, в том числе бактериологический, за открытыми водоемами, проводится иммунизация населения и т. п.
Особенности патогенеза и клиники. Инкубационный период при холере варьирует от нескольких часов до 6 сут., чаще всего – 2 – 3 дня. Попав в просвет тонкого кишечника, холерные вибрионы за счет подвижности и хемотаксиса к слизистой оболочке направляются к слизи. Чтобы проникнуть через нее, вибрионы вырабатывают ряд ферментов: нейраминидазу, муциназу, протеазы, лецитиназу, которые разрушают вещества, содержащиеся в слизи, и облегчают продвижение вибрионов к эпителиальным клеткам. Путем адгезии вибрионы прикрепляются к гликокаликсу эпителия и, теряя подвижность, начинают интенсивно размножаться, колонизируя микроворсинки тонкого кишечника (см. цв. вкл., рис. 101.2), и одновременно вырабатывать большое количество экзотоксина-холерогена. Молекулы холерогена связываются с моносиалоганглиозидом Gm1 и проникают в мембрану клетки, где активируют аденилатциклазную систему, а накапливающийся цАМФ вызывает гиперсекрецию жидкости, катионов и анионов Na+, HCO3—, K+, Cl— из энтероцитов, что и приводит к холерной диарее, обезвоживанию и обессоливанию организма. Различают три типа течения болезни:
1) бурное, тяжелое обезвоживающее диарейное заболевание, приводящее к смерти больного через несколько часов;
2) менее тяжелое течение, или понос без обезвоживания;
3) бессимптомное течение заболевания (вибриононосительство).
При тяжелой форме холеры у больных появляется понос, стул учащается, испражнения становятся все более обильными, принимают водянистый характер, утрачивают фекальный запах и имеют вид рисового отвара (мутная жидкость с плавающими в ней остатками слизи и клетками эпителия). Затем присоединяется изнурительная рвота, сначала содержимым кишечника, а затем рвотные массы приобретают вид рисового отвара. Температура у больного падает ниже нормы, кожа становится синюшной, морщинистой и холодной – холерный алгид. В результате обезвоживания происходит сгущение крови, развивается цианоз, кислородное голодание, резко страдает функция почек, появляются судороги, больной теряет сознание и наступает смерть. Летальность от холеры во время седьмой пандемии варьировала от 1,5 % в развитых странах до 50 % в развивающихся странах.
Постинфекционный иммунитет прочный, длительный, повторные заболевания наблюдаются редко. Иммунитет антитоксический и антимикробный, обусловлен антителами (антитоксины сохраняются дольше, чем антимикробные антитела), клетками иммунной памяти и фагоцитами.
Лабораторная диагностика. Основным и решающим методом диагностики холеры является бактериологический. Материалом для исследования от больного служат испражнения и рвотные массы; на вибриононосительство исследуют испражнения; у лиц, погибших от холеры, для исследования берут лигированный отрезок тонкого кишечника и желчный пузырь; из объектов внешней среды чаще всего исследуют воду открытых водоемов и сточные воды.
При проведении бактериологического исследования необходимо соблюдать следующие три условия:
1) как можно быстрее произвести посев материала от больного (холерный вибрион сохраняется в испражнениях короткий срок);
2) посуда, в которую берут материал, не должна обеззараживаться химическими веществами и не должна содержать их следы, так как холерный вибрион к ним очень чувствителен;
3) исключить возможность загрязнения и заражения окружающих.
Выделение культуры проводят по схеме: посев на ПВ, одновременно на щелочной МПА или какую-либо избирательную среду (лучше всего TCBS). Через 6 ч исследуют пленку, образующуюся на ПВ, и в случае необходимости делают пересев на вторую ПВ (высеваемость холерного вибриона в этом случае повышается на 10 %). С ПВ делают пересев на щелочной МПА. Подозрительные колонии (стекловидно-прозрачные) пересевают для получения чистой культуры, которую идентифицируют по морфологическим, культуральным, биохимическим свойствам, подвижности и окончательно типируют с помощью диагностических агглютинирующих сывороток О-, ОR-, Инаба и Огава и фагов (ХДФ). Предложены различные варианты ускоренной диагностики, наилучшим из них является люминесцентносерологический метод. Он позволяет обнаружить холерный вибрион непосредственно в исследуемом материале (или после предварительного подращивания в двух пробирках с 1 %-ной ПВ, в одну из которых добавляют холерный фаг) в течение 1,5 – 2 ч. Для ускоренного обнаружения холерного вибриона Нижегородским ИЭМ предложен набор бумажных индикаторных дисков, состоящих из 13 биохимических тестов (оксидаза, индол, уреаза, лактоза, глюкоза, сахароза, манноза, арабиноза, маннит, инозит, аргинин, орнитин, лизин), которые позволяют дифференцировать представителей рода Vibrio от родов Aeromonas, Plesiomonas, Pseudomonas, Comamonas и от семейства Enterobacteriaceae. Для быстрого обнаружения холерного вибриона в испражнениях и в объектах внешней среды может быть использована РПГА с антительным диагностикумом. С целью выявления некультивируемых форм холерного вибриона в объектах внешней среды применяют только метод цепной полимеразной реакции.
В тех случаях, когда выделяются V. cholerae не О1-группы, они должны быть типированы с помощью соответствующих агглютинирующих сывороток других серогрупп. Выделение от больного диареей (в том числе холероподобной) V. cholerae не О1-группы требует проведения таких же противоэпидемических мероприятий, как и в случае выделения V. cholerae О1-группы. При необходимости у таких вибрионов с помощью ПЦР определяют наличие генов патогенности ctxAB, tcp, toxR и hap.
Серологическая диагностика холеры имеет вспомогательный характер. С этой целью может быть использована реакция агглютинации, но лучше – определение титра вибриоцидных антител или антитоксинов (антитела к холерогену определяют иммуноферментным или иммунофлуоресцентным методами).
Лечение больных холерой должно заключаться прежде всего в регидратации и восстановлении нормального водно-солевого обмена. С этой целью рекомендуется использовать солевые растворы, например такого состава: NaCl – 3,5; NaHCO3 – 2,5; KCl – 1,5 и глюкоза – 20,0 г на 1 л воды. Такое патогенетически обоснованное лечение в сочетании с рациональной антибиотикотерапией позволяет снизить летальность при холере до 1 % и менее.
Специфическая профилактика. Для создания искусственного иммунитета были предложены различные вакцины, в том числе из убитых штаммов Инаба и Огава; холероген-анатоксин для подкожного применения и энтеральная химическая бивалентная вакцина, состоящая из анатоксина и соматических антигенов серотипов Инаба и Огава, так как перекрестный иммунитет не формируется. Однако продолжительность поствакцинального иммунитета составляет не более 6 – 8 мес., поэтому прививки проводят только по эпидемическим показаниям. В очагах холеры неплохо зарекомендовала себя антибиотикопрофилактика, в частности тетрациклином, к которому холерный вибрион проявляет высокую чувствительность. С такой же целью могут быть использованы и другие эффективные против V. cholerae антибиотики.
Патогенные для человека вибрионы, не относящиеся к виду V. cholerae
К роду Vibrio относится более 25 видов, из которых помимо V. cholerae по крайней мере следующие восемь способны вызывать заболевания у людей: V. parahaemolyticus, V. alginolyticus, V. vulnificus, V. fluvialis, V. furnissii, V. mimicus, V. damsela и V. hollisae. Признаки, по которым они различаются между собой, представлены в табл. 42. Все эти вибрионы являются обитателями морей и заливов. Заражение ими происходит либо при купании, либо при употреблении в пищу продуктов морского происхождения. Как выяснилось, холерные и нехолерные вибрионы могут вызывать не только гастроэнтериты, но и раневые инфекции. Эта способность обнаружена у V. cholerae O1– и не О1-групп, у V. parahaemolyticus, V. alginolyticus, V. mimicus,
Таблица 42
Дифференциальные признаки патогенных видов рода Vibrio
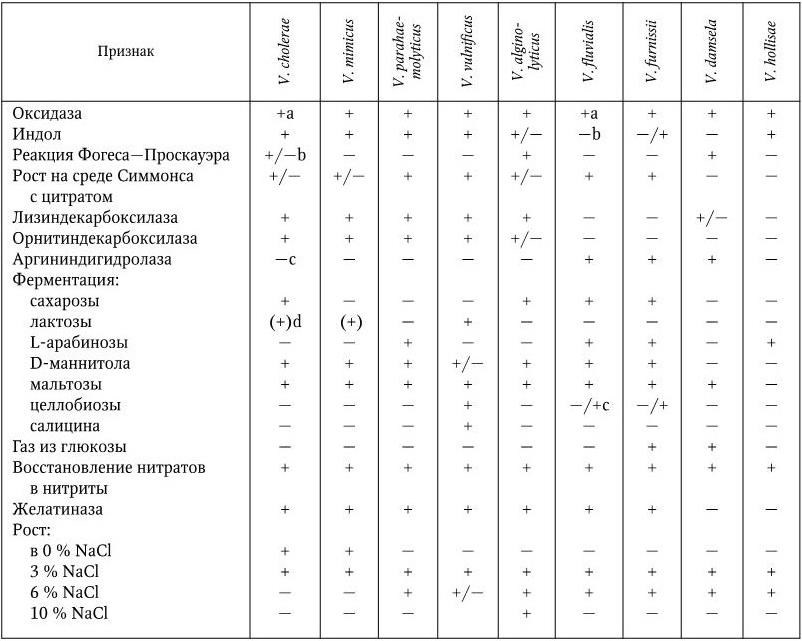
Примечание. +a – более чем 90 % штаммов позитивны; +/ – b – преобладающие реакции указаны в числителе; +c – более чем 90 % штаммов позитивны; – c – более чем 90 % штаммов негативны; (+)d – положительная реакция происходит в течение 3 дней.
V. damsela и V. vulnificus. Они вызывают воспалительные процессы в мягких тканях при повреждении их панцирем морских животных или при прямом контакте с инфицированной морской водой.
Из числа перечисленных патогенных нехолерных вибрионов наибольший практический интерес представляют V. parahaemolyticus, V. alginolyticus, V. vulnificus и V. fluvialis.
V. parahaemolyticus – парагемолитический вибрион – впервые был выделен в Японии в 1950 г. во время большой вспышки пищевой токсикоинфекции, вызванной употреблением полувысушенных сардин (летальность составила 7,5 %). Принадлежность возбудителя к роду Vibrio была установлена Р. Саказаки в 1963 г. Он разделил изученные штаммы на 2 вида: V. parahaemolyticus и V. alginolyticus. Оба вида обнаруживаются в прибрежной морской воде и у ее обитателей, они являются галофилами (греч. hals – соль); в отличие от обычных вибрионов, галофильные не растут на средах без NaCl и хорошо размножаются при высоких концентрациях ее. Видовую принадлежность галофильных вибрионов определяют по их способности ферментировать сахарозу, образовывать ацетилметилкарбинол, размножаться в ПВ с 10 % NaCl. Все эти признаки присущи виду V. alginolyticus, но отсутствуют у V. parahaemolyticus.
Парагемолитический вибрион имеет три типа антигенов: термолабильные жгутиковые Н-антигены, термостабильные, не разрушающиеся при нагревании до 120 °C в течение 2 ч О-антигены и поверхностные К-антигены, разрушающиеся при нагревании. Свежевыделенные культуры V. parahaemolyticus имеют хорошо выраженные К-антигены, которые предохраняют живые вибрионы от агглютинации гомологичными О-сыворотками. Н-антигены у всех штаммов одинаковы, но Н-антигены монотрихов отличаются от Н-антигенов перитрихов. По О-антигену V. parahaemolyticus разделяют на 14 серогрупп. Внутри серогрупп вибрионы подразделяют на серотипы по К-антигенам, общее количество которых составляет 61. Антигенная схема V. parahaemolyticus разработана применительно только к его штаммам, выделяемым от людей.
Патогенность V. parahaemolyticus связана с его способностью синтезировать гемолизин, обладающий энтеротоксическим свойством. Последнее выявляется с помощью метода Канагавы. Сущность его заключается в том, что патогенные для человека V. parahaemolyticus вызывают четкий гемолиз на кровяном агаре, содержащем 7 % NaCl. На кровяном агаре, содержащем менее 5 % NaCl, гемолиз вызывают многие штаммы V. parahaemolyticus, а на кровяном агаре с 7 % NaCl – только штаммы с энтеропатогенными свойствами. Парагемолитический вибрион обнаружен на побережьях Японского, Каспийского, Черного и других морей. Он вызывает пищевые токсикоинфекции и дизентериеподобные заболевания. Заражение происходит при употреблении в пищу сырых или полусырых морских продуктов, инфицированных V. parahaemolyticus (морская рыба, устрицы, ракообразные и т. п.).
Среди выше указанных восьми видов нехолерных вибрионов наиболее патогенным для человека является V. vulnificus, который впервые был описан в 1976 г. как Beneckea vulnificus, а затем в 1980 г. переклассифицирован в Vibrio vulnificus. Он часто обнаруживается в морской воде и ее обитателях и служит причиной различных заболеваний человека. Штаммы V. vulnificus морского и клинического происхождения не отличаются друг от друга ни фенотипически, ни генетически.
Раневые инфекции, вызываемые V. vulnificus, быстро прогрессируют и ведут к образованию опухолей с последующим некрозом ткани, сопровождаются лихорадкой, ознобом, иногда сильными болями, в некоторых случаях требуют ампутации. У V. vulnificus обнаружена способность продуцировать экзотоксин. В опытах на животных установлено, что возбудитель вызывает сильные местные повреждения с развитием отека и некроза ткани с последующим летальным исходом. Роль экзотоксина в патогенезе болезни изучается.
Помимо раневых инфекций, V. vulnificus может вызывать пневмонию у тонувших людей и эндометриты у женщин после пребывания их в морской воде. Наиболее тяжелой формой инфекции, вызываемой V. vulnificus, является первичная септицемия, связанная с употреблением в пищу сырых устриц (возможно, и других морских животных). Это заболевание развивается очень быстро: у больного появляются недомогание, лихорадка, озноб и прострация, затем сильная гипотония, являющаяся главной причиной смерти (летальность около 50 %).
V. fluvialis впервые как возбудитель гастроэнтерита был описан в 1981 г. Он относится к подгруппе нехолерных патогенных вибрионов, у которых есть аргининдигидролаза, но нет орнитин– и лизиндекарбоксилаз (V. fluvialis, V. furnissii, V. damsela, т. е. фенотипически сходных с Aeromonas). V. fluvialis – частый возбудитель гастроэнтеритов, которые сопровождаются сильной рвотой, поносом, абдоминальными болями, повышением температуры и сильной или средней тяжести дегидратацией. Главным фактором патогенности является энтеротоксин.
Лабораторная диагностика. Основным методом диагностики заболеваний, вызываемых нехолерными патогенными вибрионами, является бактериологический с использованием таких селективных сред, как TCBS, Мак-Конки и др. Принадлежность выделенной культуры к роду Vibrio определяют на основании ключевых признаков бактерий этого рода. Видовую принадлежность устанавливают с учетом признаков, указанных в табл. 39.
Микробиология кампилобактериозов
К семейству Campylobacteriaceae относятся аэробные или микроаэрофильные подвижные вибриоидные не образующие спор грамотрицательные бактерии трех родов: Campylobacter, Helicobacter и Arcobacter. Состав родов по мере получения новых данных постоянно уточняется.
Кампилобактериоз – инфекционное заболевание, характеризующееся острым началом, лихорадкой, поражением желудочно-кишечного тракта. Исследования, проведенные в последние годы, показали, что в ряде стран кампилобактерии вызывают от 3 до 15 % всех случаев острых кишечных заболеваний.
В инфекционной патологии человека и животных важнейшую роль играют виды C. jejuni, C. coli и C. lari, вызывающие ОКЗ сходного клинического течения. На основании способности к росту при относительно высокой температуре инкубации (42 °C) они объединены в одну группу термофильных кампилобактерий. Среди прочих мезофильных видов кампилобактерий, предпочитающих умеренную температуру инкубации (37 °C), известную роль в патологии человека играет C. fetus, зачастую являющийся возбудителем артритов, менингитов, васкулитов; виды C. concisus и C. sputorum расцениваются как комменсалы полости рта, возможно, играющие роль в патогенезе пародонтита, а виды C. fennelliae, C. cinaedi и C. hyointestinalis встречаются в толстом кишечнике при иммунодефицитах различного генезиса.
Кампилобактерии – грамотрицательные, тонкие, спирально изогнутые палочки размером 0,2 – 0,3 × 0,5 – 5,0, иногда до 8,0 мкм. Они могут образовывать один полный (или чуть больше) виток спирали, могут быть С– или S-образной формы или напоминать крылья чайки при соединении двух клеток в короткую цепочку. В старых культурах клетки могут иметь кокковидную или гиперспирализованную форму. Спор и капсул не образуют, имеют 1 или 2 (иногда до 5) полярно расположенных жгутика, обеспечивающих им высокую подвижность со стремительным штопорообразным или винтообразным поступательным движением. Жгутики могут быть в 2 – 3 раза длиннее клетки. Подвижность лучше видна при темнопольной или фазовоконтрастной микроскопии. Содержание Г + Ц в ДНК – 30 – 38 мол %.
Кампилобактерии являются хемоорганотрофами. Будучи термофилами, способны к росту при температуре 37 – 44 °C, но не при 25 °C. Большинство кампилобактерий – микроаэрофилы и капнофилы, оптимальная атмосфера для культивирования патогенных видов имеет состав: О2 – 5 %, СО2 – 10 %, N2 – 85 %. Некоторые кампилобактерии при выращивании могут проявлять себя как облигатные анаэробы. Энергию освобождают из аминокислот и трикарбоновых кислот, но не из углеводов, к окислению и ферментации которых не способны.
Для культивирования кампилобактерий чаще используют специальные питательные среды, в основу которых положены среды для выделения бруцелл. Однако в эти среды необходимо добавлять вещества, повышающие аэротолерантность кампилобактерий и снижающие редокс-потенциал среды (кровь, тиогликолат натрия, метабисульфит натрия, пируват натрия, сульфат Fe2+). Обычно используют мясные, печеночные, кровяные среды, часто в них добавляют антибиотики (новобиоцин, циклогексамид, бацитрацин, триметоприм) для подавления сопутствующей микрофлоры. На питательных средах рост кампилобактерий наблюдается обычно через 2 – 4 сут. На жидких питательных средах наблюдается диффузное помутнение с трудно разбиваемым выраженным осадком. На полужидких средах они вырастают в виде диффузного мутного кольца толщиной 1 – 4 мм под поверхностью среды. Если кампилобактерии растут в условиях строгого анаэробиоза, отмечается помутнение всей среды.
На плотных средах с кровью кампилобактерии образуют два типа колоний: а) округлые неправильной формы, с ровными краями, диаметром 2 – 8 мм, бесцветные или светло-серые, прозрачные, гомогенные (напоминают капли воды); при длительном культивировании могут приобретать серебристо-матовый оттенок; б) колонии правильной округлой формы, с ровными краями и диаметром 1 – 2 мм, с блестящей выпуклой поверхностью, прозрачные, гомогенные; в старых колониях центр более плотный, чем периферия, и может образовываться желтоватый пигмент. Консистенция колоний невязкая, зона гемолиза отсутствует.
Кампилобактерии оксидазоположительны, желатин и мочевину не гидролизуют, реакции с метиловым красным и Фогеса – Проскауэра отрицательны. Они продуцируют цитохромоксидазу, не растут на среде Ресселя; по способности образовывать каталазу делятся на две группы: каталазопозитивные (С. fetus, С. jejuni, С. coli) и каталазонегативные (С. sputorum и С. concisus). Некоторые их виды могут образовывать сероводород, расти в присутствии 1 и 3,5 % NaCl, бриллиантового зеленого, налидиксовой кислоты, цефалотина, гидролизовать гиппурат натрия, образовывать пигмент желтого цвета. На этих свойствах основана межвидовая дифференциация (табл. 43).
Таблица 43
Свойства некоторых видов родов Campylobacter и Helicobacter
Примечание.(+) – положительный признак; ( – ) – отрицательный признак; (?) – непостоянный признак; У – устойчив; Ч – чувствителен.
Кампилобактерии имеют О-, Н– и К-антигены. С. jejuni и С. coli, наиболее часто вызывающие заболевания у человека, серологически гетерогенны. В зарубежной литературе описано 55 серогрупп, различающихся по термостабильному О-антигену. Установлено, что штаммы, выделенные от человека, дают реакцию агглютинации только с сывороткой от людей, а сывороткой от иммунизированных животных они не агглютинируются. Можно предположить, что идет формирование штаммов, специфичных для человека.
Кампилобактерии имеют целый комплекс факторов вирулентности, в том числе липополисахарид, энтеротоксин (вызывает диарею), цитотоксин, повреждающий слизистую оболочку толстой кишки у человека, и др.
При комнатной и, в особенности, при пониженной температурах резистентность кампилобактерий к действию факторов внешней среды весьма высока: в пищевых продуктах, водопроводной и сточных водах, молоке, моче, испражнениях они могут сохранять жизнеспособность в течение 1 – 5 нед. Кампилобактерии очень чувствительны к нагреванию свыше 50 °C, действию прямого солнечного и ультрафиолетового света и воздуха, высыханию, низким и высоким значениям рН среды, чувствительны к действию дезинфицирующих веществ в рабочих концентрациях.
Эпидемиология. Кампилобактерии (особенно термофильные) обнаруживаются у всех видов диких и домашних зверей и птиц, многие из которых являются их естественными резервуарами (крупный и мелкий рогатый скот, куры, скворцы, воробьи, попугаи и др.). Основным резервуаром кампилобактерий следует считать сельскохозяйственных животных, дополнительными – больных людей и домашних животных, диких городских птиц и грызунов. Основной путь передачи инфекции – пищевой (сырое молоко, битая птица, говядина, свинина), дополнительные – водный (речная и морская вода, загрязненная испражнениями животных) и бытовой (грубые нарушения санитарно-гигиенических норм при уходе за больными людьми и животными, а также при кулинарной обработке мясных продуктов). Кампилобактериозу свойственна выраженная летняя сезонность с почти полным отсутствием заболеваемости в зимние месяцы. Чаще заболевание регистрируется в виде спорадических случаев («диарея путешественников»), изредка – в виде более или менее крупных вспышек. После перенесенного заболевания у людей, не леченных антибиотиками, бактерии с испражнениями выделяются достаточно долго, в течение 2 – 5 нед., а иногда до 10 нед.
Патогенез и клиника. У людей кампилобактериоз протекает в основном в виде энтеритов и энтероколитов, хотя описаны заболевания и другой локализации: септицемия, эндокардит, перикардит, менингит; поражения внекишечной локализации чаще отмечаются у людей старшего возраста или у больных со сниженной резистентностью организма.
Инкубационный период 1 – 10 дней, чаще 1 – 5 дней. Начало заболевания чаще острое, реже – подострое. Обычно наблюдаются умеренно выраженная интоксикация и диарея (до 10 – 20 раз в сутки), боли в нижней части живота. В половине случаев отмечается наличие крови в испражнениях, реже – обезвоживание. Чаще возникает и тяжелее протекает заболевание у детей в возрасте от 1 до 3 лет. Патогенез и степень тяжести находятся в прямой зависимости от факторов патогенности, имеющихся у данного штамма кампилобактерии, а также от количества бактерий, попавших в организм.
Иммунитет. Кампилобактерии высокоиммуногенны. Антитела появляются в крови в ранние сроки заболевания и в достаточно высоких титрах. Титр до 1: 5000 бывает уже на 5-й день заболевания; достигнув максимума, титры антител (IgG) в течение длительного времени медленно снижаются и через месяц могут быть еще достаточно высокими.
Лабораторная диагностика. Для диагностики кампилобактериозов используют микроскопический, бактериологический и серологический методы. Микроскопический метод используется в качестве ориентировочного. Тонкий мазок испражнений, зафиксированный на огне, окрашивают 1 %-ным водным раствором основного фуксина в течение 10 – 20 с, затем промывают водой. Поскольку для окрашивания большинства других бактерий требуется 2 – 5 мин, в мазке за 10 – 20 с обычно успевают окраситься только кампилобактерии. В нативном материале они имеют характерную форму (S-образные короткие цепочки в виде крыльев чайки, реже – С-образные с оттянутыми концами).
Основной метод диагностики – бактериологический. Материал для посева – испражнения или содержимое прямой кишки, иногда кровь, а также вода, молоко, другие пищевые продукты, смывы с предметов и т. д. Посевы делают на специальные питательные среды, создают микроаэрофильные условия и инкубируют при температуре 37 и 42 °C. После получения типичных колоний культуру идентифицируют по совокупности признаков.
Серологический метод исследования играет весьма важную роль при широкомасштабных эпидемиологических исследованиях, но в диагностике кампилобактериозов его роль невелика. Реакция агглютинации ставится с аутоштаммами, можно с живой музейной культурой, но с формалинизированной культурой результаты получаются более четкими. Наиболее чувствительные методы РИФ и ИФМ. Могут также использоваться РСК, латекс-агглютинация, иммуноэлектрофорез, РПГА.
Специфическая профилактика и лечение. Специфическая профилактика не разработана; другие профилактические мероприятия включают строгое соблюдение норм переработки, транспортировки и хранения пищевых продуктов, правил личной гигиены, защиту водоемов от загрязнения сточными водами (особенно животноводческих хозяйств).
Для лечения кампилобактериозов используют антибиотики; наиболее эффективны гентамицин и эритромицин, менее эффективны канамицин, левомицетин и полусинтетические пенициллины.
Хеликобактеры. Helicobacter pylori был открыт в 1982 г. Б. Маршаллом и Р. Уорреном при исследовании биоптатов слизистой желудка. К роду Helicobacter в настоящее время относят уже более 10 видов, часть которых ранее включали в род Campylobacter. H. pylori несколько крупнее других видов (0,5 – 1,0 × 2,5 – 5 мкм) и имеет форму палочки, спирали или «дуги вола». Лофотрих (до 5 жгутиков) или монотрих, иногда в популяции присутствуют обе формы. На агаровых средах малоподвижен или неподвижен. Растет на средах для кампилобактерий, но лучше растет на «шоколадном» агаре, образуя на нем через 2 – 7 сут. колонии диаметром 0,5 – 1,0 мм. На 10 %-ном кровяном агаре отмечается слабый α-гемолиз. Для роста требуются микроаэрофильные условия или атмосфера, обогащенная СО2. В аэробных или анаэробных условиях не растет.
Н. pylori оксидазо– и каталазопозитивен; сероводород не образует, гиппурат не гидролизует, обладает высокой уреазной активностью. Устойчив к хлориду трифенилтетразолия в концентрации 0,4 – 1,0 мг/мл; устойчив к 0,1 % раствору селенита натрия, в меньшей степени – к 1 %-ному глицину.
Факторами вирулентности Н. pylori служат подвижность; уреаза (нейтрализует HCl и повреждает эпителиоциты); протеиновый цитотоксин, вызывающий вакуолизацию эпителиальных клеток и повреждающий межклеточные мостики; липополисахарид; протеиназа; липаза; каталаза, гемолизин и др.
Заражение людей, вероятнее всего, происходит по фекально-оральному механизму. Возбудитель, проникая через муцин в подслизистую желудка, колонизирует эпителиоциты, нередко внедряясь в них. Прогрессирующее очаговое воспаление приводит к развитию гастрита, пептических язв желудка и двенадцатиперстной кишки. В дальнейшем может происходить развитие аденокарциномы или лимфомы желудка (MALT'омы – Mucosa Associated Lymphoid Tissue Lymphoma).
Наиболее эффективным препаратом для лечения хронического гастрита и язвенной болезни желудка или двенадцатиперстной кишки является ДеНол (коллоидный субцитрат висмута), избирательно действующий только на Н. pylori, который сочетают с трихополом (метронидазолом) и амоксициллином (или кларитромицином) для усиления терапевтического действия.

