Книга: В поисках кота Шредингера. Квантовая физика и реальность
Назад: Глава третья Свет и атомы
Дальше: Часть вторая Квантовая механика
Глава четвертая
Атом бора
К 1912 году кусочки атомной мозаики начали складываться воедино. Эйнштейн дал широкое обоснование идее кванта и ввел представление о фотонах, хотя оно пока не получило всеобщего признания. Продолжая аналогию с банкоматом, можно сказать, что Эйнштейн полагал, будто энергия распространяется лишь кусками определенного размера – банкомат дает только суммы, кратные десяти фунтам, потому что это самая мелкая купюра, с которой он работает, а не из того, что так захотел программист, настроивший его. Резерфорд предложил новую картину атома, с маленьким ядром в центре и облаком электронов вокруг, хотя эта идея тоже не получила всеобщей поддержки. Впрочем, атом Резерфорда не мог быть стабилен согласно классическим законам электродинамики. Решение крылось в том, чтобы использовать квантовые законы для описания поведения электронов внутри атомов. И опять прорыв совершил молодой исследователь со свежим взглядом на проблемы – квантовая теория развивалась именно так.
Датский физик Нильс Бор окончил аспирантуру летом 1911 года и в сентябре отправился в Кембридж, чтобы работать вместе с Дж. Дж. Томсоном в Кавендишской лаборатории. Он был очень молодым исследователем, сильно стеснялся и не владел в совершенстве английским языком. Ему было непросто найти себе место в Кембридже, однако во время поездки в Манчестер Бор познакомился с Резерфордом и тот по-дружески отнесся к нему, заинтересовавшись его исследованиями. В итоге в марте 1912 года Бор переехал в Манчестер и приступил к работе в команде Резерфорда, сконцентрировавшись на загадке структуры атома. Через шесть месяцев он вернулся в Копенгаген, но лишь на короткое время, до 1916 года оставшись вместе с группой Резерфорда в Манчестере.
Прыгающие электроны
Бор обладал редким гением, который и был необходим, чтобы толкнуть атомную физику вперед на десять – пятнадцать лет. Он не стремился объяснить все детали в полной теории, а пытался свести воедино различные идеи, чтобы создать воображаемую «модель», которая хотя бы в первом приближении согласовывалась бы с экспериментальными данными наблюдений реальных атомов. Когда у него появлялось грубое представление о том, что происходит, с помощью него он сшивал вместе кусочки и таким образом продвигался к цельной картине. Он отталкивался от представления, что атом являет собой миниатюрную Солнечную систему, в которой электроны движутся по орбитам согласно законам классической механики и электромагнетизма, и утверждал, что электроны не могут сойти с этих орбит, излучая при этом, поскольку они могут испускать только целые куски энергии – кванты, – а не непрерывное излучение, как того требует классическая теория. «Устойчивые» орбиты электронов соотносились с некоторыми фиксированными величинами энергии, каждая из которых была кратна основному кванту, при этом промежуточные орбиты отсутствовали, поскольку они требовали бы дробного значения энергии. Если продолжить аналогию с Солнечной системой, то это все равно что сказать, что земная орбита вокруг Солнца устойчива и орбита Марса тоже, но между ними невозможно существование ни одной другой устойчивой орбиты.
То, что сделал Бор, не имело права на жизнь. Идея об орбите всецело опирается на классическую физику. Идея о состояниях электрона, соответствующих определенному количеству энергии, – или, как их позже назвали, энергетических уровнях – происходит из квантовой теории. Модель, построенная на соединении классической и квантовой теорий, не дала верного понимания, почему атомы дергаются, однако предоставила Бору достаточно сведений, чтобы пойти дальше. Его модель оказалась в итоге неверна почти во всем, однако она обеспечила переход к истинной квантовой теории атома, и это неоценимо. К сожалению, из-за своей простоты, легкого смешения квантовых идей с классическими и привлекательной картины атома в виде миниатюрной Солнечной системы эта модель продолжает существовать на первых страницах не только популярных книг, но и учебников и университетских работ. Если вы изучали атомы в школе, я уверен, что вы изучали модель атома Бора, как бы ее ни называли на уроках. Не буду призывать вас забыть все, что вам говорили, однако приготовьтесь к тому, что во многом все обстоит иначе. И вы должны постараться забыть об электронах в виде маленьких «планет», вращающихся вокруг ядра, – эта первая мысль Бора оказалась совсем не верна. Электрон представляет собой лишь нечто, находящееся рядом с ядром и обладающее определенным количеством энергии и рядом других свойств. Как мы убедимся, он движется таинственным образом.
Крупный ранний успех работы Бора в 1913 году состоял в том, что она прекрасно объяснила спектр излучения водорода – простейшего атома. Корни спектроскопии как науки уходят в ранние годы XIX столетия, когда Уильям Волластон открыл темные линии в спектре излучения Солнца, однако именно после работы Бора она стала инструментом для исследования структуры атома. Подобно Бору, смешавшему во имя прогресса классические и квантовые теории, нам придется сделать шаг назад от идей Эйнштейна о световых квантах, чтобы понять, как работает спектроскопия. В этом контексте нет смысла считать свет чем-то иным, нежели электромагнитной волной.
Как установил Ньютон, белый цвет состоит из всех цветов радуги, или спектра. Каждый цвет соответствует различной длине световой волны, и, используя стеклянную призму, можно разложить белый цвет на цветовые компоненты, то есть получить спектр, в котором волны разных частот располагаются на экране или фотопластинке друг под другом. Синие и фиолетовые цвета, имеющие короткие длины волн, находятся на одном конце оптического спектра, а длинноволновые красные – на другом. Однако спектр распространяется и дальше – в обе стороны за пределами видимого диапазона. При таком разложении солнечного света получающийся спектр имеет очень резкие темные линии в определенных местах, соответствующих определенным частотам. Не зная, почему возникают эти линии, исследователи Йозеф Фраунгофер, Роберт Бунзен (его именем названа горелка Бунзена) и Густав Кирхгоф в XIX веке экспериментально установили, что различные химические элементы дают собственный набор спектральных линий. Когда элемент (например, натрий) подогревается на горелке Бунзена, он приобретает характерное свечение (в случае натрия – желтого цвета), которое является следствием сильного излучения в виде яркой линии или линий на одном участке спектра. Когда белый цвет проходит через жидкость или газ, содержащие тот же элемент, то даже если этот элемент находится в химическом веществе в соединении с другими, спектр света приобретает темные полосы поглощения, подобные тем, что наблюдаются в солнечном излучении. Эти полосы соответствуют частотам, характерным для этого элемента (характеристическим частотам. – Примеч. пер.).
Таким образом были объяснены темные линии в солнечном спектре. Должно быть, они происходят от более холодных облаков вещества в атмосфере Солнца, которые на характеристических частотах поглощают проходящее через них излучение света от более горячей поверхности Солнца. Такой подход дал химикам удобный способ определять элементы, присутствующие в химическом веществе. Например, если бросить в огонь обычную соль, пламя приобретет характерный для натрия желтоватый оттенок (так же светятся дорожные фонари). В лаборатории можно увидеть характеристический спектр, если поместить тестируемое вещество на проволоку (обмакнуть ее) и держать ее в пламени горелки Бунзена. Каждый химический элемент дает собственный набор спектральных линий, и их структура всегда остается одинаковой, даже если изменяется температура пламени, хотя может меняться интенсивность. Резкость каждой спектральной линии означает, что каждый атом элемента излучает или поглощает на одной и той же частоте без исключений. Проводя сопоставления с подобными тестами на пламени, спектроскописты выяснили природу большинства линий в солнечном спектре и объяснили их наличием известных на Земле химических элементов. Известно, что английский астроном Норман Локьер (основатель научного журнала Nature) нашел в спектре Солнца линии, которые не могли быть объяснены спектром какого-либо известного элемента, и предположил, что они обязаны своим появлением неизвестному тогда элементу, который он назвал гелием. В свое время гелий был обнаружен и на Земле, и было установлено, что его спектр в точности соответствует тому, чего требовали линии в спектре Солнца.
С помощью спектроскопии астрономы могут изучать химический состав отдаленных звезд и галактик. В свою очередь, физики-атомщики этим методом могут исследовать внутреннюю структуру атома.
Спектр излучения водорода является особенно простым, что, как мы знаем сегодня, следует из простейшей структуры этого элемента – каждый атом содержит лишь один положительно заряженный протон в качестве ядра и связанный с ним отрицательно заряженный электрон. Линии в спектре водорода называются серией Бальмера в честь швейцарского школьного учителя Иоганна Бальмера, предложившего в 1885 году (в том же году родился Нильс Бор) формулу, описывающую спектр водорода. Формула Бальмера описывает взаимосвязь частот спектра, на которых появляются линии водорода. Отталкиваясь от частоты первой линии водорода в красной части спектра, формула Бальмера дает частоту следующей линии в зеленой части. Отталкиваясь от зеленой линии, та же самая формула, примененная к этой частоте, дает частоту следующей линии в фиолетовой части спектра – и так далее. Когда Бальмер вывел свою формулу, ему было известно только о существовании четырех линий водорода в видимом спектре, но к тому моменту были открыты и другие линии, которые прекрасно вписывались в его простую численную схему, как и линии в ультрафиолетовой и инфракрасной части спектра, обнаруженные позже. Формула Бальмера явно сказала что-то важное о структуре атома водорода. Но что?
К моменту появления Бора формула Бальмера была известна всем физикам и входила в любой университетский курс. Но она была лишь частью огромного количества сложных сведений о спектрах, а Бор не был спектроскопистом. Взявшись за загадку структуры атома водорода, он не сразу понял, что серия Бальмера была очевидным ключом к ее разгадке, но однажды коллега показал ему, насколько простой была формула Бальмера (вне зависимости от сложности спектров других атомов), и он тотчас понял ее ценность. В то время, в начале 1913 года, Бор уже уверился, что ответ на загадку отчасти заключался в том, чтобы ввести постоянную Планка ft в уравнения, описывающие атом. В структуру атома Резерфорда были вписаны только два фундаментальных числа: заряд электрона е и массы задействованных частиц. Неважно, как играть с величинами: смешав массу и заряд, невозможно получить величину с размерностью длины, поэтому модель Резерфорда не имеет «естественной» единицы размера. Однако если добавить к этому действие – например ft, – можно создать число, включающее в себя значение длины, которое в очень грубой форме даст нам представление о размере атома. Выражение h2/me2 имеет размерность длины и равно приблизительно 20 × 10~8 см, что в целом согласуется со свойствами атомов, выявленными в опытах по рассеянию и других экспериментах. Бору было очевидно, что ft должна присутствовать в атомной теории, и серия Бальмера показала ему как.
Как атом может давать очень резкую спектральную линию? Либо излучая, либо поглощая энергию на очень точной частоте v. Энергия связана с частотой постоянной Планка (Е = hν), и если электрон в атоме излучает квант энергии hν, то энергия электрона должна измениться в точности на соответствующее количество Е. Бор утверждал, что электроны на «орбите» ядра атома оставались на месте, потому что не могли постоянно излучать энергию, но в этой модели они могли излучать (или поглощать) целый квант энергии – один фотон – и перепрыгивать с одного энергетического уровня (одной орбиты в соответствии со старой моделью) на другой. Эта, казалось бы, простая мысль стала очередным значительным шагом в сторону от классических идей. Это все равно что Марс вдруг исчез бы со своей орбиты и мгновенно появился бы вновь на орбите Земли, при этом излучив в космос сгусток энергии (в этом случае речь шла бы о гравитационном излучении). Теперь вы видите, как плохо планетарная модель атома описывает происходящее и насколько лучше представлять себе электроны внутри атома в разных состояниях, соответствующих разным энергетическим уровням.
Прыжок от одного состояния к другому может происходить в любом направлении, как вверх, так и вниз по энергетической лестнице. Если атом поглощает свет, то квант hv используется для того, чтобы передвинуть его на более высокий энергетический уровень (на следующую ступеньку лестницы). Если электрон затем падает на свое изначальное место, излучается ровно такая же энергия hv. Таинственная константа 36,456 × 10-5 в формуле Бальмера может быть свободно записана с помощью постоянной Планка, а это означало, что Бор мог рассчитать возможные энергетические уровни, «открытые» для одиночного электрона в атоме водорода. Кроме того, измеренная частота спектральных линий теперь могла толковаться как определение энергетической разницы между различными уровнями.
Водород получает объяснение
Обсудив свою работу с Резерфордом, в серии статей в 1913 году Бор опубликовал собственную теорию атома. Теория хорошо работала для водорода, и казалось, что она может быть развита дальше, чтобы объяснить также спектры более сложных атомов. В сентябре Бор посетил восемьдесят третью ежегодную встречу Британской ассоциации развития науки и представил свою работу аудитории, которая в основном состояла из самых именитых физиков того времени. В общем и целом его доклад восприняли хорошо, а сэр Джеймс Джинс назвал его изобретательным, убедительным и заставляющим задуматься. Дж. Дж. Томсон оказался в числе тех, кого доклад не убедил, однако именно благодаря этой встрече ученые, которые сочли аргументы недостаточными, хотя бы услышали о Боре и его работе над атомами.
Спустя тринадцать лет с отчаянного решения Планка ввести квант в теорию света Бор ввел квант в теорию атома. Однако потребовалось еще тринадцать лет, чтобы появилась настоящая квантовая теория. В то время прогресс шел болезненно медленно – нужно было делать шаг назад, чтобы потом продвигаться на два шага вперед, а иногда и два шага назад взамен на один шаг в правильном направлении. Атом Бора представлял собой настоящую мешанину. Он сочетал квантовые идеи с классическими, используя любую кажущуюся необходимой смесь, чтобы сметать куски и сделать модель работоспособной. Он «разрешал» существование гораздо большего количества спектральных линий, чем наблюдалось в излучении различных атомов, и приходилось вводить произвольные правила, чтобы некоторые переходы между различными энергетическими состояниями в атоме стали «запрещенными». Новые свойства атома – квантовые числа – назначались от случая к случаю, чтобы соответствовать наблюдениям, хотя не существовало должного теоретического обоснования того, зачем нужны были эти квантовые числа или почему некоторые из переходов оказывались запрещены. В процессе этого европейский мир потрясло начало Первой мировой войны, разразившейся на следующий год после того, как Бор представил свою первую модель атома.
Как и любая другая сфера жизни, наука после 1914 года уже не могла быть прежней. Из-за войны ученые больше не могли свободно переезжать из одной страны в другую. Начиная с Первой мировой войны некоторым ученым из ряда стран стало трудно общаться с коллегами по всему миру. Война также оказала прямое воздействие на научные исследования в крупных исследовательских центрах, где в начале XX века физики добились существенного прогресса. В условиях войны многие молодые ученые покинули лаборатории и ушли на фронт, оставив более зрелых профессоров вроде Резерфорда продолжать исследования в одиночку. Многие из этих юношей, представителей поколения, которое должно было подхватить идеи Бора и начало подхватывать их в 1913-м, погибли в боях. Война повлияла и на работу нейтральных ученых, хотя в некотором роде они получили преимущество из-за проблем остальных. Сам Бор стал лектором физики в Манчестере, в Геттингене голландец Петер Дебай хорошо изучил структуру кристаллов, используя рентгеновские лучи. В то время Дания и Голландия стали настоящими научными оазисами, и в 1916 году Бор вернулся в Данию, где стал профессором теоретической физики в Копенгагене, а в 1920 году основал исследовательский институт, названный в его честь. Вести от немецкого исследователя Арнольда Зоммерфельда (одного из физиков, которые улучшили модель атома Бора, внесшего в нее такой вклад, что иногда эту модель называют «атомом Бора – Зоммерфельда») могли приходить в нейтральную Данию, а затем от Бора – к Резерфорду, находившемуся в Англии. Прогресс продолжался, но все уже было иначе.
После войны немецких и австрийских ученых многие годы не приглашали на международные конференции, Россия оказалась охвачена пламенем революции, а наука вместе с молодыми исследователями потеряла и свой международный характер. Совершенно новому поколению предстояло подхватить квантовую теорию, которая остановилась в своем развитии на полпути после представления запутанного атома Бора (который, стоит признать, был значительно улучшен благодаря усилиям многих ученых и стал эффективной, хоть и беспорядочной моделью), и привести ее к расцвету. Имена исследователей этого поколения знакомы любому современному физику: Вернер Гейзенберг, Поль Дирак, Вольфганг Паули, Паскуаль Йордан и другие. Представители первого квантового поколения, они все родились и выросли уже после великого открытия Планка (Паули в 1900 году, Гейзенберг в 1901-м, Дирак и Йордан – в 1902-м) и пришли в науку в 1920-х годах. Им не нужно было преодолевать прочно засевшие в сознании идеи классической физики, и они, в отличие от великих ученых вроде Бора, уже не чувствовали необходимости идти на полумеры и сохранять связь с классическими идеями, представляя свои концепции атома. Все это было абсолютно закономерно: вероятно, не было совпадением и то, что с момента открытия Планком уравнения излучения абсолютно черного тела до расцвета квантовой физики прошло всего двадцать шесть лет – ровно столько, сколько нужно было новому поколению физиков, чтобы превратиться в настоящих исследователей. Более старшие ученые, которые все еще принимали активное участие в работе, оставили этому поколению в наследство две идеи, помимо самой постоянной Планка. Первой был атом Бора, который явно показал, что квантовые идеи должны быть вплетены в любую удовлетворительную теорию объяснения атомных процессов. Вторая стала заслугой одного великого ученого того времени, который, казалось, наперекор всему никогда не хватался за идеи классической физики. В 1916 году, в разгар войны работая в Германии, Эйнштейн ввел в атомную теорию понятие вероятности. Это была уловка – еще одно дополнение к атому Бора, благодаря которому его поведение стало похожим на наблюдаемое поведение настоящих атомов. Но эта уловка продлила жизнь атома Бора и сделала его крепкой основой истинной квантовой теории – хотя по иронии судьбы впоследствии Эйнштейн сам же отказался от нее, как известно, заявив: «Бог не играет в кости».
Элемент случайности: боги игральные кости
Еще в начале 1900-х годов, когда Резерфорд с коллегой Фредериком Содди изучали природу радиоактивности, они открыли необычное и фундаментальное свойство атома, или, точнее, его ядра. Радиоактивный «распад», как это называется сегодня, подразумевал фундаментальные изменения в атоме (сегодня мы знаем, что причиной является распад ядра и вылет его осколков), происходившие без внешнего воздействия. Радиоактивный распад идет независимо от того, подогреть или охладить атом, поместить его в вакуум или в ведро с водой. Казалось, что невозможно точно предсказать, когда определенный атом радиоактивного вещества подвергнется распаду, испустив альфа– или бета-частицу и гамма-лучи, однако эксперименты показали, что из большого числа радиоактивных атомов в заданный промежуток времени будет всегда распадаться определенная часть. Для каждого радиоактивного элемента существует характерное время, называемое периодом полураспада, за которое распадается ровно половина атомов. Например, период полураспада радия составляет 1600 лет. Радиоактивной формы углерода – углерода-14 – чуть меньше 6000 лет, что делает его полезным при определении археологических возрастов. А период полураспада радиоактивного калия составляет 1300 миллионов лет.
Не зная, что заставляет один атом из множества распадаться, в то время как его соседи остаются целыми, Резерфорд и Содди использовали это открытие для вывода статистической теории радиоактивного распада. В этой теории применялись актуарные методы расчета, сходные с теми методами, которые используются страховыми компаниями, понимающими, что, хотя некоторые из застрахованных ими людей скончаются в молодом возрасте и их наследники получат от страховщиков выплаты, значительно превосходящие суммы уплаченных страховых взносов, другие клиенты проживут долгие жизни и внесут достаточное количество взносов, чтобы компенсировать это. Хотя страховые компании не могут знать, когда умрет каждый из их клиентов, актуарные таблицы помогают их бухгалтерам сводить баланс. В некотором роде статистические таблицы позволили физикам свести баланс радиоактивного распада, учитывая, что речь в данном случае шла об огромных скоплениях атомов.
В связи с этим интересно, что радиоактивность никогда не исчезает полностью из радиоактивного вещества. Из миллионов атомов половина распадается за определенное количество времени. В течение следующего периода полураспада – ровно такого же отрезка времени – распадается половина оставшихся атомов и так далее. Количество радиоактивных атомов, остающихся в веществе, становится с каждым разом все меньше, стремясь к нулю, но каждый шаг в сторону нуля проходит только половину расстояния до него.
В те дни физики вроде Резерфорда и Содди полагали, что в конце концов кто-нибудь поймет, что именно заставляет распадаться каждый отдельный атом, и это открытие объяснит статистическую природу процесса. Когда Эйнштейн применил статистические методы к модели Бора, чтобы объяснить детали атомных спектров, он тоже предположил, что последующие открытия отбросят необходимость в «актуарных таблицах». Они все ошибались.
Энергетические уровни атома или электрона в атоме можно представить как лестничный пролет. Высоты каждой ступеньки не эквивалентны с точки зрения энергии – верхние уровни располагаются ближе друг к другу, чем нижние. Бор показал, что в случае водорода (простейшего атома) энергетические уровни могут быть представлены в виде лестницы, у которой высота каждой ступени, ведущей к вершине, пропорциональна 1 /гг2, где n – это номер каждой ступени при счете снизу. Переход с первого уровня этой лестницы на второй требует, чтобы электрон поглотил ровно столько энергии hv, сколько необходимо для перехода на следующую ступеньку; если электрон падает обратно на первый уровень (на «основной уровень» атома), он испускает точно такое же количество энергии. Электрон с основного уровня не может поглотить меньшее количество энергии, потому что не существует промежуточной «ступеньки», на которой он может остановиться. Точно так же электрон со второго уровня не может испустить меньше кванта энергии, поскольку он не может спуститься никуда, кроме как на основной уровень. Так как существует множество ступеней, на которых может остановиться электрон, и так как он может перепрыгивать туда-обратно с любой ступени на любую другую, в спектре каждого элемента множество линий. Каждая линия соотносится с переходом между ступенями – между энергетическими уровнями с разными квантовыми числами. Например, все переходы, которые оканчиваются на основном уровне, производят спектральные линии, подобные серии Бальмера; все переходы с более высоких уровней на второй соответствуют другому набору линий и так далее. В горячем газе атомы постоянно сталкиваются друг с другом, а потому электроны поднимаются на высокие энергетические уровни и затем падают назад, излучая при этом яркие линии спектра. Когда свет проходит сквозь холодный газ, электроны основного уровня набирают энергию, в процессе этого поглощая свет и оставляя темные линии в спектре.
Если модель атома Бора имела хоть какое-то значение, то это объяснение того, как горячие атомы излучают энергию, должно было быть связано с законом Планка. Спектр излучения абсолютно черного тела должен был представлять собой комбинированный эффект излучения энергии множеством атомов в процессе того, как электроны перепрыгивали с одного энергетического уровня на другой.

Рис. 4.1. Энергетические уровни в простом атоме вроде атома водорода можно сравнить с набором ступеней, имеющих различную высоту. Мяч, помещаемый на различные ступени, символизирует электрон на различных энергетических уровнях атома. Движению вниз с одного уровня на другой соответствует высвобождение определенного количества энергии, связанной в атоме водорода со спектральными линиями серии Бальмера. Промежуточных линий не существует, поскольку нет промежуточных «ступеней» для электрона.
В 1916 году Эйнштейн завершил работу над своей общей теорией относительности и снова обратился к квантовой теории (в сравнении с его главным трудом это, должно быть, казалось для него отдыхом). Возможно, он был вдохновлен успехом модели атома Бора и тем фактом, что как раз в это время его новая версия корпускулярной теории света наконец-то начала обретать признание. В 1905 году, когда Эйнштейн только опубликовал свою интерпретацию фотоэлектрического эффекта, одним из его главных оппонентов стал американский физик Роберт Эндрюс Милликен. Он десять лет проверял эту идею в серии блестящих опытов, начав их с целью доказать, что Эйнштейн был неправ, и закончив в 1914 году обнаружением прямого экспериментального доказательства того, что объяснение фотоэлектрического эффекта с помощью световых квантов, или фотонов, предложенное Эйнштейном, было верным. В процессе этих экспериментов он опытным путем установил точное значение h ив 1923 году по иронии судьбы получил Нобелевскую премию за свои исследования и измерение заряда электрона.
Эйнштейн понял, что переход атома из «возбужденного» энергетического состояния – с электроном на высоком энергетическом уровне – в состояние с меньшей энергией во многом сходен с радиоактивным распадом атома. Он использовал статистические методы, развитые Больцманом (для оперирования с поведением групп атомов), чтобы исследовать индивидуальные энергетические состояния, рассчитывая вероятность того, что определенный атом окажется в энергетическом состоянии, соответствующем определенному квантовому числу n. Он использовал вероятностные «актуарные таблицы» радиоактивности, чтобы выяснить вероятность «распада» атома из состояния n в другое состояние с меньшей энергией (то есть с меньшим квантовым числом). Все это ясным и простым путем привело к формуле Планка для излучения абсолютно черного тела, полученной всецело на основании квантовых идей. Вскоре, используя статистические идеи Эйнштейна, Бор сумел расширить свою модель атома, включив в нее объяснение большей четкости одних линий по сравнению с другими: так происходило из-за того, что некоторые переходы между энергетическими состояниями были более вероятны – могли случиться скорее, чем другие. Он не мог объяснить, почему все было именно так, но в то время это никого особенно не волновало.
Как и многие люди, изучавшие в те дни радиоактивность, Эйнштейн верил, что актуарные таблицы не были последним словом в этих расчетах и что последующие исследования объяснят, почему конкретный переход происходил в четко определенное время, а не в какое-нибудь другое. Но как раз тогда квантовая теория стала окончательно откалываться от классических идей, и никакой «глубинной причины», по которой радиоактивный распад или энергетические переходы внутри атома происходят в конкретный момент времени, так и не было обнаружено. И правда, кажется, что эти изменения происходят исключительно по воле случая, на статистической основе, и уже из-за этого возникают фундаментальные философские вопросы.
В классическом мире ничего не происходит без причины. Причину любого события можно отследить дальше, чтобы обнаружить причину причины, а затем выяснить, что вызвало ее – и так далее до самого Большого взрыва (если вы космолог) или до момента сотворения мира в религиозном смысле (если вы придерживаетесь этой модели). Но в квантовом мире эти прямые причинно-следственные связи исчезают, стоит только взглянуть на радиоактивный распад и атомные переходы. Электрон не передвигается с более высокого энергетического уровня на более низкий в конкретный момент и по конкретной причине. Более низкий энергетический уровень статистически желаннее для атома, поэтому высока вероятность (а уровень вероятности можно даже проквантовать), что рано или поздно электрон совершит этот переход. Но нет возможности установить, когда случится такой переход. Никакая внешняя сила не толкает электрон и никакой внутренний механизм не отсчитывает время прыжка. Это просто происходит без определенных причин в какой-то момент времени.
Это не полное нарушение причинно-следственной связи. Хотя многие ученые XIX столетия пришли бы в ужас от этой идеи, я сомневаюсь, что хоть кто-то из читателей обеспокоен ею. Но это только верхушка айсберга, первый намек на истинную странность квантового мира, о котором стоит упомянуть, хотя его истинное значение в то время еще не разглядели. Признание пришло в 1916 году, и пришло оно от Эйнштейна.
Атомы в перспективе
Нам пришлось бы долго и нудно перечислять все мельчайшие усовершенствования модели атома Бора, которые были сделаны до 1926 года, а потом обреченно сказать, что большинство этих дополнений, стремившихся к истине, все равно было ошибочно. Однако атом Бора так прочно вошел в учебники и популярную литературу, что невозможно совсем обойти его вниманием. В своей итоговой версии он стал практически последней моделью атома, которая хоть как-то напоминает тот образ, к которому мы привыкли в обычной жизни.
Неделимый цельный атом древности оказался не просто делимым: выяснилось, что внутри него огромное количество пустого пространства, в котором находятся странные частицы, ведущие себя странным образом. Бор предложил модель, которая ставила некоторые особенности их странного поведения в контекст, близкий к повседневному. Хотя в некотором роде и лучше отказаться от всех обычных идей, прежде чем полностью погрузиться в квантовый мир, большинство людей с радостью делают паузу, чтобы разобраться с моделью Бора, прежде чем совершить это погружение. Давайте остановимся на полпути от классической физики к квантовой теории, чтобы перевести дух, немного отдохнуть и только потом ступить в неизвестность. Но не будем тратить время и силы на то, чтобы отследить все ошибки и полуправды, которые возникали в процессе постепенного развития модели Бора и ядра вплоть до 1926 года. Вместо этого я взгляну на атом Бора из 1980-х, чтобы описать современное прочтение идей Бора и его коллег, включая несколько кусочков мозаики, которые, в общем-то, обрели свое место гораздо позже.
Атомы крайне малы. Число Авогадро является числом атомов водорода в одном грамме газа. В повседневной жизни мы не встречаемся с газом водорода, однако чтобы хоть как-то представить себе, насколько малы атомы, давайте вообразим кусок углерода – уголь, алмаз или сажу. Поскольку каждый атом углерода весит в двенадцать раз больше атома водорода, такое же число атомов углерода, как в грамме водорода, весит двенадцать граммов. Ложка сажи, довольно крупный алмаз или довольно маленький кусок угля весят примерно по десять граммов. Именно столько углерода содержит число атомов, равное числу Авогадро – 6 × 1023 (шестерка с двадцатью тремя нулями). Как поместить это число в перспективу? Огромные числа часто называют «астрономическими», а многие астрономические числа действительно огромны, поэтому давайте попытаемся найти сравнимо крупное число в астрономии.
По оценкам астрономов, возраст Вселенной составляет чуть меньше 15 миллиардов лет, 15 × 109. Очевидно, что 1023 гораздо больше, чем в 109. Давайте превратим возраст Вселенной в еще большее число, используя минимальную единицу времени, которую можно легко ощутить, – секунду. В году 365 суток, в сутках 24 часа, а каждый час состоит из 3600 секунд. Округлив, получим, что год содержит около 32 миллионов, или 3 × 107, секунд. Таким образом, 15 миллиардов лет содержат в себе 45 × 1016 секунд, ведь для перемножения чисел вроде 109 и 107 необходимо сложить их степени, что в итоге дает 1016. Итак, в грубом приближении возраст Вселенной в секундах составляет 5 × 1017.
Однако это еще не может сравниться с 6 × 1023 – разница составляет еще шесть степеней десятки. Казалось бы, это не так уж страшно, учитывая, что десять возводится в двадцать третью степень, но что это вообще-то значит? Мы делим 6 × 1023 на 5 × 1017 и, вычисляя разницу степеней, получаем чуть больше 1 × 106, или миллиона. Представьте сверхъестественное существо, которое наблюдает за развитием нашей Вселенной с момента Большого взрыва. У этого существа есть десять граммов чистого углерода и тонкие щипцы, которыми можно вытаскивать отдельные атомы углерода из горстки. Приступив к этому в момент начала Большого взрыва, в котором родилась наша Вселенная, существо вытаскивает из горстки по одному атому в секунду и выбрасывает их. В таком случае к настоящему моменту вытащено уже 5 × 1017 атомов. Много ли это? Непрерывно работая на протяжении 15 миллиардов лет, сверхъестественное существо вытащило только около одной миллионном атомов углерода: в горстке все еще остается в миллион раз больше атомов, чем уже выброшено.
Возможно, теперь у вас появилось примерное представление о том, насколько мал атом. Неожиданность не в том, что модель атома Бора является грубой и легкой аппроксимацией, и не в том, что законы повседневной физики к атомам неприменимы. Чудо в том, что мы понимаем об атоме хоть что-то и способны найти пути соединения классической ньютоновской физики и атомной квантовой физики.
Таким и является атом – насколько вообще можно составить реальное представление о чем-то столь малом. Как показал Резерфорд, крошечное центральное ядро окружено облаком электронов, снующих рядом, подобно пчелам. Сперва считали, что ядро состоит только из протонов, каждый из которых имеет положительный заряд, равный заряду электрона, что делает каждый атом электрически нейтральным. Позже выяснилось, что существует еще одна фундаментальная частица, очень похожая на протон, но не обладающая зарядом. Она называется нейтроном и вместе с протонами присутствует в ядрах всех атомов, за исключением простейшей формы водорода. Но число протонов в нейтральном атоме действительно совпадает с числом электронов. Количество протонов в ядре определяет, атому какого элемента оно принадлежит, количество электронов в облаке (равное количеству протонов) определяет химический состав этого атома и элемента. Однако некоторые атомы могут иметь одинаковое количество протонов и электронов и при этом различаться по количеству нейтронов, тем самым образуя разные вариации одного и того же химического элемента, которые называются изотопами. Это название в 1913 году предложил Содди. Оно происходит от греческой фразы «одно место», так как было открыто, что атомы различного веса могут иметь одинаковое место в таблице химических свойств, то есть в периодической таблице Менделеева. В 1921 году Содди получил Нобелевскую премию по химии за свою работу с изотопами.
Простейший изотоп простейшего элемента представляет собой самую распространенную форму водорода, в которой содержится один протон и один электрон. Атом дейтерия состоит из одного протона и одного нейтрона, а также одного электрона, но его химические свойства не отличаются от свойств обычного водорода. Так как протоны и нейтроны обладают практически одинаковой массой и каждый из них примерно в 2000 раз тяжелее электрона, суммарное количество протонов и нейтронов в ядре определяет практически всю массу атома, за исключением маленькой части. Обычно она обозначается числом А, называемым массовым числом. Количество протонов в ядре, которое определяет свойства элемента, называется атомным числом (Ζ). Единица измерения атомных масс вполне закономерно называется единицей атомной массы и равняется одной двенадцатой массы изотопа углерода, ядро которого содержит шесть протонов и шесть нейтронов. Этот изотоп называется углерод-12 и на письме обозначается как 12С. Другими изотопами являются 13С и 14С, ядра которых содержат семь и восемь нейтронов соответственно.
Чем тяжелее ядро (чем больше в нем протонов), тем больше существует изотопов. В ядре олова, например, содержится пятьдесят протонов (Ζ = 50), что дает олову десять стабильных изотопов, массовые числа которых находятся в диапазоне от А=112 (62 нейтрона) до А=124 (74 нейтрона). Число нейтронов в стабильных ядрах (за исключением простейшего атома водорода) всегда как минимум равняется числу протонов. Нейтральные нейтроны помогают удерживать вместе положительно заряженные протоны, которые имеют тенденцию отталкиваться друг от друга. Радиоактивность присуща нестабильным изотопам, которые преобразуются в стабильную форму и в процессе испускают излучение. Бета-луч – это электрон, который вылетает из атома, когда нейтрон становится протоном, а альфа-частица – это само атомное ядро, два протона и два нейтрона (ядро гелия-4), которая вылетает, когда нестабильное ядро перестраивает свою внутреннюю структуру. Очень тяжелые нестабильные ядра разделяются на два или более стабильных ядра с меньшей массой посредством хорошо известного сегодня ядерного, или атомного, распада, в ходе которого также испускаются альфа– и бета-частицы. Все это происходит в почти невообразимо меньшем масштабе, чем даже невообразимо малый масштаб самого атома. Диаметр среднего атома составляет 10-10 метра, радиус ядра составляет примерно 10-15 метра, что в 105 раз меньше атома. Так как объем пропорционален радиусу в кубе, необходимо умножить степень на три, и мы получим, что объем ядра в 1015 раз меньше объема атома.
Химия получает объяснение
Облако электронов является внешней частью атома, с помощью которой он взаимодействует с другими атомами. Неважно, что находится глубоко внутри этого электронного облака, – другой атом «видит» и «чувствует» лишь электроны, и именно взаимодействие электронных облаков отвечает за химию. Объясняя широкий спектр свойств электронного облака, модель атома Бора дает химии научную основу. Химики уже знали, что некоторые элементы имеют весьма схожие химические свойства, хотя их атомные массы различны. Если сгруппировать элементы в таблицу согласно их атомной массе (и особенно если учесть также различные изотопы), то эти схожие элементы оказываются на одинаковых интервалах, например одна из закономерностей повторяется каждые восемь элементов. Таблица, элементы в которой сгруппированы согласно одинаковым свойствам, называется периодической таблицей, или таблицей Менделеева.
В июне 1922 года Бор посетил университет Геттингена в Германии и прочитал серию лекций по квантовой теории и атомной структуре. Под руководством Макса Борна, который в 1921 году получил там звание профессора теоретической физики, Геттинген стал одним из трех ключевых центров развития полноценной версии квантовой механики. Борн родился в 1882 году и был сыном профессора анатомии университета Бреслау. В начале 1900-х годов, когда появились первые идеи Планка, он еще был студентом. Сперва он изучал математику, а к физике обратился после завершения своей докторской в 1906 году (и некоторое время проработал в Кавендишской лаборатории). Как мы увидим, это дало ему важные навыки. Будучи экспертом в теории относительности, Борн писал работы с исключительной математической точностью, что сильно отличалось от запутанных теоретических набросков Бора, которые содержали блестящие идеи и физическую интуицию, но зачастую требовали доработки в математической части. Однако оба гения были важны для нового понимания атомов.
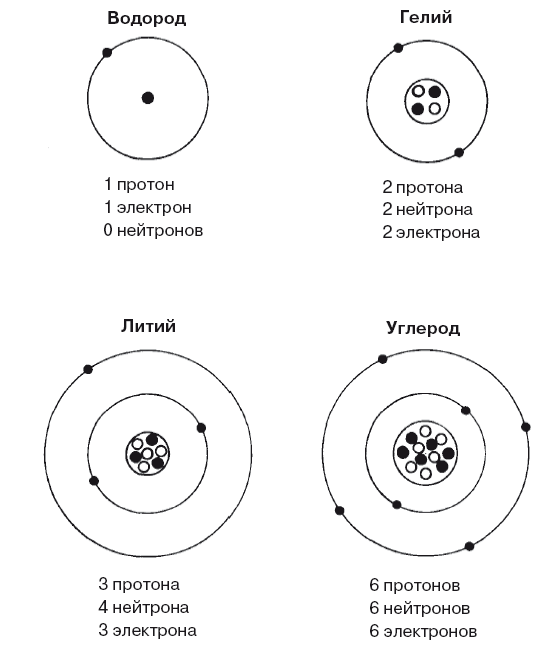
Рис. 4.2. Атомы некоторых простейших элементов зачастую можно представить как ядро, окруженное электронами в оболочках, соответствующих энергетическим уровням. Квантовые законы позволяют только двум электронам находиться на нижнем уровне, поэтому литий, имеющий три электрона, имеет один электрон на второй ступени энергетической лестницы. Вторая оболочка может «вместить» восемь электронов, поэтому у углерода она заполнена ровно наполовину, что является причиной его интересных химических свойств, лежащих в основе жизни.
Лекции Бора в июне 1922 года стали важной вехой в возрождении физики в послевоенной Германии, а также в истории квантовой теории. На них присутствовали ученые со всей Германии, и лекции прозвали «Фестивалем Бора» (с намеком на некоторые другие известные немецкие праздники). На этих лекциях, сперва подготовив себе почву, Бор представил первую успешную теорию о Периодической таблице, которая в сущности дожила и до наших дней. Идея Бора основывалась на том, как электроны окружают ядро атома. Каким бы ни было атомное число этого ядра, первый электрон отправляется на энергетический уровень, соответствующий основному уровню водорода. Следующий электрон оседает на том же самом энергетическом уровне, и внешне атом уже походит на атом гелия, обладающего двумя электронами. Бор утверждал, что на этом уровне больше нет места для электронов, а потому следующий электрон должен осесть на другом энергетическом уровне. Таким образом, атом с тремя протонами в ядре и тремя электронами вне ядра должен содержать два электрона, посаженных ближе к ядру, и один – чуть дальше. В химическом отношении он должен вести себя подобно атому с одним электроном (атому водорода). Элемент с Ζ = 3 – это литий, который действительно проявляет некоторое химическое сходство с водородом. Следующий элемент Периодической таблицы, свойства которого сходны со свойствами лития, – это натрий (Ζ = 11), находящийся на восемь клеток дальше лития. В связи с этим Бор заявил, что на энергетических уровнях, расположенных дальше двух внутренних электронов, должно быть восемь мест. Когда они заполняются, следующий электрон, одиннадцатый по счету, должен оседать на следующем энергетическом уровне, связанном с ядром еще слабее, снова копируя внешний вид атома с одним-единственным электроном.
Эти энергетические уровни называются «оболочками». Объяснение Периодической таблицы, предложенное Бором, с успехом включало в себя заполнение оболочек по мере увеличения Ζ. Оболочки можно представить себе в виде луковицы, имеющей много слоев. Химические свойства определяются числом электронов на внешней оболочке атома. Находящееся глубже играет второстепенную роль в том, как один атом взаимодействует с другими.
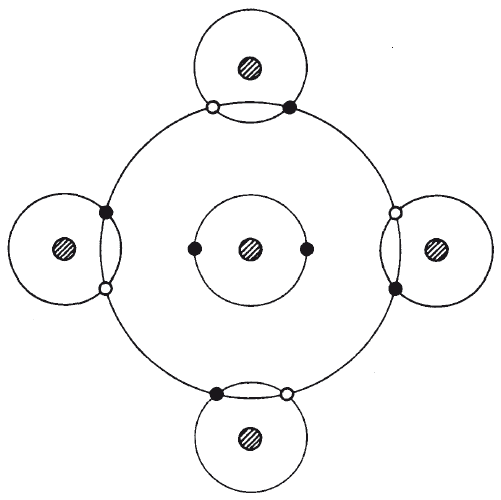
Рис. 4.3. Когда один атом углерода создает связь с четырьмя атомами водорода, электроны распределяются так, что у каждого атома водорода как будто заполняется первая оболочка (два электрона) и каждый атом углерода «видит» на своей второй оболочке восемь электронов. Это очень стабильная конфигурация.
Бор шел по электронным оболочкам от ядра атома к его периферии, используя все свидетельства, предоставленные спектроскопией, и объяснил взаимосвязь элементов в периодической системе с точки зрения атомной структуры. Он понятия не имел, почему оболочка, содержащая восемь электронов, должна была считаться заполненной («замкнутой»), но не оставил ни у кого из своих слушателей сомнения в том, что открыл основополагающую истину. Как позже сказал Гейзенберг, Бор «ничего не доказал математически… он просто понял, что связь была примерно такой». В 1949 году, комментируя успех работы Бора, основанной на квантовой теории, в своих «Автобиографических заметках», Эйнштейн написал: «Это неустойчивое и противоречивое основание оказалось достаточным, чтобы позволить человеку, обладающему таким уникальным чутьем и здравым смыслом, как Бор, открыть основные законы спектральных линий и электронных оболочек атома, описав одновременно их влияние на химию, и это показалось мне истинным чудом – и кажется чудом даже сегодня».
Химия изучает, как атомы взаимодействуют и объединяются, образуя молекулы. Почему углерод взаимодействует с водородом так, что четыре атома водорода объединяются с одним атомом углерода, образуя молекулу метана? Почему водород существует в форме молекул, каждая из которых состоит из двух атомов, тогда как атомы гелия не образуют молекул? И так далее. Оболочечная модель дала поразительно простые ответы. Каждый атом водорода имеет один электрон, тогда как у гелия их два. «Самая глубокая» оболочка заполняется, когда на ней оказываются два электрона. По неизвестной причине заполненные оболочки более стабильны – атомы «любят» заполненные оболочки. Когда два атома водорода объединяются, образуя молекулу, они делятся друг с другом электронами таким образом, что каждый атом выигрывает, получая замкнутую оболочку. Гелий уже обладает замкнутой оболочкой, поэтому он не заинтересован в таком взаимодействии и отказывается вступать с чем-либо в химическую связь.
Ядро углерода содержит шесть протонов, а рядом с ним находится шесть электронов. Два из них расположены на замкнутой внутренней оболочке, а четыре – на внешней, что делает ее наполовину пустой. Четыре атома водорода могут вступить во взаимодействие с четырьмя внешними электронами углерода и поделиться собственными электронами. Каждый атом водорода получает в итоге псевдозамкнутую оболочку с двумя внешними электронами, в то время как атом углерода получает псевдозамкнутую вторую оболочку с восемью электронами.
Бор утверждал, что атомы объединяются таким образом, чтобы как можно ближе подойти к созданию замкнутой внешней оболочки. Иногда, как в случае с молекулой водорода, лучше всего представить себе пару электронов, которые являются общими для двух ядер; в других случаях удобнее представить атом, имеющий один электрон на внешней оболочке (например, атом натрия), который отдает этот электрон другому атому, имеющему на внешней оболочке семь электронов и одно свободное место (в этом случае, например, атому хлора). Все атомы довольны: натрий, теряя электрон, позволяет более глубокой, но при этом заполненной оболочке стать «видимой», а хлор, получая электрон, заполняет свою внешнюю оболочку. Однако итоговый результат заключается в том, что атом натрия, теряя одну единицу отрицательного заряда, становится положительно заряженным ионом, а атом хлора становится отрицательно заряженным ионом. Так как противоположные заряды притягиваются, атомы остаются связанными в форме электрически нейтральной молекулы хлорида натрия, или обыкновенной соли.
Таким образом можно объяснить все химические реакции: фактически они представляют собой перераспределение электронов между атомами в целях достижения стабильности заполненных электронных оболочек. Энергетические переходы с участием внешних электронов дают характерный спектральный отпечаток элемента, в то время как энергетические переходы, в которых задействованы более глубокие оболочки (а следовательно, гораздо больше энергии, в рентгеновской части спектра), должны быть одинаковыми для всех элементов, что и было доказано. Как и все лучшие теории, модель Бора была подтверждена успешным предсказанием. Элементы были расставлены в Периодической таблице, но даже в 1922 году в ней существовало несколько пропусков, соответствующих еще не открытым элементам с атомными числами 43, 61, 72, 75, 85 и 87. Модель Бора точно предсказала свойства этих «недостающих» элементов и предположила, что элемент 72, в частности, должен был иметь свойства, схожие со свойствами циркония, а этот прогноз противоречил предсказаниям, сделанным на основе альтернативных моделей атома. Прогноз подтвердился в течение года, когда был открыт гафний, элемент 72, спектральные свойства которого в точности соответствовали предсказанным Бором.

Рис. 4.4. Отдавая единственный находящийся на внешней оболочке электрон, атом натрия достигает желаемой квантово-механической конфигурации и оказывается положительно заряженным. Хлор принимает этот дополнительный электрон, заполняя внешнюю оболочку, и приобретает отрицательный заряд. Заряженные ионы объединяются электростатическими силами, образуя молекулы и кристаллы поваренной соли (NaCl).
Это стало кульминацией старой квантовой теории. В течение трех лет она была отброшена, хотя с точки зрения химии представления об электронах как о крошечных частицах, вращающихся вокруг ядра в оболочках, которые «любят» быть заполненными (или пустыми, но не заполненными частично), недостаточно. А если вас занимает физика газов, вам недостаточно и представления об атомах как о твердых неделимых бильярдных шарах. Физика XIX века хорошо работает в повседневности. Физика 1923 года неплоха для основ химии. А физика 1930-х годов переносит нас ближе, чем когда-либо, к пониманию фундаментальных истин. За более чем полвека не было прорыва, сравнимого с квантовой революцией, и на протяжении всего этого времени остальные науки пытались успеть за идеями нескольких гениев. Успех опыта Аспе, проведенного в Париже в начале 1980-х годов, ознаменовал начало конца этой гонки, дав первое прямое экспериментальное подтверждение тому, что даже самые странные аспекты квантовой механики являются буквальным описанием устройства реального мира. Итак, настало время узнать, насколько удивителен на самом деле квантовый мир.
Назад: Глава третья Свет и атомы
Дальше: Часть вторая Квантовая механика

