Книга: Закон «джунглей». В поисках формулы жизни
Назад: Глава 4. Жиры, обратная связь и чудесный грибок
Дальше: 03 Закон джунглей
Глава 5. Заклинившие акселераторы и отказавшие тормоза
Рак будет побежден не из-за жалости к больным и не из страха перед болезнью, а из любопытства – узнать, как и почему он возникает.Герберт Уэллс
Велосипед в кампусе – дело обычное, поэтому студенты могли и не обратить внимания на один красный велик, каждый день пересекавший кампус Чикагского университета. Но если бы они присмотрелись более внимательно, то с удивлением заметили бы, что едет на нем элегантная седовласая женщина. Однако и тогда они бы не догадались, что этой заправской велосипедистке 88 лет и что она, бабушка пятерых внуков, – одна из наиболее прославленных американских ученых, незадолго до того удостоенная высочайшей гражданской награды в стране – Президентской медали Свободы.
Но Джанет Дэвисон Роули была именно такой. Важнейшее достижение Роули, одной из первых исследовательниц рака, было таково: именно она доказала, что рак является генетическим заболеванием. Хотя она занималась исследованием значительно более сложных проблем, чем метаболизм сахара у бактерий или регуляция холестерина у человека, она пользовалась тем же научным методом, что Моно и Жакоб, Браун и Голдштейн, а именно – определила ситуацию, в которой законы регуляции нарушаются, и выяснила, почему это происходит. Ее прорыв позволил по-новому объяснить рак и создать новый спасительный препарат.

Рис. 5.1
Джанет Роули по дороге в лабораторию
Фотография Дэна Драя. Публикуется с разрешения University of Chicago Magazine
Хромосомы и бумажные куклы
Джанет Дэвисон росла в Чикаго в годы Великой депрессии. Денег не хватало, семья была вынуждена часто переезжать из одного района в другой, поэтому маленькая Джанет сменила много школ. Из-за нужды она не могла позволить себе никаких роскошеств или экзотических увлечений. Отец познакомил ее с филателией, и девочка хорошо научилась анализировать мелкие детали. В юном возрасте она уже подмечала тонкие различия между выпусками, будь то период выпуска или другие характерные признаки. Она продолжала увлекаться филателией, и когда повзрослела, а умение распознавать закономерности впоследствии очень ей пригодилось.
Проучившись в старших классах всего два года, Дэвисон выиграла стипендию на обучение по специальной программе в Чикагском университете, что позволило ей в 15-летнем возрасте поступить в университет, а затем закончить курс высшей школы и получить степень бакалавра одновременно. Дэвисон преуспела в этой атмосфере требовательности и отзывчивости, серьезно заинтересовалась биологией и медициной. Затем она подала заявку в медицинскую школу при университете и получила возможность там учиться. Но в 1944 г. девушки могли попасть на эту специальность лишь по квоте: всего три места на курсе из 65 человек. Квота уже была заполнена, поэтому Дэвисон решила выждать год. Эта пауза не слишком ей помешала – ведь когда Дэвисон поступила на медика, ей было всего 20. Она получила степень по медицине в 1948 г. и на следующий день после вручения дипломов вышла замуж за сокурсника Дональда Роули.
Хотя Дэвисон (теперь – доктор Роули) в очень юном возрасте закончила обучение и практику, исследовательской карьерой она занялась много позже. Поступая в медицинскую школу, она хотела состояться как жена и мать, считала, что профессия врача (частичная занятость) будет ей интересна. Итак, по окончании интернатуры они с Дональдом вплотную занялись семьей. Роули воспитывала четырех сыновей, а по паре дней в неделю работала в различных клиниках – сначала в Мэриленде, а затем вновь в Чикаго.
Среди первых клиник в ее карьере была такая, где лечили детей с отклонениями в развитии. В 1959 г., всего через пару лет после определения точного количества хромосом у здорового человека (46), удалось установить, что у детей с синдромом Дауна есть лишний экземпляр 21-й хромосомы. Роули, хотя и не проходила курс генетики, очень заинтересовалась наследованием генетических заболеваний. Проработав в этой клинике несколько лет, она решила взяться за более серьезные исследования.
Вскоре такая возможность представилась, когда Дональд собрался провести годичный творческий отпуск в Оксфордском университете и поработать с Говардом Флори, который в свое время делил палатку с Чарльзом Элтоном, а в 1945 г. стал одним из лауреатов Нобелевской премии за разработку пенициллина. Роули поняла, что за год пребывания в Англии она может научиться анализировать хромосомы, а затем применить этот опыт на основной работе в Чикаго. В те годы исследования велись так: брали кровяные клетки, выращивали их в присутствии помеченного радиоактивными изотопами предшественника ДНК, а затем фотографировали радиоактивные хромосомы на чувствительную пленку. Такая процедура позволяла точно подсчитывать хромосомы и выявлять грубые отклонения, но с ее помощью было сложно различить детали, которыми одни хромосомы отличались от других.
Роули достаточно хорошо изучила этот метод, даже была соавтором статьи, в которой анализировалось копирование хромосом при делении клеток. Вернувшись в Чикаго, она решила не продолжать работу в клинике, а заняться исследованиями. Имея в активе всего одну научную статью, она обратилась к доктору Леону Джейкобсону, директору Аргоннского онкологического исследовательского госпиталя, который ранее работал главным врачом в команде ученых Чикагского университета, занятых в Манхэттенском проекте.
«Я начала в Англии исследовательский проект и хочу его продолжить. Можно у вас поработать в порядке частичной занятости? – объяснила Роули. – Мне понадобится только микроскоп и проявочная. Кстати, вы будете мне платить? Я должна буду платить няне».
Джейкобсон согласился, и Роули занялась изучением хромосом людей, страдавших различными заболеваниями крови. В клетках некоторых пациентов она находила лишние хромосомы, в других хромосом не хватало, но она не могла определить, какие именно хромосомы предопределяют болезнь. Так продолжалось до тех пор, пока не появился новый метод окрашивания хромосом, при котором использовался флуоресцентный краситель, позволявший различать такие детали. Роули познакомилась с этой техникой во время еще одного творческого отпуска, проведенного в Англии. Вернувшись домой, она стала подробнее изучать образцы крови пациентов, больных лейкемией.
В начале 1972 г. она обнаружила нечто необычное в клетках двух пациентов, страдающих острой миелоидной лейкемией: казалось, что фрагменты двух разных хромосом (8-й и 21-й) оторвались от них и поменялись местами. Такое явление называлось транслокацией, и тот факт, что одинаковая перестановка произошла у двух пациентов с одинаковым типом рака, был поразителен.
Тогда уже было хорошо известно, что в раковых клетках есть лишние хромосомы или каких-то хромосом недостает. Но более внимательный осмотр показал, что многие виды раковых клеток довольно сильно отличаются друг от друга. Поскольку в них не прослеживались какие-либо устойчивые закономерности, хромосомные аберрации обычно считались следствием, а не причиной рака. Действительно, идея о том, что у рака могут быть конкретные генетические причины, не получила широкого признания. Когда в 1966 г. Пейтон Роус получил Нобелевскую премию за открытие вируса, вызывавшего рак у кур, он заявил: «Существует мнение, что онкогены (гены, вызывающие рак) вызывают изменения в генах клеток… но многочисленные факты, рассматриваемые в комплексе, решительно исключают такую гипотезу».
Роули воодушевилась. Возможно, те самые изменения, которые она наблюдала в хромосомах двоих пациентов с лейкемией, могли быть причиной заболевания? Она написала об этом короткую статью и отправила ее в ведущее издание New England Journal of Medicine («Медицинский журнал Новой Англии»). Статью не приняли. Когда Джанет попыталась выяснить почему, ей ответили, что открытие было сочтено «незначительным». Тогда она отправила работу в малоизвестный французский журнал Annales de Génétique («Анналы генетики»), где ее опубликовали.
Вскоре после этого Роули стала изучать клетки пациентов, страдавших другим видом рака – хроническим миелоидным лейкозом (ХМЛ). Работая дома в «свободные» дни, она исследовала особенности их хромосом. Фотографировала окрашенные препараты, вырезала из снимков отдельные хромосомы, наклеивала их на макулатурной бумаге и раскладывала прямо на обеденном столе. Хромосомы существуют парами, многие из них соединены в центральной части двумя длинными «плечами», направленными вверх и вниз. Мальчишки поддразнивали мать, что та играет с бумажными куклами.
За много лет до этого двое исследователей из Филадельфии обнаружили, что в некоторых клетках у пациентов с ХМЛ 22-я хромосома до странности маленькая. Такую хромосому назвали «филадельфийской». Когда Роули внимательно рассмотрела клетки ХМЛ, применив новые методы окрашивания, она обнаружила, что 9-я хромосома в трех образцах длиннее, чем должна быть. На самом деле, недостающая часть 22-й хромосомы путем транслокации попадала в 9-ю хромосому. Таким образом, генетическая информация в клетках ХМЛ на самом деле не отсутствовала, как полагали ранее, она просто находилась не в том месте (рис. 5.2).
Имея на руках три независимых случая транслокации 9-й и 22-й хромосом, исследовательница отправила отчет о своих находках в Nature, ведущий международный научный журнал. Редакторы отвергли статью на том основании, что транслокация могла быть лишь проявлением нормальной изменчивости в человеческой популяции.
Тем временем Роули исследовала хромосомы других клеток из образцов крови пациентов: в этих клетках оказалось по 46 нормальных хромосом. Транслокация была специфична именно для раковых клеток. Более того, Роули обнаружила еще несколько независимых случаев – всего девять – такой же транслокации у пациентов с ХМЛ. Эта аномалия не могла быть совпадением. Дополнительные данные убедили редколлегию, и журнал Nature все-таки опубликовал статью летом 1973 г.
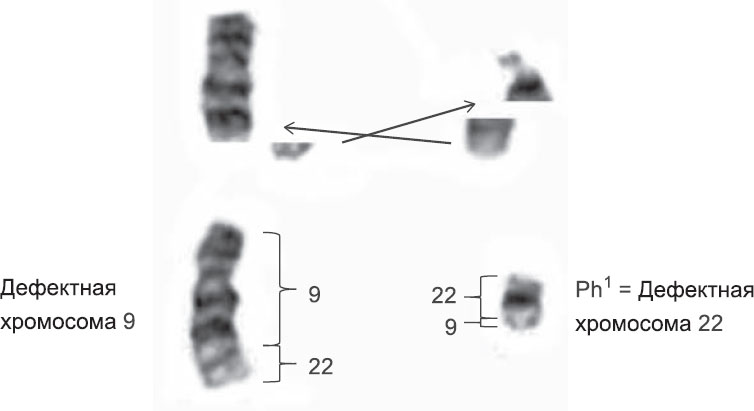
Рис. 5.2
Изменения хромосом при лейкемии. Джанет Дэвисон Роули заметила, что в клетках больных хроническим миелоидным лейкозом 22-я хромосома не слишком маленькая, просто ее кончик попадает в 9-ю хромосому
Иллюстрация воспроизведена с разрешения Рут Мак-Киннон (Ruth Mac-Kinnon) http://scifundchallenge.org/firesidescience/2013/11/11/philadephia-the-birthplace-of-cancer-genetics/
Открытые Роули хромосомные изменения при двух типах лейкемии, специфичные, но все-таки разные, были серьезными доказательствами в пользу того, что по крайней мере некоторые виды рака обусловлены конкретными, возможно, уникальными генетическими мутациями. Обнаруженные ею транслокации ставили массу вопросов. Существуют ли другие подобные транслокации? Как они провоцируют рак? Эти вопросы не давали Роули покоя. Внезапно ее «приработок» стал самой интересной частью жизни. В нарушение ее давних планов и к ее собственному удивлению, карьера и исследования переместились с периферии в самый центр ее жизни, когда самой Роули было уже 48. Она стала ездить в лабораторию на велосипеде, работая по пять дней в неделю.
Вскоре Роули обнаружила другую транслокацию – между 15-й и 17-й хромосомами, – характерную для острого промиелоцитарного лейкоза. Другая исследовательская группа открыла транслокацию при лимфоме Бёркитта.
Транслокация означает, что воедино сливаются два фрагмента ДНК, которые ранее не были смежными. Роули подозревала, что новое наложение двух генов должно быть важнейшим фактором возникновения рака. Но в середине и конце 1970-х геном человека (ДНК всех 23 хромосом, где содержатся все наши гены) был настоящей terra incognita. Выявить гены, вовлеченные в процесс, а тем более понять, как их транслокация вызывает рак, казалось практически невозможным. Так было до тех пор, пока не случились удивительные открытия, связанные с совершенно иным направлением исследований.
Как найти гены рака
Если влияние хромосомных изменений на возникновение рака вызывало скепсис, причем немалый, то роль вирусов в этом процессе казалась еще более сомнительной. В 1910 г. ученый Пейтон Роус из Института Рокфеллера обнаружил вирус, способный вызывать саркому у кур. Однако это открытие было воспринято очень скептически, да и самому ученому оставалось лишь утверждать, что онкогенный вирус действительно существует, поэтому он забросил это направление исследований. Вернуться к нему удалось лишь десятилетия спустя, когда оказалось возможно рассмотреть вирус в мощный электронный микроскоп, а у животных были выделены другие онкогенные вирусы. Только тогда существование таких вирусов стало общепризнанным. Итак, между открытием Роуса и присуждением Нобелевской премии за него прошло 56 лет. Но поскольку у человека такие вирусы обнаружены не были, их роль в заболеваемости людей оставалась в лучшем случае неясной.
Тем не менее существование онкогенных вирусов у животных давало потенциально важные подсказки о том, каковы закономерности развития рака. Одно из основных преимуществ, связанных с изучением таких вирусов, как RSV (вирус саркомы Роуса), заключалось в их простоте. У RSV было всего несколько генов, и возникал вопрос: какие из них вызывают рак?
Важнейшую деталь обнаружил Стив Мартин, аспирант Калифорнийского университета в Беркли, который выделил мутантный RSV, способный воспроизводиться в клетках, но не превращавший их в раковые. Соответствующая мутация возникла всего в одном из четырех генов этого вируса, который называется src (произносится «сарк»). Поскольку нормальный ген src у вируса был необходим для запуска рака, src назвали вирусным онкогеном (геном, вызывающим рак). Но что мог поведать ген куриного вируса о возникновения рака вообще и в частности у людей?
Основное открытие, связанное с опухолевыми вирусами, было сделано еще одним тандемом врачей, учившихся в NIH, – однокашниками Голдштейна и Брауна Харолдом Вармусом и Дж. Майклом Бишопом. Вармус изучал в NIH ту самую систему регуляции ферментов, которую впервые стали исследовать Моно и Жакоб. Бишоп изучал вирус полиомиелита. Тандем возник, когда в 1970 г. Вармус начал работать в лаборатории Бишопа при университете Сан-Франциско, там он собирался исследовать опухолевые вирусы, RSV в частности. В дальнейшем у Вармуса и Бишопа была общая лаборатория.
Открытие гена src побудило Вармуса и Бишопа задуматься о происхождении подобного гена. Он не требовался вирусу для инфицирования клеток и размножения в них. Если ген не нужен вирусу для распространения, то почему он существует, откуда взялся? Возможно, рассуждали они, это мог быть клеточный ген, который вирус случайно захватил на каком-то этапе эволюции. В таком случае ген src мог найтись в нормальных куриных клетках.
До эры развития генной инженерии объявить о поиске такого гена было гораздо проще, чем осуществить сам поиск. Прошло почти четыре года, прежде чем удалось поставить критически важный эксперимент, в котором меченный радиоактивными изотопами «зонд» ДНК, представлявший собой вирусный ген src, использовался для поиска подобного гена в ДНК нормальных клеток. Первые результаты, пролившие свет на эту проблему, получил в октябре 1974 г. постдок Доминик Стеэлен. Действительно, в куриных клетках был подобный ген src. Его назвали «c-src» (от «клеточный src»), чтобы отличать от v-src, вирусного онкогена. Вскоре c-src нашли у других птиц, в том числе у уток, индеек и даже эму.
Но ген c-src встречался не только у птиц. Вармус, Бишоп и их коллега Дебора Спектор нашли этот ген и у млекопитающих, в том числе у людей. Его наличие у других животных показывало, что c-src – древний ген, существующий несколько сотен миллионов лет.
Что бы это значило? Вармус и Бишоп обдумывали удивительные возможности. Во-первых, длительная эволюционная родословная c-src указывала, что он выполнял какую-то задачу в нормальных клетках. Во-вторых, близкое сходство между c-src и v-src подсказывало, что онкогенный вирус RSV мог приобрести ген v-src, подхватив копию c-src, но при этом изменив его так, что новая разновидность гена стала провоцировать рост опухолей.
Все-таки src представлял собой единичный случай. Существовали ли другие вирусные онкогены, у которых были клеточные аналоги? Их поиск превратился в гонку. Очень скоро было открыто несколько вирусных онкогенов у различных опухолевых вирусов, инфицировавших кур, мышей или крыс, а их аналоги имелись не только у вида-хозяина, но и у других животных, а также у людей. Гены myc, abl и ras дополнительно подтвердили, что вирусные онкогены происходят от нормальных клеточных генов, так называемых «протоонкогенов».
К концу 1970-х казалось, что формируются два солидных, но невзаимосвязанных «досье» о происхождении рака. Существование вирусных онкогенов и клеточных протоонкогенов убедительно объясняло, как вирусы могут вызывать рак, но только у животных. Демонстрация характерных хромосомных изменений при некоторых видах человеческого рака была красноречивой, но ограничивалась лишь некоторыми типами опухолей, причем было неизвестно, какими именно генами вызваны эти изменения. Каким образом можно было объединить два этих «досье»?
Способ был, и он позволил понять, почему природа рака связана с регуляцией.
Нарушение законов регуляции
Среди самых первых вирусных онкогенов и клеточных протоонкогенов, открытых после src, был ген v-abl, вызывавший у мышей лейкоз Абельсона, а также его клеточный аналог, ген c-abl. Подобно c-src и другим, c-abl также присутствует в человеческом геноме. Когда ученые выяснили, что ген c-abl относится к 9-й человеческой хромосоме и та же хромосома участвует в транслокации, описанной Роули при ХМЛ, они задумались: могут ли быть связаны эти факты? Возможно ли, что у больных ХМЛ 9-я хромосома повреждалась вблизи от гена c-abl?
Это было весьма смутное предположение. Хромосомы очень велики, в каждой содержится около 1000 генов. C-abl мог оказаться в любом участке хромосомы. Команда голландских и английских ученых взялась исследовать клетки с филадельфийской хромосомой (22-й). Они были просто поражены, выяснив, что ген c-abl из 9-й хромосомы действительно переместился в 22-ю хромосому (рис. 5.3, слева).
Далее открывалась захватывающая перспектива: возможно, ген c-abl непосредственно причастен к возникновению рака у человека. Чтобы подробнее выяснить, что происходит с геном c-abl в ХМЛ-клетках, исследователи выделили ту часть 22-й хромосомы, которая накладывалась на ген c-abl. Примечательно, что у 17 разных пациентов ген c-abl переместился практически в одну и ту же точку 22-й хромосомы. Итак, характерным признаком рака являлась не только транслокация из 9-й хромосомы в 22-ю, но и то, что склеивание участков происходило практически в одном и том же месте. Это подсказывало, что там, где ген c-abl попадал в 22-ю хромосому, происходило нечто очень важное. Дальнейшие исследования показали, что ген c-abl сливался с другим геном под названием bcr (это аббревиатура, означающая «кластер точек разрыва»). В результате объединенный ген кодировал аномальный белок, в котором «головная» часть белка c-abl сливалась с «хвостом» белка bcr (см. рис. 5.3 справа).
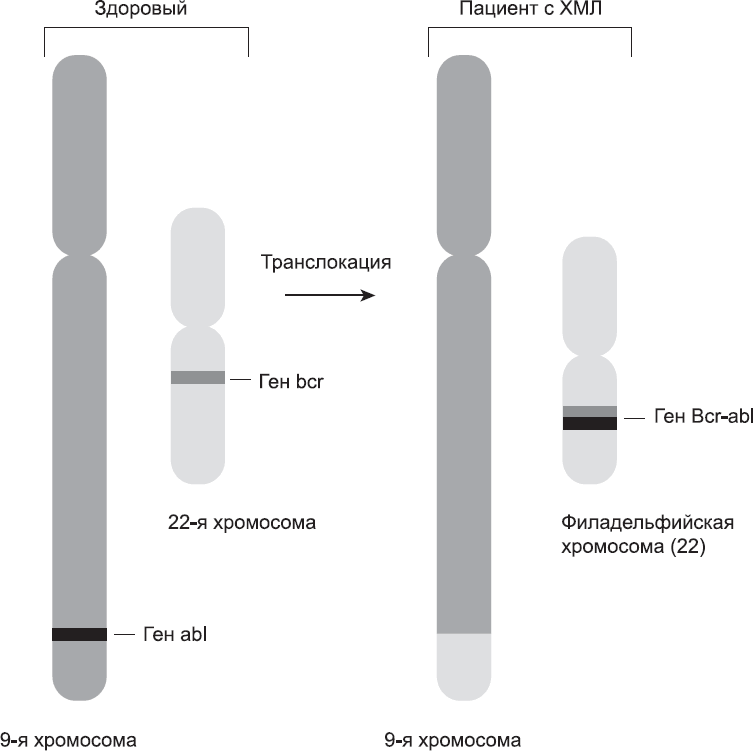
Рис. 5.3
При слиянии двух генов образуется онкоген, вызывающий рак. В клетках, пораженных хроническим миелоидным лейкозом, ген abl из 9-й хромосомы сливается с геном bcr 22-й хромосомы; гибридный ген кодирует аномально активный белок
Иллюстрация Лиэнн Олдз
Каким-то образом такое слияние превращало нормальный протоонкоген в смертельный онкоген. Этот механизм стал понятен, когда исследователи сравнили действие нормального белка c-abl и слившегося белка bcr/abl. Белок c-abl относится к классу так называемых тирозинкиназ, которые добавляют к белкам фосфатные группы. Добавление и удаление фосфатов – один из распространенных способов регуляции действия белка, то есть переключения его из неактивного в активное состояние и наоборот. Многие киназы входят в состав химических «реле», передающих информацию из внеклеточного пространства во внутренние механизмы, определяющие, что делать клетке: делиться, дифференцироваться или отмирать. В здоровых клетках тирозинкиназа c-abl обычно малоактивна. Но активность слившегося белка bcr/abl гораздо выше. В результате объединения возникает мутантный фермент, который, подобно конститутивным мутантам из опытов Моно и Жакоба, постоянно «включен».
В таком случае лейкоз – болезнь, связанная с регуляцией. При ХМЛ нормальный контроль над делением лейкоцитов нарушается из-за мутантного белка bcr/abl. Гиперактивный белок выводит из строя многочисленные клеточные «реле», которые застывают в состоянии «вкл», как будто заклинившая педаль газа в автомобиле. Оказывается, мутации в нескольких десятках других онкогенов, связанные со множеством других видов рака, по-видимому, также дают подобный общий эффект; поэтому причины рака связаны с регуляцией.
Хотя открытие онкогенов и того, как они действуют, стало прорывом в понимании механизмов рака, это была всего лишь половина генетической истории онкологии. Возможно, дочитав книгу до этого места и учитывая все, что было сказано о логике регуляции, вы уже догадываетесь, какова вторая половина этой истории. Разумеется, машина может потерять управление не только из-за заклинившего акселератора. Каков второй механизм? (Подсказка: вспомните об отрицательной регуляции и регуляторном законе двойного отрицания.)
Такой же эффект возможен, если нога соскользнет с тормоза либо если перерезать тормозной контур. Исследователи выяснили, что, действительно, отказ генетических «тормозов» – очень распространенный механизм развития рака.
Супрессоры опухолей
Первый генетический «тормоз», который удалось открыть, был связан с редким глазным раком, который называется ретинобластома. Это заболевание обычно развивается у маленьких детей, а иногда является семейным. Важнейшим ключом к генетической тайне ретинобластомы было то, что в некоторых случаях теряется участок обеих копий 13-й хромосомы; это означает, что утрата обеих копий какого-то гена – основной фактор образования ретинобластомы. Ситуация отличается от случаев с онкогенами, когда толчком к развитию рака становится изменение одной копии гена (например, bcr/abl).
На языке генетики можно сказать, что онкогенные мутации являются доминантными, так как они действуют, даже если нормальный протоонкоген не поврежден. Напротив, мутация при ретинобластоме является рецессивной – чтобы началась болезнь, должны измениться обе копии гена. По-видимому, исправная работа недостающего гена – необходимое условие для предотвращения или подавления опухоли, поэтому такой ген был назван опухолевым супрессором.
В результате подробного изучения той части ДНК, которой не хватало у больных ретинобластомой, удалось идентифицировать ген ретинобластомы (под названием Rb). Разумеется, функциональный Rb не вызывает рак, онкология – это следствие потери или изменения данного гена. Детальное исследование белка Rb показало, что в нормальном виде от него зависит важнейшая регуляция клеточного жизненного цикла. Чтобы разделиться, клетка должна скопировать свою ДНК, а потом превратиться в две клетки. Этот процесс жестко регулируется, а протекает в несколько этапов. Rb играет в начале этого цикла роль важной контрольной точки, блокируя репликацию ДНК. В таком случае при утрате обеих копий гена Rb репликация клеток может продолжаться бесконтрольно.
Rb – не единственный опухолевый супрессор, уже выявлено около 70 таких генов. Кроме того, мутации Rb связаны не только с ретинобластомой, они встречаются и при других видах рака, например при остеосаркоме и раке легких.
Более того, Rb может выключаться не только в результате мутаций. Работа белка Rb регулируется добавлением фосфатных групп, за что отвечают протеинкиназы. Rb тем активнее, чем меньше он фосфорилирован, а при высокой фосфорилированности он перестает работать. Прямое или косвенное воздействие многих онкогенных белков, в том числе bcr/abl, заключается в усилении фосфорилизации Rb, из-за этого активность Rb ингибируется, и клетки могут постоянно делиться. На самом деле Rb отключается при многих, а возможно, и при всех видах рака у человека.
Здесь мы вновь сталкиваемся с определенной отрицательной регуляцией и уже знакомым нам регуляторным законом двойного отрицания. В приницпе, Rb тормозит деление клеток. Таким образом, рост клеток возможен лишь при ингибировании этого репрессора. Но при выключении (слева) или утрате (справа) гена Rb клетки могут постоянно де литься.

Роль Rb замечательно согласуется с размышлениями Моно и Жакоба, которые десятилетиями ранее полагали, что причиной рака может быть отключение репрессора деления клеток (см. главу 3).
Теперь, зная, как мутации определенных генов нарушают законы регуляции клеточного роста, мы сталкиваемся с вызовом: как (если это возможно) затормозить деление раковых клеток.
Логическая терапия и рациональные лекарства
Десятилетиями рак пытались лечить хирургически, облучением и смесями препаратов, убивающих делящиеся клетки. Химиотерапия является неизбирательным инструментом, она не нацелена на раковые клетки как таковые, поэтому эффективность химиотерапии не гарантирована, а еще такая терапия чревата многочисленными опасными побочными эффектами. Давняя надежда, связываемая с онкологическими исследованиями, – разработать более эффективные и безопасные варианты лечения, нацеленные против конкретного вида рака, которым страдает человек. Эта надежда уже становится реальностью. Один из первых препаратов этого нового класса называется иматиниб. Он борется с той самой мутацией, которую Джанет Роули заметила, разложив снимки перед собой на обеденном столе.
Как и многие первопроходцы, иматиниб несколько раз чуть не сгинул на пути к цели. Действительно, прослеживаются поразительные параллели между историей иматиниба и разработкой первого статина. Но вновь благодаря врачам, видевшим необходимость в препарате и неустанно стимулировавшим работу над ним, эти исследования завершились головокружительным клиническим успехом, изменившим историю медицины.
При транслокации bcr/abl возникает гиперактивная протеинкиназа, вызывающая отключение репрессора Rb, что в свою очередь приводит к неконтролируемому делению клеток. Требовалось лекарство, которое бы справилось с законом двойного отрицания ХМЛ, то есть ингибировало бы bcr/abl и не позволяло ферменту-предателю творить свое черное дело.
Ник Лайдон и Алекс Маттер, двое ученых из фармацевтической компании Ciba-Geigy, расположенной в швейцарском Базеле, определили, что, поскольку многие гены кодируют измененные киназы, ингибиторы ферментов могут блокировать рост раковых клеток. В отличие от Эндо, они не стали искать такое средство в природе, не стали действовать и принятым в фармакологической индустрии методом проб и ошибок, а воспользовались методом «рационального проектирования» и стали разрабатывать такие молекулы, которые входили бы в активный центр киназы, как ключ в замок, и блокировали его, закрывая доступ для настоящего «ключа». Потратив годы на химический синтез и опыты, они получили несколько перспективных соединений, в том числе и такую молекулу, которая ингибировала нормальную киназу c-abl.
Чтобы выяснить, будут ли какие-либо из этих соединений действовать на клетки ХМЛ, Лайдон показал их знакомому врачу. Этот врач, Брайан Дракер из Орегонского университета медицинских наук в Портленде, не только очень интересовался потенциальными ингибиторами киназы bcr/abl, но и (что очень важно) имел доступ к клеткам ХМЛ-пациентов. Дракер обнаружил, что одно из соединений, полученных от Лайдона, в очень низких концентрациях убивало лишь клетки ХМЛ, а обычные клетки не затрагивало.
Дракер, Лайдон и Маттер были воодушевлены результатами, однако фармкомпания полагала, что рыночные перспективы ХМЛ-специфичного препарата сомнительны. Ученым потребовалось более года, чтобы убедить руководство продолжить испытания на животных. Затем первые токсикологические опыты на собаках вызвали подозрение, что препарат небезопасен для людей при внутривенном введении. Вскоре после этого произошло слияние Ciba-Geigy с фармацевтической компанией Sandoz, и возникла новая компания Novartis. После слияния компаний разработка препарата приостановилась, и Лайдон уволился.
В конце концов ученые Novartis опробовали на животных пероральную форму лекарства, но результаты вновь получились противоречивыми. Один токсиколог сказал Маттеру: «Если вы собираетесь колоть это человеку, то только через мой труп».
Однако Дракер не отступил. Прогноз у его пациентов был суровый – от четверти до половины всех больных умирали в течение года после постановки диагноза, а те терапевтические возможности, которыми он располагал, позволяли по крайней мере выиграть время. Дракер полагал, что любые проблемы с токсичностью решаемы, если тщательно наблюдать пациентов и контролировать дозировку. Он уговорил Маттера «не губить лекарство». Маттер продолжал убеждать руководство в необходимости препарата. Наконец Даниэль Васелла, новый исполнительный директор Novartis, санкционировал клинические испытания на людях. Исследование началось в июне 1998 г., спустя почти пять лет после того, как Дракер впервые опробовал препарат на клетках ХМЛ в лаборатории.
Дракер и два других врача стали давать малые дозы препарата небольшой группе пациентов с ХМЛ, постепенно увеличивая дозировку и отслеживая как ход болезни, так и потенциальные побочные эффекты. Основным индикатором полезности было бы снижение количества лейкоцитов: как правило, в микролитре крови должно быть 4000–10 000 лейкоцитов, а у пациентов с ХМЛ этот показатель достигал 100 000–500 000 клеток. Низкие дозы не действовали. Затем, когда доза была увеличена, у некоторых пациентов уровень лейкоцитов снизился до нормального. Анализ крови показал, что также уменьшилась доля клеток с филадельфийской хромосомой. Препарат попадал в цель.
Novartis бросила все силы на разработку препарата. Испытания были расширены, дозы увеличены, а пациентов наблюдали в течение девяти месяцев. У 97 % пациентов, получавших максимальную дозу препарата, уровень лейкоцитов нормализовался, обычно на это требовалось от одного до полутора месяцев. Три четверти пациентов избавились от раковых клеток, содержавших филадельфийскую хромосому. Эти результаты были не просто хорошими, а грандиозными, беспрецедентными в истории химиотерапии. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) рассмотрело препарат вне очереди и менее чем через три месяца, в мае 2001 г., одобрило его.
Благодаря иматинибу прогноз при лечении ХМЛ-пациентов радикально улучшился. Долгосрочная выживаемость (более восьми лет) была достигнута для 90 % пациентов – до появления препарата этот показатель составлял около 45 %. Несмотря на опасения компании, лекарство стало для Novartis золотой жилой в течение 10 лет выручка от продажи препарата составила почти 28 млрд долл. В 2012 г. Лайдон, Дракер и Роули были удостоены престижной Японской премии за свой вклад в изучение и лечение ХМЛ.
Рациональный подход к лечению ХМЛ привел к впечатляющему успеху. Но «Гливек» – всего одно лекарство, bcr/abl – всего один онкоген, а ХМЛ – конкретная разновидность рака. Что делать и как быть с остальными онкологическими заболеваниями?
Знай врага в лицо
Тело взрослого человека состоит примерно из 37 трлн клеток, которые подразделяются более чем на 200 типов. Для производства таких разнообразных клеток и для того, чтобы все они существовали в нужном количестве, требуется серьезная регуляция. Кроме того, при этом должны копироваться триллионы длинных молекул ДНК. При копировании ДНК случаются ошибки. Большинство таких мутаций безвредны, но некоторые могут обернуться катастрофой. Понимание того, почему при том или ином виде рака возникают конкретные мутации, – ключ к более точной диагностике и целевой терапии.
Технология анализа рака шагнула далеко вперед с тех пор, как Джанет Роули вырезала снимки отдельных хромосом и раскладывала их на столе. Благодаря прогрессу, позволившему ускорить и удешевить секвенирование ДНК, врач может заглянуть в любую опухоль и оценить целостность каждого гена. Изучая тысячи опухолей во всевозможных тканях, исследователи составили каталог генетических мутаций. При поиске генов, которые часто мутируют (или утрачиваются) при каждом виде рака, удалось идентифицировать большинство генов, обычно способствующих возникновению рака.
Важнейший вывод, сделанный на основании этих исследований, – лишь малая толика человеческих генов связана с раком. Человеческий геном состоит примерно из 20 000 генов, и всего 140 из них часто мутируют; причем эта группа примерно поровну состоит из онкогенов и опухолевых супрессоров. В принципе, такая цифра выглядит оптимистичной для исследователей, врачей и пациентов, поскольку сужает количество тех «врагов», с которыми нам нужно разобраться. Тем лучше, что нам многое известно о том, какую полезную функцию выполняет каждый из этих генов – практически все они относятся примерно к десяти хорошо изученным «релейным системам» или к биохимическим «путям», регулирующим дифференцирование или выживаемость клеток.
Исследования также показывают, что при большинстве видов рака мутации возникают в двух – восьми из этих 140 генов. Зная, какие гены изменяются при конкретных опухолях, мы можем заново классифицировать их по генетическому строению, соотнести мутации с течением рака и целенаправленно разрабатывать лекарства против этих мутаций. В 1997 г. не было ни одного официально утвержденного препарата, специально нацеленного на лечение раковых мутаций; в 2015 г. было уже более 30 таких лекарств, а еще несколько находились на этапе исследования. Мы укрепляем позиции, но объявлять о победе еще очень рано.
В 2010 г. у Джанет Роули диагностировали рак яичников. В ходе лечения она отправляла коллегам для изучения результаты биопсии и другие образцы своей опухоли. Но 17 декабря 2013 г. она умерла от осложнений. Роули заранее распорядилась о своей аутопсии, чтобы исследователи могли изучить, как прогрессировала ее болезнь.
В эпиграфе к этой главе я поставил цитату из Герберта Уэллса о том, что поможет нам победить рак. Но я пропустил предыдущее предложение из диалога, который присутствует в его романе «Накануне»: «Рак будет искоренен спокойными, неторопливыми, настойчивыми мужчинами и женщинами, которые, зажав в кулак все чувства и эмоции, будут работать в больницах и лабораториях».
Ученых, сделавших важнейшие шаги в борьбе с раком, не назовешь неторопливыми, кроме того, они не обуздывали и не подавляли в себе сострадание и прекрасно понимали неотложность действий…
Назад: Глава 4. Жиры, обратная связь и чудесный грибок
Дальше: 03 Закон джунглей

