Книга: Закон «джунглей». В поисках формулы жизни
Назад: Глава 3. Общие правила регуляции
Дальше: Глава 5. Заклинившие акселераторы и отказавшие тормоза
Глава 4. Жиры, обратная связь и чудесный грибок
Можно не заменять гены, а пользоваться принципами регуляции, чтобы хорошие гены работали усерднее.Доктор Джозеф Голдштейн – доктору Рою Вагелосу, генеральному исполнительному директору компании Merck & Co
Двадцать девятого июня 1935 г. американец Ансел Киз и англичанин Брайан Мэтьюз разбили лагерь близ вершины пика Ауканкильча в северном Чили, на высоте около 6100 м. Они выстроили простое укрытие от снега, вертикально укрепив несколько жердей и накрыв их одеялами, а затем заползли внутрь, чтобы уберечься от ветра и ночных температур – мороз достигал –50 °C. Они оставались в этом лагере целых 15 дней и за это время несколько раз поднимались на вершину. На тот момент пик Ауканкильча являлся одним из самых высоких покоренных пиков в Андах. А эти бесстрашные скалолазы были вовсе не профессиональными альпинистами, а учеными-физиологами: Киз – из Гарварда, а Мэтьюз – из Кембриджского университета. Оба они входили в состав Международной высотной экспедиции (IHAE) из 10 исследователей, отправившихся в Чили, чтобы изучить, как человеческий организм приспосабливается к экстремальным высотам.
На высоте более 5330 м на склоне Ауканкильча находится самое высокогорное постоянное поселение в мире, а на высоте почти 5800 м прорыта самая высотная шахта. Эта «высотнейшая» экспедиция была самым долгим, оснащенным по последнему слову техники и максимально сложным в реализации научным проектом, призванным изучить, как люди могут жить и работать в столь суровых условиях.
Если одним из признаков настоящего ученого является отвага, заставляющая идти туда, куда влечет любопытство, – Кеннон, Элтон и Моно принадлежали к людям именно такого сорта, – то Киз был образцовым представителем этой когорты. Он бросил школу в 15 лет, решив разгребать помет летучих мышей в аризонской пещере, затем трудился на золотом прииске в штате Колорадо рабочим-взрывником – подносил порох рудокопам. Вернувшись в школу и закончив ее, Киз стал изучать химию в колледже, разочаровался и нанялся смазчиком на океанский пароход, ходивший в Китай. Выжив на пайке, состоявшем «в основном из алкоголя», Киз вернулся в колледж, получил степень по экономике, а затем всего за полгода – еще и степень по биологии. Затем он поступил в Институт Скриппса в городе Ла-Хойя, штат Калифорния, где получил степень PhD по океанографии и биологии, потом учился в Кембриджском университете, где получил еще и степень PhD по физиологии. Наконец, он стал работать в Гарвардской лаборатории исследования усталости и занялся организацией экспедиции IHAE в Чили.

Рис. 4.1
Ансел Киз в Андах. У Киза (лежит на спине) берут кровь на высоте 6138 м, чтобы проверить, как организм реагирует на большие высоты
Из работы Keys, A. (1936) «The Physiology of Life at High Altitudes». Scientific Monthly 43(4): 309
Второй по распространенности элемент одиссеи любого ученого – это инстинктивная прозорливость (серендипность). Вспомните злых котов Кеннона, книгу о леммингах, которую Элтон купил в Тромсё, странную кривую роста, обнаруженную Моно. Для Киза подобную роль сыграл вызов из армии. В течение шести дней, проведенных у самой вершины Ауканкильча, Киз и Мэтьюз были вынуждены питаться только сублимированной пищей, запивая ее водой. Разумеется, такой ценный опыт был интересен армейским снабженцам. Когда в Европе началась война, военные сочли, что целесообразно разработать какой-либо легкий непортящийся паек, которым могли бы питаться десантники, дожидаясь подхода основных сил. Поэтому Киза вызвали на консультацию в квартирмейстерскую службу Министерства обороны.
К тому времени Киз перебрался в Университет Миннесоты. К нему в Миннеаполис прибыл полковник, и они вместе пошли за покупками в лучший гастроном городов-близнецов. Потом они распределили еду по бумажным пакетам и отнесли их на местную военную базу для испытаний. После дальнейших исследований, проводившихся на военной базе Форт-Беннинг, штат Джорджия, были определены ингредиенты пайка энергетической ценностью около 3000 калорий. Туда входили: кусок сухой колбасы или банка консервов, сухари, плитка шоколада, полоска жевательной резинки, спички и пара сигарет. Все это упаковывалось в непромокаемый пакет, помещавшийся в кармане. Этот паек стали производить под названием «К-рацион» (где «К» предположительно означало «Киз»), к 1944 г. было выпущено более 100 млн таких пайков.
После войны Киз сконцентрировался на других проблемах. Его заинтересовала статистика из охваченной голодом Европы: там значительно снизилась смертность от сердечных заболеваний, тогда как многие знаменитые американцы умирали от сердечного приступа. Почему у некоторых мужчин случается приступ, а у других нет? Киз набрал мужчин-добровольцев из Миннеаполиса в возрасте от 44 до 55 лет и окрестностей в количестве 281 человек и начал лонгитюдное исследование. Его интересовало, как риск сердечного приступа соотносится с 60 различными факторами, в частности с диетой.
Пока шло миннесотское исследование, Киз ездил по всему миру с лекциями о сердечных приступах. Когда коллега из Неаполя заявил, что в это городе сердечные приступы не представляют особой проблемы, Киз отнесся к этому скептически и решил изучить вопрос. Исследовав группу неапольских пожарных, он обнаружил, что у них в крови гораздо меньше холестерина, чем у американских бизнесменов. Мало холестерина было и у испанских бедняков. Киз счел, что корреляция очевидна: богачи питались более жирной пищей, поэтому у них повышалась вероятность сердечного приступа.
Но коллеги-врачи скептически восприняли идею о связи между диетой, уровнем холестерина в сыворотке крови и сердечными приступами. Поэтому Киз и его соратники организовали беспрецедентное по масштабу международное исследование риска сердечных заболеваний, в котором участвовали более 12 000 мужчин из различных стран мира: Югославии, Италии, Греции, Финляндии, Нидерландов, Японии и США. Рацион в этих странах очень различается. «Исследование семи стран» началось в 1958 г., мужчины должны были проходить обследование каждые пять лет.
В 1963 г. были получены результаты обоих исследований. Наблюдая предпринимателей из Миннесоты в течение 15 лет, Киз выявил основной фактор риска, связанный с сердечными приступами: уровень холестерина в сыворотке крови. У мужчин, имевших более 260 мг холестерина на 100 мл крови, риск сердечного приступа был впятеро выше, чем у мужчин с уровнем холестерина менее 200. «Исследование семи стран», когда были подведены итоги первых пяти лет, показало такой же результат. Например, у жителей восточной Финляндии уровень холестерина составлял в среднем 270 мг, и они умирали от сердечного приступа в среднем впятеро чаще хорватов, уровень холестерина в крови которых не превышал 200 мг.
Теперь Киз располагал серьезными доказательствами, что люди заболевают из-за особенностей своего рациона питания. К тому времени уже на протяжении полувека было известно, что в атеросклеротических бляшках со стенок аорты содержалось как минимум в 20 раз больше холестерина, чем в нормальных тканях аорты. Если животные получали много холестерина с пищей, у них развивались гиперхолестеринемия и атеросклероз. Но именно вышеупомянутые крупномасштабные эпидемиологические исследования помогли обосновать связь между высоким уровнем холестерина и сердечным приступом у человека, привлечь внимание к этому риску.
Однако эти корреляции не объясняли, как лечить сердечников, чтобы восстановить их здоровье. Холестерин – это не угроза, от которой нужно просто избавиться, молекула холестерина жизненно важна. Это важнейший компонент мембран всех животных клеток, он помогает создавать барьеры между отдельными клетками и средой, в которой они находятся. Холестерин модулирует текучесть мембраны и подвижность других молекул внутри нее. Более того, холестерин – представитель важного класса молекул, стеринов, являющихся предшественниками гормонов-стероидов, в том числе кортизола, половых гормонов тестостерона и эстрогена. Также холестерин входит в состав желчи, критически важной для пищеварения. Итак, важная проблема заключалась в следующем: как поддерживать безопасный для здоровья уровень стеринов, то есть гомеостаз холестерина. В начале 1960-х сердечные заболевания являлись основной причиной смерти среди взрослых американцев. Чтобы переломить ситуацию (если это вообще было возможно), требовалось знать законы регуляции холестерина.
Важнейшие сведения о регуляции холестерина удалось получить благодаря двум молодым врачам, которые, вдохновившись идеями Моно и Жакоба, решили действовать точно так же. Во-первых, они стали работать над проблемой сообща. Во-вторых, решили изучать таких людей, у кого была нарушена регуляция синтеза ферментов – как и у конститутивных бактерий-мутантов, с которыми работали Моно и Жакоб. Затем, анализируя эти человеческие мутации, они методично выстроили логику регуляции холестерина. Ровно через два года после Моно и Жакоба эти двое также отправились в Стокгольм – получить свои Нобелевские премии.
Открытие обратной связи
Джо Голдштейн и Майк Браун познакомились в 1966 г., еще будучи интернами в Общеклинической больнице штата Массачусетс в Бостоне, где посменно дежурили в палате интенсивной терапии. Хотя Голдштейн вырос в небольшом городке в штате Южная Каролина, а Браун – в Нью-Йорке и Филадельфии, они сразу нашли общий язык. После длительных дежурств они, в отличие от других молодых врачей, подолгу обсуждали, какие патологии могут быть связаны с теми случаями, что им приходится наблюдать.
Отработав практику в Бостоне, оба перебрались в Национальные институты здравоохранения (NIH) в город Бетесда, штат Мэриленд, где стали клиническими наблюдателями, которые должны были не только заниматься исследованиями, но и вести пациентов. Голдштейн получил назначение в Национальный институт сердца. В самом начале работы ему попались двое особых пациентов – шестилетняя девочка и ее восьмилетний брат, оба ребенка страдали от сердечных приступов. Для Голдштейна это был настоящий момент истины.
Брат и сестра попали в больницу NIH, так как страдали заболеванием под названием «семейная гиперхолестеринемия». Эта наследственная болезнь встречается в двух формах. Первая, гетерозиготная, встречается примерно у одного из 500 человек. У таких людей есть одна копия мутантного гена, из-за которого уровень холестерина держится в диапазоне 300–400, сердечные приступы у них начинаются уже в возрасте около 35 лет. Совсем редко встречается гомозиготная форма, примерно один случай на 1 млн человек. Эти больные имеют две копии мутантного гена, у них совершенно астрономический уровень холестерина (около 800), и сердечные приступы у них начинаются уже в пятилетнем возрасте.
У брата с сестрой из Техаса была именно тяжелейшая гомозиготная форма. Голдштейн рассказал Брауну о детях, и они оба стали размышлять, какой дефект мог спровоцировать такой зашкаливающий уровень холестерина. Несмотря на то что оба были загружены работой в NIH, молодые врачи находили время на вечерние курсы по различным дисциплинам. На одном из этих курсов подробно обсуждались идеи Моно и Жакоба о регуляции. В университете Голдштейн и Браун выучили, что синтез холестерина подчинялся обратной регуляции: когда собак кормили пищей с высоким содержанием холестерина, синтез холестерина в организме угнетался. Может быть, предположили двое врачей, у пациентов с семейной гиперхолестеринемией нарушена обратная регуляция холестерина?
Тогда как большинство их талантливых сокурсников планировали сделать исследовательскую карьеру в онкологии, нейрофизиологии и других престижных дисциплинах, Голдштейн и Браун решили работать вместе и всерьез заняться изучением регуляции холестерина. «Это просто жирные капельки», – подначивали их приятели. Но Голдштейн и Браун игнорировали такие насмешки и, перебравшись в Юго-Западный медицинский центр при Университете Техаса, официально объединили свои лаборатории. Всего через два года, работая без выходных, они смогли приоткрыть тайну холестеринемии и понять логику регуляции холестерина, поставив ряд изящных экспериментов.
К тому моменту, как они начали свою работу, уже был расшифрован биохимический «путь», приводивший к образованию молекулы холестерина, содержавшей 27 атомов углерода, из молекул предшественника, в которых было всего по два атома углерода. Это достижение стало результатом серии открытий, за которые было присуждено в общей сложности 11 Нобелевских премий. Биохимический «путь» включал в себя около 30 ферментов, но было известно, что активность синтеза холестерина определяется на первом этапе «пути», где образуется вещество с длинным названием: 3-гидрокси-3-метилглютарил-кофермент А редуктаза. Я буду называть его просто редуктазой, так как это единственный фермент, о котором пойдет речь в этой главе, и в данном случае несущественно, как именно он работает. В данном случае, как и в предыдущем, важна сама логика регуляции.
Брауну и Голдштейну требовалось изучить активность редуктазы у человека, но, поскольку этот фермент действует в печени, поставить такие опыты на людях было бы сложно. Тогда они разработали способ наблюдения за ферментом в клеточных культурах, взятых у человека и выращиваемых в пробирке. Чтобы клетки росли в культуре, им требуются питательные вещества, обычно предоставляемые в виде сыворотки. Один из первых феноменов, открытых Брауном и Голдштейном, заключался в следующем: активность редуктазы подвергалась отрицательной регуляции со стороны какого-либо компонента сыворотки; в присутствии сыворотки активность снижалась, а при отсутствии сыворотки – десятикратно возрастала.
Тогда они захотели выяснить, какой компонент сыворотки подавляет активность редуктазы. Они полагали, что все дело в каком-нибудь липидосодержащем веществе, поэтому проверили активность ЛПНП (липопротеина низкой плотности), ЛВП (липопротеина высокой плотности) и фракций, не содержащих липидов. Оказалось, что именно ЛПНП, но не ЛВП и не другие фракции был мощным ингибитором активности фермента.
Исходя из логики и открытий Моно и Жакоба, Голдштейн и Браун предположили, что у пациентов с гиперхолестеринемией, страдавших избытком холестерина, могли возникать мутации в гене редуктазы, из-за которых этот фермент не поддавался регуляции со стороны ЛПНП. Первая серия экспериментов, казалось бы, подкрепляла эту версию. Когда клетки пациентов с семейной гиперхолестеринемией выращивались в культурах, Голдштейн и Браун отмечали, что активность редуктазы в этих клетках в 40–60 раз выше, чем в клетках здоровых людей, и что ЛПНП не влияет на активность фермента в них.
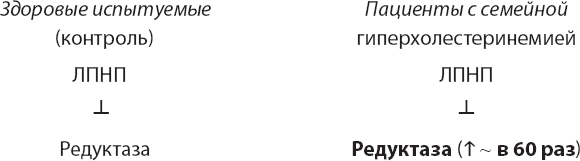
Но следующий эксперимент позволил отмести идею о том, что у пациентов с семейной гиперхолестеринемией изменяется редуктаза как таковая, зато подсказал иную возможность. ЛПНП – это структура, в состав которой входят и белки, и липиды, в том числе холестерин. Браун и Голдштейн предположили, что холестерин является действующим веществом, подавляющим активность фермента. Поэтому они стали «кормить» клетки холестерином, не содержавшим липопротеинов, и в результате обнаружили, что холестерин – действительно мощный ингибитор активности фермента в клетках здорового человека, но с удивлением заметили, что холестерин также снижает активность редуктазы в клетках пациентов, страдающих семейной гиперхолестеринемией. Таким образом, редуктаза у таких пациентов была не менее чувствительна к обратному контролю холестерина, чем у здоровых людей, за исключением случаев, когда холестерин присутствовал только в составе ЛПНП.
Поскольку дефект у пациентов с семейной гиперхолестеринемией был связан не с ферментом-редуктазой, причина должна была заключаться в чем-то ином, в каком-то факторе, о котором Голдштейн и Браун пока не знали. Поскольку холестеринсодержащий ЛПНП циркулирует вне клеток, возможно ли, что у пациентов с семейной гиперхолестеринемией была нарушена передача холестерина из внеклеточного ЛПНП в сами клетки?
Браун и Голдштейн предположили, что вне клеток может существовать специфический рецептор ЛПНП. Чтобы проверить эту идею, они поставили схожий эксперимент. Они снабдили частицы ЛПНП радиоактивными «метками», чтобы измерить, насколько активно они связываются с клетками. Выяснилось, что меченые частицы ЛПНП связывались именно со здоровыми клетками, но не с клетками, пораженными семейной гиперхолестеринемией. Этот эксперимент выявил специфичный рецептор ЛПНП в здоровых клетках, который, однако, отсутствовал в клетках пациентов с семейной гиперхолестеринемией. Действительно, в регуляции уровня холестерина участвовал еще какой-то фактор.
Браун и Голдштейн выяснили, как действует рецептор, доставляющий холестерин извне клеток в сами клетки. Белковая часть ЛПНП несет холестерин и пристыковывается к рецептору, затем молекулы холестерина внутри клеток отделяются от белка и, уже будучи в клетках, могут регулировать активность редуктазы. Открытие рецептора ЛПНП объясняло, почему циркулирующий ЛПНП не может регулировать синтез холестерина у больных семейной гиперхолестеринемией, а у здоровых людей – может.

Браун и Голдштейн также установили, что количество рецепторов ЛПНП на клетках подчиняется обратной регуляции так же, как и редуктаза: когда уровень холестерина в клетках низок, увеличивается количество рецепторов ЛПНП и активность редуктазы; когда уровень холестерина высок, количество рецепторов и активность редуктазы снижаются. Это абсолютно логично, поскольку клетки могут поддерживать стабильный уровень холестерина: когда уровень холестерина низок, клетки извлекают холестерин из кровотока, а также синтезируют его; когда холестерина достаточно, угнетаются как редуктаза, так и рецепторы ЛПНП.
Более 93 % всего холестерина в организме содержится в клетках, он для них жизненно важен. Но 7 % циркулирует в крови; примерно две трети от этой доли – в форме ЛПНП, треть – в форме ЛВП. Эпидемиологические исследования и опыты на животных показали, что именно циркулирующий в крови ЛПНП-холестерин («плохой холестерин») – основная причина образования бляшек и возникновения сердечных заболеваний. Можно ли было использовать в медицине открытия Голдштейна и Брауна о законах регуляции холестерина? Эти двое даже не подозревали, что семена медицинской революции уже посажены очень далеко от Техаса.
«Пенициллин» для холестерина?
Акира Эндо рос в большой семье на ферме в японской префектуре Акита. Дедушка поддерживал его интерес к медицине и естествознанию, рассказывая маленькому Акире о природе. В 10-летнем возрасте Эндо увлекался грибами и плесенью. Он узнал, что существуют грибы, смертельно опасные для мух, но не для людей. В колледже он познакомился с новаторскими работами Александра Флеминга, открывшего антибиотик пенициллин – вещество, образующееся в голубовато-зеленой плесени Penicillium.
Закончив колледж, Эндо устроился на работу в фармацевтическую компанию «Санкё» в Токио, где первое время занимался пищевыми добавками. Получив задание найти такой фермент, который позволил бы уменьшить содержание мезги в вине или сидре, Эндо исследовал более 200 штаммов плесени. Он нашел грибок-паразит, который рос на виноградинах и синтезировал нужные ферменты. После того как этот продукт стал хорошо продаваться, Эндо заинтересовался другим веществом – холестерином.
Когда эпидемиологические исследования, связывающие сердечные заболевания с высоким уровнем холестерина, получили широкую известность, Эндо, как и научные сотрудники многих фармацевтических компаний, подумал: ингибиторы синтеза холестерина могут оказаться очень важными лекарствами. Действительно, в 1960-е было разработано много препаратов, нацеленных на борьбу с повышенным холестерином, но эти лекарства в большинстве своем действовали неважно и давали тяжелые побочные эффекты. Никто не пытался использовать редуктазу.
Но у Эндо созрела оригинальная идея и был особый подход. Он хорошо знал, что плесневые грибки синтезируют всевозможные соединения, в том числе пенициллин, подавляющие рост конкурирующих с ними микробов. Он также знал, что основным стерином в клеточных мембранах некоторых грибков был не холестерин, а эргостерин. Итак, рассуждал он, возможно, некоторые грибки естественным образом выработали такое соединение, которое может ингибировать синтез холестерина в других организмах. Удастся ли найти такой «пенициллин» против холестерина?
Эндо придумал простую стратегию поиска. Он знал, что редуктаза – первый компонент в биохимическом «пути» холестерина, поэтому разработал простой анализ для выявления любого вещества, которое бы ингибировало активность фермента. Затем можно было взять выращенные в лаборатории образцы плесени и проверить, синтезирует ли какой-либо грибок ингибитор редуктазы. В апреле 1971 г. он и трое ассистентов приступили к поискам.
День за днем Эндо с коллегами выращивали и проверяли множество видов грибка – всего около 6000. Спустя два года поисков они выявили два многообещающих вида. Затем попробовали выделить активные ингредиенты соответствующих культур. Первый, полученный от грибка Pythium ultimum, оказался открытым ранее антибиотиком, который назывался «цитринин». Он ингибировал редуктазу, но, как уже установили, был очень токсичен для животных. Второе вещество, выделенное летом 1973 г., было получено от грибка Penicillium citrinum, голубовато-зеленой плесени, выросшей на рисе, приобретенном у уличного торговца в Киото. Этот грибок оказался родственным тому, из которого был получен пенициллин.
Чтобы собрать достаточное количество активного вещества для лабораторных исследований, ученые вырастили гигантскую 600-литровую емкость грибка, из которой удалось получить в общей сложности 23 мг нужного соединения – меньше обычной таблетки аспирина. Работая с этим драгоценным веществом, ученые смогли показать, что молекула, обозначенная ими ML-236B (позже названная «компактин»), является мощным ингибитором редуктазы, эффективным в малых концентрациях. Участок молекулы компактина сильно напоминал обычный субстрат редуктазы – вот почему компактин ингибировал этот фермент. Он встраивался в активный центр («замок») редуктазы – на то место, куда обычно вставал субстрат («ключ»). Таким образом, работа фермента блокировалась.
Компактин казался многообещающим препаратом. А если я добавлю, что открытое Эндо вещество оказалось первым статином – представителем класса лекарств, сегодня принимаемых 25 млн человек во всем мире, и общие продажи этого препарата в 2012 г. составили 29 млрд долл., то вы решите, что Эндо стал богатым и знаменитым, может быть, даже получил Нобелевскую премию.
Нет, ничего подобного не произошло.
Путь от открытия компактина до создания кардиологического лекарства оказался извилистым и тернистым. Это история об убеждениях и упорстве нескольких людей, в том числе Эндо, Брауна и Голдштейна, а также некоторых фармацевтических менеджеров – но никак не функционеров «Санкё».
От грибка к лекарству
Эндо совместно с корпорацией «Санкё»(Sankyo) опубликовал статью об открытии компактина и запатентовали новое соединение. Следующий важный этап заключался в проверке действия компактина на животных. Радовал тот факт, что соединение не вызывало никаких заметных патологий у крыс. Но кое-что и настораживало: у крыс, принимавших препарат в течение семи дней, уровень холестерина не изменялся, эффект отсутствовал и при приеме более высоких доз препарата в течение пяти недель. Компактин не работал и на мышах. Учитывая такие отрицательные результаты опытов на животных, казалось, что фармацевтических перспектив у компактина нет, а годы упорного труда Эндо пошли прахом.
Однако Эндо не сдавался. Однажды весенним вечером 1976-го он зашел в бар неподалеку от работы и встретил там коллегу, который использовал в своих исследованиях кур-несушек. Эндо успел поставить дополнительные эксперименты, оставлявшие надежду, что отрицательные результаты на крысах и мышах были связаны с тонкостями регуляции холестерина именно у этих видов и что препарат может оказаться эффективен на других животных.
Всего через месяц приема уровень холестерина у птиц снизился на 50 %! Успешные опыты с несушками сподвигли Эндо провести опыты на мартышках и собаках, у которых компактин позволил снизить уровень холестерина на 30–44 %. Учитывая близкое биологическое родство между обезьяной и человеком, эти результаты свидетельствовали о высоком потенциале препарата. Компания «Санкё» сформировала группу «Проект по развитию компактина», в которую входил Эндо, а также фармакологи, патофизиологи, химики и токсикологи, которым было поручено продолжить работу над этим лекарством.
Но как только для компактина забрезжили радужные перспективы, токсикологи заметили аномалию в клетках печени у крыс, получавших очень высокие дозы препарата. Минуло много месяцев, прежде чем было решено продолжить клинические разработки. Однако, когда уже полным ходом шли испытания на людях, токсикологи «Санкё» обнаружили другую проблему: у собак, принимавших компактин на протяжении двух лет, развивалась патология, напоминавшая рак кишечника. «Санкё» прекратила разработку компактина в августе 1980 г.
К тому времени работа Эндо в «Санкё» уже получила известность. Рой Вагелос, выдающийся специалист по липидам, возглавлял исследовательский отдел американской фармацевтической компании «Мерк». Он перешел в «Мерк» с академической должности, надеясь изменить весь процесс открытия новых лекарств. Десятилетиями компании отыскивали потенциальные препараты, исследуя множество соединений на предмет их воздействия на клетки или микробов, а не на конкретную молекулярную мишень. Вагелос стремился использовать биохимию и разработать более целенаправленные подходы. Кроме того, он провел плодотворный год в Париже, работая с Жаком Моно, поэтому научился мыслить в контексте регуляционной логики. Сопоставив работы Брауна и Голдштейна о законах регуляции холестерина и открытый Эндо грибок, естественным образом ингибировавший редуктазу, Вагелос распознал в этом потенциал для создания нового антихолестеринового лекарства.
Вагелос убедил исследователей из «Мерк» искать компактиноподобные вещества в других грибках и уже в 1979 г. открыл похожее соединение в грибке Aspergillus terreus. Это вещество, позже названное ловастатином, отличалось от компактина только наличием в молекуле дополнительной метильной группы (один атом углерода, три атома водорода). «Мерк» оперативно запустила клиническое испытание ловастатина на людях, но, как только Вагелос узнал о намерении «Санкё» прекратить испытания компактина, а также о подозрениях на развитие опухолей у собак, исследование «Мерк» также было немедленно остановлено. Компактин и ловастатин так и остались бы тупиковыми разработками, если бы не неожиданный результат, полученный в Техасе.
Браун и Голдштейн также узнали об открытии Эндо. Впечатлившись силой ингибитора фермента, они попросили образец соединения. Кроме того, они пригласили Эндо взглянуть на их лабораторию в Техасе и помогли ему с изучением эффектов компактина. Ученые с немалым удивлением обнаружили, что компактин не просто ингибирует активность редуктазы – оказалось, что под действием лекарства сами клетки начинают синтезировать гораздо больше данного фермента. Так удалось выявить важную логику двойного отрицания в законах регуляции холестерина – когда угнетается синтез холестерина внутри организма, угнетается и обратная репрессия синтеза фермента.
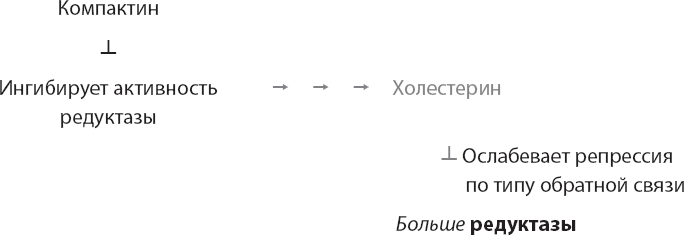
Теперь же, с учетом этих конкретных законов, Браун и Голдштейн обнаружили удивительную возможность Поскольку ранее они установили, что регуляция редуктазы и рецепторов ЛПНП в клетках происходит в унисон, то рассудили, что соединения, ингибирующие фермент редуктазу, также должны повышать уровень рецепторов ЛПНП. А в таком случае, если количество рецепторов ЛПНП в клетках повысится, эти рецепторы выведут из кровотока еще больше ЛПНП, снизив тем самым уровень ЛПНП-холестерина в крови, что критически важно при лечении сердечных заболеваний.

Чтобы проверить такую возможность, Браун и Голдштейн приобрели в «Мерк» небольшое количество ловастатина и стали давать его собакам. Действительно, у собак увеличилось и количество рецепторов ЛПНП, и клиренс ЛПНП в кровотоке. Результаты убедили Брауна и Голдштейна, что препарат может чистить человеческие сосуды и снижать уровень ЛПНП, но и «Мерк», и «Санкё» остановили исследования из-за данных об образовании опухолей у собак.
Голдштейн отправился в Японию и навестил Эндо, который к тому времени уже покинул «Санкё» и работал в токийском университете Ноко. Эндо сообщил Голдштейну, что, на его взгляд, никаких опухолей у собак не было – патофизиологи просто неверно интерпретировали увиденное. Он считал, что в кишечнике у собак просто скапливались большие количества неусвоенного лекарства. Эндо полагал, что аномалии – просто побочный эффект, так как собакам давали очень большие дозы препарата по сравнению с теми, что предполагалось назначать людям. Голдштейн также замечал странные структуры в клетках, испытавших воздействие очень высоких доз компактина. Возможно, опасения о токсичности компактина оказались преувеличены?
Голдштейн и Браун стремились выяснить, могут ли ингибиторы редуктазы в самом деле давать терапевтический эффект при лечении людей – особенно тех, кто подвержен максимальному риску, например пациентов с семейной гиперхолестеринемией. Поэтому они подключили к работе двух врачей, Дэвида Билхаймера и Скотта Гранди, и решили проверить, может ли ловастатин снизить уровень ЛПНП. Для этого было решено провести небольшое клиническое исследование на шестерых пациентах с семейной гиперхолестеринемией, имевших высокие уровни холестерина и ЛПНП. Как рассчитывали и надеялись ученые, благодаря лечению ловастатином увеличилось количество рецепторов ЛПНП, а уровень ЛПНП-холестерина снизился примерно на 27 %.
Воодушевившись этими результатами, Браун и Голдштейн написали Вагелосу в «Мерк». Они объяснили, как лечение «отменяет генетический дефект», связанный с недостатком рецепторов ЛПНП у пациентов с семейной гиперхолестеринемией, и предложили совершенно новаторский подход к лечению генетических заболеваний. «Можно не заменять гены, а пользоваться принципами регуляции, чтобы хорошие гены работали усерднее», – утверждали они. На тот момент прошло 10 лет после открытия компактина и три года с тех пор, как «Мерк» и «Санкё» отказались от разработки ингибиторов редуктазы. Голдштейн и Браун убеждали Вагелоса и «Мерк» возобновить эти работы «в кратчайшие сроки».
Через несколько месяцев в «Мерк» перезапустили большое клиническое исследование ловастатина, но только на пациентах из группы высокого риска, имевших запредельные уровни холестерина и страдавших сердечными заболеваниями. Функционеры по-прежнему опасались, что ловастатин обладает канцерогенными или иными токсическими свойствами. Новый директор по базовым исследованиям в компании «Мерк» доктор Эдвард Школьник полагал, что ловастатин может оказаться очень важным лекарством, если эти опасения удастся устранить, поэтому собрал группу, которой поручил провести комплексное исследование токсичности препарата. Браун и Голдштейн очень обрадовались, что Школьник подключился к проекту и стал отстаивать препарат, – все трое познакомились, еще когда работали в Общеклинической больнице штата Массачусетс. Позже Голдштейн и Школьник трудились в одной лаборатории в NIH, где крепко подружились. Вместе с бывшими коллегами Школьник отправился в Техас, чтобы максимально подробно разобраться в регуляции холестерина.
Голдштейн и Браун предложили продуманный эксперимент, который позволил бы определить, возникают ли поражения слизистой у животных непосредственно из-за действия препарата, либо их причина – в передозировке, что легко предотвратить. К восхищению Школьника, их гипотеза сработала как заклинание; никаких язв не возникло, канцерогенные процессы также отсутствовали. Школьник больше не сомневался, что ловастатин можно смело назначать людям.
Спустя два года исследований удалось выяснить, что ловастатин снижает уровень холестерина в плазме и в ЛПНП на 20–40 %. «Мерк» подала заявку на регистрацию препарата, и в августе 1987 г. она была одобрена FDA (Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов).
Но даже с учетом хороших клинических результатов и одобрения FDA врачи по-прежнему серьезно сомневались в общей полезности препарата. В конце концов, цель лечения заключалась не в снижении уровня холестерина, а в снижении смертности. Чтобы проверить полезность статинов в долгосрочной перспективе, «Мерк» впоследствии организовала пятилетнее исследование с участием 4444 пациентов, применив статин следующего поколения (симвастатин, также называемый «Зокор»). Результаты превзошли все ожидания: исследование показало ошеломительное снижение смертности от коронарных заболеваний на 42 %.
Учитывая столь явную полезность препарата, статиновая революция стала раскручиваться по полной. Во многом благодаря применению этих лекарств смертность от сердечных заболеваний в США с тех пор, как Ансел Киз забил тревогу о холестерине, снизилась почти на 60 %.
Эта революция не могла бы состояться без открытий Брауна и Голдштейна, распознавших основные законы регуляции холестерина, без оригинальной идеи Эндо – искать естественные ингибиторы редуктазы в плесени, а также без упорства руководителей «Мерк» и горстки врачей.
В 1985 г. Браун и Голдштейн за свои достижения разделили Нобелевскую премию по физиологии и медицине (рис. 4.2). Вагелос в 1985 г. стал главным исполнительным директором «Мерк», и следующие 10 лет в истории компании были отмечены удивительными инновациями и коммерческим успехом.
А что Эндо? Оказалось, что Эндо не получил ни копейки за свое изобретение, долгое время его вклад в разработку статинов оставался непризнан. Эта ошибка была частично исправлена в 2003 г., когда в Киото состоялся симпозиум в честь Эндо, приуроченный к 30-летию открытия компактина. В своем посвящении Браун и Голдштейн отметили: «Без Эндо статины, возможно, так и не были бы открыты… Миллионы людей, чья жизнь продолжается благодаря статиновой терапии, обязаны этим Акире Эндо и тому, что он исследовал вытяжку из примитивных грибов».
Рис. 4.2
Джозеф Голдштейн и Майкл Браун. Фотография сделана в тот день, когда было объявлено, что они совместно получат Нобелевскую премию по физиологии и медицине за 1985 год
Фотография публикуется с разрешения Джозефа Голдштейна
Назад: Глава 3. Общие правила регуляции
Дальше: Глава 5. Заклинившие акселераторы и отказавшие тормоза

