Место происхождения жизни, «первичный бульон», пицца и майонез
Сколько воды надо для появления жизни?
«Первичный бульон» как среда для появления жизни имеет свои недостатки. В водной среде белки, РНК и ДНК неустойчивы. Эти длинные молекулы со временем распадаются на отдельные звенья — аминокислоты или нуклеотиды. Химическое соединение аминокислот в белок или нуклеотидов в РНК происходит с выделением воды. Поэтому когда ее вокруг много, равновесие этой реакции смещено в сторону распада белка или РНК (такой распад с участием воды называется «гидролиз»). Первым обратил внимание на эту проблему в контексте происхождения жизни Джон Бернал еще в 1949 году.
Клетки строят длинные молекулы, используя активированные нуклеотиды и аминокислоты. При построении РНК и ДНК в ход идут нуклеотид-трифосфаты, их соединение в цепочку сопровождается выделением пирофосфорной кислоты, а не воды. Похожая хитрость позволяет клеткам собирать белки. Однако в аппарате Миллера получаются обычные, а не активированные аминокислоты. Без сложных клеточных систем активации получить из них белки в водной среде нельзя. Поэтому на безжизненной планете для соединения аминокислот и нуклеотидов в цепочки надо как-то избавляться от воды. Для этого хорошо подходят, например, заливы и лагуны по берегам океана, которые наполняются водой во время прилива и пересыхают в отлив. Похожие условия частого высыхания возможны в вулканических районах благодаря регулярным выбросам горячей воды из гейзеров.
Эксперименты показали, что запекание сухих смесей нуклеотидов при температуре 120 оС приводит к образованию коротких цепочек РНК из 3–10 нуклеотидов. Для соединения аминокислот в белки эти условия слишком жесткие, они приводят к разложению самих аминокислот. Однако, как выяснилось, полного высыхания и не требуется: достаточно, чтобы в растворе не было «химически свободной» воды. В крепком рассоле (100 и более граммов NaCl на литр, как в Мертвом море) все молекулы воды прочно связаны с ионами натрия и хлора и не являются химически свободными. Поэтому в рассоле при температурах 60–80 оС равновесие смещено в сторону образования связей, и аминокислоты соединяются в короткие цепочки (эта реакция называется «солевой пептидный синтез» и будет подробнее описана в следующих главах). Так что, хотя вода и необходима для жизни, ее не должно быть слишком много.
Другая проблема теории «первичного бульона» связана с тем, что в нем нет границ. В клетках тысячи генов «играют в одной команде» благодаря клеточной мембране, отделяющей их от внешней среды. Чтобы возникла простейшая кооперация между разными РНК, одни из которых занимаются копированием, а другие, например, готовят для этого детали-нуклеотиды, эти РНК должны как-то отделить свою тесную компанию от остального мира. Тогда нуклеотиды пойдут на копирование только тех РНК, которые их делали, а копирующая РНК будет копировать только себя и своих соседей, которые поставляют ей нуклеотиды. В безграничном бульоне же эти нуклеотиды будут расплываться и достанутся всем соседям, независимо от их вклада в общее дело. Копирующая РНК, которая попытается копировать не только себя, но и другие молекулы, в условиях бульона не сможет отличить союзников от прихлебателей и в итоге проиграет в конкуренции.
Ученые предложили два разных решения проблемы границ, которые по аналогии с «первичным бульоном» были названы «первичная пицца» и «первичный майонез». В модели «первичной пиццы», изложенной в книге «The Major Transitions in Evolution» (John Maynard Smith, Eörs Szathmáry, 1995), предполагается, что жизнь зарождалась в виде тонкого слоя органических молекул на поверхности глины (например, каолинита или смектита), частицы которой состоят из тонких алюмосиликатных слоев. Глина может набухать, потому что молекулы воды, как и другие катионы и анионы, внедряются между этими слоями, увеличивая расстояния между ними.
Эксперименты показали, что глина довольно прочно связывает аминокислоты, нуклеотиды, белки, РНК и другие биологические молекулы. На поверхности кристаллов глины и между ее слоями они накапливаются в высокой концентрации даже из очень разбавленного раствора. Адсорбирующие свойства глины используются и в быту: вы наверняка видели смектит под названием «минеральный наполнитель для кошачьих туалетов». На глине нуклеотиды самопроизвольно выстраиваются именно так, как нужно для их «сшивания» в цепочку РНК. Длинные молекулы РНК очень редко отделяются от глины полностью, но могут медленно перемещаться по ее поверхности, открепляясь то одним, то другим концом. Математическое моделирование взаимодействия разных РНК на плоской минеральной поверхности (Czaran T., Szathmary E., 2000) показало, что в таких условиях легко образуются группы разных молекул, связанных взаимной помощью, а размножение паразитов ограничено и не приводит к вымиранию кооперирующихся РНК. Так что, хотя четких границ на минеральной поверхности нет, она достаточно ограничивает подвижность РНК и нуклеотидов, чтобы могли появиться тесные группы взаимопомощи.
Еще один вклад минеральной подложки в возникновение жизни состоит в том, что она может работать катализатором, т.е. ускорять химические реакции. Эта функция выходит на первый план в тех вариантах модели «первичной пиццы», в которых в качестве минеральной основы предлагается не глина, а сульфидные минералы — пирит (FeS2), сфалерит (ZnS), алабандин (MnS). Дальше в этой главе мы подробнее рассмотрим связь сульфидных минералов с биохимией.
Модель «первичного майонеза» предложена Гарольдом Моровицем в книге «Mayonnaise and The Origin of Life: Thoughts of Minds and Molecules». Она предполагает, что примитивные аналоги клеточных мембран существовали с древнейших времен, еще до появления самокопирующихся РНК. Иными словами, весь мир РНК существовал внутри протоклеток — мелких жировых пузырьков. Теория «первичного майонеза» имеет меньше сторонников, чем теория «первичной пиццы», потому что для протоклеток существует проблема питания: нуклеотиды очень плохо проходят через мембраны. В современных клетках для этого существуют специальные транспортные белки, но адекватного решения для поглощения нуклеотидов примитивными протоклетками пока не найдено. Зато в модели «первичного майонеза» достигается очень эффективное разделение молекул РНК на кооперирующиеся группы, поэтому отвергать ее ученые не спешат. Более того, есть пути совмещения теорий «первичной пиццы» и «первичного майонеза»: частицы глины, как оказалось, помогают образованию мембранных пузырьков, при этом возникший пузырек окружает частицу глины со всех сторон.
Солнце: друг или враг?
Почти вся современная жизнь прямо или косвенно зависит от энергии солнечного света, которая в ходе фотосинтеза используется для построения сахаров и других клеточных веществ. Даже глубоководные сообщества, обитающие в полной темноте, зависят от кислорода, вырабатываемого водорослями в верхних слоях океана. Как известно, в стратосфере существует озоновый слой, который поглощает 99% ультрафиолетового излучения Солнца. Озон (О3) образуется из кислорода под действием того же ультрафиолета. В древние геологические эпохи, когда кислорода в атмосфере еще не было, озонового слоя тоже не могло быть. Более того, молодое Солнце излучало больше ультрафиолета, чем сейчас, когда оно, разменяв пятый миллиард лет, стало спокойной звездой среднего возраста. Поэтому во времена появления жизни на Земле ее поверхность подвергалась мощному ультрафиолетовому излучению, и смертельная для многих современных организмов доза излучения набиралась за несколько минут. В связи с этим многие ученые склонялись к тому, чтобы спрятать первые живые организмы поглубже под воду для защиты от губительных лучей.
Однако ультрафиолетовое излучение вызывает самые разнообразные химические реакции, в том числе ведущие к синтезу аминокислот и нуклеотидов из простых молекул. Так что для каких-то этапов происхождения жизни оно, наоборот, могло быть полезно. Как же разобраться, какие из первых шагов жизни происходили на свету, а какие — в темноте?
Ответ на этот вопрос пришел с неожиданной стороны. В последние годы бурно развивается синтетическая биология, целью которой является создание организмов с принципиально новыми свойствами. Например, коллектив под руководством Стивена Беннера достиг больших успехов в создании альтернативных нуклеотидов. Эти искусственные звенья хорошо встраиваются в ДНК и РНК обычными природными ферментами, образуют комплементарные пары друг с другом, но не со стандартными нуклеотидами А, Г, Т и Ц, и расширяют нуклеотидный алфавит до шестибуквенного (рис. 6.1) (Malyshev et al., 2014; Yang et al., 2011 (русский краткий анонс: http://www.chemport.ru/datenews. php? news=2557)).
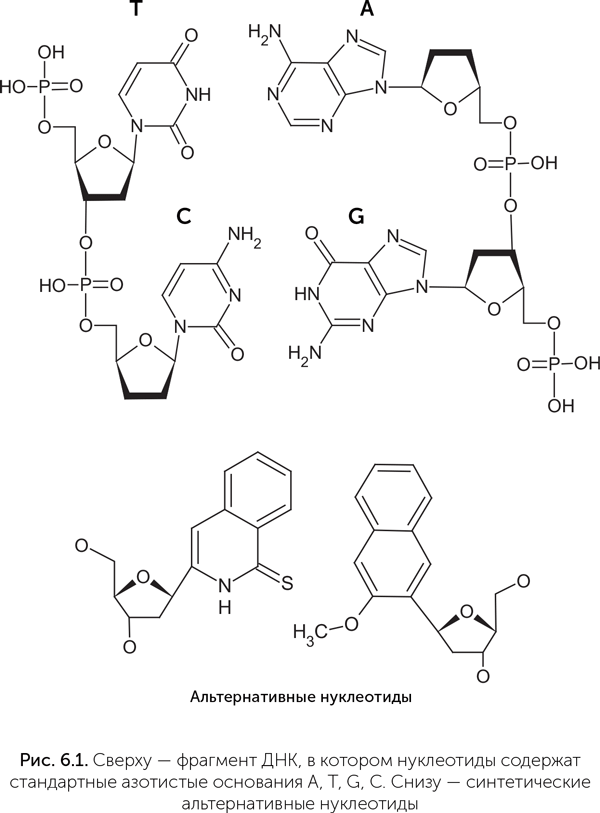
Получается, что с задачей хранения генетической информации в принципе могут справиться самые разные варианты нуклеиновых оснований, и А, Г, Т, Ц, возможно, были отобраны природой совсем по другим признакам. Как считает известный биофизик Армен Мулкиджанян, таким признаком была устойчивость к ультрафиолетовому излучению (Mulkidjanian, A. Y., Galperin, M. Y., 2007).
Здесь надо пояснить, как устроены молекулы и как происходит их взаимодействие со светом. Каждая химическая связь, изображаемая в структурных формулах линией между атомами, обычно состоит из двух электронов, которые вместе движутся между двумя связанными атомами. У каждого электрона есть собственное магнитное поле, направление которого называется «спин». Два электрона, образующие химическую связь, имеют противоположные спины, так что их магнитные поля взаимно компенсируются. Такие электроны называются «спаренными». Если молекулу разорвать на две части, то электроны из разорванной связи имеют два варианта дальнейшей судьбы. Они могут разойтись по одному в каждый фрагмент молекулы или оба вместе в один из фрагментов. В первом случае эти электроны остаются без пары и готовы к образованию новой связи с любой подходящей молекулой. Фрагменты молекул, имеющие неспаренный электрон, очень химически активны и называются «радикалы». Во втором случае, когда одному фрагменту достаются два электрона, а другому — ни одного, эти фрагменты имеют электрический заряд и называются «ионами». Неспаренных электронов в них нет, и они более стабильны, чем радикалы.
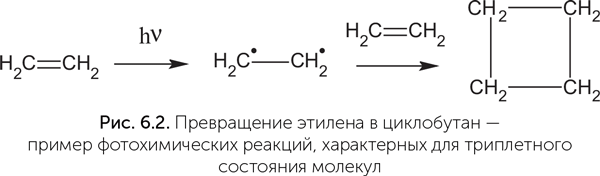
Когда в молекулу попадает фотон с подходящей энергией, он поглощается парой электронов, образующей химическую связь, и молекула переходит в возбужденное состояние с избыточной энергией. Возбужденных состояний как минимум два. Сначала молекула оказывается в неустойчивом и короткоживущем состоянии (так называемом синглетном состоянии). В нем спины электронов возбужденной пары еще антипараллельны, как и в спокойном состоянии молекулы. В синглетном состоянии молекула может сбросить возбуждение и вернуться в исходное состояние путем флюоресценции (излучения светового кванта с энергией чуть меньше исходной) или рассеяния энергии в тепло либо перейти в следующее — триплетное — состояние, в котором спины электронов становятся параллельными и химическая связь между атомами фактически разрывается. Если в молекуле была возбуждена одинарная связь, то молекула разрушается в этом месте. Если же была возбуждена двойная связь (точнее, так называемая пи-электронная система, образующая «вторые палочки» двойных связей), то молекула в триплетном состоянии сохраняет целостность, но становится бирадикалом — иными словами, у нее теперь имеются два неспаренных электрона, которые могут образовать две новые химические связи. Поэтому молекула в триплетном состоянии химически активна и вступает в разнообразные реакции. Например, молекулы этилена (С2H4), имеющие двойную связь между атомами углерода, при УФ-облучении частично объединяются попарно в циклобутан (С4H8), у которого вместо одной двойной связи образуются две одинарные связи между двумя дополнительными атомами углерода (рис. 6.2). Молекула может также вернуться из триплетного состояния в основное, невозбужденное путем излучения кванта света — фосфоресценции. В отличие от флюоресценции фосфоресценция может происходить спустя минуты и часы после облучения вещества, а разница в энергии поглощенного и излученного кванта света больше.
Так вот, у природных азотистых оснований синглетное состояние крайне короткоживущее. Оно легко рассеивает энергию возбуждения в тепло через колебания и вращение молекулы, обмен атомами водорода и другие механизмы и возвращается обратно в невозбужденное состояние. Синглетное состояние пуриновых оснований, аденина и гуанина, живет около 10–12 секунды — примерно в 10 000 раз меньше, чем синглетные состояния большинства молекул сравнимого размера и сложности, например аминокислоты триптофана. Благодаря быстрому рассеиванию энергии они из синглетного состояния практически всегда переходят в невозбужденное, а не в химически активное триплетное. А раз азотистые основания практически не попадают в триплетное состояние, то и разрушение их под действием ультрафиолета происходит очень редко.
Пиримидиновые основания, цитозин и тимин, рассеивают энергию несколько хуже, чем пурины, и, соответственно, менее устойчивы. Однако образование комплементарных пар улучшает рассеивание энергии еще примерно в 50 раз благодаря обмену протонами в водородных связях пары. Поэтому устойчивость комплементарной пары нуклеотидов к ультрафиолету выше, чем каждого из них по отдельности. Кроме того, в нуклеиновых кислотах плоские молекулы азотистых оснований лежат стопкой, поэтому их пи-электронные системы взаимодействуют между собой (так называемое стэкинг-взаимодействие) и могут передавать друг другу энергию возбуждения, еще усиливая рассеивание и дополнительно увеличивая устойчивость к ультрафиолету — до 20 раз по сравнению с одной комплементарной парой нуклеотидов (Mulkidjanian et al., 2003).
Азотистые основания не только сами устойчивы к ультрафиолету, они защищают соседние молекулы. Например, они предохраняют от УФ-расщепления фосфоэфирную связь (О-Р). При облучении УФ глицеролфосфата отщепление фосфорной кислоты происходит в 300 раз быстрее, чем при облучении аденозинмонофосфата, а образование комплементарных пар и стэкинг-взаимодействие в цепочке ДНК или РНК еще увеличивают степень защиты.
Таким образом, солнечный ультрафиолет, который в принципе разрушительно воздействует на нуклеотидную цепочку, как и на любые органические молекулы, может служить фактором отбора по следующим направлениям:
- отбор самых УФ-стойких азотистых оснований;
- отбор азотистых оснований, склонных образовывать комплементарные пары;
- отбор нуклеотидов одной хиральности из смеси правых и левых нуклеотидов (так называемой рацемической смеси), потому что смесь правых и левых нуклеотидов в цепочке нарушает стэкинг-взаимодействие;
- отбор длинных молекул РНК по сравнению с более короткими, потому что в длинных цепочках стэкинг-взаимодействие увеличивает устойчивость к ультрафиолету;
- отбор молекул РНК, содержащих двуспиральные участки (шпильки), среди молекул со случайными последовательностями, потому что в них больше нуклеотидов входят в состав комплементарных пар.
Минеральный состав живых клеток
Важную информацию об условиях обитания древнейших форм жизни мы можем получить из состава солей в современных клетках. Как это возможно?
Еще в 1920-х годах физиолог Арчибальд Макалум обратил внимание на то, что относительный состав солей в крови человека и других позвоночных очень похож на относительный состав солей в морской воде. Он так объяснил это наблюдение: первые животные возникли в море и поначалу не имели почек или других систем регуляции состава солей в межклеточных жидкостях своего тела. А к тому времени, когда у животных появились эффективные почки, многие процессы в разных органах уже были завязаны на «морской» состав солей в крови. Поэтому млекопитающие, предки которых вышли на сушу более 300 млн лет назад, до сих пор носят в крови соли в том же соотношении, что и их далекие предки, хотя на суше необходимые соли (прежде всего хлориды) в дефиците. Поэтому соленая пища, содержащая хлорид натрия, для нас более вкусна, чем пресная.
История минерального (солевого) состава клеток в чем-то аналогична. Так как первые клетки вряд ли были способны контролировать содержание неорганических солей (для этого требуются сложные липидные мембраны и энергозатратные системы активного транспорта), то солевой состав тех клеток должен был быть таким же, как в их окружающей среде. К этому солевому составу изначально приспосабливались первые РНК и белки, и затем менять его было бы уже слишком сложно.
Если сравнить содержание различных ионов в цитоплазме клеток и морской воде (табл. 6.1), бросается в глаза высокое содержание в клетках калия и низкое — натрия. Геологи уверены, что морская вода во все эпохи, как и сейчас, содержала мало калия и много натрия. В континентальных озерах, как пресных, так и соленых, «клеточные» пропорции ионов тоже не встречаются. Ближе всего к клеткам по соотношению калия и натрия оказываются воды некоторых геотермальных источников.
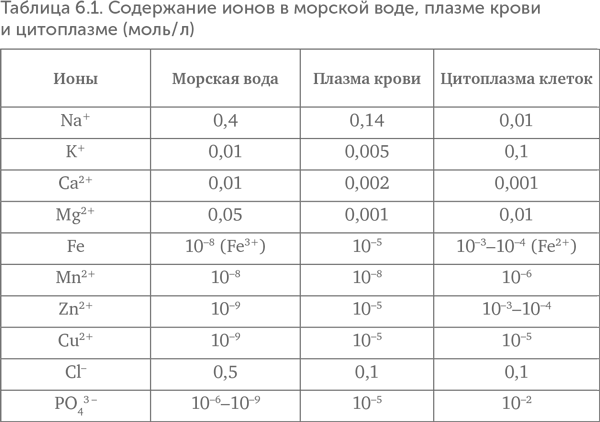
Другой особенностью ионного состава клеток оказывается высокая концентрация ионов переходных металлов, прежде всего железа и цинка, а также марганца и меди. Если железо широко распространено и в неживой природе, то медь, марганец и особенно цинк содержатся в клетках в очень большом количестве по сравнению с внешней средой. Концентрация цинка в клетках в миллион раз выше, чем в морской воде! Обогащение этими переходными металлами характерно для одной разновидности геотермальных источников — «черных курильщиков».
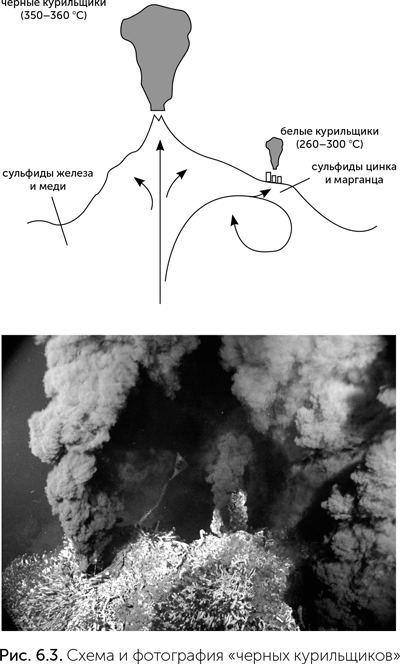
«Черные курильщики» были открыты в 1977 году при погружениях батискафа «Алвин» к срединно-океаническому хребту в Атлантике. Исследователям открылась поражающая воображение картина — торчащие из морского дна трубы, из которых валит густой черный дым (рис. 6.3). Это, конечно, не дым, а перегретая глубинная (так называемая геотермальная, ее источником являются химические процессы в нижних слоях земной коры и мантии) вода с температурой до 400 оС, которая не закипает из-за большого давления. Ее мутность и черный цвет обусловлены взвесью сульфидов металлов. При контакте геотермальной воды с океанской первая охлаждается, и из нее сначала выпадают сульфиды железа, меди и никеля, имеющие черный цвет. Из этих сульфидных осадков складываются трубы «черных курильщиков». При дальнейшем охлаждении, в диапазоне температур 200–300 °C, из воды выпадают сульфиды цинка и марганца, покрывающие белым ковром дно вокруг «черных курильщиков». Если геотермальная вода поднимается вверх относительно медленно, она успевает остыть до 300 °C еще до выхода в океан, и в этом случае образуются небольшие «белые курильщики», трубы которых сложены из сульфидов цинка и марганца. Кроме сульфидов переходных металлов геотермальная вода обогащена также сероводородом, калием и магнием и имеет щелочную реакцию.
«Черные курильщики» обладают и другими свойствами, полезными для зарождения жизни. Во-первых, минеральные осадки в них образуются из частиц микронного (0,001 мм) размера и пронизаны громадным количеством пор. Эти поры по размеру соответствуют бактериальным клеткам и образуют сложный лабиринт, в котором могут в относительной изоляции размножаться разные доклеточные формы жизни. Во-вторых, сульфидные минералы, которые откладываются вокруг «черного курильщика», являются отличными катализаторами разных химических реакций, в том числе ведущих к синтезу аминокислот и других клеточных веществ. Более того, в состав многих современных клеточных ферментов входят неорганические кластеры — наночастицы некоторых минералов. И это именно те минералы, которые образуются в «черных курильщиках»: пирит FeS2, макинавит (Fe, Ni) S, грейгит Fe5NiS8, виоларит FeNi2S4 (Russell et al., 2014, таблица на с. 14). В-третьих, в «черных курильщиках» и других геотермальных источниках существуют устойчивые мощные градиенты температуры и химического состава, т.е. неравновесные условия, которые, как мы помним из прошлой главы, совершенно необходимы для жизни. Хотя современные организмы используют химические градиенты, для первых живых организмов мог быть полезен и устойчивый перепад температур. В условиях перепада температур растворенные крупные молекулы, такие как РНК и белки, могут двигаться от тепла к холоду. Это явление называется «термофорез». Оно объясняется большей энергией частиц в нагретых зонах и, соответственно, их большими импульсами, направляющими частицы из нагретых зон в холодные. Это явление используется для концентрирования РНК и других молекул.
Как показали эксперименты, в длинных заполненных водой порах в условиях перепада температур может происходить очень сильное концентрирование нуклеотидов, РНК и других растворенных веществ — в миллионы и миллиарды раз! Например, в стеклянном капилляре, нагреваемом с боковой стороны и выходящем верхним концом в холодную колбу (Baaske et al., 2007), нуклеотиды подсасываются из холодного раствора и концентрируются в нижней, горячей части. Их концентрация там возрастает в 6–10 раз на каждый миллиметр длины трубки, т.е. 10-сантиметровый капилляр может повысить их концентрацию в миллиард раз. Молекулы РНК, состоящие из 5–10 нуклеотидов, концентрируются легче при увеличении толщины трубки. Кроме простого концентрирования в таких капиллярах идут более сложные процессы, связанные с колебаниями температур и концентраций, помогающие образованию длинных молекул РНК, которые мы подробнее рассмотрим в главе 9.
Все это делает «черные курильщики» подходящим местом для появления жизни, и происходящие в них процессы привлекли пристальное внимание ученых. Сейчас существует две хорошо разработанные теории происхождения жизни в связи с геотермальными источниками: «железосерного мира» и «цинкового мира». Обе они предлагают решение сразу многих проблем на пути появления жизни, включая восстановление углекислого газа и образование биополимеров. Рассмотрим их подробнее.
«Железосерный мир»
Теория «железосерного мира» принадлежит немецкому биофизику Гюнтеру Вахтерхойзеру (Wächtershäuser, 2006. Пересказ одной из предыдущих его статей на русском языке: http://elementy.ru/news/430373).
Вахтерхойзер и его последователи обосновали теоретически и проверили экспериментально многие химические реакции, происходящие в условиях окрестностей «черных курильщиков» — при температурах 50–150 оС и высоком давлении. Основным источником водорода для восстановления СО2 является происходящая при температурах выше 100 оС реакция взаимодействия сероводорода с сульфидом железа:
H2S + FeS → FeS2 + 2 [H],
в которой сульфид железа превращается в пирит, а атомы водорода остаются адсорбированы на его поверхности. С помощью этих атомов водорода на поверхности сульфида железа может происходить, например, восстановление СО2 до метилмеркаптана:
CO2 + 4 H2S + 3 FeS → CH3SH + 3 FeS2 + 2 H2O,
а также фиксация азота:
N2 + 3 H2S + 3 FeS → 2 NH3 + 3 FeS2,
и дальше превращение альфа-кетокислот в аминокислоты:
R-CO-COOH + NH3 + FeS + H2S → R-CHNH2-COOH + FeS2 + H2O.
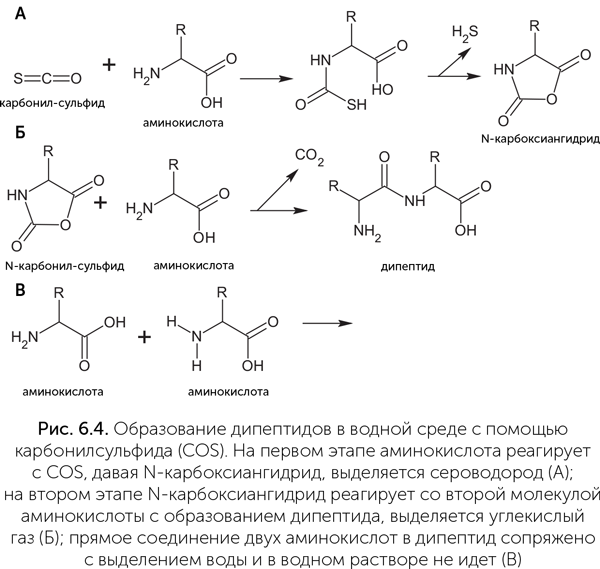
В присутствии сульфида никеля, тоже характерного для «черных курильщиков», разнообразие химических реакций сильно возрастает. СО2 и присутствующий в вулканических газах угарный газ (СО) превращаются в уксусную, пировиноградную и другие органические кислоты, а также тиометилацетат (CH3CO-S-CH3). Важным промежуточным продуктом в этой химической системе является карбонилсульфид (COS). С его помощью, например, происходит «сшивание» аминокислот в пептиды даже в воде: на первом шаге реакции уходящей группой становится не вода, а H2S, и CO2 — на втором (рис. 6.4, Leman et al., 2004). В присутствии фосфатов COS может фосфорилировать аминокислоты и «сшивать» фосфат в пирофосфат (Leman et al., 2006).
Отрицательно заряженные органические кислоты адсорбируются (прилипают) на поверхности сульфидных минералов и могут накапливаться в больших концентрациях. В целом в условиях «черного курильщика» возможен синтез большого разнообразия органики, едва ли не больше, чем в опытах Миллера.
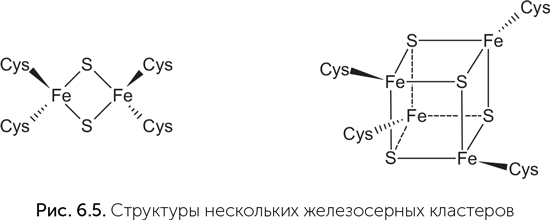
Аргументом в пользу такого сценария являются содержащиеся в ферментах современных клеток железосерные кластеры — фактически, наночастицы пирита (рис. 6.5). Они переносят электроны и участвуют в разнообразных окислительно-восстановительных реакциях.
«Цинковый мир»
Другой сценарий абиогенного синтеза органики на геотермальных источниках — теория «цинкового мира» — предложен Арменом Мулкиджаняном (Mulkidjanian, 2009; Mulkidjanian, Galperin, 2009). Он основан на способности сульфидов цинка и марганца к фотохимическому восстановлению разных веществ. Кристаллы ZnS и MnS поглощают ближний ультрафиолет (так называемый «черный свет», т.е. волны с диапазоном 400–315 нм). Их возбужденное состояние устойчиво, благодаря чему сульфид цинка, например, может часами фосфоресцировать в темноте. В этом состоянии возбужденный электрон обычно находится в «потенциальной яме» на поверхности кристалла и может участвовать в химических реакциях, восстанавливая разные вещества. В водной среде эти кристаллы восстанавливают CO2 до муравьиной кислоты (НСООН), уксусной кислоты и других органических кислот, сульфид цинка оказывается самым эффективным восстановителем с квантовым выходом до 80% (80% поглощенных фотонов вызывают химическую реакцию). При этом на кристалле накапливается положительный электрический заряд. Если нет подходящих восстановителей, то происходит фотокоррозия сульфида цинка с выходом ионов цинка в раствор и образованием молекулярной серы:

Аналогично сульфидам железа в «черных курильщиках» сульфид цинка на свету может восстанавливать азот до аммиака:

Образование аминокислот из кетокислот тоже эффективно происходит на кристаллах сульфида цинка при освещении.
Если в воду с освещенными кристаллами сульфида цинка поступает сероводород, то вышедшие в раствор ионы цинка вновь осаждаются в виде кристаллов. Иначе говоря, в этом случае сульфид цинка не расходуется, а выступает катализатором для восстановления CO2 сероводородом:
CO2 + H2S → HCOOH + S.
Муравьиная кислота и аммиак, образующиеся на сульфиде цинка, при подсыхании воды выпадают в осадок в виде формиата аммония HCOONH4. Эта соль при прогревании в сухом виде теряет воду и превращается в формамид CHONH2. Формамид может служить сырьем для синтеза азотистых оснований РНК (подробнее — в следующей главе). Кроме того, благодаря высокой температуре кипения (218 oC при обычном давлении) он эффективно накапливается в пересыхающих лужах, и в среде формамида, в отличие от водной среды, нуклеотиды легко соединяются в РНК и не распадаются.
Сульфид цинка хорошо удерживает на своей поверхности ДНК и РНК. Кроме того, сульфид цинка способен принимать световое возбуждение с нуклеотидов, РНК и других молекул. Это защищает РНК от УФ-расщепления, и в то же время накопление РНК на поверхности минерала позволяет собирать больше света и ускоряет фотосинтез в этом месте.
Нет ли здесь противоречия? С одной стороны, абиогенный фотосинтез на ZnS требует света, и нуклеотиды несут следы отбора на устойчивость к ультрафиолету. С другой стороны, в наше время отложения сульфида цинка образуются только в темных морских глубинах вокруг «черных курильщиков». Чтобы вода могла выносить из недр Земли и накапливать на поверхности ZnS и MnS, требуется ее температура 200–250 oC, а для выноса FeS — 300–350 oC. Чтобы вода при таких температурах не закипала, необходимо высокое давление, которое сейчас бывает только в глубинах океана. Но, как мы помним, после гигантского столкновения и появления Луны Земля еще 50–100 млн. лет имела сверхплотную атмосферу углекислого газа, подобно современной Венере. Давление этой атмосферы в 50–200 раз превышало современное, и в ту эпоху геотермальные источники с отложениями ZnS и MnS (аналоги «белых курильщиков») могли существовать на поверхности Земли, под лучами Солнца.
Именно сульфид цинка позволяет снять противоречие между необходимостью ультрафиолета для появления нуклеотидов и РНК и его опасностью для сколько-нибудь сложных форм жизни. Всего один миллиметр осадка ZnS защищает от ультрафиолета так же эффективно, как 40-метровый слой воды. Поэтому первые организмы могли укрываться от света в толще минерального осадка, но при этом иметь доступ к продуктам фотохимических реакций в верхнем слое. Более того, видимый свет хорошо проходит через осадок сульфида цинка, и населяющие этот осадок организмы имели возможность вести свой собственный фотосинтез, используя видимый свет.
Как сделать выбор между «цинковым» и «железосерным» мирами?
По первой теории жизнь зарождалась в среде, где было очень много растворенного цинка. Он мог включаться в структуры РНК и первых белков и сохраниться там до наших дней. Если же жизнь вышла из «черных курильщиков», то скорее можно ожидать, что в РНК и древних белках будет содержаться железо.
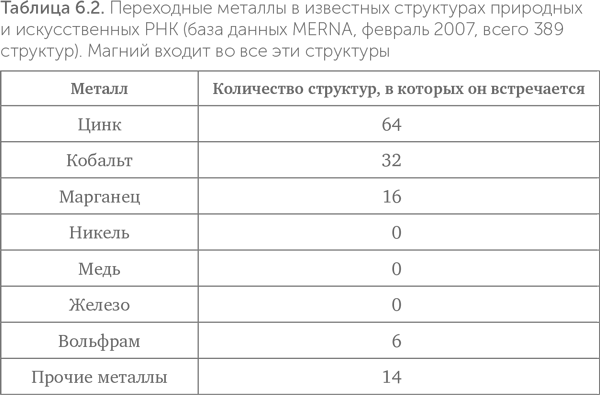
Как мы видели выше (табл. 6.1), цинк по общему содержанию в клетках сравним с железом и превосходит все прочие переходные металлы. В известных структурах РНК железо совершенно отсутствует, а цинк встречается чаще других переходных металлов (табл. 6.2). На втором месте — марганец, ведущий себя подобно цинку. Многие рибозимы требуют присутствия ионов металлов для проявления каталитической активности. Среди таких металлов самые распространенные — магний, цинк и марганец, а железо никогда не встречается.
Цинком также обогащены самые древние белки и ферменты с древними функциями. Из 49 универсальных белков (таких, которые присутствовали во всех прочитанных на 2008 год геномах) 37 содержат цинк, 19 — марганец и только 3 — железо. Причем цинк не обязательно нужен для каталитической активности, часто он просто стабилизирует трехмерную структуру. Один из таких древних белковых фолдов (укладок) — ДНК-РНК-связывающий домен, называемый «цинковый палец», где атом цинка связан между двумя остатками цистеина и двумя — гистидина, очень широко распространен, например, среди ДНК-связывающих белков.
Таким образом, можно сказать, что содержание металлов в клетках подтверждает теорию «цинкового мира», а не «железосерного».
В пользу «цинковой» теории говорит еще то обстоятельство, что ионы железа легко расщепляют РНК, связываясь с 2' и 3' гидроксильными группами рибозы. Поэтому клетки хранят избыток железа в связанном виде, вместе с белком ферритином. Вахтерхойзер, чтобы обойти эту сложность, предполагает, что первые нуклеиновые кислоты содержали вместо рибозы четырехуглеродные сахара, такие как эритроза. Подобные ксенонуклеиновые кислоты были получены искусственно, они устойчивы к ионам железа, щелочам и высокой температуре, могут комплементарно соединяться с классическими РНК, но в таком случае непонятно, почему они сменились более уязвимыми нуклеиновыми кислотами с рибозой (подробнее об этом будет рассказано в главе 12).
В целом теория «цинкового мира» находит больше подтверждений, но полностью отвергать роль химических реакций на поверхности пирита нельзя. В конце концов, зоны сульфидов железа и сульфидов цинка соседствуют в одних и тех же геотермальных источниках. Вещества, синтезируемые на сульфиде железа, постепенно смываются и переносятся с током воды и пара в зону сульфида цинка, где могут включаться в происходящие там под действием света процессы. Именно железосерный «нижний этаж» геотермальных источников мог поставлять наверх серосодержащие вещества: карбонилсульфид, меркаптаны, тиоацетат и тиометилацетат. Последний особо важен для биохимии, так как является простейшим аналогом ацетилкофермента А, способного легко присоединять ацетильную группу (CO-CH3) к другим органическим молекулам (подробнее об ацетилкоферменте А будет рассказано в главе 11).
Фосфорная проблема и пути ее решения
Живые клетки содержат большое количество фосфора. Он входит в состав ДНК, РНК, энергетической «валюты» — АТФ и многих других жизненно важных молекул. Сахара присутствуют в клетках в основном в фосфорилированной форме. Однако в неживой природе фосфор существует практически только в виде фосфатных минералов, таких как апатит Ca5 (PO4) 3OH, которые нерастворимы в воде и химически инертны. Более того, высокая концентрация растворенного фосфата несовместима с клеточными концентрациями магния и кальция — их фосфаты плохо растворимы и должны выпадать в осадок. В клетке этого не происходит, потому что почти весь внутриклеточный фосфор находится в составе различных фосфорилированных органических молекул, соли которых с магнием и кальцием растворимы.
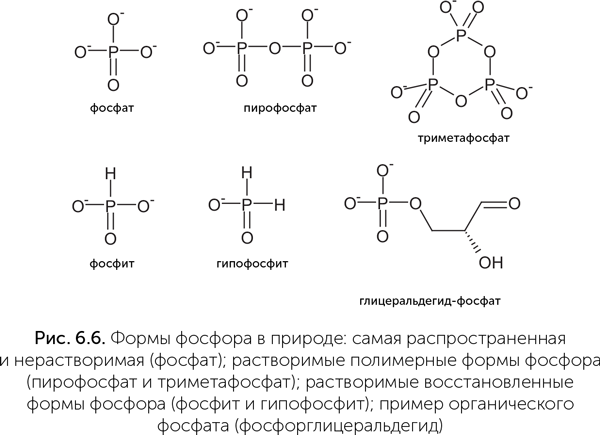
Как же собрать в колыбели жизни достаточно фосфора, причем в форме, пригодной для получения сахарофосфатов и нуклеотидов? В принципе, возможно несколько решений (рис. 6.6). Например, пирофосфат (P2O74 – ) растворим в воде в присутствии кальция и магния и, более того, способен служить источником энергии для биохимических реакций, подобно АТФ. Некоторые микроорганизмы и сейчас используют пирофосфат для тех реакций, которые у других организмов требуют затрат АТФ. Другая растворимая и химически активная форма фосфора — фосфит (HPO32 — ). Это соединение может окисляться до фосфата с выделением большого количества энергии и давно используется химиками для синтеза искусственной ДНК (Lestinger et al., 1975). Кроме того, многие бактерии обладают ферментами для окисления фосфита и могут использовать его как единственный источник фосфора. Некоторые бактерии даже способны получать энергию из процесса окисления фосфита.
Где и как могли накопиться пирофосфаты или фосфиты в высоких концентрациях? Хорошим источником могут быть метеориты. В двух типах метеоритов (состоящие из железа и силикатов энстатитовые хондриты и железные метеориты) содержится до 0,1–0,5% минерала шрайберзита (фосфид железа Fe3P). При попадании в воду шрайберзит постепенно разлагается, выделяя фосфиты, фосфаты, пирофосфаты, оксид железа и водород. До 50% фосфора из шрайберзита переходит в фосфиты и до 5% — в пирофосфаты. Фосфит устойчив к ультрафиолетовому излучению, не окисляется в отсутствии катализаторов и может сохраняться в морской воде сотни миллионов лет (Pasek et al., 2008).
Другой источник фосфитов и пирофосфатов — вулканы и связанные с ними наземные геотермальные источники. Измерения японских геохимиков на вулкане Усу (остров Хоккайдо) показали, что в выходящих из фумарол вулканических газах с температурой 540–700 оС содержится заметное количество летучих оксидов фосфора: P4O10, PO2 и P4O6. При лабораторном моделировании поведения жидкой лавы при температуре 1300 оС оказалось, что до 40% фосфора из нее улетучивается в виде оксидов (Yamagata et al., 1991). Последующее растворение этих оксидов в воде дает фосфиты и пирофосфаты.
Вода многих наземных геотермальных источников обогащена соединениями фосфора: например, в грязевых котлах Мутновской сопки на Камчатке его концентрация достигает 0,01% (Bortnikova et al., 2009). В большинстве геохимических анализов геотермальной воды измерялся общий уровень фосфора во всех формах, не различая фосфат, пирофосфат и фосфит, но для горячих источников Мамонтовых озер в Калифорнии показано, что до половины фосфора в их воде содержится в виде фосфита (Pech et al., 2009). В древних вулканических газах и геотермальных водах, скорее всего, содержание всех форм фосфора было еще в несколько раз выше, потому что древнейшие материки, как мы помним из главы 4, были сложены богатыми фосфором KREEP-базальтами.
Еще один механизм накопления фосфора связан с уже упомянутыми кристаллами сульфида цинка. Как мы помним, на свету эти кристаллы постепенно разрушаются. В качестве подходящего восстановителя для предохранения ZnS от фотокоррозии, как оказалось, идеально подходят восстановленные формы фосфора — фосфиты и гипофосфиты (H2PO2−). В присутствии фосфитов ZnS проводит восстановление CO2, сопряженное с окислением фосфита до фосфата. Более того, значительная часть этого фосфата соединяется с прилипшими к кристаллу органическими молекулами, образуя фосфорилированные сахара и кислоты, как в клетках. Это один из возможных путей накопления фосфорилированной органики в местах зарождения жизни.
Наземные геотермальные поля — колыбель жизни?
Поиск местообитаний, богатых переходными металлами и фосфором, ведет нас к горячим источникам вблизи вулканов. Как мы помним, еще одна особенность минерального состава клеток — это высокая концентрация калия и малая — натрия. В морской воде соотношение этих металлов обратное. Если фосфор и соли переходных металлов в принципе могут накапливаться в высыхающих водоемах любого типа, то соотношение калий— натрий не меняется при высыхании и поэтому является самым надежным признаком возможной колыбели жизни.
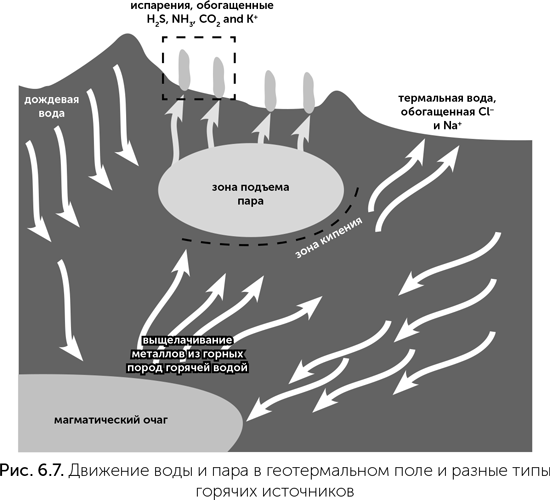
Геотермальные воды горячих источников разных типов сильно отличаются друг от друга по соотношению калия и натрия, среди них есть похожие в этом отношении как на морскую воду, так и на клетки. Горячие источники обычно питаются водой с поверхности — дождевой, снеговой или речной, так называемыми метеорными водами. Метеорные воды стекают по трещинам и сквозь поры вглубь земной коры, ближе к магматическому очагу, там нагреваются и частично растворяют горные породы. Поднимаясь снова к поверхности, горячая вода закипает по мере снижения давления. Чаще всего пар выходит из земли по трещинам прямо над магматическим очагом, и такие выходы называются фумаролами. Жидкая вода, которая не успела выкипеть, тоже поднимается по трещинам и выходит на поверхность горячими источниками. Типичное геотермальное поле, например, Лардерелло в Италии, состоит из множества фумарол в середине и горячих источников по краям.
В холодном и влажном климате (Камчатка, Исландия, Йеллоустоун, Новая Зеландия) встречается еще два типа горячих источников — гейзеры и грязевые котлы. Гейзер периодически выбрасывает струю горячей воды под давлением, а в остальное время из него идет пар. Если пар охлаждается не текущей сверху холодной водой, а холодным воздухом на поверхности, то он конденсируется, и получаются грязевые котлы. Их грязь состоит из мельчайших частиц глины, которые образуются из поднимающихся с паром летучих силикатов.
В совместной работе Армен Мулкиджанян и вулканолог Андрей Бычков (2012) показали, что из всех типов водоемов и горячих источников именно грязевые котлы лучше всего подходят на роль колыбели жизни. Как известно геологам, при кипении горячей минеральной воды, особенно при температурах выше 100 оС (под давлением), происходит разделение растворенных веществ. Одна их часть остается в жидкости и выходит в горячих источниках, а другая испаряется вместе с водой и выходит через фумаролы и грязевые котлы. Понятно, что с паром вырываются прежде всего вулканические газы, которые были растворены в воде (H2S, CO2, NH3, HCN), но также в пар переходят оксиды фосфора, силикаты и соли некоторых металлов, прежде всего калия, цинка и марганца (рис. 6.7)! За счет разделения ионов металлов при кипении пар, поднимающийся от магматического очага, содержит много калия и мало натрия, как цитоплазма клеток. Такой же минеральный состав имеет и жидкость грязевых котлов, образуемая при охлаждении и конденсации этого пара. Иными словами, жидкость грязевых котлов — это наиболее похожая на цитоплазму клеток природная среда. Вода геотермальных источников, которая не выкипела под землей, а поднималась на поверхность в жидком виде, наоборот, обогащена нелетучими солями — хлоридами натрия и железа.
Грязевые котлы обогащены именно теми элементами, которые накапливают клетки: калием, фосфором, азотом (в виде аммиака) и микроэлементами: цинком, марганцем, молибденом и бором (в следующей главе мы увидим, что молибден и бор очень важны для появления РНК). Натрия в них немного, и соотношение калий/натрий получается близким к внутриклеточной среде. Правда, современные грязевые котлы содержат много серной кислоты, которая получается при реакции сероводорода с кислородом воздуха, и практически необитаемы. Но в древние эпохи, когда кислорода в атмосфере еще не было, грязевые котлы должны были иметь нейтральную среду и быть пригодными для жизни. В нейтральной среде силикаты должны были осаждаться не в виде жидкой глины, а в виде цеолитов и других твердых пористых силикатных минералов с огромной поверхностью. Ионы цинка и марганца в сероводородной воде должны были осаждаться в виде сульфидов, причем для такого способа накопления ZnS и MnS даже не требуется повышенное атмосферное давление.
Получается, что наземное геотермальное поле предоставляет почти все необходимое для зарождения жизни:
- среду, обогащенную калием, фосфором и необходимыми микроэлементами;
- местообитание со встроенным источником тепла, с практически постоянными условиями независимо от капризов погоды;
- пористые минеральные осадки, работающие в качестве катализаторов и предоставляющие огромное количество раздельных микроотсеков для обитания доклеточных форм жизни;
- испаряющиеся лужи, в которых могут накапливаться органические вещества и благодаря высокой концентрации солей и формамида может идти образование цепочек РНК и белков;
- несколько разных механизмов получения органических веществ из атмосферного CO2 и азота;
- освещаемую солнцем поверхность, на которой идут фотохимические реакции, и совсем рядом с ней — защищенные от ультрафиолета поры в осадках;
- подогреваемые с одной стороны поры и трещины, в которых происходит накопление нуклеотидов и РНК до высоких концентраций.
Никакие другие местообитания не обладают сразу всеми этими достоинствами. Например, в «черных курильщиках» нет обогащения калием и фосфором, нет ультрафиолета и нет накопления веществ в испаряющихся лужах. Так что грязевые котлы наземных геотермальных полей на сегодня представляются самым вероятным местом появления жизни.

