Книга: Смотри, что у тебя внутри. Как микробы, живущие в нашем теле, определяют наше здоровье и нашу личность
Назад: 5. Как взломать микробиом?
Дальше: 7. Будущее
6. Антибиотики
Узнав, какую важную роль микроорганизмы играют во всех аспектах нашей жизни, мы должны спросить себя: стоит ли использовать антибиотики так часто, как мы это обычно делаем?
Мы с Амандой впервые принесли нашу дочь к врачу, когда ей было всего несколько дней. Педиатр сформулировала вопрос с дипломатичностью ветеринара, опасающегося, как бы льву, которому он собирается лечить зубы, не дали слишком маленькую дозу снотворного.
“Как вы знаете, – сказала она, – по поводу вакцинации существует большой разброс мнений. А как мы к этому относимся?”
Переглянувшись, мы ответили: “Мы хотим, чтобы наша дочь получила все полагающиеся прививки, большое спасибо”. Центры по контролю и профилактике заболеваний США издают рекомендованный график иммунизации детей.
Я не виню доктора. Она просто реагировала на (неадекватные) страхи общества, часть которого – пациенты педиатров. Меня поражает, как сильно люди беспокоятся из-за прививок и как мало – из-за антибиотиков.

Взять хотя бы обстоятельства рождения нашей дочери. Перед тем как сделать Аманде экстренное кесарево сечение, ей вкололи антибиотики. А через несколько минут после появления нашей дочери на свет доктор закапал малышке антибиотики в глаза. У нас никто ничего не спрашивал – они просто это сделали. Это стандартная процедура, направленная на защиту от передающегося половым путем заболевания – гонореи, которая может вызвать конъюнктивит у новорожденных.
Мы были абсолютно уверены, что у нас нет никакой гонореи. Но самое главное – об антибиотиках мы узнали уже постфактум. Сейчас применение антибиотиков стало настолько рутинным, что пациентов о нем даже не предупреждают. Люди с ума сходят из-за вакцинации, хотя почти все ужасы, которые о ней рассказывают, не имеют под собой научного основания или уже опровергнуты. Например, данные о том, что некоторые вакцины якобы вызывают аутизм, оказались полностью ложными, статья, в которой они были приведены, отозвана, а ее автору в его родной Англии запретили заниматься медициной. Конечно, у прививок тоже есть риски, но эти риски хорошо изучены и относительно редки: серьезные реакции встречаются примерно в одном случае на миллион.
И при этом давно ли вам приходилось слышать об отказе от антибиотиков? А ведь они гораздо менее эффективны, чем вакцины. В то время как эффективность прививок против многих болезней составляет минимум 90 %, антибиотики становятся все менее эффективными (отчасти из-за их неправильного использования) и резистентность к этим препаратам встречается все чаще. Все это очень красноречиво описал Марти Блейзер, врач-микробиолог из Университета Нью-Йорка, в своей книге “Недостающие микробы: как чрезмерное использование антибиотиков провоцирует современные эпидемии”. (Печальный факт: более 70 % бактерий, вызывающих инфекции в больницах США, устойчивы по крайней мере к одному из антибиотиков, обычно используемых для их лечения.)
Блейзер утверждает – и многие с ним соглашаются – что антибиотики по действию можно сравнить с напалмом. Они действуют сразу на множество организмов внутри нас, уничтожая наше микробное наследие, и последствия этого для нашего личного и общественного здоровья мы еще только начинаем осознавать.
Антибиотики – это яды, просто они более токсичны для бактерий, чем для человека. Биохимически бактерии во многом отличаются от нас. Иногда эта разница проявляется в форме общих молекул, таких как рибосомы, которые вырабатывают белок. В других случаях это могут быть молекулярные механизмы, которые есть у них, но нет у нас: например, энзимы, синтезирующие клеточные стенки, не имеют аналогов в клетках млекопитающих. Антибиотики влияют на самые основы жизни бактерий: синтез белка; деление; синтез клеточной стенки; транспортировку питательных веществ в клетку и другие жизненно важные процессы. Иногда антибиотики проделывают дырку в клеточной стенке или мембране, из которой, как из прорванного пакета, вытекают необходимые клетке вещества.
Антибиотики относительно безопасны для нас, потому что они нацелены на процессы жизнедеятельности микробов и не затрагивают большую часть наших клеток. Но есть другие опасности: помимо нецелевого уничтожения как “плохих”, так и “хороших” бактерий, нам следует опасаться, что бактерии смогут перехитрить лекарства.
Патогенные микроорганизмы способны приспосабливаться к антибиотикам. Бактериальные популяции могут размножаться с огромной скоростью, что позволяет им быстро и гибко реагировать на эволюционное давление. Антибиотики – один из видов этого давления. И что еще страшнее, часто бактерии в этой гонке имеют фору, потому что уже сталкивались с антибиотиками. Мы не изобретаем антибиотики с нуля; скорее, мы находим их аналоги в окружающей среде. Многие из соединений, которые становятся основой для антибиотиков, уже используются микробами, особенно почвенными, для коммуникации во внешней среде. Поскольку бактерии раньше уже сталкивались с этими веществами, многие виды микроорганизмов обладают некоторой, пусть низкой, устойчивостью к ним. Но при частом воздействии антибиотиков происходит селекция, и у видов бактерий, в том числе наиболее опасных, вырабатывается более высокий уровень устойчивости, или резистентность.
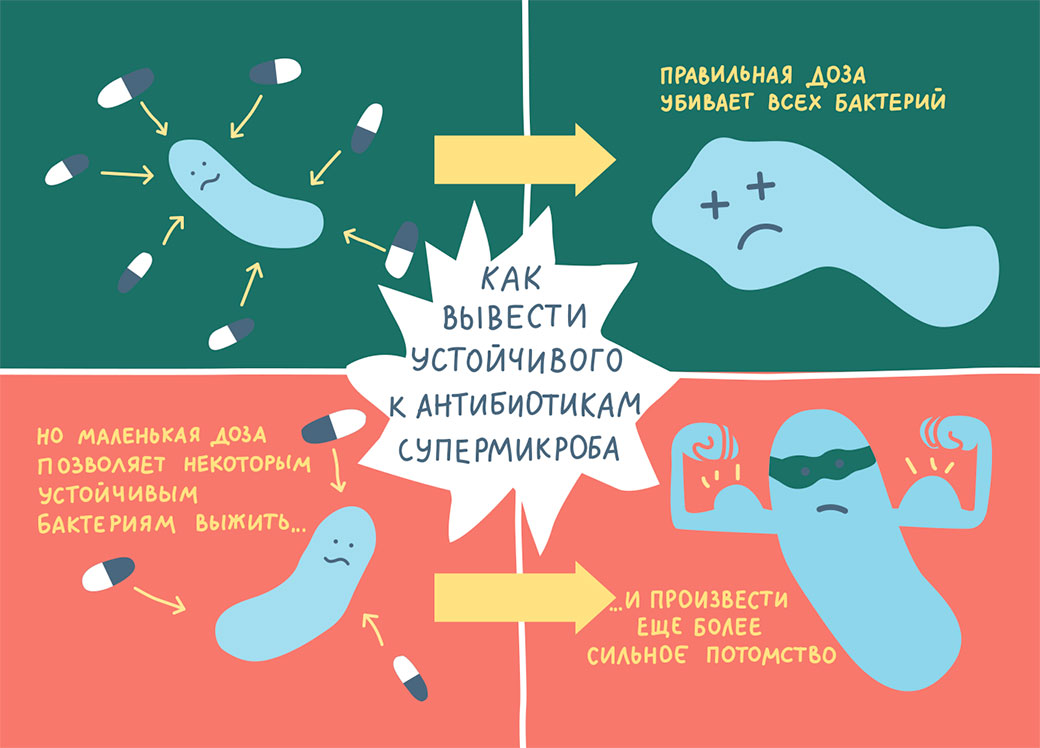
Причем беспокоиться надо не только о бактериях, связанных с человеком. Устойчивые к антибиотикам гены очень легко передаются при половом размножении бактерий. А бактерии невероятно плодовиты, они, выражаясь нашим языком, ведут чрезвычайно беспорядочную половую жизнь, причем скрещиваются как с ближними, так и с очень дальними родственниками. В итоге, если применять антибиотики в животноводстве, это может привести к тому, что резистентные к ним микробы окажутся в нашем организме.
Одно дело, если бы антибиотики использовались только для лечения заболевших животных, как для лечения больных людей. Но еще в 1950-х годах фермеры заметили, что низкие – ниже терапевтических – дозы антибиотиков способствуют быстрому росту и набору веса у животных. Поэтому в США домашний скот получает низкие дозы антибиотиков исключительно в целях стимулирования роста, а следовательно, повышения коммерческой ценности животных.
С точки зрения устойчивости к антибиотикам – это наихудший сценарий. В то время как высокие дозы антибиотиков убивают (почти) все бактерии, низкие дозы делают микроорганизм немного более устойчивым, и когда какая-то бактерия начнет по-настоящему угрожать нашей жизни, окажется, что мы сами научили ее бороться с нашим главным оружием. Хуже того, резистентные микроорганизмы выживают, распространяются по всем отраслям сельского хозяйства, могут переходить от одного вида к другому и в конце концов заражают человека. Вот почему в 2006 году Евросоюз наложил запрет на использование антибиотиков для стимулирования роста животных.
Вы можете подумать: если низкие дозы антибиотиков заставляют животных набирать вес, то не действуют ли они аналогичным образом и на нас? В конце концов, следы антибиотиков в окружающей среде обнаруживаются повсюду, в том числе в питьевой воде.
Чтобы это выяснить, Блейзер и его коллеги проверили, увеличивается ли вес мышей, получавших низкие дозы антибиотиков, по сравнению с обычными мышами. Оказалось, что это действительно так и антибиотики действуют на мышей так же, как и на домашний скот. Ученые также проверили, вызывают ли повторяющиеся курсы высоких доз антибиотиков (такие применяются, скажем, для лечения ушных инфекций у детей) рост массы тела у мышей. И вновь получили положительный ответ. Второй этап исследования Блейзер проводил вместе с эпидемиологами, изучающими тенденции в изменении здоровья популяции в целом. Их интересовало, не набирали ли избыточный вес в течение жизни люди, которых в раннем детстве лечили антибиотиками. И снова ответ был “да”: получение антибиотиков в первые шесть месяцев жизни четко коррелирует с избыточным весом. Как мы уже говорили во второй главе, антибиотики очень сильно влияют на развитие микрофлоры ребенка, и здесь может корениться связь с последующим ожирением.
Меня особенно беспокоит действие антибиотиков на микробиоту новорожденных. Даже короткое лечение их антибиотиками вызывает значительные изменения в составе кишечных бактерий. Самая большая опасность здесь, возможно, заключается в том, что антибиотики нарушают нормальный порядок заселения организма (его колонизацию) полезными бактериями Bifidobacterium. Эта колонизация играет важную роль в развитии иммунной системы ребенка. Тем самым применение антибиотиков на ранних этапах жизни повышает риск развития аллергии и астмы из-за уменьшения благотворного воздействия микробного сообщества. Одно крупное многоцентровое исследование показало связь между использованием антибиотиков в первый год жизни и симптомами астмы, риноконъюнктивита (сенной лихорадки) и экземы у детей в возрасте шести-семи лет. Раннее применение антибиотиков, возможно, играет также роль в стремительном росте аллергий на различные пищевые продукты у американских детей. Группа исследователей из Университета Чикаго недавно показала, что молодые мыши, получавшие антибиотики, более склонны к развитию аллергии на арахис. Но им помогает внесение определенных видов распространенных микроорганизмов рода клостридий, которые, по всей вероятности, блокируют попадание арахисовых белков в кровь животного.
Это вовсе не означает, что антибиотики вообще не нужно принимать. Они спасли и спасают множество жизней и во многих случаях представляют собой единственное эффективное лечение. По иронии судьбы, одна из самых больших проблем с антибиотиками заключается в их быстродействии – во многих случаях вы почти сразу испытываете облегчение. Отчасти этим объясняется, почему люди относятся к антибиотикам гораздо лучше, чем к вакцинам. Прививки делают, когда человек здоров, и они уменьшают риск заболеть в отдаленном будущем – у них отложенный и неявный эффект. Другое дело – антибиотики: вы больны уже сейчас, вам плохо, вы принимаете лекарство, и очень скоро вам становится лучше. Но здесь-то и кроется опасность – вы начинаете чувствовать себя лучше, но в вас еще множество бактерий, которые смогли пережить первые дозы препарата. Если вы, как только вам станет чуть полегче, прекращаете принимать антибиотик, то тем самым вы даете оставшимся бактериям шанс не только выжить, но и выработать полную устойчивость к нему. То есть в следующий раз этот антибиотик может уже не сработать, и вы будете продолжать болеть и при этом заражать окружающих. Поэтому не прекращайте прием антибиотиков раньше, чем предписано врачом: если вы начали, то должны пройти полный курс.
Ко всему прочему, мы усугубляем проблему неправильным выбором препарата. Я столкнулся с этим, когда моей дочке было около года. У нее была повторяющаяся стафилококковая инфекция – сыпь в области паха. Очередное обострение случилось под Новый год, и мы повезли ее в больницу, где выяснилось, что ее педиатр в отпуске. Новый доктор, осмотрев девочку, сказал, что это похоже на стафилококк. Я сказал, что, видимо, он прав, потому что в предыдущих двух случаях это действительно был стафилококк – и вот опять. С другой стороны, предположил доктор, возможен и стрептококк. В любом случае первая помощь будет одна и та же: принять амоксициллин. Доктор сказал, что они возьмут пробу и посеют культуру, и через три дня мы узнаем точный ответ. Мы получили рецепт, дали дочери лекарство, и раздражение прошло. Антибиотики – потрясающая штука, когда они работают.
Третьего января в восемь утра нас разбудил телефонный звонок доктора. Вернувшись на работу после праздников и просмотрев результаты лабораторных анализов, он обнаружил, что стафилококк нашей дочери устойчив к пенициллину. Поскольку в этом случае амоксициллин должен был быть неэффективен, доктор беспокоился, не ухудшилось ли состояние нашей девочки. Но амоксициллин тем не менее сработал, а годовалые дети слишком простодушны для того, чтобы на них действовал “эффект плацебо”.
Узнав, что сыпь все же прошла, доктор объяснил это тем, что лаборатория проводила тест на пенициллин, а амоксициллин все-таки от него отличается, хотя эти антибиотики относятся к одной группе. Возможно также, что устойчивый к антибиотику стафилококк находился только на поверхности, но не в глубине пузырьков сыпи.
Вся эта история показывает, насколько примитивны сегодняшние диагностические методы по сравнению с теми потрясающими вещами, которые мы умеем делать в лаборатории. Аппарат секвенирования ДНК, который стоит в том же здании, где находится моя лаборатория, мог бы выполнить те же самые анализы гораздо быстрее и выдать гораздо более детальные результаты. Больница не виновата: приборы и методы, которые мы используем в лаборатории, еще не получили одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Поскольку бактериальные инфекции могут угрожать жизни и не могут быть быстро диагностированы, антибиотики часто прописывают даже в тех случаях, когда вероятность, что болезнь вызвали именно те бактерии, против которых направлен антибиотик, достаточно низка. Если добавить к этому требования обеспокоенных пациентов или их родителей, а также “эффект плацебо”, то понятно, что антибиотики выписывают гораздо чаще, чем это действительно нужно. В какой-то мере это объяснимо: если считать, что антибиотики относительно безопасны, потому что они не наносят нашим организмам немедленного и очевидного вреда, то почему бы не выписывать их просто на всякий случай?
Однако лечение антибиотиками может иметь коварные долгосрочные последствия: с каждым приемом они становятся все менее эффективными и при этом способствуют появлению штаммов устойчивых резистентных бактерий, которые угрожают населению в целом. Кроме того, антибиотики широкого спектра действия, такие как амоксициллин и ципрофлоксацин, нацеленные на обширный спектр видов, уничтожают весь наш микробиом, а не только патогенные микроорганизмы, от которых мы пытаемся избавиться.
Вырваться из этого круга поможет только более качественная и быстрая диагностика. Уже разработана технология так называемой полимеразной цепной реакции (ПЦР), которая позволяет относительно быстро и с высокой достоверностью выявлять ряд патогенных микроорганизмов. Она особенно полезна в тех случаях, когда нужно отличить бактериальную инфекцию от вирусной, против которой антибиотики бессильны (вирусы имеют другую природу, чем бактерии, так что, если вы подхватили вирус, вам нужны соответствующие противовирусные препараты). Будем надеяться, что в ближайшем будущем эта технология перекочует из научно-исследовательских лабораторий в больницы.
Если у вас бактериальная инфекция, то для ответа на вопрос, насколько опасен данный штамм и устойчив ли он к антибиотикам, потребуется культивирование, антитела и анализ ДНК. Это займет несколько дней, а к тому времени может быть слишком поздно. Новые, более быстрые технологии, такие как лазерная масс-спектрометрия (использующая выгорание образца и очень точное взвешивание на молекулярном уровне) и усовершенствованное секвенирование ДНК, могут ускорить этот процесс и спасти многие жизни. Эти технологии уже на горизонте: пока что они имеются только в научно-исследовательских лабораториях, но уже через несколько лет можно будет провести клинические испытания и получить одобрение FDA. Пусть эти технологии не были доступны для моей дочери в начале ее жизни, но я настроен оптимистично: к тому времени, когда она вырастет, медицина станет гораздо умнее. Если мы сумеем использовать антибиотики только при необходимости и очень селективно, мы не только пролонгируем полезное действие антибиотиков, но и нанесем меньший ущерб своим микробиомам.
Назад: 5. Как взломать микробиом?
Дальше: 7. Будущее

