Книга: Эволюция. Классические идеи в свете новых открытий
Назад: Стресс помогает справиться с вредными мутациями
Дальше: Hox-гены обрели свободу — и змеи потеряли ноги
Надзор за надзирателями: кто присматривает за регуляцией развития
К билатериям (двусторонне-симметричным) относится большинство животных, в том числе черви, моллюски, членистоногие и хордовые. Специалисты по сравнительной анатомии и эмбриологии в течение прошлого века разработали несколько альтернативных теорий происхождения и ранней эволюции билатерий. Решить, какая из них ближе к реальности, помогли новые данные, в том числе молекулярно-генетические ( Малахов, 2004).
По современным представлениям, последний общий предок всех современных билатерий был сегментированным животным, имел вторичную полость тела ( цело́м) и, возможно, парные конечности ( параподии). Иными словами, из всех современных животных он был больше всего похож на кольчатого червя. Соответственно, кольчатые черви — наименее изменившиеся из всех его потомков, или, что то же самое, самые примитивныеиз современных билатерий. Это звучит удручающе непривычно для зоологов старой школы, которые привыкли считать самыми примитивными билатериями не кольчатых, а плоских червей. Однако эволюционные реконструкции, основанные на молекулярных данных, свидетельствуют о том, что плоские и круглые черви, устроенные проще кольчатых, произошли от более высокоорганизованных предков, т. е. подверглись вторичному упрощению.
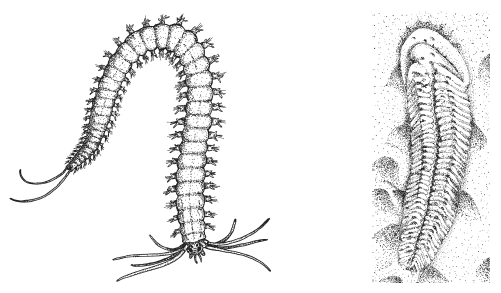 Современный кольчатый червьPlatynereis (слева) и загадочное ископаемое животноеSpriggina (вендский период, около 550 млн лет назад). Некоторые авторы сближают сприггину с предками билатерий, другие оспаривают такую трактовку.
Современный кольчатый червьPlatynereis (слева) и загадочное ископаемое животноеSpriggina (вендский период, около 550 млн лет назад). Некоторые авторы сближают сприггину с предками билатерий, другие оспаривают такую трактовку.
Подобно тому как ланцетник может служить живой упрощенной схемой хордовых (см. главу 5), кольчатые черви являются удобной моделью для изучения древнейших этапов эволюции билатерий.
Ранняя эволюция билатерий представляет особый интерес в связи с тем, что именно на этом этапе произошло радикальное усложнение и диверсификация планов строения и появилось много новых тканей и органов, в том числе центральная нервная система, разнообразные органы чувств, сквозной кишечник, специализированная мускулатура.
Чтобы понять, откуда взялись все эти новшества, необходимо прежде всего разобраться, как они возникают в онтогенезе современных животных. Дело тут не только в том, что индивидуальное развитие иногда отчасти воспроизводит («рекапитулирует») эволюционную историю, но и в том, что эволюция организма, как мы уже знаем, — это прежде всего эволюция программы индивидуального развития. Вопрос о том, как появились новые органы и ткани, сводится к вопросу об изменениях в программе онтогенеза, которые произошли у древних билатерий.
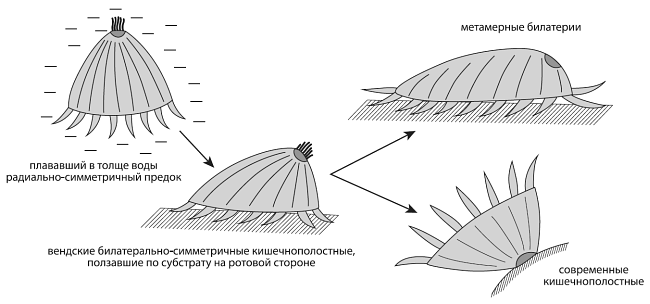 Схема происхождения билатерий по В. В. Малахову (2004).Темное пятнышко — орган равновесия (аборальный орган), маркирующий передний полюс развивающегося животного.
Схема происхождения билатерий по В. В. Малахову (2004).Темное пятнышко — орган равновесия (аборальный орган), маркирующий передний полюс развивающегося животного.
Важные шаги к пониманию этих изменений были сделаны в ходе изучения генов — регуляторов индивидуального развития животных, таких как Hox-гены. Наиболее очевидная функция белков, кодируемых этими генами, состоит в том, что они «размечают» эмбрион, определяя, где будет голова, а где хвост, где спина, а где брюхо, где расти ногам, а где быть границам между сегментами. Манипулируя работой белков-регуляторов, можно превратить, например, третий сегмент груди дрозофилы в дубликат второго, и тогда у мухи вырастет лишняя пара крыльев, можно превратить антенны в ноги или добиться появления зачатков конечностей на брюшных сегментах, где им быть не положено. Открытие сходных Hox-генов у разных типов животных заставило по-новому взглянуть на морфогенез животных и его преобразования в ходе эволюции. Стало ясно, что, изменив один ген (или только время и место его включения), можно трансформировать, создать, удалить или перенести в другое место сразу целый орган, сохранив при этом общий план строения.
Кроме регуляторных белков онтогенезом управляют маленькие молекулы РНК — микроРНК. Как и белки-регуляторы, микроРНК влияют на активность генов, причем под их контролем находятся также и гены, кодирующие те самые белки-регуляторы (как дополнительная система надзора за надзирателями). Во многих случаях удалось установить, какие именно гены регулируются теми или иными микроРНК, но как все это связано с конкретными планами строения билатерий и с их эволюцией, выяснить оказалось не так-то просто. Возможно, ключ к ответу на эти вопросы можно найти, исследуя работу микроРНК в ходе развития кольчатых червей.
Германские биологи изучили распределение микроРНК в органах и тканях развивающихся личинок кольчатых червей Platynereisи Capitella( Christodoulou et al., 2010). Для сравнения использовался морской еж Strongylocentrotus— представитель вторичноротых. Билатерии вскоре после своего появления подразделились на две группы — первичноротых и вторичноротых. К первым относятся кольчатые, плоские и круглые черви, моллюски, членистоногие и много всякой мелочи, ко вторым — иглокожие, полухордовые и хордовые. Обе группы билатерий — и первичноротые, и вторичноротые — сравнивались с представителем кишечнополостных актинией Nematostella, животным с радиальной симметрией.
Ранее было установлено, что у билатерий имеется более 30 уникальных микроРНК, которых нет у других организмов. Это подтвердилось в ходе поиска микроРНК у платинереиса. У этого червя обнаружилось 34 микроРНК, общих для первично- и вторичноротых. Значит, они уже имелись у последнего общего предка билатерий, но их не было у более древних радиально-симметричных предков (кроме одной-единственной микроРНК, которая называется miR-100 и которая есть у актинии).
Получается, что резкое усложнение организма и появление новых тканей у древних билатерий сопровождалось приобретением трех десятков новых микроРНК. Главный вопрос состоит в том, была ли между этими новоприобретениями связь. Если да, то следует ожидать, что в ходе онтогенеза у примитивных билатерий микроРНК распределяются неким закономерным образом по формирующимся тканям. Ранее это пытались изучить на «высших» животных, таких как членистоногие и хордовые, но картина получалась слишком сложная и запутанная.
Оказалось, что в ходе развития платинереиса микроРНК действительно четко распределены по дифференцирующимся тканям. В частности, древнейшая микроРНК miR-100 и три другие микроРНК обнаруживаются исключительно в двух группах клеток по обе стороны от личиночной глотки (передней кишки). Клетки при ближайшем рассмотрении оказались нейросекреторными. Это интересно, потому что у позвоночных одна из этих молекул (miR-375) маркирует нейросекреторные клетки гипофиза и поджелудочной железы, формирование которых в онтогенезе связано с передней кишкой.
У актинии экспрессия miR-100 обнаружилась в отдельных клетках вдоль края личиночного рта (бластопора), примерно в той области, которая по сравнительно-анатомическим данным соответствует передней кишке или глотке билатерий (предполагается, что у предков билатерий был щелевидный рот, как у некоторых кишечнополостных, который потом склеился посередине, оставив два отверстия по краям: они потом стали ртом и анусом).
У личинок червя Capitellaи морского ежа эти микроРНК тоже локализуются вокруг глотки. По-видимому, такая их локализация первична для билатерий, но у продвинутых животных, таких как членистоногие и хордовые, эти микроРНК расширили сферу своей деятельности и стали работать не только в передней кишке и связанных с ней нейросекреторных клетках, но и в других частях зародыша.
Личинки кольчатых червей, иглокожих и многих других билатерий плавают при помощи ресничных шнуров — полосок эпителиальных клеток, покрытых согласованно бьющимися ресничками. Три микроРНК (miR-29, miR-34, miR-92) у обоих исследованных червей и морского ежа оказались приуроченными к ресничным шнурам. У позвоночных эти микроРНК экспрессируются в нейронах, выстилающих желудочки мозга, причем некоторые из этих нейронов несут реснички.
Этот факт должен привести в восторг сравнительных анатомов и эмбриологов, которые давно говорили о тесной связи между ресничными шнурами и нервными стволами и о том, что нервная пластинка (из которой формируется спинная нервная трубка — зачаток центральной нервной системы хордовых) гомологична невротроху— ресничному шнуру, образующемуся у личинок билатерий на месте замкнувшегося щелевидного бластопора. Иными словами, клетки с ресничками, выстилающие желудочки мозга позвоночных, исторически восходят к невротроху. Поэтому то, что в них экспрессируются те же микроРНК, что и в невротрохе, показывает, что сравнительные анатомы XIX–XX веков не даром ели свой хлеб.
Два набора микроРНК оказались приуроченными к двум разным областям мозга. Один набор присутствует в нейросекреторной ткани верхней (дорзальной, спинной) части мозга. Те же самые микроРНК ранее были обнаружены в нейросекреторных клетках гипоталамуса у рыб. То, что гипоталамус находится в нижней (брюшной) части мозга, это правильно, потому что брюшная сторона хордовых гомологична спинной стороне других билатерий ( Малахов, 1996). Второй набор «мозговых» микроРНК у червей экспрессируется у оснований антенн — органов химического чувства. У мышей те же микроРНК приурочены к переднему мозгу, изначальной функцией которого у позвоночных была обработка обонятельной информации. Таким образом, здесь тоже наблюдается эволюционная преемственность.
Остальные микроРНК тоже оказались распределены закономерным образом по разным типам формирующихся тканей, причем были выявлены многочисленные параллели между их распределением у разных билатерий. Например, miR-124 приурочена к центральной нервной системе у насекомых и плоских червей, а у позвоночных — к нервным клеткам вообще. У платинереиса эта микроРНК экспрессируется только в центральной нервной системе — мозге и брюшной нервной цепочке. Другие микроРНК, у позвоночных экспрессирующиеся в некоторых органах чувств, у платинереиса тоже оказались приуроченными к органам чувств (глазам, антеннам, чувствительным придаткам параподий). МикроРНК miR-1 и miR-133 у кольчатых червей, как и у позвоночных, присутствуют только в развивающихся мышцах, и т. д.
Полученные результаты показывают, что одновременное появление у ранних билатерий новых тканей и новых микроРНК не было случайным совпадением. По-видимому, микроРНК изначально играли важную роль в дифференцировке тканей у билатерий. Их функции, однако, оказались более пластичными, чем у Hox-генов, и поэтому у высших билатерий «сфера влияния» многих микроРНК стала сильно отличаться от исходной.
Назад: Стресс помогает справиться с вредными мутациями
Дальше: Hox-гены обрели свободу — и змеи потеряли ноги

