Книга: Эволюция. Классические идеи в свете новых открытий
Назад: Вид из пробирки
Дальше: Встреча после разлуки
В поисках генов видообразования
Итак, постзиготическая изоляция возникает в результате фиксации несовместимых (конфликтующих) аллелей в разобщенных популяциях. Что же это за гены, изменения которых порождают такие конфликты? В принципе при скрещивании представителей двух давно разошедшихся популяций конфликтовать может что угодно с чем угодно. Но все-таки интересно было бы найти конкретные гены, ответственные за несовместимость. Для таких генов придумано броское название — « гены видообразования». Ясно, что в разных парах видов конфликтующие гены, скорее всего, будут разными. Несмотря на их несомненное присутствие у разошедшихся видов, идентифицировать их пока удается нечасто. Мы расскажем о нескольких таких удачных примерах.
Несколько генов видообразования нашли у дрозофил ( Orr et al., 2004). Как правило, это гены, так или иначе связанные с размножением. Например, один из них, OdsH, вызывает гибридную стерильность (бесплодие) у самцов, полученных от скрещивания Drosophila simulansи D. mauritiana— видов, разделившихся 0,3–1,0 млн лет назад. Функция гена состоит в регуляции экспрессии ряда других генов, участвующих в сперматогенезе. Многие гены видообразования несут следы действия положительного отбора. По-видимому, это значит, что постзиготическая несовместимость часто развивается под действием разнонаправленного отбора (как в эксперименте с дрожжами), а не просто за счет пассивного накопления нейтральных различий.
Что касается млекопитающих, то у них пока описан только один такой ген — Prdm9, ответственный за стерильность мужского потомства при скрещивании двух видов (или подвидов, случай спорный) домовых мышей: Mus musculusи Mus domesticus. То, что где-то на 17-й мышиной хромосоме есть «ген гибридной стерильности», конфликтующий с несколькими другими генами при межвидовых скрещиваниях, было известно давно, но установить его идентичность удалось лишь в 2008 году. С тех пор ген Prdm9активно изучают. При этом выяснилось много интригующих фактов. В частности, обнаружилась связь Prdm9со стерильностью не только у гибридных мышей, но и у других животных. Например, у людей мутации этого гена приводят к мужскому бесплодию.
Функцию Prdm9установили лишь в 2012 году. Оказалось, что ген отвечает за формирование «горячих точек рекомбинации» — мест, где хромосомы чаще всего рвутся, чтобы обменяться участками во время мейоза. В норме у мышей разрывы хромосом при подготовке к кроссинговеру происходят в нефункциональных частях генома, но, если работа Prdm9нарушена, хромосомы начинают рваться где попало, в том числе в регуляторных областях жизненно важных генов. Мыши с такими генетическими дефектами бесплодны, потому что у них не образуются жизнеспособные половые клетки ( Brick et al., 2012).
У растений выявлено около 40 генов видообразования. Как правило, это тоже гены, связанные с размножением — с созреванием пыльцы, ускорением или отсрочкой цветения, механизмами «узнавания» подходящей пыльцы тканями пестика (к этим механизмам относится и самонесовместимость, о которой мы говорили в главе 3). У растений признаки действия положительного отбора на гены видообразования тоже есть, но не такие четкие, как у дрозофил. Возможно, случайные процессы играют в видообразовании у растений более важную роль ( Rieseberg, Blackman, 2010).
Один из интересных случаев связан с домашним рисом (см. главу 2). Согласно данным археологии и генетики, азиатский культурный рис Oryza sativaбыл одомашнен на юге Китая 9 тыс. лет назад ( Molina et al., 2011). С тех пор было выведено много сортов, подразделяющихся на две большие группы: O. s. indica(длиннозерные сорта) и O. s. japonica(круглозерные).
«Индийские» и «японские» сорта разделились не менее 3–4 тыс. лет назад и с тех пор эволюционировали аллопатрически, т. е. выращивались в разных районах, почти не скрещиваясь друг с другом. За это время в их генофондах успели накопиться взаимно несовместимые мутации, что привело к частичной репродуктивной изоляции, а именно к снижению плодовитости гибридов indicaи japonica. Это можно рассматривать как наметившееся разделение азиатского культурного риса на два вида.
Несовместимость indicaи japonicaопределяется несколькими локусами, структура и функция которых активно изучаются. Китайским генетикам удалось в общих чертах расшифровать принцип действия одного из «локусов несовместимости» S5( Yang et al., 2012). Локус включает пять белок-кодирующих генов: ORF1, ORF2, ORF3, ORF4и ORF5(от open reading frame, открытая рамка считывания — так по традиции обозначают плохоизученные гены с неизвестной функцией). У локуса S5есть три варианта (аллеля), один из которых ( S5i) характерен для большинства сортов indica, другой ( S5j) — для japonica, а третий ( S5n) — для некоторых сортов, которые дают нормальное плодовитое потомство при скрещивании как с индийскими, так и с японскими сортами. Было показано, что, если вставить в геном japonicaген ORF5 indica, получаются растения с пониженной плодовитостью. Если то же самое проделать с генами ORF3и ORF4, плодовитость растений не снижается.
Этого недостаточно, чтобы понять, как работает локус S5и почему аллели S5iи S5jплохо сочетаются друг с другом. Для выяснения этого вопроса авторы скрещивали в разных сочетаниях многочисленные сорта риса (как обычные, так и трансгенные), оценивали плодовитость гибридов, подсчитывали соотношение разных генотипов в гибридном потомстве и, конечно же, сравнивали нуклеотидные последовательности локуса S5у разных сортов.
Выяснилось, что гены ORF1и ORF2одинаковы у всех сортов, а значит, не в них причина несовместимости. Ген ORF3кодирует белок, похожий на белок теплового шока, — шаперон Hsp70. Такие белки защищают клетку от различных стрессов. У indicaген ORF3в рабочем состоянии, у japonicaв нем произошла делеция (выпало 13 нуклеотидов), и поэтому белок ORF3утратил функциональность.
Белок ORF4, кодируемый геном ORF4, в норме располагается на мембране мегаспор (клеток, из которых у цветковых растений образуется зародышевый мешок, а после оплодотворения — семя). ORF4является рецептором, т. е. реагирует на какое-то вещество, находящееся снаружи от клеточной мембраны, и передает сигнал внутрь клетки. У indica ORF4испорчен мутацией, у japonicaон в рабочем состоянии.
Наконец, ORF5является ферментом (аспартатной протеазой) и в норме выделяется клеткой во внешнюю среду. Там он участвует в синтезе сигнального вещества, на которое реагирует рецептор ORF4. У indica ORF5активен, у japonica— нет.
Таким образом, генотип indicaможно обозначить как 3+4−5+, japonica— как 3−4+5−. Механизм действия этих генов, объясняющий пониженную плодовитость гибридов, показан на рисунке. Белки 5+ и 4+, действуя сообща, выступают в роли «убийц», а белок 3+ является «защитником».
Сигнальное вещество, синтезируемое при участии белка 5+, воспринимается рецептором 4+, что приводит (по неизвестной пока причине) к нарушению работы важной внутриклеточной структуры (эндоплазматической сети). Если в клетке есть белок-защитник 3+, клетка останется жива. Если же белок 3+ отсутствует, в клетке включится программа клеточной смерти (апоптоза), и клетка погибнет. Именно это и происходит с половиной будущих семян у гибридов indicaи japonica. Погибают мегаспоры, унаследовавшие от гибридного родительского организма генотип japonica, в котором нет гена-защитника 3+, зато есть ген 4+, позволяющий белку 5+ довести клетку до самоубийства.
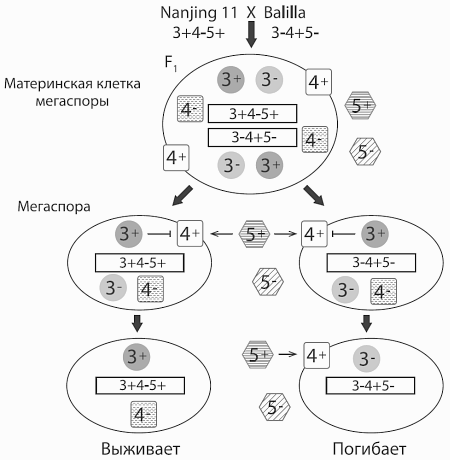 Схема, объясняющая пониженную плодовитость гибридного потомства от скрещивания сортовNanjing 11 (indica, генотип 3+4−5+) иBalilla (japonica, генотип 3−4+5−). Материнская клетка (диплоидная) дает в результате мейоза четыре гаплоидные мегаспоры. Материнская клетка, как и все гибридное растение, гетерозиготна по трем рассматриваемым генам и поэтому содержит как рабочие(3+, 4+, 5+) , так и нерабочие(3−, 4−, 5−) варианты трех белков. В результате мейоза из нее образуются гаплоидные мегаспоры двух типов: с генотипомindica и с генотипомjaponica (генотипы не перекомбинируются, потому что все три гена расположены вплотную друг к другу на хромосоме). Поначалу в мегаспорах сохраняются все шесть белков, унаследованных от материнской клетки, но впоследствии в них остаются только белки, закодированные в геноме самой мегаспоры. При этом белок5+ , выделяющийся в межклеточное пространство, действует на все мегаспоры независимо от того, закодирован ли он в их геноме. Мегаспоры с генотипомjaponica погибают, потому что на них действуют совместно оба белка-убийцы5+ и4+ , а белка-защитника3+ у них нет. Мегаспоры с генотипомindica выживают, потому что у них нет убийцы4+ и есть защитник. ИзYang et al., 2012 .
Схема, объясняющая пониженную плодовитость гибридного потомства от скрещивания сортовNanjing 11 (indica, генотип 3+4−5+) иBalilla (japonica, генотип 3−4+5−). Материнская клетка (диплоидная) дает в результате мейоза четыре гаплоидные мегаспоры. Материнская клетка, как и все гибридное растение, гетерозиготна по трем рассматриваемым генам и поэтому содержит как рабочие(3+, 4+, 5+) , так и нерабочие(3−, 4−, 5−) варианты трех белков. В результате мейоза из нее образуются гаплоидные мегаспоры двух типов: с генотипомindica и с генотипомjaponica (генотипы не перекомбинируются, потому что все три гена расположены вплотную друг к другу на хромосоме). Поначалу в мегаспорах сохраняются все шесть белков, унаследованных от материнской клетки, но впоследствии в них остаются только белки, закодированные в геноме самой мегаспоры. При этом белок5+ , выделяющийся в межклеточное пространство, действует на все мегаспоры независимо от того, закодирован ли он в их геноме. Мегаспоры с генотипомjaponica погибают, потому что на них действуют совместно оба белка-убийцы5+ и4+ , а белка-защитника3+ у них нет. Мегаспоры с генотипомindica выживают, потому что у них нет убийцы4+ и есть защитник. ИзYang et al., 2012 .
Что касается сортов, которые свободно скрещиваются и с indica, и с japonica, то у них могут быть разные генотипы, например, 3−4−5− или 3+4+5−. Несовместимость проявляется, только когда с носителем аллеля 5+ скрещивается растение с генами 3− и 4+. Тогда у половины мегаспор не окажется защитника (3+) от действующих совместно «убийц» 5+ и 4+.
Для диких родственников культурного риса, в том числе для предкового вида Oryza rufipogon, характерен генотип 3+4+5+, т. е. активны и оба «убийцы», и «защитник». Скорее всего, такой же генотип был и у первых одомашненных сортов риса. Вероятно, у диких предков все три гена зачем-то нужны (хотя мы пока не знаем зачем), а переход к «культурной» жизни на возделываемых полях сделал их излишними. Впоследствии у двух групп сортов, indicaи japonica, закрепились мутации, выводящие из строя некоторые гены этого комплекса. Внутри каждой группы мутации были взаимно совместимыми, потому что несовместимые комбинации, такие как 3−4+5+, отсеивались отбором. Но отбор не проверял мутации, закрепившиеся в одной группе, на совместимость с мутациями, закрепившимися в другой. Так и возникла частичная постзиготическая несовместимость между сортами — в полном согласии с моделью Добжанского — Мёллера.
—————Ранние этапы видообразования могут сопровождаться геномными перестройкамиКрупные геномные перестройки, такие как разрыв или слияние хромосом, могут привести к быстрому развитию постзиготической изоляции. Часто особи с разным числом хромосом либо вовсе не могут произвести потомство либо это потомство будет бесплодным. У гибридов первого поколения, получивших от отца и матери разное количество хромосом, в ходе мейоза хромосомы не могут должным образом разбиться на пары и распределиться по половым клеткам; в результате гибриды оказываются бесплодными.Но это, конечно, не абсолютное правило. Будь оно абсолютным, все мутации, меняющие число хромосом, немедленно отсеивались бы отбором, а мы знаем, что это не так. Различия в числе хромосом не всегда препятствуют их нормальному спариванию в ходе мейоза. Хромосомы просто соединяются гомологичными участками: например, две половинки разорвавшейся хромосомы могут пристроиться к соответствующим половинкам своего неразорванного прототипа. И тогда гибридная особь произведет жизнеспособные половые клетки.Есть виды, у которых число хромосом варьирует, а особи с разным числом хромосом сохраняют генетическую совместимость. Впрочем, такая ситуация вряд ли может сохраняться долго: плодовитость гибридов, скорее всего, будет все-таки понижена, поэтому отбор будет способствовать выработке дополнительных изолирующих механизмов. В итоге родительский вид разделится на два дочерних, различающихся по числу хромосом. Или измененный кариотип(хромосомный набор) будет отсеян отбором, и вид сохранит исходное число хромосом.Межвидовая изменчивость по числу хромосом встречается гораздо чаще, чем внутривидовая. Например, у человека 23 пары хромосом, а у шимпанзе и других человекообразных — 24. Вторая хромосома человека возникла в результате слияния двух предковых хромосом, причем в месте слияния остался «шрам», который ни с чем не спутаешь: две расположенные «голова к голове» последовательности, типичные для концевых участков хромосом (теломер).Если не учитывать многочисленные случаи полиплоидии, то самая большая вариабельность по числу хромосом среди видов одного рода наблюдается у бабочек-голубянок Agrodiaetus. В пределах этого рода диплоидное число хромосом варьирует от 20 до 268, хотя род появился и начал дивергировать недавно: 2,5–3,8 млн лет назад ( Lukhtanov et al., 2005) и все его виды очень похожи друг на друга. У позвоночных изменчивость тоже может быть значительной: например, у сомиков Corydorasдиплоидное число хромосом колеблется от 44 до 102, у южноамериканских грызунов туко-туко ( Ctenomys) — от 10 до 70.Каким образом у недавно разделившихся видов формируются такие сильные различия по числу хромосом, если внутривидовая хромосомная изменчивость — явление довольно редкое? Возможны два сценария.Во-первых, различия могут накапливаться постепенно, причем каждая перестройка (слияние или разрыв хромосом) соответствует одному акту видообразования. Такое «пошаговое» формирование межвидовых хромосомных различий, по-видимому, широко распространено в природе. Его начальные этапы можно наблюдать у некоторых видов с варьирующим числом хромосом, таких как домовая мышь и обыкновенная бурозубка.Но возможен и другой сценарий: кратковременный взрывообразный рост хромосомной изменчивости внутри вида, за которым следует быстрое разделение исходного вида на несколько дочерних. Этот второй сценарий недавно удалось подтвердить В. А. Лухтанову из Зоологического института в Санкт-Петербурге и его испанским коллегам ( Lukhtanov et al., 2011). Исследователи описали удивительный случай высокого хромосомного полиморфизма в пределах одного вида бабочек, горошковой беляночки Leptidea sinapis. Этот вид встречается от Португалии и Испании на западе до Сибири на востоке.Оказалось, что число хромосом у бабочек этого вида убывает с запада на восток — от 2n = 106 в испанских популяциях до 2n = 56 в Восточном Казахстане. Кроме того, число хромосом может варьировать в одной и той же популяции (такое наблюдается в Италии, Румынии и Казахстане).Большинство особей в этих популяциях являются хромосомными гетерозиготами. Это значит, что они получили разное число хромосом от отца и матери. В ходе мейоза у них образуются наряду с обычными бивалентами (парами соединившихся гомологичных хромосом) еще и триваленты(две хромосомы из одного набора спариваются с одной хромосомой из другого). Эти триваленты затем нормально разделяются и расходятся по дочерним клеткам. Судя по обилию хромосомных гетерозигот, они не отсеиваются отбором (или отсеиваются медленно), т. е. потомство родителей с разным числом хромосом имеет нормальную приспособленность.Сравнение нуклеотидных последовательностей митохондриальных и ядерных генов подтвердило, что между особями и популяциями с разным числом хромосом нет существенных генетических различий: это действительно один и тот же вид, а не комплекс из нескольких «скрытых видов» или видов-двойников. По оценкам авторов, последний общий предок всех изученных популяций жил от 8500 до 31 000 лет назад. По-видимому, быстрый рост численности и расселение Leptidea sinapisпо обширным территориям были приурочены к завершению последнего ледникового максимума, причем экспансия сопровождалась взрывообразным ростом хромосомной изменчивости.
 У горошковой беляночки (Leptidea sinapis ) число хромосом варьирует от 56 в восточной части ареала до 106 в западной, что не мешает этим бабочкам сохранять генетическую совместимость.
У горошковой беляночки (Leptidea sinapis ) число хромосом варьирует от 56 в восточной части ареала до 106 в западной, что не мешает этим бабочкам сохранять генетическую совместимость.
Тот факт, что число хромосом варьирует не хаотически, а закономерно убывает с запада на восток, едва ли может быть случайностью. Причины такой клинальной изменчивостипока неизвестны, так же как и то, откуда и в каком направлении расселялись бабочки. Хотя особи, живущие по соседству, сохраняют генетическую совместимость невзирая на различия в числе хромосом, вполне возможно, что бабочки из удаленных популяций, у которых число хромосом различается очень сильно, уже стали частично или полностью несовместимыми (это еще предстоит проверить).Так или иначе, исследование показало, что быстрый рост внутривидовой изменчивости по числу хромосом — реальное явление. Какую роль оно играет в видообразовании — опять-таки покажут дальнейшие исследования, а пока можно лишь констатировать, что теоретически эта роль может быть значительной. Помимо того что хромосомные перестройки могут стать непосредственной причиной постзиготической изоляции, они могут способствовать этому косвенно — через ослабление рекомбинации (обмена участками) перестроенных хромосом в процессе кроссинговера.Схожее явление обнаружено недавно у коловраток Brachionus plicatilis. Эти крошечные (0,3 мм в длину) существа обитают в соленых озерах по всему миру и используются как корм для мальков аквариумных рыбок. Коловратки Brachionusв последнее время стали популярным лабораторным объектом (в главе 3 рассказано об эволюционном эксперименте с ними).Что касается вида B. plicatilis, то он привлекает внимание исследователей как раз тем, что на нем удобно изучать ранние этапы видообразования. B. plicatilisявляется единым видом только на первый взгляд. В действительности этих коловраток правильнее считать комплексом «скрытых» (криптических) видов, или видов-двойников, которые начали дивергировать несколько миллионов лет назад.В зависимости от применяемых критериев классификации число видов в комплексе B. plicatilisоказывается разным. Биологи чаще всего используют три концепции вида: морфологическую(вид как совокупность особей с похожим строением), генеалогическую(вид как обособленная ветвь на эволюционном дереве) и биологическую(по признаку наличия или отсутствия репродуктивной совместимости).На основе морфологической концепции эти коловратки были описаны как один вид. Генеалогический подход, основанный на сравнении ДНК, позволил разным авторам выделить от 14 до 22 видов-двойников, которые по морфологии либо вообще неразличимы, либо для их определения требуются большие выборки и изощренный статистический анализ. При этом некоторые из видов-двойников отличаются друг от друга по своим экологическим характеристикам: они приспособились к разной температуре и солености.Применение критерия репродуктивной совместимости требует экспериментов по скрещиванию коловраток из разных популяций. Таких экспериментов пока проведено немного, но уже ясно, что «биологических» видов в этом комплексе больше, чем «морфологических», но меньше, чем «генеалогических». Три основных клады (A, B и C) полностью изолированы друг от друга: не дают гибридного потомства и, как правило, даже не спариваются. Однако между представителями многих «генеалогических видов», относящихся к одной и той же кладе, возможна гибридизация.Австрийские биологи определили размер генома у представителей зз популяций В. plicatilisиз разных районов мира ( Stelzer et al., 2011). Размер генома у животных меняется в основном за счет разрастания или сокращения некодирующих участков ДНК. Обычно эти изменения мало влияют на приспособленность, т. е. являются нейтральными.Изученные коловратки относятся к 12 «генеалогическим» видам. Размах выявленной изменчивости по размеру генома оказался поистине потрясающим. Оказалось, что в разных популяциях он может различаться более чем в семь раз: от 55 до 407 млн пар нуклеотидов!Значительные различия по размеру генома не являются непреодолимым препятствием для гибридизации. Например, два генеалогических вида, для которых ранее была показана репродуктивная совместимость, различаются по размеру генома в 1,4 раза (71,4 млн п. н. и 99,1 млн п. н.) Выяснилось также, что размер генома положительно коррелирует, во-первых, с размером животных, во-вторых — с размером их яиц. Оба признака могут иметь адаптивное значение, т. е. влиять на выживаемость коловраток в различных условиях.С одной стороны, известно, что размер генома, как правило, положительно коррелирует с размером клеток. С другой, для коловраток характерно фиксированное количество клеток во взрослом организме. Из этого следует, что изменение размера генома может быть для коловраток удобным способом быстро изменить размер своего тела, если такое изменение почему-либо оказывается для них выгодным.Обе работы оставляют больше вопросов, чем дают ответов, но это общее свойство новаторских исследований. Ясно, что на ранних этапах видообразования может расти изменчивость по таким «крупномасштабным» характеристикам, как число хромосом и размер генома. О причинах и роли этих изменений пока можно лишь гадать. Кроме того, обе работы наводят на мысль, что как число хромосом, так и размер генома иногда могут иметь адаптивное значение и эволюционировать под действием отбора.—————
Назад: Вид из пробирки
Дальше: Встреча после разлуки

