Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 12.2. Энергетика реакций
Дальше: 13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
12.3. Обратимость реакций
Химическая реакция называется обратимой, если в данных условиях протекает не только прямая реакция (→), но также и обратная реакция т. е. из исходных веществ образуются продукты и одновременно из продуктов получаются реагенты:
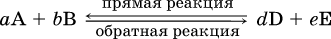
Обратимые реакции не доходят до конца. Концентрации реагентов уменьшаются, что приводит к уменьшению скорости прямой реакции 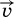 . Скорость же обратной реакции
. Скорость же обратной реакции 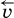 постоянно возрастает, поскольку увеличиваются концентрации продуктов.
постоянно возрастает, поскольку увеличиваются концентрации продуктов.
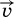
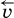
Когда скорости прямой и обратной реакций станут одинаковыми (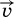 =
= 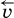 ), наступит состояние химического равновесия, при котором не происходит дальнейшего изменения концентраций реагентов и продуктов.
), наступит состояние химического равновесия, при котором не происходит дальнейшего изменения концентраций реагентов и продуктов.
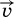
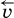
В состоянии равновесия концентрации реагентов и продуктов постоянны, их называют равновесными концентрациями и обозначают [А], [В], [D] и [Е], в отличие от концентраций сА, св, cD и сЕ в любой другой момент времени. Установлено, что:
В состоянии равновесия произведение концентраций продуктов в степенях, равных стехиометрическим коэффициентам, деленное на такое же произведение концентраций реагентов, есть величина постоянная при T = const.
Такое соотношение обозначают Кс и называют константой равновесия данной реакции:
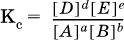
Это выражение носит название равновесный закон действующих масс (К. Гулльберг, П. Воге, 1867).
Значение Кс характеризует состояние равновесия в данной реакции и определяется соотношением концентраций, т. е. величина Кс не зависит от каждой в отдельности равновесной концентрации – [А], [В], [D] или [Е].
Химическое равновесие не означает, что наступило состояние покоя. Прямая и обратная реакции протекают и в состоянии равновесия, но с одинаковой скоростью. Поэтому оно называется подвижным (динамическим) равновесием.
Подвижное химическое равновесие можно нарушить, оказывая на систему внешнее воздействие и тем самым изменяя условия протекания реакции – температуру, давление, концентрацию. При любом нарушении (сдвиге) химического равновесия система перейдет (сместится) в другое состояние равновесия.
Влияние условий на смещение химического равновесия определяется принципом, который установлен французским ученым A.-Л. Ле-Шателье (1884).
Современная формулировка принципа смещения равновесия, называемого принципом Ле-Шателье:
При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
Рассмотрим подробнее влияние таких факторов, как температура, давление, концентрация, на смещение равновесия.
1. Температура. Повышение температуры смещает равновесие обратимой реакции в сторону процесса, идущего с поглощением теплоты (эндотермическое направление), а понижение температуры – в сторону процесса, идущего с выделением теплоты (экзотермическое направление).
Для экзотермической реакции:
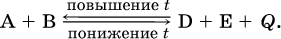
Для эндотермической реакции:
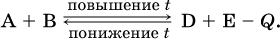
Значение Кс обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (→) и обратной (←) реакций по-разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры:
Kc = ƒ(t)
Примеры:
а) повышение температуры (нагревание):
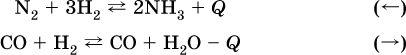
б) понижение температуры (охлаждение):
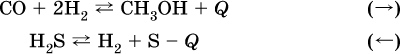
2. Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров).
Увеличение давления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшением объема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением объема:
а)
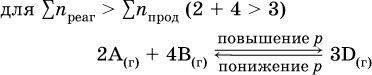
б)
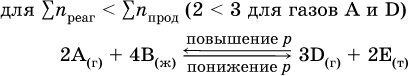
При Σnреаг = Σnпрод изменение не вызовет смещения равновесия.
Примеры гомогенных реакций:
а) увеличение давления (сжатие):
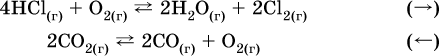
б) уменьшение давления (расширение):
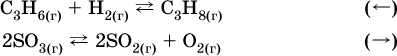
Примеры гетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются):
а) увеличение давления (сжатие):
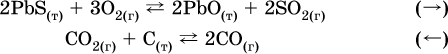
б) уменьшение давления (расширение):
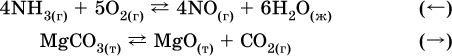
В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах):
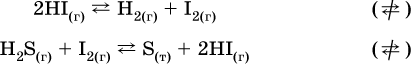
сдвиг равновесия наблюдаться не будет.
3. Концентрация. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации этого вещества равновесие смещается в сторону образования данного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия.
Для некоторой реакции:
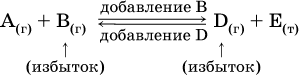
Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество).
Этот вывод следует непосредственно из равновесного закона действующих масс:
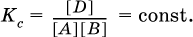
При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным Кс. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен).
Примеры:
а) при добавлении аммиака равновесие сместится вправо:
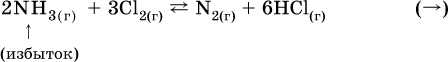
б) при добавлении водорода равновесие сместится влево:
Примеры заданий части А
1. Гетерогенные реакции – это
1) Н2 + I2(г) → HI
2) Fe2(SO4)3(т) → Fe2O3(T) + SO3
3) Zn + H2SO4 → ZnSO4 + H2↑
4) CO + H2 → CO + H2O (nap)
2. При взаимодействии H2 с Cl2, Br2 и I2 в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции
1) выше для I2
2) выше для Cl2
3) одинакова
4) выше для Br2
3. Для гомогенной реакции А + В →… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет
1) в 2 раза
2) в 3 раза
3) в 6 раз
4) в 9 раз
4—6. Скорость реакции
4. 2CuО(т) + СО →…
5. 2FeO(т) + С(т) →…
6. N2 + 2С(т) + Н2 →…
при V = const и увеличении количества веществ в 4 раза изменится так:
1) возрастет в 4 раза
2) возрастет в 8 раз
3) возрастет в 16 раз
4) не изменится
7—8. Равновесие смещается вправо (→) при
7. нагревании
8. охлаждении реакционных систем
1) 2СО + O2  2СO2 + Q
2СO2 + Q
2) 2HI +  Н2 + I2 – Q
Н2 + I2 – Q
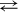
3) N2 + O2 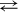 2NO – Q
2NO – Q
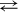
4) 2Н2 + O2 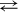 2Н2O + Q
2Н2O + Q
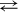
9. Равновесие реакции этерификации СН3СООН + С2Н5ОН 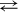 СН3СООС2Н5 + Н2O + Q
СН3СООС2Н5 + Н2O + Q
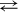
можно сдвинуть вправо (→)
1) добавлением серной кислоты
2) добавлением едкого натра
3) нагреванием
4) добавлением воды
10. Равновесие в гетерогенной реакции СаО(ст) + СО2 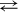 СаСO3(т) + Q сместится влево (←) при
СаСO3(т) + Q сместится влево (←) при
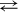
1) добавлении СаО
2) добавлении СаСO3
3) сжатии
4) нагревании
11. Выход продукта в реакции CaS(т) + 2O2 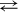 CaSO4(т) + Q
CaSO4(т) + Q
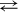
можно увеличить
1) добавлением CaS
2) нагреванием
3) введением катализатора
4) повышением давления
12. Доменный процесс Fe2O3 + ЗСО 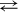 2Fe + ЗСO2 сопровождается экзо-эффектом, следовательно, при охлаждении выход продуктов
2Fe + ЗСO2 сопровождается экзо-эффектом, следовательно, при охлаждении выход продуктов
1) увеличивается
2) уменьшается
3) не изменяется
4) не знаю
Назад: 12.2. Энергетика реакций
Дальше: 13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей

