Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 12.1. Скорость реакций
Дальше: 12.3. Обратимость реакций
12.2. Энергетика реакций
Любая реакция сопровождается выделением или поглощением энергии в форме теплоты. В исходных веществах химические связи разрываются, и на это энергия затрачивается (т. е. она при этом поглощается системой), в продуктах же, наоборот, химические связи образуются, и при этом энергия выделяется. Разность между затраченной и выделившейся энергией называется тепловым эффектом химической реакции (обозначается Q). Если затрата энергии выше, чем ее выделение, то тепловой эффект будет отрицательным, или эндо-эффектом (-Q) в противном случае – положительным, или экзо-эффектом (+Q).
Тепловой эффект является внешним признаком реакций, в термохимических уравнениях он указывается после продуктов:
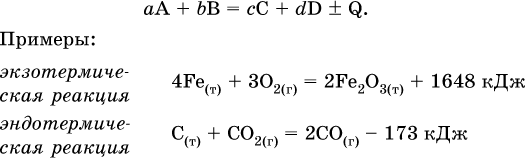
Такая запись означает, что при сгорании 4 моль железа в 3 моль кислорода с образованием 2 моль оксида железа (III) выделяется 1648 кДж теплоты, а при взаимодействии 1 моль углерода (в виде кокса) и 1 моль углекислого газа с получением 2 моль угарного газа поглощается извне 173 кДж теплоты.
Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку. Например, реакция
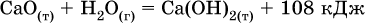
(обработка 1 моль оксида кальция водяным паром в количестве 1 моль с образованием 1 моль гидроксида кальция) сопровождается экзо-эффектом Q = +108 кДж, тогда как обратная реакция
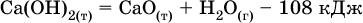
(разложение 1 моль гидроксида кальция на 1 моль оксида кальция и 1 моль водяного пара) сопровождается эндо-эффектом Q = -108 кДж.
При протекании реакций (особенно с участием газов) могут существенно меняться объем и температура реакционной системы. Если тепловой эффект определяется при постоянном давлении (1 атм для каждого газа в системе, а при отсутствии газов общее давление 1 атм) и постоянной температуре (обычно 298 К, или 25 °C), то он отвечает стандартной энтальпии реакции, характеризующей в целом всю систему (функция системы). Энтальпия реакции обозначается ΔН°, знак ΔН° противоположен знаку Q:
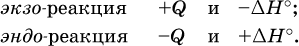
Значение ΔН° записывается после уравнения и отделяется от него запятой:
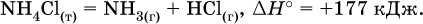
Реакции, протекающие с высоким экзо-эффектом, часто требуют только начального нагревания (инициирования), а далее протекают самопроизвольно, например процесс алюминотермии:
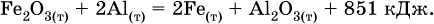
Помимо энтальпии, химическая система характеризуется еще одной функцией – стандартной энтропией реакции ΔS° (кДж/К), связанной с неупорядоченностью системы (степенью беспорядка). Чем больше частиц в системе и чем выше ее температура, тем больше степень беспорядка. В идеальном кристалле (при абсолютном нуле температуры) степень беспорядка нулевая (идеальный порядок), в реальных твердых телах существует всегда некоторая степень беспорядка, в жидкостях она уже выше, но наибольшая степень беспорядка в газах, где молекулы не зависят друг от друга и двигаются весьма хаотично. Например, для льда, жидкой воды и водяного пара значения ΔS° равны соответственно 0,039, 0,07 и 0,189 кДж/К.
Всякая химическая реакция, таким образом, имеет две энергетические характеристики – энтальпию ΔН° и энтропию ΔS°. Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет теплопередачи в окружающую среду и одновременно к увеличению степени беспорядка. Эти факторы действуют в противоположных направлениях, поэтому результирующая величина будет равна их разности:
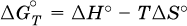
(здесь энтропия умножена на температуру для адекватности единиц, ΔН° и TΔS° приведены в килоджоулях, так как К кДж/К = кДж).
Суммарная энергетическая функция системы называется стандартной энергией Гиббса реакции ΔG°T, индекс Т подчеркивает зависимость этой величины от температуры, что очевидно из уравнения (отметим еще, что ΔН° и ΔS° мало зависят от температуры).
По значениям G°T можно судить о возможности протекания реакций в направлении слева направо по химическому уравнению:
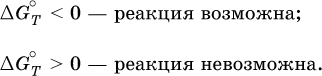
Например, синтез аммиака
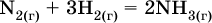
при 25 °C возможен:
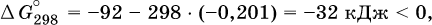
а при 350 °C невозможен:
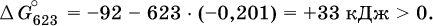
Следовательно, при 25 °C имеется принципиальная возможность получения аммиака, а при сильном нагревании системы (реакция экзотермическая, ΔН° = -92 кДж) аммиак получить не удастся. Правда, при 25 °C реакция возможна только в принципе, так как она протекает очень медленно и с малым выходом. Ускорение реакций определяется факторами химической кинетики, а увеличение степени протекания – соответствующим смещением химического равновесия.
Назад: 12.1. Скорость реакций
Дальше: 12.3. Обратимость реакций

