Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 10.2. Альдегиды и кетоны
Дальше: 10.4. Углеводы
10.3. Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН (карбоксил).
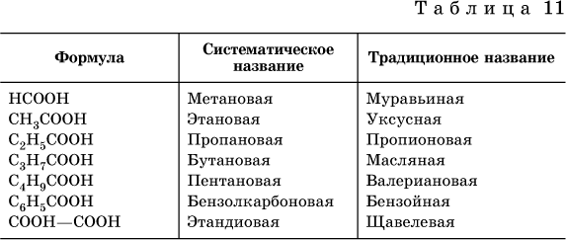
Формулы и названия некоторых распространенных карбоновых кислот приведены в табл. 11.
Традиционные названия кислот НСООН (муравьиная), СН3СООН (уксусная), С6Н5СООН (бензойная) и (СООН)2 (щавелевая) рекомендуется использовать вместо их систематических названий.
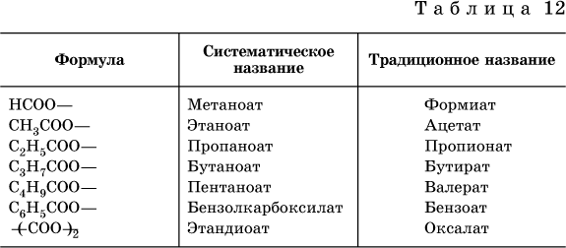
Формулы и названия кислотных остатков приведены в табл. 12.
Для составления названий солей этих карбоновых кислот (а также их сложных эфиров, см. ниже) обычно используются традиционные названия, например:
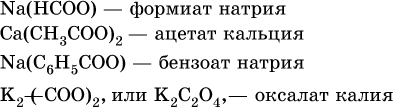
Низшие карбоновые кислоты – бесцветные жидкости с резким запахом. При увеличении молярной массы температура кипения возрастает.
Карбоновые кислоты обнаружены в природе:

Простейшие карбоновые кислоты растворимы в воде, обратимо диссоциируют в водном растворе с образованием катионов водорода:
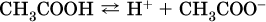
и проявляют общие свойства кислот:
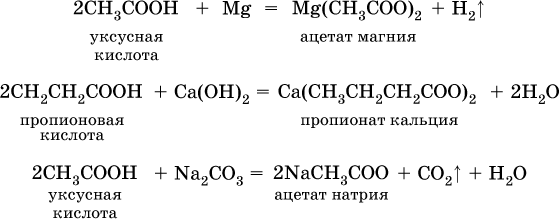
Важное практическое значение имеет взаимодействие карбоновых кислот со спиртами (подробнее см. ниже):
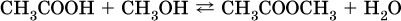
Отметим, что кислота НСООН вступает в реакцию «серебряного зеркала» как альдегиды:
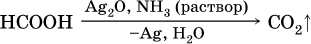
и разлагается под действием водоотнимающих реактивов:
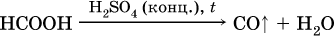
Получение:
• окисление альдегидов:
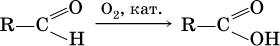
• окисление углеводородов:
а)
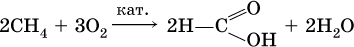
б)
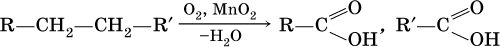
Кроме того, муравьиную кислоту получают по схеме:
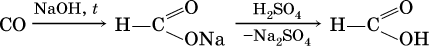
а уксусную кислоту – по реакции:
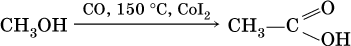
Применяют муравьиную кислоту как протраву при крашении шерсти, консервант фруктовых соков, отбеливатель, дезинфекционный препарат. Уксусную кислоту используют как сырье в промышленном синтезе красителей, медикаментов, ацетатного волокна, негорючей кинопленки, органического стекла. Натриевые и калиевые соли высших карбоновых кислот – основные компоненты мыла.
Сложные эфиры – продукты обменного взаимодействия карбоновых кислот со спиртами. Это взаимодействие называется реакцией этерификации:

Механизм реакции этерификации был установлен при использовании спирта, меченного изотопом 18O; этот кислород после реакции оказался в составе эфира (а не воды):
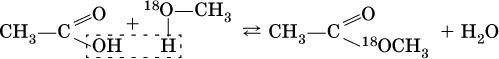
Следовательно, в отличие от реакции нейтрализации неорганической кислоты щелочью (Н+ + ОН- = Н2O), в реакции этерификации карбоновая кислота всегда отдает группу ОН, спирт – атом Н (образуется вода). Реакция этерификации обратима; она лучше протекает в кислотной среде, обратная реакция (гидролиз, омыление) – в щелочной среде.
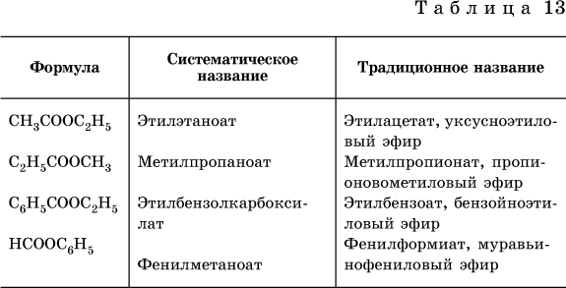
Формулы и названия распространенных сложных эфиров приведены в табл. 13.
Среди сложных эфиров есть бесцветные низкокипящие горючие жидкости с фруктовым запахом, например:
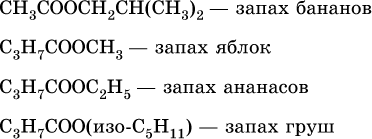
Используются сложные эфиры как растворители для лаков, красок и нитратов целлюлозы, носители фруктовых ароматов в пищевой промышленности.
Сложные эфиры трехатомного спирта – глицерина и высших карбоновых кислот (в общем виде RCOOH), например с формулами и названиями:
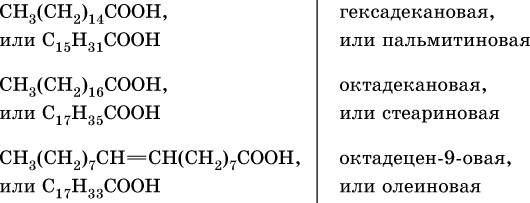
носят названия жиров. Примером жира будет смешанный сложный эфир глицерина и этих кислот:
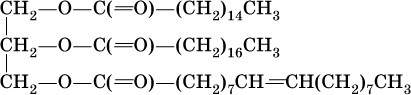
Чем выше содержание остатков олеиновой кислоты (или других ненасыщенных кислот), тем ниже температура плавления жира. Жидкие при комнатной температуре жиры называются маслами. Путем гидрогенизации, т. е. присоединения водорода по двойной связи, масла превращают в твердые жиры (например, растительное масло – в маргарин). Реакция этерификации (образования жира) обратима:

Прямая реакция лучше идет в кислотной среде, обратная реакция – гидролиз, или омыление, жира – в щелочной среде; при пищеварении жир омыляется (расщепляется) с помощью ферментов.
Назад: 10.2. Альдегиды и кетоны
Дальше: 10.4. Углеводы

