Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 7.2. Галогены
Дальше: 7.4. Неметаллы VA-группы
7.3. Халькогены
7.3.1. Кислород
Кислород – элемент 2-го периода и VIA-группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым.
Шкала степеней окисления кислорода:
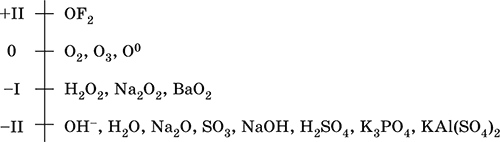
Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно-чистые соединения кислорода-16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O2. Простое вещество. Состоит из неполярных молекул О2 (дикислород) с σπ-связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло-голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает после азота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из-за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:

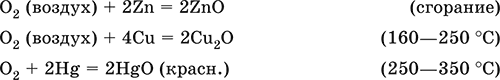
Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности – фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории – нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O2 (450–500 °C)
2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C)
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
2KNO3 = 2KNO2 + O2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O3. Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло-синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2-гибридизация, валентный угол 117°), содержит ковалентные σπ-связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево-красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе — озонаторе.
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций:
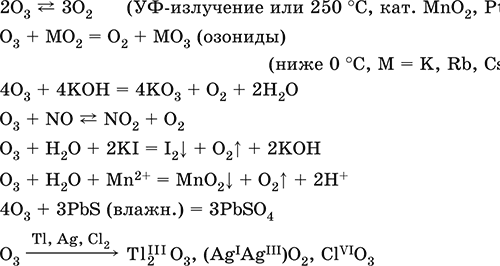
Получение: под действием электрического разряда в озонаторе:
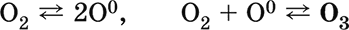
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О0. Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их:
KNO3 = KNO2 + O0
О0 + С (графит) = СO2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
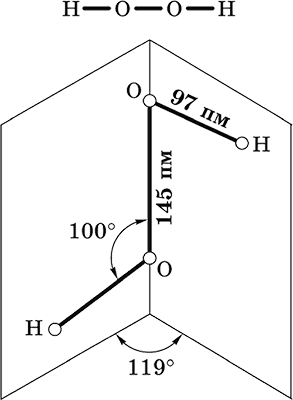
Пероксид водорода Н2O2. Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с σ-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %-ный раствор Н2O2 (пергидроль), в медицине – 3 %-ный раствор.
Уравнения важнейших реакций:
2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2)
Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O
Н2O2 (конц.) + 2NaOH(т) = Na2O2↓ + 2H2O (0 °C)
Н2O2 (3 %) + 2H+ + 2I- = I2↓ + 2Н2O
5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O
Н2O2 (10 %) + SO32- = SO32- + H2O
4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)↓
3H2O2 + 2[Cr(OH)6]3- = 2CrO42- + 8H2O + 2OH-
2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2↑
5H2O2 + 6H+ + 2MnO4- = 2Mn2+ + 5O2↑ + 8Н2O
Получение: в лаборатории вначале синтезируют пероксид бария ВаO2:
2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO2 + H2SO4 = BaSO4↓ + Н2O2 (на холоду)
В промышленности (старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2:
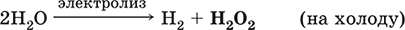
Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2-этилантрагидрохинон кислородом воздуха на холоду.
7.3.2. Сера. Сероводород. Сульфиды
Сера – элемент 3-го периода и VIA-группы Периодической системы, порядковый номер 16, относится к халькогенам. Электронная формула атома [10Ne]3s23p4, характерные степени окисления 0, -II, +IV и +VI, состояние SVI считается устойчивым.
Шкала степеней окисления серы:
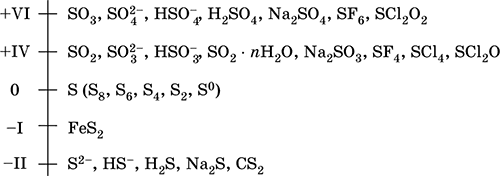
Электроотрицательность серы равна 2,60, для нее характерны неметаллические свойства. В водородных и кислородных соединениях находится в составе различных анионов, образует кислородсодержащие кислоты и их соли, бинарные соединения.
В природе – пятнадцатый по химической распространенности элемент (седьмой среди неметаллов). Встречается в свободном (самородном) и связанном виде. Жизненно важный элемент для высших организмов.
Сера S. Простое вещество. Желтая кристаллическая (α-ромбическая и β-моноклинная,  при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S8 (неплоские циклы типа «корона»), аморфная сера состоит из цепей Sn. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S8, переплетение цепей Sn). В паре – молекулы S8, S6, S4, S2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S8 (неплоские циклы типа «корона»), аморфная сера состоит из цепей Sn. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S8, переплетение цепей Sn). В паре – молекулы S8, S6, S4, S2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
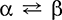
Сера не растворяется в воде и при обычных условиях не реагирует с ней, хорошо растворима в сероуглероде CS2.
Сера, особенно порошкообразная, обладает высокой активностью при нагревании. Реагирует как окислитель с металлами и неметаллами:
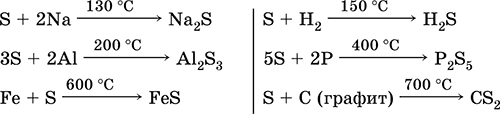
а как восстановитель – с фтором, кислородом и кислотами (при кипячении):
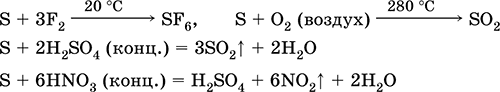
Сера подвергается дисмутации в растворах щелочей:
3S0 + 6КОН (конц.) = 2K2S-II + K2SIVO3 + 3H2O
При высокой температуре (400 °C) сера вытесняет иод из иодоводорода:
S + 2НI(г) = I2 + H2S,
но в растворе реакция идет в обратную сторону:
I2 + H2S(p) = 2 HI + S↓
Получение: в промышленности выплавляется из природных залежей самородной серы (с помощью водяного пара), выделяется при десульфурации продуктов газификации угля.
Сера применяется для синтеза сероуглерода, серной кислоты, сернистых (кубовых) красителей, при вулканизации каучука, как средство защиты растений от мучнистой росы, для лечения кожных заболеваний.
Сероводород H2S. Бескислородная кислота. Бесцветный газ с удушающим запахом, тяжелее воздуха. Молекула имеет строение дважды незавершенного тетраэдра [::S(H)2]
(sp3-гибридизация, валетный угол Н – S—Н далек от тетраэдрического). Неустойчив при нагревании выше 400 °C. Малорастворим в воде (2,6 л/1 л Н2O при 20 °C), насыщенный раствор децимолярный (0,1М, «сероводородная вода»). Очень слабая кислота в растворе, практически не диссоциирует по второй стадии до ионов S2- (максимальная концентрация S2- равна 1 10-13 моль/л). При стоянии на воздухе раствор мутнеет (ингибитор – сахароза). Нейтрализуется щелочами, не полностью – гидратом аммиака. Сильный восстановитель. Вступает в реакции ионного обмена. Сульфидирующий агент, осаждает из раствора разноокрашенные сульфиды с очень малой растворимостью.
Качественные реакции – осаждение сульфидов, а также неполное сгорание H2S с образованием желтого налета серы на внесенном в пламя холодном предмете (фарфоровый шпатель). Побочный продукт очистки нефти, природного и коксового газа.
Применяется в производстве серы, неорганических и органических серосодержащих соединений как аналитический реагент. Чрезвычайно ядовит. Уравнения важнейших реакций:
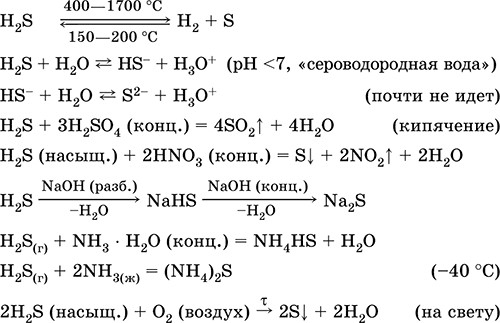

Получение: в промышленности – прямым синтезом:
Н2 + S = H2S (150–200 °C)
или при нагревании серы с парафином;
в лаборатории – вытеснением из сульфидов сильными кислотами
FeS + 2НCl (конц.) = FeCl2 + H2S↑
или полным гидролизом бинарных соединений:
Al2S3 + 6Н2O = 2Al(ОН)3↓ + 3H2S↑
Сульфид натрия Na2S. Бескислородная соль. Белый, очень гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Качественные реакции на ион S2- – осаждение разноокрашенных сульфидов металлов, из которых MnS, FeS, ZnS разлагаются в НCl (разб.).
Применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии.
Уравнения важнейших реакций:
Na2S + 2НCl (разб.) = 2NaCl + H2S↑
Na2S + 3H2SO4 (конц.) = SO2↑ + S↓ + 2H2O + 2NaHSO4 (до 50 °C)
Na2S + 4HNO3 (конц.) = 2NO↑ + S↓ + 2H2O + 2NaNO3 (60 °C)
Na2S + H2S (насыщ.) = 2NaHS
Na2S(т) + 2O2 = Na2SO4 (выше 400 °C)
Na2S + 4H2O2 (конц.) = Na2SO4 + 4H2O
S2- + M2+ = MnS (телесн.)↓; FeS (черн.)↓; ZnS (бел.)↓
S2- + 2Ag+ = Ag2S (черн.)↓
S2- + M2+ = СdS (желт.)↓; PbS, CuS, HgS (черные)↓
3S2- + 2Bi3+ = Bi2S3 (кор. – черн.)↓
3S2- + 6H2O + 2M3+ = 3H2S↑ + 2M(OH)3↓ (M = Al, Cr)
Получение в промышленности – прокаливание минерала мирабилит Na2SO4 10Н2O в присутствии восстановителей:
Na2SO4 + 4Н2 = Na2S + 4Н2O (500 °C, кат. Fe2O3)
Na2SO4 + 4С (кокс) = Na2S + 4СО (800—1000 °C)
Na2SO4 + 4СО = Na2S + 4СO2 (600–700 °C)
Сульфид алюминия Al2S3. Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N2, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций:
Al2S3 + 6Н2O = 2Al(ОН)3↓ + 3H2S↑ (чистый)
Al2S3 + 6НCl (разб.) = 2AlCl3 + 3H2S↑
Al2S3 + 24HNO3 (конц.) = Al2(SO4)3 + 24NO2↑ + 12H2O (100 °C)
2Al2S3 + 9O2 (воздух) = 2Al2O3 + 6SO2 (700–800 °C)
Получение: взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
2Al + 3S = AL2S3 (150–200 °C)
Сульфид железа (II) FeS. Бескислородная соль. Черно-серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Соединение железа(III) состава Fe2S3 не известно (не получено).
Уравнения важнейших реакций:
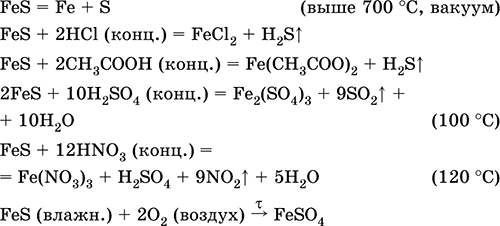
Получение:
Fe + S = FeS (600 °C)
Fe2O3 + H2 + 2H2S = 9FeS + 3H2O (700-1000 °C)
FeCl2 + 2NH4HS (изб.) = FeS ↓ + 2NH4Cl + H2S↑
Дисульфид железа FeS2. Бинарное соединение. Имеет ионное строение Fe2+ (—S – S—)2-. Темно-желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами-окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит.
Уравнения важнейших реакций:
FeS2 = FeS + S (выше 1170 °C, вакуум)
2FeS2 + 14H2SO4 (конц., гор.) = Fe2(SO4)3 + 15SO2↑ + 14Н2O
FeS2 + 18HNO3 (конц.) = Fe(NO3)3 + 2H2SO4 + 15NO2↑ + 7H2O
4FeS2 + 11O2 (воздух) = 8SO2 + 2Fe2O3 (800 °C, обжиг)
Гидросульфид аммония NH4HS. Бескислородная кислая соль. Белый, плавится под избыточным давлением. Весьма летучий, термически неустойчивый. На воздухе окисляется. Хорошо растворим в воде, гидролизуется по катиону и аниону (преобладает), создает щелочную среду. Раствор желтеет на воздухе. Разлагается кислотами, в насыщенном растворе присоединяет серу. Щелочами не нейтрализуется, средняя соль (NH4)2S не существует в растворе (условия получения средней соли см. в рубрике «H2S»). Применяется в качестве компонента фотопроявителей, как аналитический реагент (осадитель сульфидов).
Уравнения важнейших реакций:
NH4HS = NH3 + H2S (выше 20 °C)
NH4HS + НCl (разб.) = NH4Cl + H2S↑
NH4HS + 3HNO3 (конц.) = S↓ + 2NO2↑ + NH4NO3 + 2H2O
2NH4HS (насыщ. H2S) + 2CuSO4 = (NH4)2SO4 + H2SO4 + 2CuS↓
Получение: насыщение концентрированного раствора NH3 сероводородом:
NH3 Н2O (конц.) + H2S(г) = NH4HS + Н2O
В аналитической химии раствор, содержащий равные количества NH4HS и NH3 Н2O, условно считают раствором (NH4)2S и используют формулу средней соли в записи уравнений реакций, хотя сульфид аммония полностью гидролизуется в воде до NH4HS и NH3 • Н2O.
7.3.3. Диоксид серы. Сульфиты
Диоксид серы SO2. Кислотный оксид. Бесцветный газ с резким запахом. Молекула имеет строение незавершенного треугольника [: S(O)2] (sр2-гибридизация), содержит σ,π-связи S=O. Легко сжижается, термически устойчивый. Хорошо растворим в воде (~40 л/1 л Н2O при 20 °C). Образует полигидрат, обладающий свойствами слабой кислоты, продукты диссоциации – ионы HSO3- и SO32-. Ион HSO3- имеет две таутомерные формы – симметричную (некислотную) со строением тетраэдра [S(H)(O)3] (sр3-гибридизация), которая преобладает в смеси, и несимметричную (кислотную) со строением незавершенного тетраэдра [: S(O)2(OH)] (sр3-гибридизация). Ион SO32- также тетраэдрический [: S(O)3].
Реагирует со щелочами, гидратом аммиака. Типичный восстановитель, слабый окислитель.
Качественная реакция – обесцвечивание желто-коричневой «йодной воды». Промежуточный продукт в производстве сульфитов и серной кислоты.
Применяется для отбеливания шерсти, шелка и соломы, консервирования и хранения фруктов, как дезинфицирующее средство, антиоксидант, хладагент. Ядовит.
Соединение состава H2SO3 (сернистая кислота) не известно (не существует).
Уравнения важнейших реакций:
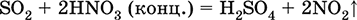
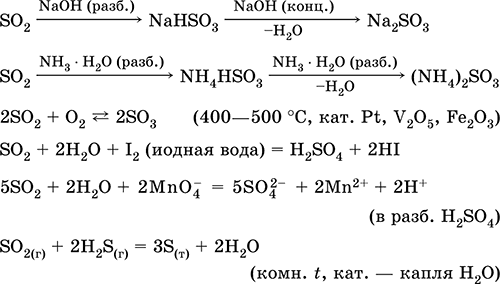
Растворение в воде и кислотные свойства:
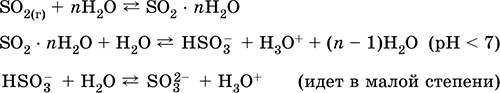
Получение: в промышленности – сжигание серы в воздухе, обогащенном кислородом, и, в меньшей степени, обжиг сульфидных руд (SO2 – попутный газ при обжиге пирита):
S + O2 = SO2 (280–360 °C)
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (800 °C, обжиг)
в лаборатории – вытеснение серной кислотой из сульфитов:
BaSO3(т) + H2SO4 (конц.) = BaSO4↓ + SO2↑ + Н2O
Сульфит натрия Na2SO3. Оксосоль. Белый. При нагревании на воздухе разлагается без плавления, плавится под избыточным давлением аргона. Во влажном состоянии и в растворе чувствителен к кислороду воздуха. Хорошо растворим в воде, гидролизуется по аниону. Разлагается кислотами. Типичный восстановитель.
Качественная реакция на ион SO32- – образование белого осадка сульфита бария, который переводится в раствор сильными кислотами (НCl, HNO3).
Применяется как реактив в аналитической химии, компонент фотографических растворов, нейтрализатор хлора при отбеливании тканей.
Уравнения важнейших реакций:
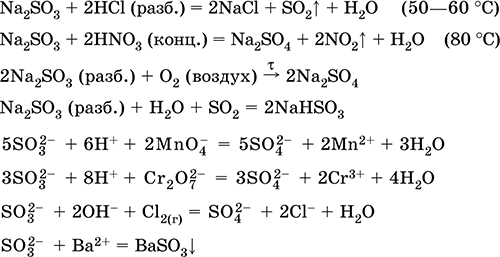
Получение:
Na2CO3 (конц.) + SO2 = Na2SO3 + CO2↑
7.3.4. Серная кислота. Сульфаты
Серная кислота H2SO4. Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно-тетраэдрическое строение [S(O)2(OH)2] (sр3-гибридизация), содержит ковалентные σ-связи S – ОН и σπ-связи S=O. Ион SO42- имеет правильно-тетраэдрическое строение [S(O)4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо-эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет НI), сильный – в концентрированном растворе (за счет SVI). Хорошо растворяет SO3 и реагирует с ним (образуется тяжелая маслообразная жидкость — олеум, содержит H2S2O7).
Качественная реакция на ион SO42- – осаждение белого сульфата бария BaSO4 (осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO3).
Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций:
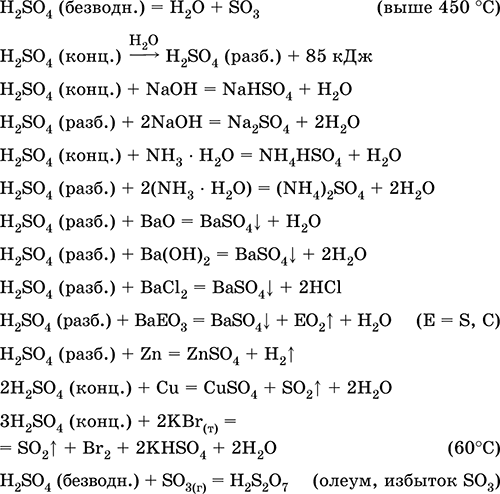
Получение в промышленности:
а) синтез SO2 из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O2 (воздух) = SO2 (280–360 °C)
4FeS2 + 11O2 (воздух) = 8SO2 + 2Fe2O3 (800 °C, обжиг)
2H2S + 3O2 (изб.) = 2SO2 + 2Н2O (250–300 °C)
CaSO4 + С (кокс) = СаО + SO2 + СО (1300–1500 °C)
б) конверсия SO2 в SO3 в контактном аппарате:
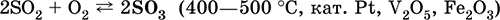
в) синтез концентрированной и безводной серной кислоты:
Н2O (разб. H2SO4) + SO3 = H2SO4 (конц., безводн.)
(поглощение SO3 чистой водой с получением H2SO4 не проводится из-за сильного разогревания смеси и обратного разложения H2SO4, см. выше);
г) синтез олеума – смеси безводной H2SO4, дисерной кислоты H2S2O7 и избыточного SO3. Растворенный SO3 гарантирует безводность олеума (при попадании воды тут же образуется H2SO4), что позволяет безопасно перевозить его в стальных цистернах.
Сульфат натрия Na2SO4. Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H2SO4 (конц.), SO3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена.
Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара-Богаз-Гол Каспийского моря.
Уравнения важнейших реакций:
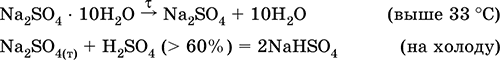
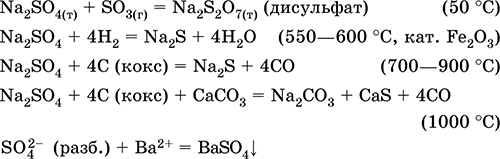
Гидросульфат калия KHSO4. Кислая оксосоль. Белый, гигроскопичный, но кристаллогидратов не образует. При нагревании плавится и разлагается. Хорошо растворим в воде, в растворе анион подвергается диссоциации, среда раствора сильнокислотная. Нейтрализуется щелочами.
Применяется как компонент флюсов в металлургии, составная часть минеральных удобрений.
Уравнения важнейших реакций:
2KHSO4 = K2SO4 + H2SO4 (до 240 °C)
2KHSO4 = K2S2O7 + Н2O (320–340 °C)
KHSO4 (разб.) + КОН (конц.) = K2SO4 + Н2O KHSO4 + КCl = K2SO4 + НCl (450–700 °C)
6KHSO4 + М2O3 = 2KM(SO4)2 + 2K2SO4 + 3H2O (350–500 °C, M = Al, Cr)
Получение: обработка сульфата калия концентрированной (более чем 6O%-ной) серной кислотой на холоду:
K2SO4 + H2SO4 (конц.) = 2KHSO4
Сульфат кальция CaSO4. Оксосоль. Белый, весьма гигроскопичный, тугоплавкий, при прокаливании разлагается. Природный CaSO4 встречается в виде очень распространенного минерала гипс CaSO4 2Н2O. При 130 °C гипс теряет часть воды и переходит в жжёный (штукатурный) гипс 2CaSO4 • Н2O (техническое название алебастр). Полностью обезвоженный (200 °C) гипс отвечает минералу ангидрит CaSO4. Малорастворим в воде (0,206 г/100 г Н2O при 20 °C), растворимость уменьшается при нагревании. Реагирует с H2SO4 (конц.). Восстанавливается коксом при сплавлении. Определяет большую часть «постоянной» жесткости пресной воды (подробнее см. 9.2).
Уравнения важнейших реакций: 100–128 °C
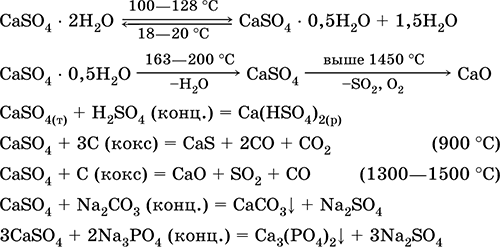
Применяется как сырье в производстве SO2, H2SO4 и (NH4)2SO4, как флюс в металлургии, наполнитель бумаги. Приготовленный из жженого гипса вяжущий строительный раствор «схватывается» быстрее, чем смесь на основе Са(ОН)2. Затвердевание обеспечивается связыванием воды, образованием гипса в виде каменной массы. Используется жженый гипс для изготовления гипсовых слепков, архитектурно-декоративных форм и изделий, перегородочных плит и панелей, каменных полов.
Сульфат алюминия-калия KAl(SO4)2. Двойная оксосоль. Белый, гигроскопичный. При сильном нагревании разлагается. Образует кристаллогидрат — алюжокалиевые квасцы. Умеренно растворим в воде, гидролизуется по катиону алюминия. Реагирует со щелочами, гидратом аммиака.
Применяется как протрава при крашении тканей, дубитель кож, коагулянт при очистке пресной воды, компонент составов для проклеивания бумаги, наружное кровоостанавливающее средство в медицине и косметологии. Образуется при совместной кристаллизации сульфатов алюминия и калия.
Уравнения важнейших реакций:
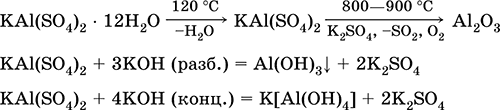
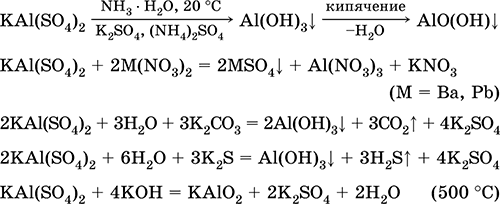
Сульфат хрома(III) – калия KCr(SO4)2. Двойная оксосоль. Красный (гидрат темно-фиолетовый, техническое название хрожокалиевые квасцы). При нагревании разлагается без плавления. Хорошо растворим в воде (серо-синяя окраска раствора отвечает аквакомплексу [Cr(Н2O)6]3+), гидролизуется по катиону хрома(III). Реагирует со щелочами, гидратом аммиака. Слабый окислитель и восстановитель. Вступает в реакции ионного обмена.
Качественные реакции на ион Cr3+ – восстановление до Cr2+ или окисление до желтого CrO42-.
Применяется как дубитель кож, протрава при крашении тканей, реактив в фотографии. Образуется при совместной кристаллизации сульфатов хрома(III) и калия. Уравнения важнейших реакций:
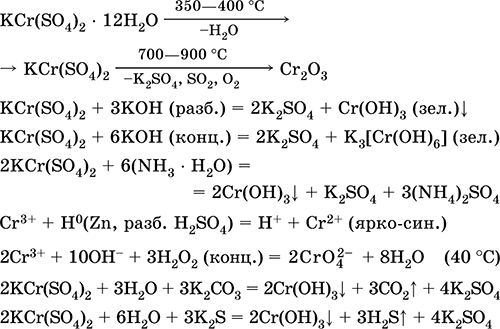
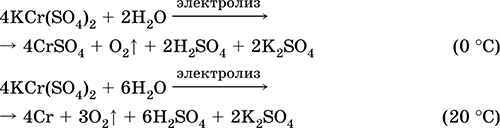
Сульфат марганца (II) MnSO4. Оксосоль. Белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO4 5Н2O – красно-розовый, техническое название марганцевый купорос. Хорошо растворим в воде, светло-розовая (почти бесцветная) окраска раствора отвечает аквакомплексу [Mn(Н2O)6]2+; гидролизуется по катиону. Реагирует со щелочами, гидратом аммиака. Слабый восстановитель, реагирует с типичными (сильными) окислителями.
Качественные реакции на ион Mn2+ – конмутация с ионом MnO4 и исчезновение фиолетовой окраски последнего, окисление Mn2+ до MnO4 и появление фиолетовой окраски.
Применяется для получения Mn, MnO2 и других соединений марганца, как микроудобрение и аналитический реагент.
Уравнения важнейших реакций:
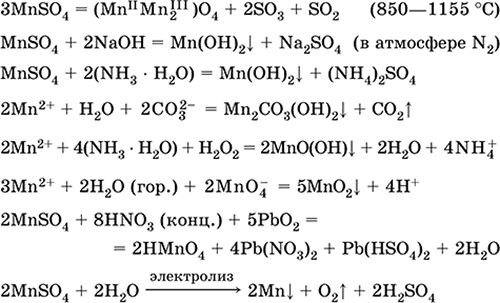
Получение:
2MnO2 + 2H2SO4 (конц.) = 2MnSO4 + O2↑ + 2H2O (100 °C)
Сульфат железа (II) FeSO4. Оксосоль. Белый (гидрат светло-зеленый, техническое название железный купорос), гигроскопичный. Разлагается при нагревании. Хорошо растворим в воде, в малой степени гидролизуется по катиону. Быстро окисляется в растворе кислородом воздуха (раствор желтеет и мутнеет). Реагирует с кислотами-окислителями, щелочами, гидратом аммиака. Типичный восстановитель.
Применяется как компонент минеральных красок, электролитов в гальванотехнике, консервант древесины, фунгицид, лекарственное средство против анемии. В лаборатории чаще берется в виде двойной соли Fe(NH4)2(SO4)2 6Н2O (соль Мора), более устойчивой к действию воздуха.
Уравнения важнейших реакций:
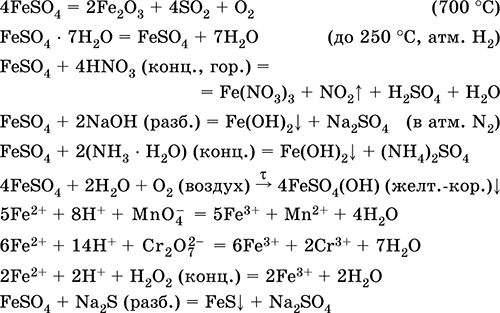
Получение:
Fe + H2SO4 (разб.) = FeSO4 + H2↑
FeCO3 + H2SO4 (разб.) = FeSO4 + CO2↑ + H2O
Назад: 7.2. Галогены
Дальше: 7.4. Неметаллы VA-группы

