Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 6.3. Железо
Дальше: 7. Неметаллы главных подгрупп IV–VII групп
6.4. Общие свойства металлов. Коррозия
Элементы с металлическими свойствами расположены в IA – VIA группах Периодической системы (табл. 7).
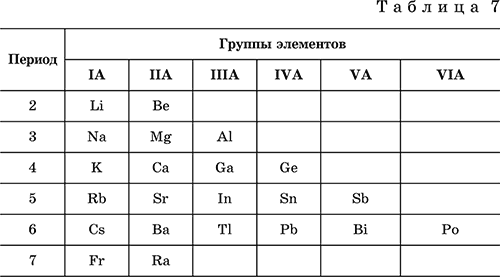
Металлами являются также все элементы, расположенные в IБ – VIIIБ-группах (переходные металлы).
В настоящее время в Периодической системе 92 металла.
Типичными металлами являются s-элементы (элементы IA-группы от Li до Fr, элементы IIA-группы от Mg до Ra). Общая электронная формула их атомов ns1–2. Для них характерны степени окисления +I и +II соответственно.
Небольшое число электронов (1–2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами – это ионные кристаллы «катион металлаанион неметалла», например К+Br-, Са2+O2-. Катионы типичных металлов входят также в состав соединений со сложными анионами – гидроксидов и солей, например Mg2+(OH-)2, (Li+)2CO32-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Be-Al-Ge-Sb-Po, а также примыкающие к ним металлы (Ga, In, Tl, Sn, Pb, Bi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns2np0–4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры – соединения ТlIII, PbIV, Biv). Подобное химическое поведение характерно и для большинства d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры – амфотерные элементы Cr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути(II) AlCl3 и HgCl2 содержат сильно ковалентные связи, но в растворе AlCl3 диссоциирует почти полностью, a HgCl2 – в очень малой степени (да и то на ионы HgCl+ и Cl-).
В свободном виде все металлы – твердые вещества, кроме одного – ртути Hg, которая при обычных условиях жидкость. В кристаллах металлов преобладает особый вид связи (металлическая связь); валентные электроны слабо связаны с конкретным атомом в решетке, и внутри металла существует так называемый электронный газ. Все металлы обладают высокой электропроводимостью (наибольшая y Ag, Cu, Аи, Al, Mg) и теплопроводностью. Встречаются низкоплавкие металлы (цезий Cs с температурой плавления 28,7 °C плавится от тепла руки) и, наоборот, весьма тугоплавкие (вольфрам W плавится лишь при 3387 °C). Отличительным свойством металлов служит их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы – фольгу (Sn, Al, Au) или вытянуты в проволоку (Cu, Al, Fe), однако встречаются и очень хрупкие металлы (Zn, Sb, Bi).
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка {ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Be, Bi, Со, Fe, Mg и Nb, а в концентрированной азотной кислоте – металлы Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Na+, Са2+, Al3+, Fe2+ и Fe3+).
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Cu, Ag и Hg – только серной (концентрированной) и азотной кислотами, a Pt и Аи – «царской водкой».
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СO2 и SO2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fe, и другим металлом, например Sn или Cu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Fe), к менее активному металлу (Sn, Cu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора CuSO4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры – Ag, Au, Pt, Hg), но чаще металлы находятся в виде соединений (металлические руды). По распространенности в земной коре металлы различны: от наиболее распространенных – Al, Na, Са, Fe, Mg, К, Ti до самых редких – Bi, In, Ag, Au, Pt, Re.
Примеры заданий части A
1. В железосодержащих продуктах реакций между железом и разбавленными кислотами HCl, H2SO4 и HNO3 общая сумма числа атомов всех элементов равна
1) 14
2) 18
3) 22
4) 26
2. В уравнениях реакций
Fe + O2 → (FeIIFeIII2)O4
Fe + Cl2 → FeCl3
Fe + Н2O (пар) → (FeIIFeIII2)O4 + Н2
общая сумма коэффициентов равна
1) 6
2) 7
3) 12
4) 25
3. Соль NaCrO2 получают при взаимодействии между
1) CrO3 и Na2O
2) Cr2O3 и Na2CO3
3) CrО и NaOH
4) CrO2 и NaHCO3
4. Будет протекать реакция при внесении меди в разбавленные растворы
1) бромоводорода
2) нитрата ртути(II)
3) серной кислоты
4) азотной кислоты
5. Протекают реакции
1) H2SO4 + FeCO3 →…
2) AgNO3 + HI (p-p) →…
3) K2Cr2O7 (p-p) + PbO2 →…
4) AgNOg (p-p) + Au →…
6—9. Масса тигля из
6. платины
7. меди
8. серебра
9. железа
при прокаливании на воздухе
1) уменьшается
2) увеличивается
3) не изменяется
4) не знаю
10—11. В молекулярных уравнениях реакций
10. Fe2O3 + HNOg →…, Fe(OH)2 + O2 → FeO(OH) +…
11. CuO + С → CO2 + Cu, Fe2O3 + CO → Fe +…
общая сумма коэффициентов равна
1) 12
2) 15
3) 16
4) 22
12. Сплав, оба компонента которого реагируют с концентрированной азотной кислотой, – это
1) Al + Cu
2) Pt + Аu
3) Hg + Ag
4) Fe + Cr
13. He протекает реакция замещения между реагентами
1) CuSO4 и Zn
2) Pb(NO3)2 и Cr
3) Fe и ZnSO4
4) Cd и Hg(NO3)2
14. Для удаления примеси NiSO4 из раствора FeSO4 надо добавить
1) хлорид бария
2) нитрат серебра(I)
3) гидроксид калия
4) железо
15. Пластинка металла окажется покрытой другим металлом, взятым в виде раствора соли, в наборах
1) Zn и Pb(NO3)2
2) Cu и Hg(NO3)2
3) Со и MnSO4
4) Pb и CrCl3
16—17. Коррозия стального изделия, склепанного с
16. хромом
17. никелем
во влажном воздухе
1) усиливается
2) ослабевает
3) не изменяется
4) не знаю
Назад: 6.3. Железо
Дальше: 7. Неметаллы главных подгрупп IV–VII групп

