Анемии
Анемия (малокровие) – группа заболеваний, характеризующихся снижением содержания в эритроцитах гемоглобина, количества эритроцитов в единице объема крови, а также общей массы крови в организме.
Классификация анемий по этиопатогенетическому принципу включает 3 большие группы:
1) анемии вследствие кровопотерь (постгеморрагические);
2) анемии вследствие нарушения кровообразования (дефицитные анемии), анемии вследствие опустошения костного мозга и др.;
3) анемии вследствие повышенного кроворазрушения – гемолитические (врожденные энзимопатические, гемоглобинопатии, аутоиммунные формы и др.).
Постгеморрагические анемии
Постгеморрагические анемии возникают в результате острой или хронической кровопотери.
Этиология. Острая кровопотеря наблюдается у детей довольно часто и бывает обусловлена асфиксией и родовой травмой (кровоизлияния во внутренние органы и мозговые оболочки), фетоматеринскими и фетофетальными трансфузиями, плацентарными кровотечениями, геморрагическими диатезами, травмами, язвенными процессами в желудочно-кишечном тракте, метроррагиями у девочек и т. д.
Массивная потеря крови сопровождается развитием гиповолемического шока, централизацией кровообращения, гидремической реакцией с признаками эксикоза, сердечнососудистой недостаточностью и быстрым истощением глюкокортикоидной функции надпочечников.
Симптомокомплекс может развиться под влиянием других этиологических факторов, например хронических инфекций.
Клиника постгеморрагических анемий зависит от величины скорости кровопотери, возраста больного, этиологического фактора. При массивном кровотечении может развиться шок.
Острая кровопотеря на первом этапе складывается из двух клинических синдромов – анемического и коллаптоидного. Ребенок становится бледным, вялым, адинамичным. Появляются головокружение, шум в ушах, у некоторых тревожный беспокойный взгляд, холодный пот, зевота, иногда икота, снижение артериального давления, частый нитевидный пульс, одышка; над верхушкой сердца выслушивается систолический шум, определяется тахикардия. В тяжелых случаях – цианоз, судороги, нарушение зрения.
В этом раннем периоде после кровопотери не выявляется снижение количества эритроцитов и гемоглобина в связи с компенсаторным поступлением в сосуды депонированной крови и уменьшением емкости общего сосудистого русла в результате рефлекторного сужения значительной части капилляров. Количество тромбоцитов и лейкоцитов в течение первых часов после кровопотери повышается. Выраженная анемия после острой кровопотери выявляется спустя 1–2 дня, когда наступает так называемая «гидремическая фаза компенсации», характеризующаяся обильным поступлением в кровеносную систему тканевой жидкости. В этой фазе наблюдается прогрессирующее снижение гемоглобина и эритроцитов. В периферической крови появляется большое количество новообразованных эритроцитов – ретикулоцитов, а у детей грудного возраста могут появляться единичные нормо– и эритробласты, отмечается также полихроматофилия эритроцитов.
Хроническая постгеморрагическая анемия характеризуется медленным темпом развития. Клиническая картина определяется степенью тяжести анемии. В легких случаях анемия длительное время может оставаться незамеченной. При нарастании степени тяжести анемии появляется общая слабость, снижается физическая и психическая активность ребенка, ухудшается аппетит, появляется головокружение, шум в ушах. Кожные покровы бледные с восковидным оттенком или фарфорово-бледные, слизистые губ, конъюнктивы бескровные, склеры голубоватые. Лицо становится одутловатым, появляется пастозность, иногда отеки нижних конечностей. Границы сердца расширены влево, над верхушкой и у основания выслушивается систолический шум анемического характера, тахикардия, выявляется гипохромная анемия с дегенеративными и частично регенеративными формами эритроцитов. Диагноз ставится на основании клинических данных, а при острой кровопотере – коллапса и гематологических исследований.
Лечение заключается в остановке кровотечения, ликвидации симптомов шока (плазма, кровезаменители) и восстановлении баланса железа.
Дефицитные анемии
Дефицитные анемии – анемии, возникающие в результате недостаточного поступления в организм или нарушенного всасывания продуктов, необходимых для построения молекулы гемоглобина. Ведущее место в педиатрической практике занимают «дефицитные» анемии. Они обусловлены дефицитом железа и других микроэлементов, дефицитом витаминов кроветворения и белка. Из «дефицитных» анемий наиболее распространенными являются железодефицитные.
Железодефицитная анемия.
Этиология. Железо входит в состав гемоглобина эритроцитов и ферментов, участвующих в клеточном дыхании, и почти не выводится из организма. Ведущей причиной железодефицитной анемии являются дефекты вскармливания детей (недостаточное или позднее введение соков, яблочного пюре, овощных прикормов и одностороннее питание).
К предрасполагающим факторам относятся: раннее искусственное вскармливание, частые заболевания ребенка, рахит, гипотрофия, а также нарушения ухода за ребенком. Дефицит железа может также быть обусловлен низким содержанием его в «депо» в результате недоношенности, многоплодной беременности или анемии матери в период беременности, а также нарушением обмена железа, главным образом, его всасывания.
В результате перечисленных факторов в организме ребенка происходит нарушение различных видов обмена, при этом наиболее страдает усвоение железа. Железодефицитной анемии в ряде случаев сопутствует так называемая дизалиментарная анемия, возникающая от недостаточного поступления с пищей белка и витаминов.
У детей раннего возраста (6-18 мес.) в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из «депо»: у недоношенных детей к 3-му мес., у доношенных – к 5-6-му мес. жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет – не менее 10 мг.
Распространенность железодефицитной анемии у детей в России и развитых европейских странах составляет: около 50 % – у детей младшего возраста; более 20 % – у детей старшего возраста. Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и желудочно-кишечного тракта. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. В последнее время стали обращать внимание на то, что дефицит железа увеличивает абсорбцию свинца в ЖКТ. Это особенно важно для детей, живущих в больших городах, вблизи магистральных дорог.
Клиника. При типичных формах железодефицитных анемий можно выделить легкую (эритроциты – 3,0–4,0 1012/л, гемоглобин – 90-100 г/л), среднетяжелую (эритроциты – 2,0–3,0 1012/л, гемоглобин -70-90 г/л) и тяжелую форму (эритроциты– 2,0*1012/л и ниже, гемоглобин– 70 г/л и ниже). Все они встречаются в основном в раннем возрасте. Легкая форма диагностируется не всегда, так как самочувствие ребенка остается удовлетворительным. Клиническая картина железодефицитных состояний (сидеропений) неспецифична и включает несколько синдромов.
Астеновегетативный синдром – следствие нарушения функций головного мозга. Маленькие дети с железодефицитной анемией отстают в психомоторном развитии. Они плаксивы, раздражительны, капризны, плохо контактируют со сверстниками. У детей старшего возраста страдает интеллектуальное развитие: снижены память, внимание, интерес к учебе. Появляются признаки синдрома вегетативной дистонии. Возможны мышечные боли и гипотония (в частности – мочевого пузыря), энурез.
Эпителиальный синдром включает дистрофию и атрофию барьерных тканей (слизистых оболочек, кожи и ее производных – ногтей, волос). К трофическим нарушениям легко присоединяются воспалительные изменения. В результате снижается аппетит, возникают извращение вкуса и обоняния, дисфагия, диспепсические расстройства, нарушения процессов всасывания в кишечнике, скрытые кишечные кровотечения. Бледность кожи и конъюнктивы выявляют только при значительном снижении концентрации гемоглобина.
Синдром снижения местной иммунной защиты проявляется частыми ОРВИ и острыми кишечными инфекциями. Около 70 % часто болеющих детей страдают сидеропенией. У них снижен как неспецифический (лизоцим, пропердин и т. д.), так и специфический иммунитет. Показано, что в отсутствие железа IgA теряет свою бактерицидную активность.
Сердечно-сосудистый синдром наблюдают при тяжелой железодефицитной анемии. У детей развиваются повышенная утомляемость, низкое артериальное давление, тахикардия, снижение тонуса сердечной мышцы, приглушение тонов, функциональный, довольно грубый систолический шум, хорошо выслушиваемый на сосудах («шум волчка») и связанный с гидремией. Возможны головокружения.
Гепатолиеналъный синдром возникает редко, обычно при тяжелой анемии и сочетании рахита и анемии.
Ювенильный хлороз («бледная немочь», ранний хлороз) – форма анемии, встречающаяся у девочек в препубертатном и пубертатном периодах. Заболевание проявляется слабостью, легкой утомляемостью, иногда обмороками, головокружением, сердцебиением, снижением аппетита, склонностью к запорам, олиго– или аменореей. Кожа алебастровой бледности. Характерно выпадение волос, ломкость ногтей, извращение вкуса (желание есть мел, зубной порошок, уголь, грифели от карандашей), расстройства мочеиспускания (ночное недержание мочи, частые позывы на мочеиспускание).
Возрастно-половая обусловленность патологии свидетельствует об участии в патогенезе эндокринных факторов.
Диагноз ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: снижения уровня гемоглобина ниже 110 г/л для детей до 5 лет и ниже 120 г/л для детей старше 5 лет; цветового показателя ниже 0,8; микроцитоза и пойкилоцитоза эритроцитов (в мазке периферической крови); уровня сывороточного железа ниже 12,5 мкмоль/л; повышения общей железосвязывающей способности сыворотки более 85 мкмоль/л (показатель «голодания»); повышения уровня трансферрина в сыворотке крови при снижении его насыщения железом (менее 15 %); содержания сидеробластов в костном мозге ниже 10 %; снижения уровня ферритина в сыворотке (<15 мкг/л); отрицательных результатов десфераловой пробы; эффекта от приема препаратов железа, выявляемого на 7-12-й день лечения.
Дифференциальную диагностику железодефицитной анемии проводят с другими дефицитными анемиями, талассемией и сидеробластными анемиями – свинцовой и пиридоксинзависимой, при которых эритропоэз нарушен в результате нарушения включения железа в гем. Гипохромия эритроцитов в последнем случае сочетается с повышением концентрации сывороточного железа.
Клинические проявления приобретенной сидеробластной анемии, вызванной свинцовой интоксикацией, более манифестны, чем при железодефицитной анемии: схваткообразные боли в животе, выраженные диспепсические проявления, бледность с землистым оттенком, психические и неврологические расстройства. В анализах крови – базофильная зернистость, гипохромия эритроцитов, повышение концентрации сывороточного железа. В анализах мочи определяют аминолевулиновую кислоту.
При наследственной пиридоксинзависимой сидеро бластной анемии синтез гема нарушается на последнем этапе. В гипохромных эритроцитах накапливается свободный протопорфирин, концентрация сывороточного железа повышена, в красном костном мозге много сидеробластов.
Белководефицитная анемия сопровождается более выраженной бледностью и дисхромией кожи и волос, блефаритами, пастозностью тканей или отеками, анорексией, рвотой, поносами. Концентрация гемоглобина снижена до 40–90 г/л, цветовой показатель в пределах нормальных значений, выражены анизо– и пойкилоцитоз.
Витаминодефицитная анемия (дефицит витаминов В12, С) проявляется астенизацией, парестезиями, бледностью с лимонно-желтым оттенком, субиктеричностью склер, глосситом, афтозным стоматитом, умеренной гепатомегалией. Концентрация гемоглобина снижена, как и содержание эритроцитов, нормо– и гиперхромных, цветовой показатель повышен (более 1,0). Появляются макро-, пойкило– и анизоцитоз, тельца Жолли, кольца Кэбота, мегалобласты, гигантские метамиелоциты. В пунктате красного костного мозга выявляют мегалобластный тип кроветворения.
Лечение дефицитных анемий включает устранение причин, вызвавших заболевание, организацию правильного режима дня и рационального сбалансированного питания, нормализацию секреции желудочно-кишечного тракта, а также лекарственное восполнение имеющегося дефицита и применение средств, способствующих его устранению. В зависимости от тяжести анемии и домашних условий лечение ребенка проводят дома или в больнице.
Режим активный, с достаточным пребыванием на свежем воздухе. Детям раннего возраста назначают массаж и гимнастику, более старшим – умеренные занятия спортом.
Диета показана в зависимости от степени тяжести анемии: при легкой и среднетяжелой степенях и удовлетворительном аппетите – разнообразное, соответствующее возрасту ребенка питание с включением в рацион продуктов, богатых железом, белком, витаминами, микроэлементами. В первом полугодии – более раннее введение тертого яблока, овощного пюре, яичного желтка, овсяной и гречневой каш, во втором – мясного пюре и суфле, пюре из печени. Можно использовать гомогенизированные консервированные овощи (пюре) с добавлением мясных продуктов. При тяжелой анемии, сопровождающейся обычно анорексией и дистрофией, вначале выясняют порог толерантности к пище, назначая постепенно возрастающие количества грудного молока или смесей. Недостаточный объем восполняют соками, овощными отварами, у старших детей – минеральной водой. По достижении должного суточного объема пищи постепенно меняют ее качественный состав, обогащая необходимыми для кроветворения веществами. Ограничивают злаковые продукты и коровье молоко, так как при их употреблении образуются нерастворимые фитаты и фосфаты железа.
Таблица 20
Лабораторные критерии железодефицитных состояний у детей
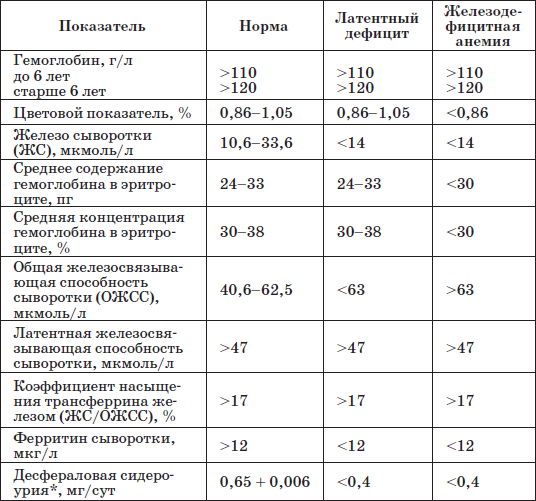
* Определяют содержание в суточной моче десферриоксамина (десферала), введенного внутримышечно из расчета 10 мг/кг.
Таблица 21
Этапы лечения железодефицитной анемии

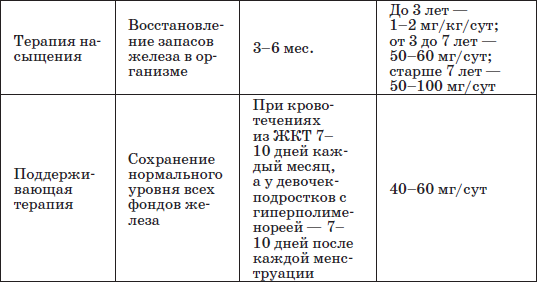
Таблица 22
Наиболее часто применяемые препараты железа
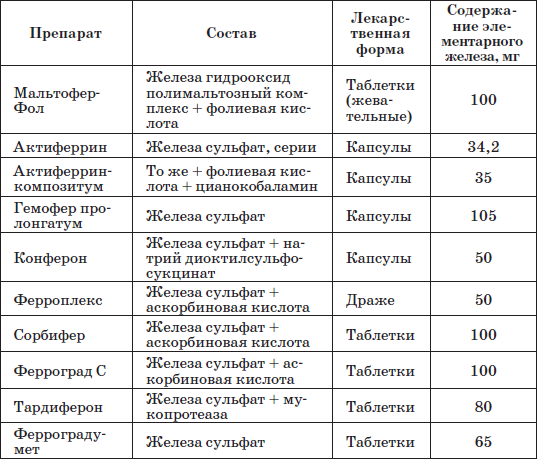
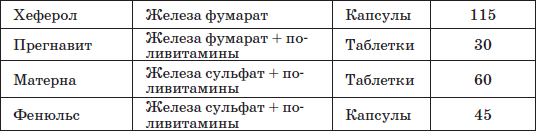
Таблица 23 Препараты железа, применяемые у детей раннего возраста
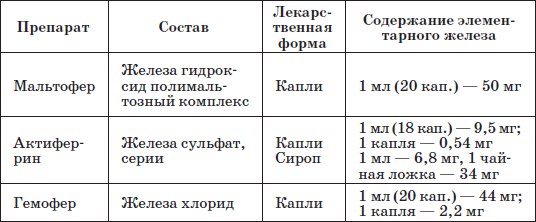
Патогенетическую терапию осуществляют лекарственными препаратами железа (ферроцерон, резоферон, конферон, актиферрин, ферроплекс, орферон) и витаминов. Чаще всего терапия железодефицитных состояний проводится препаратами железа для перорального приема. Это объясняется тем, что пероральный прием препаратов железа крайне редко вызывает серьезные побочные эффекты и не приводит к развитию гемосидероза, даже при неправильно установленном диагнозе (при неправильной трактовке анемии как железодефицитной), и при этом повышает уровень гемоглобина только на 2–4 дня позже, чем при парентеральном введении. При легкой и среднетяжелой анемиях применяют внутрь соли двухвалентного железа, которые всасываются активнее солей трехвалентного железа (лактат железа, аскорбинат железа, сироп алоэ с железом, гемостимулин и т. д.). При тяжелой форме или плохой переносимости энтеральных препаратов железо назначают парентерально (феррумлек, ферковен, ферамид, фербитол и др.).
Принимать железо рекомендуется между кормлениями или за 1 час до еды, так как некоторые ингредиенты пищи могут образовывать с ним нерастворимые соединения. Заливают препараты фруктовыми и овощными соками, особенно полезны соки цитрусовых. Детям раннего возраста средняя лечебная доза назначается из расчета 4–6 мг элементарного железа на 1 кг массы в сутки в 3 приема.
Прием железосодержащих препаратов нередко сопровождается побочными эффектами: может вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта, особенно если доза железа превышает 180 мг в сутки. Передозировка железа не менее опасна, чем его недостаток.
В профилактике железодефицитных анемий исключительно большое значение имеют: правильная организация режима, достаточное пребывание детей на свежем воздухе, своевременное введение соков и овощных прикормов, противорахитические мероприятия. Начинаться профилактика железодефицитной анемии должна в антенатальном периоде.
Гипо– и апластические анемии
Гипо– и апластические анемии объединяют группу заболеваний, основным признаком которых является функциональная недостаточность костного мозга, вызванная поражением одной, двух, а чаще всех трех ветвей гемопоэза, что выражается нормоцитарной нормохромной анемией и сопутствующей гранулоцитопенией и тромбоцитопенией (панцитопения).
Этиология. Гипо– и апластическое состояние костного мозга может быть обусловлено различными, как известными, так и неизвестными, патогенетическими факторами. Принято различать 2 основные группы гипопластических анемий: врожденные (конституциональная анемия Фанкони) и приобретенные, в результате воздействия ряда экзогенных факторов, к которым относятся: физические (лучевая энергия), химические (красители, бензены), медикаментозные (хлорэтиламины, антиметаболиты, сульфонамиды, некоторые антибиотики), инфекционные факторы (болезнь Боткина, диссеминированный туберкулез, сифилис, брюшной тиф, токсоплазмоз, тяжелый грипп, сепсис). В ряде случаев гипо– и апластические процессы в костном мозге связаны с аутоиммунными процессами.
Между гипопластическими и апластическими анемиями имеются как количественные, так и качественные различия. При апластической анемии отмечается более глубокое угнетение кроветворения. Гипопластическая анемия характеризуется умеренно выраженным нарушением процессов пролиферации и дифференциации кроветворных элементов.
Клиника. К ранним симптомам относятся общая слабость, утомляемость, боли в костях и суставах, геморрагический синдром (носовые кровотечения, кровоизлияния в кожу). Постепенно нарастают бледность кожи и слизистых оболочек. При врожденных формах гипо– и апластической анемии кожа имеет характерный пепельный оттенок. Печень несколько увеличена. Селезенка и периферические лимфоузлы не гиперплазированы. В крови – признаки анемии нормохромного типа, анизопойкилоцитоз. Количество ретикулоцитов снижено. СОЭ увеличена. Лейкопения с относительным лимфоцитозом. Тромбоцитопения иногда служит одним из ранних симптомов заболевания и обнаруживается до появления выраженной анемии.
Картина костного мозга в начальном периоде заболевания характеризуется некоторой реактивной гиперплазией эритронормобластического ростка с нарушением созревания клеток красного ряда. В дальнейшем костный мозг постепенно опустошается, редуцируется красный росток, увеличивается количество клеток лимфоидного типа. Особенно наглядно степень опустошения костного мозга и замещения миелоидной ткани жировой выявляется в прижизненных гистологических препаратах (трепанобиопсия).
Течение острое, подострое и хроническое. Иногда встречаются спонтанные ремиссии.
Врожденные панцитопенические анемии сходны с дефицитными анемиями клиническими проявлениями (бледность, головные боли и головокружение, пятнистая гиперпигментация кожи в подмышечных и паховых областях) и снижением уровня гемоглобина. Передаются по аутосомно-рециссивному типу. Проявляются поздно, чаще в возрасте 4-12 лет; нередко сопровождаются множественными пороками развития костной системы, почек, сердца, пигментного обмена, центральной нервной системы и органов чувств (анемия Фанкони) или носят семейный характер (анемия Эстрена-Дамешека), провоцируются различными заболеваниями, употреблением химических и лекарственных веществ, ионизирующей радиацией, иногда предшествуют развитию острого лейкоза.
Врожденная парциальная анемия Блекфена-Дайемонда характеризуется избирательным поражением только эритроидного ростка; протекает более доброкачественно, чем панцитопенические анемии. Проявляется на 1-2-м году жизни, для нее часто характерны своеобразная внешность ребенка (светлые волосы, широкая переносица, утолщенная верхняя губа с ярко-красной каймой), гипогонадизм и пороки развития половых органов.
У большинства больных наблюдается также спленогепатомегалия, нарастающая на фоне гемосидероза, обусловленного повторными переливаниями крови. Кроме того, извращены темпы окостенения (замедляется формирование ядер окостенения в запястье, запаздывает смена зубов, рано развивается кариес). В периферической крови – неуклонно прогрессирующая гипорегенераторная железорефрактерная анемия, преходящая эозинофилия. В пунктате костного мозга – гипопластический эритропоэз.
Приобретенная апластическая анемия (Эрлиха) у половины детей развивается после вирусных инфекций (гепатит А, грипп, корь, краснуха и др.)» контакта с химическими веществами или медикаментами (левомицетин, бутадион, акрихин, противосудорожные препараты), у остальных расценивается как идиопатическое заболевание. Отличается бурным развитием клинических симптомов (особенно острая и подострая формы), выраженной температурной реакцией и интоксикацией, «алебастровой» бледностью, геморрагическими и некротическими проявлениями (сыпи на коже и слизистых оболочках, некротические стоматит и ангина, кровавые рвота и стул), незначительными изменениями внутренних органов. В анализе крови – резкое снижение содержания гемоглобина, панцитопения, гиперхромия и макроцитоз эритроцитов, агранулоцитоз, токсическая зернистость нейтрофилов. Ретикулоцитоз снижен или отсутствует, СОЭ очень большая. Содержание железа в сыворотке нормальное или умеренно повышенное. Решает диагноз пунктат костного мозга, в котором отмечается жировое перерождение, бедность форменными элементами, отсутствие молодых форм миелоцитарного и эритроидного ряда, мегакариоцитов и клеток-предшественников. Имеющиеся клетки созревают замедленно, кроветворение мегалобластического типа.
Диагноз. Гипо– и апластические анемии диагностируют на основании изменений периферической крови (низкий уровень гемоглобина, панцитопения, отсутствие или резкое снижение числа ретикулоцитов и других молодых форм, значительное увеличение СОЭ) и пунктата костного мозга (бедность форменными элементами, замедленное созревание всех клеток крови).
Лечение. Острые формы требуют немедленной заместительной терапии: трансфузии свежей крови или эритроцитной массы до достижения показателей гемоглобина 80–90 г/л в сочетании с введением кортикостероидов, анаболических гормонов (андрогены) и массивной антибиотикотерапией в случае присоединения инфекции; больной должен быть огражден от всех возможных контактов с инфекциями. Необходим тщательный уход за кожей и слизистыми оболочками с применением местных антисептических средств. Витаминотерапия – витамин С и группы В, с обязательной поддерживающей терапией по достижении клинической ремиссии. Трансплантацию костного мозга осуществляют после тщательного подбора донора по лейкоцитарным и другим антигенам крови, на фоне иммунодепрессивной подготовки реципиента.
При всех формах врожденных и приобретенных гипо-и апластических анемий прогноз очень серьезен.
Гемолитические анемии
Гемолитические анемии характеризуются патологически повышенным разрушением эритроцитов и могут быть наследственными и приобретенными.
Наследственная микросфероцитарная анемия (семейная гемолитическая желтуха, болезнь Минковского-Шоффара).
Этиология. В основе заболевания лежит генетически обусловленная аномалия структуры мембраны эритроцитов, характеризующихся неправильной формой (сфероцитоз). Такие эритроциты в силу пониженной осмотической и механической резистентности подвергаются усиленному разрушению преимущественно в селезенке (внутриклеточный гемолиз), вследствие чего развивается анемия, гемолитическая желтуха, гиперплазия селезенки. Наследуется по аутосомно-доминантному типу. Вероятность заболевания у потомства – 50 %. Продолжительность жизни неполноценных эритроцитов составляет всего 8-10 дней.
Клиника. Болезнь может выявляться у детей разного возраста, начиная с периода новорожденности. Встречаются случаи со скрытым течением, которые диагностируются в более позднем периоде жизни. Клинические симптомы заболевания очень разнообразны. Наиболее ранним и характерным признаком микросфероцитоза является желтуха. Она меняется в своей интенсивности, усиливаясь в периоды гемолитических кризов. В дальнейшем появляются анемия и спленомегалия. Печень увеличивается в меньшей степени. Желтуха, анемия, спленомегалия – классическая клиническая триада при сфероцитарной анемии. При раннем появлении заболевания наблюдается отставание общего развития ребенка. Могут присоединяться симптомы, связанные с анемизацией больного: адинамия, вялость, головокружение, сердцебиение и др. Иногда гемолитическая анемия осложняется желчнокаменной болезнью с клинической картиной ангиохолецистита и паренхиматозного гепатита. У некоторых больных выявляются врожденные стигмы («башенный» череп, широкая переносица, высокое небо, прогнатизм и т. д.). К редким симптомам у детей следует отнести трофические язвы голеней.
Течение болезни циклическое и характеризуется чередованием гемолитических кризов и ремиссии. Обострению обычно предшествуют различные экзогенные факторы: интеркуррентные инфекции, травмы и пр.
Диагноз. Картина крови характеризуется следующей триадой: микросфероцитозом; ретикулоцитозом; понижением осмотической резистентности эритроцитов. При бессимптомном течении заболевания количество эритроцитов и гемоглобина остается нормальным. Гипербилирубинемия за счет неконъюгированного билирубина. Во время гемолитических кризов число эритроцитов может катастрофически падать (до 21012/л и ниже).
Лечение. Радикальным методом лечения является удаление селезенки – основного органа кроверазрушения, после чего наступает клиническое выздоровление, хотя сфероцитоз и сниженная осмотическая резистентность эритроцитов остаются. При редких и быстро купирующихся гемолитических кризах, особенно в раннем возрасте, показания к спленэктомии относительны. Антианемические мероприятия (гемотрансфузии цельной крови, витамин В12, железо и кортикостероиды) малоэффективны и даже противопоказаны. Прогноз чаще благоприятный.
Анемия гемолитическая несфероцитарная наследственная (анемия макроцитарная; врожденная гемолитическая анемия Дайка-Янга).
Этиология. Заболевание семейно-наследственного характера, обусловленное доминантно унаследованной неполноценностью эритроцитов (нарушение различных ферментных систем, утилизации глюкозы), приводящей к ускоренному разрушению последних. Наиболее частой причиной является дефицит глюкозо-6-фосфатдегидрогеназы, пируваткиназы, пониженное содержание восстановленного глютатиона. При дефиците Г-6-ФД гемолитические кризы чаще всего могут быть спровоцированы лекарственными средствами (сульфаниламидные препараты, нитрофурановые производные, препараты изоникотиновой кислоты).
Клиника очень сходна с таковой при врожденном сфероцитозе (анемия, ретикулоцитоз, билирубинемия, желтуха, спленомегалия).
Диагноз ставится на основании клинико-гематологических данных, макро– или нормоцитоза, нормальной осмотической стойкости эритроцитов, отсутствия сфероцитоза, отрицательной пробы Кумбса, выявления дефицита указанных ферментов в эритроцитах.
Лечение симптоматическое. Препараты железа, витамин В неэффективны. При резко выраженной анемии проводятся трансфузии эритроцитной массы, применяются кортикостероиды. Спленэктомия малоэффективна. Прогноз серьезный, особенно при частых гемолитических кризах.
Серповидноклеточная гемолитическая анемия (африканская анемия; дрепаноцитоз).
Этиология. Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу. В основе лежит нарушение строения белка гемоглобина, при котором он приобретает особое кристаллическое строение – так называемый гемоглобин S, поэтому такие эритроциты под микроскопом имеют характерную форму серпа, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, повышено их разрушение в селезенке, срок их жизни укорочен, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Клиника. У гетерозиготных носителей в эритроцитах присутствуют примерно в равных количествах гемоглобин S и гемоглобин А, при этом в нормальных условиях у носителей симптомы практически никогда не возникают, и серповидные эритроциты выявляются случайно при лабораторном исследовании крови. Симптомы у носителей могут появиться при гипоксии (например, при подъеме в горы) или тяжелом обезвоживании. У гомозиготных носителей в крови только серповидные эритроциты, несущие гемоглобин S, и болезнь протекает тяжело.
Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина). Кроме этого, периодическая закупорка мелких капилляров в любой части тела может привести к широкому спектру различных симптомов.
Обычно проявления заболевания отсутствуют до 3-х мес. Первыми признаками серповидноклеточной анемии у младенца обычно являются опухание и болезненность кистей рук или стоп, слабость и искривление конечностей, иногда отказ от ходьбы. Ребенок выглядит бледным, слегка желтушным, но в остальных отношениях, как правило, здоров. Единственным серьезным осложнением у ребенка до 5-летнего возраста является инфекция. Проблема детей школьного возраста – эпизодическая закупорка эритроцитами капилляров больших костей, сопровождающаяся слабыми ноющими болями в костях, физическое развитие задерживается на 2–3 года.
Криз проявляется в резком ухудшении самочувствия, при этом больной может жаловаться на острые боли в груди или в животе, головные боли, ригидность мышц затылка или сонливость. Все это нередко сопровождается высокой температурой, потливостью, иногда – отеком рук и ног. При наступлении криза больной нуждается в срочной госпитализации.
Диагноз. В основе диагностики серповидноклеточной анемии лежит анализ физических свойств гемоглобина (исследование «влажного мазка»).
Лечение. На сегодняшний день серповидноклеточная анемия – неизлечимая болезнь. Правильное ведение больных с хронической серповидноклеточной анемией способствует предотвращению тяжелых обострений (кризов) и продлению жизни.
Талассемия (мишеневидноклеточная анемия; средиземноморская анемия; анемия Кули).
Этиология. Талассемия обусловлена нарушением синтеза полипептидных цепей глобина, дефектом утилизации железа и преобладанием в крови патологических гемоглобинов. При этом наблюдается гипохромная и микроцитарная анемия.
Различают несколько типов талассемии, вызываемых различными мутациями. Талассемии встречаются в гомозиготных и гетерозиготных формах, клинически делятся на большую, промежуточную, малую и минимальную.
Клиника. По степени выраженности клинических проявлений различают тяжелую форму, заканчивающуюся смертью больного в возрасте до года, хроническую средней тяжести, когда больные доживают до школьного возраста, и хроническую с легким течением, при которой больные доживают до зрелого возраста.
У гетерозиготных носителей гена заболевание протекает легко или не проявляется совсем. У гомозиготных носителей гена и при комбинированных формах развивается тяжелая форма талассемии (большая талассемия, анемия Кули). Течение заболевания характеризуется тяжелой гемолитической анемией, проявляющейся к концу первого года жизни ребенка, гепато– и спленомегалией, монголоидностью лица и «башенным» черепом, отставанием ребенка в физическом развитии, нередко желтушностью и бледностью кожных покровов. У части больных развиваются язвы в области голеней. Часто развиваются перикардит, цирроз печени, гиперспленизм и снижение иммунитета.
Диагноз. Рентгенографически выявляются типичные изменения скелета: остеопороз, патологические переломы, радиальная исчерченность черепа в виде «щетки». При анализе крови определяются гиперрегенераторная анемия с выраженным ретикулоцитозом, нормо– и эритробластозом и мишеневидными эритроцитами, с базофильной пунктуацией; снижение продолжительности жизни эритроцитов при нормальной осмотической их стойкости; повышение уровня непрямого билирубина крови; нормальный или умеренно повышенный уровень сывороточного железа; повышение содержания фетального (F) и гемоглобина А2 при снижении «взрослого» гемоглобина (А) до 10 % (при гомозиготной форме большой талассемии Кули). Десфераловая проба выявляет высокую сидероурию. Лечение препаратами железа неэффективно.
Лечение легких форм симптоматическое. Назначают фолиевую кислоту курсами по 3 недели каждые 3 мес., по 1–2 мг/сут. При среднетяжелых формах переливают отмытые эритроциты по мере необходимости, проводят курсы дефероксамина для выведения лишнего железа, спленэктомию. При выраженной талассемии единственный радикальный метод лечения – трансплантация красного костного мозга.
Приобретенные идиопатические аутоиммунные гемолитические анемии (АГА)
Этиология. Большинство приобретенных гемолитических анемий носит аутоиммунный характер. В тех случаях, когда появление аутоантител не удается связать с каким-либо патологическим процессом, говорят об идиопатической аутоиммунной гемолитической анемии, которая составляет около 50 % всех аутоиммунных анемий. Образование аутоантител происходит в результате нарушения в системе иммунокомпетентных клеток, которые воспринимают эритроцитарный антиген как чужеродный и начинают вырабатывать к нему антитела.
Клиника. Аутоиммунные гемолитические анемии могут выявляться в любом возрасте (чаще у старших детей). По клиническому течению выделяют острую и хроническую аутоиммунную гемолитическую анемию. При острых формах у больных развивается картина гемолитического криза – внезапно появляется возбуждение или сонливость, резкая слабость, головная боль, сердцебиение, одышка, лихорадка, желтуха, увеличение печени. Иногда единственным симптомом заболевания является бледность кожных покровов. При хронических формах заболевание развивается исподволь. Общее состояние больных изменяется мало.
Диагноз аутоиммунной гемолитической анемии ставится на основании признаков повышенного гемолиза и выявления фиксированных на поверхности эритроцита антител при помощи проб Кумбса.
Лечение. Основным методом является глюкокортикоидная терапия, эффективная у 2/3 больных. При отсутствии эффекта применяются иммунодепрессанты, облучение тимуса, тимэктомия, спленэктомия. В момент гемолитического криза при резком снижении гемоглобина производят переливание отмытых эритроцитов или крови специально подобранного донора.
Прогноз в большинстве случаев благоприятный, достигается клиническая ремиссия или полное выздоровление; иногда возможен летальный исход.

