Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Химия привлекательности
Дальше: Щедрый этилен и его потомки
Многократное уплотнение
Два слова в заголовке – это дословный перевод термина «поликонденсация». Это своеобразное сочетание греческого и латинского корней: поли– (греч. πολύ – «многочисленный») и конденсация (лат. сondēnsāre – «уплотнять»). Поликонденсация – следующий (после полимеризации) распространенный способ получения полимеров. Если полимеризация – результат творчества химиков, то поликонденсация по существу – копирование природных процессов. При полимеризации рост цепи происходит благодаря раскрытию двойных связей или циклов. Рост цепи при поликонденсации происходит в результате взаимодействия двух реакционных групп в соседних молекулах, что сопровождается выделением низкомолекулярного продукта, обычно это вода, спирты, NaCl. Все природные полимеры образуются в результате поликонденсации.
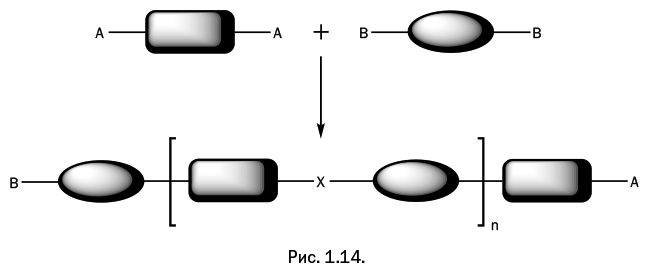
Таким образом, в реакции участвуют два соединения, у каждого имеются две реакционноспособные (функциональные) группы А и B, при их взаимодействии образуется мостиковая группа, обозначенная Х (рис. 1.14).
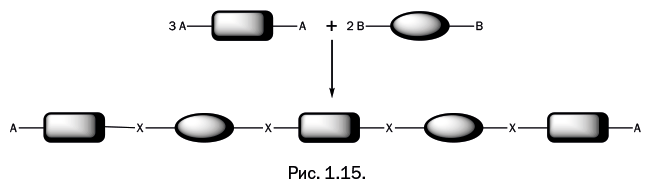
Важно, чтобы группы А и B могли вступать в реакцию друг с другом. Фрагменты двух молекул соединяются, и выделяется побочный низкомолекулярный продукт реакции, который можно легко отделить. Логически рассуждая, мы приходим к выводу, что если в реакционной смеси одно из соединений присутствует в большем количестве, чем второе, то рост полимерной цепочки быстро остановится, и на концах получившейся молекулы окажутся фрагменты того соединения, которое имеется в избытке (рис. 1.15).
Поэтому для получения длинных полимерных цепочек берут исходные соединения в эквимолекулярном соотношении, то есть 1:1. Реагентов, удовлетворяющих требованиям поликонденсации, очень много, но далеко не все стали основой производимых полимеров. Практика отобрала те варианты, которые образуют полимеры с интересными и полезными свойствами, не требуют сложного производства и экономически оправданны.
Полимер, вызвавший покупательскую истерию
В 1935 г. американский ученый У. Карозерс, ведущий химик компании DuPont, создал новый полимер. Он провел поликонденсацию адипиновой кислоты и гексаметилендиамина (рис. 1.16). При взаимодействии карбоксильных групп – С(О)ОН и аминогрупп – NH2 выделяется вода и образуется группировка – C(O)NH-, называемая амидной.
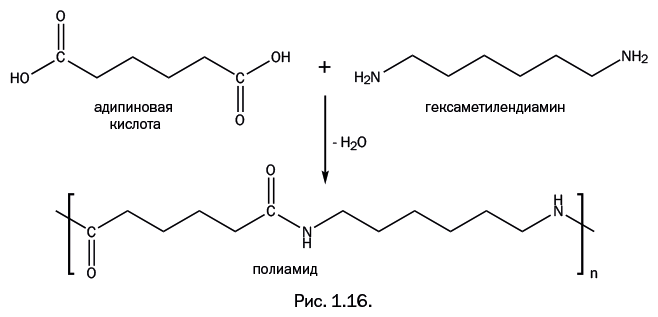
Естественно, полимеры с такими группами в цепи стали называть полиамидами. Для полимера, полученного Карозерсом, общепринятым стало название «нейлон». Существует предположение, что это объединение сокращенных названий двух городов – Нью-Йорка и Лондона: NYLON = New York + London.
Полимер размягчается при 260 оС, после чего его можно продавливать сквозь фильеру, чтобы на выходе получить тонкие нити. В 1938 г. началось промышленное производство нейлона, причем оно было сразу ориентировано на производство дамских чулок. Ранее чулки вязали из более привычных материалов – хлопка, шелка, вискозы, поэтому тонкие прозрачные чулки стали настоящей революцией. Товар оказался столь востребованным, что вызвал массовую истерию: вокруг универмагов, в которых продавались чудо-чулки, выставлялись полицейские посты, чтобы сдерживать толпы покупательниц, пытающихся прорваться к прилавкам. Сразу же после покупки женщины разрывали упаковку и надевали обновку прямо на улице. В первый же день появления в магазинах было продано семьдесят две тысячи пар новых чулок, а за первый год – 70 млн пар. Никогда в истории торговли ни один товар не имел такого успеха. Повышенный спрос не утихал вплоть до начала Второй мировой войны, когда нейлон был объявлен стратегическим материалом. Из него начали шить парашюты, палатки, тенты для военных машин, походные рюкзаки, военное обмундирование. Нейлоновые чулки можно было купить только по специальным карточкам, но после окончания Второй мировой свободная продажа возобновилась, и в первый же день в нью-йоркском универмаге Macy's за шесть часов было раскуплено 50 тысяч пар чулок.
К концу 1960-х гг. в моду вошли мини-юбки, чулки с поясом и резинками стали выглядеть неэстетично, и в результате производители придумали колготки, которые быстро обогнали чулки по количеству продаж. В настоящее время из нейлона делают не только чулки и колготки: его используют при изготовлении втулок, корпусов подшипников, так как он имеет низкий коэффициент трения и к тому же незаменим в производстве парашютов.
Можно регулировать свойства нейлона – как и других полиамидов. В этих полимерах присутствует заметное количество областей, где участки полимерных молекул расположены упорядоченно, они образуют включения кристаллической фазы, причем одна и та же макромолекула может проходить через кристаллические и аморфные области (рис. 1.17).

Между участками полимерных молекул в кристаллической фазе существуют особые «взаимоотношения». Карбонильные группы в одной молекуле и аминогруппы в соседней молекуле взаимодействуют, образуя так называемые водородные связи >С=О…Н – N<. О подобных связях между НО-группами в целлюлозе рассказывается в разделе «Лидер среди природных полимеров». Именно водородные связи формируют в полиамидах кристаллическую структуру.
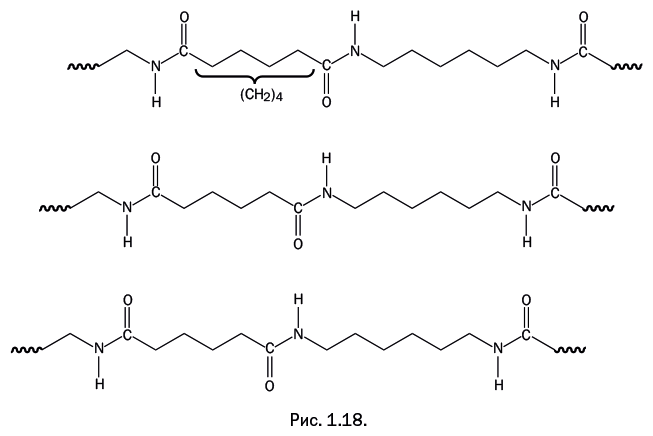
Если между двумя карбонильными группами четное количество атомов углерода – точнее, метиленовых групп -СН2– (на рис. 1.18 показаны четыре такие группы), то амино– и карбонильные группы в соседних цепях располагаются столь удачно, что каждая из них легко дотягивается до соседней, образуя водородную связь. В результате возникает плотная сетка, и температура плавления кристаллических областей достигает 260 оС.
Если в цепочку, связывающую карбонильные группы, добавить еще одну метиленовую группу (рис. 1.19, пять метиленовых групп), то взаиморасположение карбонильных и аминогрупп в соседних цепях оказывается менее удачным: часть из них не «дотягивается до соседей», сетка водородных связей становится более редкой, и температура плавления кристаллических областей снижается.
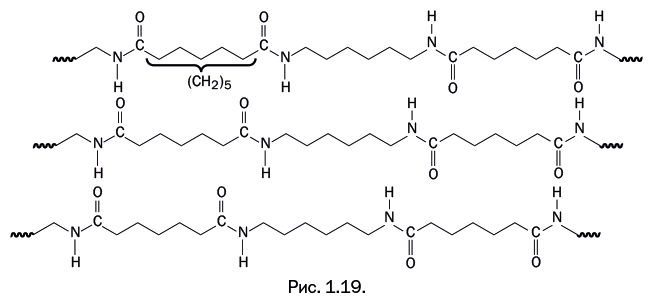
Добавление еще одной метиленовой группы вновь обусловливает «удачное» расположение >С=О и Н – N< – групп, и температура плавления повышается. Это отчетливо видно на графике, иллюстрирующем зависимость температуры плавления кристаллических областей в полиамидах от расстояния между карбонильными группами: полимеры с четным количеством метиленовых групп плавятся при более высоких температурах (рис. 1.20).
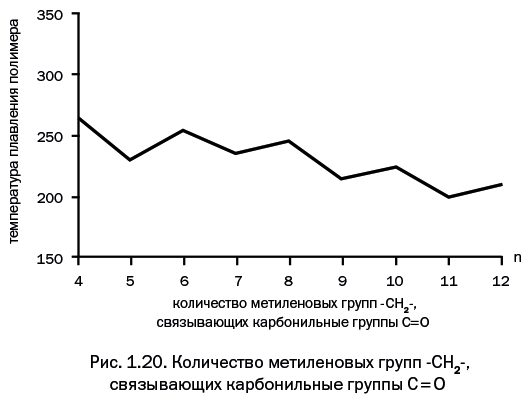
Кристаллическая фаза повышает прочность и понижает пластичность. Таким образом, изменяя состав исходных соединений, можно регулировать свойства полиамидов.
Как обойти патент
Необычайный коммерческий успех нейлона привлек внимание других стран – в первую очередь Германии, где химия была высокоразвитой. Патент на производство нейлона принадлежал американской фирме DuPont, и потому производство этого полимера другой фирмой и тем более в другой стране требовало соответствующих выплат владельцам патента. Германия же очень быстро, буквально в тот же год, когда в США в продаже появились нейлоновые чулки, нашла оригинальное решение. Немецкий химик П. Шлак предложил иной способ получения полиамида, имеющего точно такой же состав, как у нейлона. Исходным соединением был циклический амид капроновой кислоты, называемый капролактамом. Поясним название. Капроновая кислота С5Н11С(=О)ОН получила свое название потому, что содержится в жире козьего молока (лат. capra – коза) и в свободном состоянии имеет характерный «козлиный» запах. Как и любая карбоновая кислота, она может образовывать амид, то есть группировку – С(=О) – NH-. Если амид замкнут в цикл, его называют лактамом. Капролактам и раскрытие его цикла с образованием полиамида, получившего название «капрон», показаны на рис. 1.21. В Германии этот полимер называют «перлон».
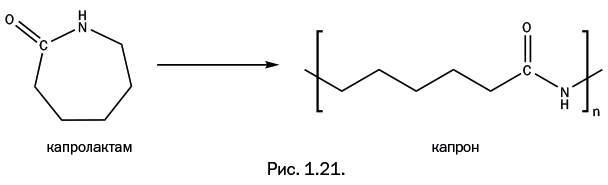
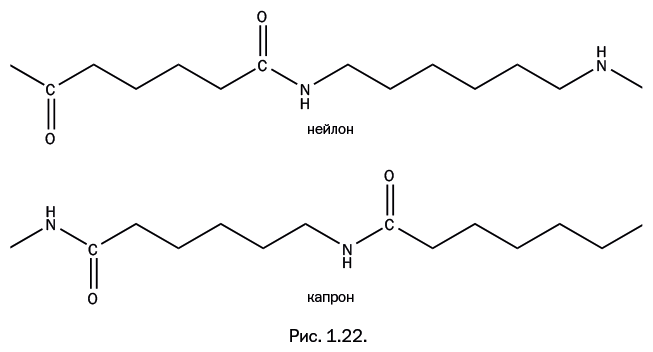
Состав капрона (количество всех атомов в элементарном звене полимера) действительно совпадает с составом нейлона, но главное заключается в другом. Если бы Германия предложила иной способ получения нейлона с тем же строением, то запатентовать такой полиамид вряд ли получилось бы. Важно, что строение – то есть порядок расположения атомов – различно. Сравните строение цепи нейлона и капрона (рис. 1.22).
В нейлоне путь от одной группы NH до такой же ближайшей группы проходит исключительно по цепочке из – CH2-групп, а при движении между этими группами в капроне неизбежно «встретится» группа C=O. Иными словами, получается, что фрагменты диамина и дикарбоновой кислоты соединены в нейлоне по принципу «голова к голове» и «хвост к хвосту», а в капроне – «голова к хвосту» (рис. 1.30). Именно это различие в строении позволило Германии организовать независимое производство практически такого же полиамида. Области применения нейлона и капрона совпадают, однако капрон размягчается при более низкой температуре и потому более удобен в переработке.
Самый прочный полиамид
В середине 1960-х гг. фирма DuPont вновь сумела всколыхнуть полимерную химию. Решая задачу разработки волокна с повышенной прочностью, которое могло бы вытеснить стальной корд в автомобильных шинах, химик-исследователь Стефани Кволек заменила в структуре нейлона цепочки из метиленовых групп – СН2– бензольными ядрами, и полученный ароматический полиамид получил название «кевлар» (рис. 1.23).
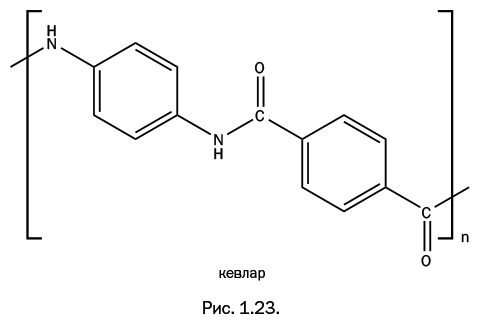
Кевлар устойчив к воздействию химических веществ, не горит, не размягчается при нагревании и начинает разлагаться только при температуре 430–480 оC. Прядение волокон производят из раствора (обычно в серной кислоте). Волокно из кевлара в семь раз прочнее стального волокна, причем с понижением температуры его прочность увеличивается. Такие волокна добавляют в оптоволоконный кабель, поскольку нить предотвращает его растяжения и разрывы по всей длине кабеля. Ткань из кевлара невозможно порвать, порезать или растянуть, из нее делают перчатки и защитные вставки в спортивную одежду для мотоспорта или сноубординга. Самый известный способ применения – изготовление бронежилетов, и, разумеется, кевлар применяют в той области, для которой он и создавался, – им заменяют тяжелый стальной корд в автомобильных шинах (кордом называют прочные нити, которые встроены в полимерный материал шины для увеличения прочности).
Назад: Химия привлекательности
Дальше: Щедрый этилен и его потомки

