Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Рискуя здоровьем и жизнью
Дальше: Досуг и увлечения
Судьба открытий и их авторов
Предвидеть результаты эксперимента, почувствовать обобщающее правило, угадать закономерность – это моменты удачи в творчестве многих ученых. Чаще всего прогноз распространяется только на ту область, которой занят исследователь, и далеко не каждому дана решимость храбро шагнуть далеко вперед в своих предсказаниях. Но порой способность к логическим построениям добавляет смелости.
Фундаментальный закон, открытый с помощью рассуждений
Идея о том, что все окружающие нас тела состоят из мельчайших частиц, возникла очень давно. Само слово «атом», обозначающее неделимую часть вещества, было введено мыслителями древности Левкиппом и Демокритом (около 500 г. до н. э.). Их идеи были затем развиты Эпикуром (около 300 г. до н. э.) и Лукрецием Каром (около 60 г. до н. э.). В своей знаменитой поэме «О природе вещей» Лукреций Кар в поэтической форме развивает цепочку размышлений, которая подводит нас к мысли о существовании невидимых мельчайших частиц материи:
…что существуют тела, которых мы видеть не можем.
Ветер, во-первых, морей неистово волны бичует,
Рушит громады судов и небесные тучи разносит…
…далее запахи мы обоняем различного рода,
Хоть и не видим совсем, как в ноздри они проникают.
Также палящей жары или холода нам не приметить
Зреньем своим никогда, да и звук увидать невозможно.
Поэма остается актуальной и в наши дни, показывая чисто научный подход к изучению явлений. Исследователь, основываясь только на наблюдениях, приходит к важным выводам.
Дальнейшее развитие идеи о том, что все тела состоят из мельчайших частиц, ранее называвшихся корпускулами, появляется в 1661 г. в трудах Роберта Бойля, а затем в работах М. В. Ломоносова, Дж. Дальтона, Ж. Гей-Люссака. Наибольший вклад в развитие этих понятий внес А. Авогадро (1776–1856). О нем следует рассказать более подробно, поскольку с помощью рассуждений он сумел открыть фундаментальный закон, основываясь на не очень обширных экспериментальных данных, доступных в его время. Ему удалось свести воедино и осмыслить работы двух предшественников. Первый – это Дж. Дальтон (1766–1844), определивший соотношение элементов в ряде простых соединений с помощью введенных им относительных атомных масс. Второй ученый – Ж. Гей-Люссак (1778–1850), который в 1805 г. сформулировал следующий закон: газы в процессе реакции соединяются в простых объемных отношениях.
Иначе говоря, реакция водорода с хлором происходит при соотношении их объемов 1:1, объемов водорода с кислородом – 2:1 и т. д. Разумеется, как настоящий исследователь, он отмечал, какой объем занимает полученный газ. Объемы всех газов он измерял в одинаковых условиях, поскольку уже отлично знал, как объем газа зависит от температуры (это первый газовый закон Гей-Люссака, который изучают в начальном курсе физики).
Забудем наше современное знание химии и будем следить только за изменением объемов.
Из 1 л водорода и 1 л хлора образуется 2 л хлорида водорода (HCl).
Из 1 л кислорода и 1 л азота получается 2 л оксида азота (NO).
Происходит простое суммирование объемов. Далее закономерность нарушается.
Из 2 л оксида углерода и 1 л кислорода получается 2 л диоксида углерода CO2 (из 3 л получили 2 л).
Из 2 л водорода и 1 л кислорода – 2 л водяного пара (вновь не хватает 1 л).
В полученных результатах Гей-Люссак не сумел почувствовать закономерность, зато она не ускользнула от Авогадро. Чтобы создать стройную картину, он использовал те соотношения элементов в полученных газах, которые были установлены Дальтоном с помощью введенных им относительных атомных масс. Если свести воедино имеющиеся сведения, то получится на первый взгляд бессистемная таблица.

Как можно вывести какую-либо закономерность из представленных данных? По существу, это логическая задача, которая даже в наше время трудна для человека, не знакомого с химией. Авогадро сумел справиться с ней блестяще.
Не будем забывать, что во времена Авогадро не существовало современных химических формул и, кроме того, не были сформулированы понятия атома и молекулы, что значительно затрудняло словесное изложение его логических построений.
Смелое допущение, которое сделал Авогадро, состояло в том, что исходные газы – водород, азот, кислород и хлор – не простые, а составные, иначе говоря, они состоят не из одной, а из двух частиц (то есть атомов). Как только он допустил, что они двухатомны, картина сразу прояснилась. Фактически он сумел изобразить все реакции, только представил все не в виде формул, а в словесном описании. Естественно, он руководствовался законом сохранения вещества, установленным ранее А. Лавуазье. В современном написании все выглядит просто и вполне привычно (рис. 9.8).
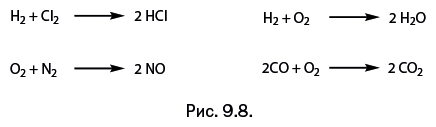
Обратите внимание, как строго стали соответствовать экспериментальные данные (объемы исходных и полученных газов) коэффициентам в уравнениях реакций: из 1 л водорода и 1 л хлора образуется 2 л хлороводорода. Все удалось привести в систему. Фактически с помощью рассуждений Авогадро открыл, что исходные газы двухатомны. После этого в рассуждениях наступил решающий этап.
В 1 л водорода содержится некое количество частиц, и они занимают объем 1 л. В образовавшихся 2 л хлористого водорода также содержится некое количество частиц, но уравнение реакции показывает, что их вдвое больше, чем двухатомных частиц водорода. Если мы возьмем половину всех образовавшихся частиц хлористого водорода, то они займут, естественно, объем вдвое меньший, то есть 1 л, и в нем будет содержаться вдвое меньше частиц хлористого водорода, то есть ровно столько же, сколько было взято частиц водорода.
Эти рассуждения, приведенные в семи вышестоящих строках, все же требуют для понимания некоего умственного напряжения. Поразительно то, что Авогадро сумел заметить закономерность, не имея возможности записать все в виде компактных формул. Окончательный вывод: в объеме 1 л помещается одинаковое количество частиц и водорода, и хлористого водорода. Проведенное рассуждение полностью справедливо в отношении всех газов. Теперь мы можем сформулировать сам закон: равные объемы газов (при одинаковых температуре и давлении) содержат одинаковое количество частиц, то есть молекул. В результате произошло четкое разделение понятий «атом» и «молекула». Двухатомные газы представляют собой молекулы, и эти понятия стали фундаментальными в атомно-молекулярном учении. Если для выведения закона все же требуется некоторое усилие мысли, то окончательная формулировка, предложенная Авогадро в 1811 г., предельно проста и понятна.
Амедео Авогадро почти всю жизнь провел в Турине, где около 30 лет возглавлял кафедру университета. Это был исключительно скромный, лишенный честолюбия человек, сохранивший до глубокой старости интерес к науке и творческую активность. Судьба закона при жизни Авогадро была печальной: закон попросту не поняли либо, скорее всего, не обратили на него внимания. Вероятно, самая жаркая критика и резкое неприятие лучше, чем равнодушие и забвение.
Спустя почти 50 лет известный итальянский химик С. Канницаро обратил внимание ученых на результаты работы Авогадро, и закон получил широчайшее распространение. Из этого закона следует один важный вывод. Допустим, вы начали определять плотность различных газов, то есть массу 1 м3 каждого газа. Экспериментально найденные плотности, естественно, различаются между собой. Теперь вспомним закон Авогадро – в каждом кубометре газа одинаковое количество частиц, независимо от химической природы газа. Следовательно, плотности различаются только потому, что различны молекулярные массы взятых газов. Полученный вывод позволяет взять один газ с известной молекулярной массой (например, водород) и путем сопоставления плотностей вычислить молекулярные массы других газов (метана, этана, пропана). Созданный закон открыл широкие возможности для экспериментальной химии. В 1911 г. в Турине состоялся международный химический съезд, посвященный столетию открытия закона Авогадро, были изданы труды ученого и открыт памятник.
Логика Авогадро оказалась безупречной, а правильность его закона позже подтвердил Дж. Максвелл расчетами на основе кинетической теории газов. Затем были получены и экспериментальные подтверждения (например, основанные на исследовании броуновского движения), определено количество частиц, содержащихся в моле каждого газа. Эту константу 6,02•1023 назвали числом Авогадро, увековечив имя проницательного исследователя.
Опередившие время
Бывают случаи, когда сделанное открытие намного опережает существующий уровень знаний, и тогда практически никто не может предсказать его судьбу, в том числе и сам автор.
М. Фарадей, открывший явление электромагнитной индукции, на вопрос своего учителя Г. Дэви, где удастся его применить, ответил, что, вероятно, можно будет делать какие-нибудь игрушки. Оказалось, что создавать можно совсем не игрушки – на этом открытии основана вся современная электроэнергетика.
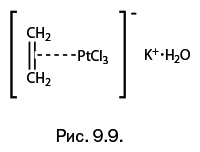
В 1827 г. датский химик В. Цейзе получил необычную соль, в которой, помимо неорганических ионов, присутствовала нейтральная органическая молекула этилена – KCl • PtCl2 • C2H4 • H2О. Состав соединения, названного солью Цейзе, вызвал удивление, но формулу, предложенную автором, химики, среди которых был авторитетнейший Ю. Либих, никак принять не могли. Естественно, и автор не мог объяснить строение и тем более предсказать судьбу нового соединения. Ученые смогли понять ее строение лишь в 1950-х гг. (спустя почти 130 лет!), когда стала интенсивно развиваться химия комплексов переходных металлов. В современном написании соль Цейзе выглядит несколько иначе. Пунктирная линия от молекулы этилена к атому платины обозначает π-комплексную связь (рис. 9.9). В настоящее время химия π-комплексов переходных металлов представляет собой крупную главу современной науки.
Английский физик Э. Резерфорд, лауреат Нобелевской премии 1908 г. по химии, впервые осуществивший в 1919 г. искусственное расщепление атома азота до атома кислорода с помощью α-частиц, считал чистым вздором надежды на то, что таким способом можно будет получать энергию. Свою уверенность Резерфорд передал ученику, немецкому ученому О. Гану, который в 1934 г. буквально высмеял известного химика Иду Ноддак, обратившуюся к нему с идеей расщеплять атомы с помощью нейтронов. О. Ган посоветовал И. Ноддак не выступать публично с подобными мыслями, чтобы не потерять репутацию хорошего ученого.
Через пять лет Ган экспериментально обнаружил то, что ранее предположила Ида Ноддак, и это стало одним из самых важных явлений ХХ столетия. Деление ядер урана под действием нейтронов заложило основу ядерной энергетики. В 1945 г. О. Ган был удостоен Нобелевской премии за открытие деления тяжелых ядер.
Передовые идеи и исследования всегда встречают ироническое отношение современников, поскольку они не сулят моментальной и очевидной пользы. Альберт Эйнштейн, понимавший, что путь от его теорий к реальным применениям весьма далек, как-то заметил, что "понимает теперь, почему так приятно колоть дрова: дело идет без задержек и видишь сразу результат своих трудов!".
Результатами работы Эйнштейна многие из нас уже пользуются постоянно – речь идет о спутниковой навигации. Спутники, посылающие навигационные сигналы, постоянно движутся вокруг Земли, и, согласно теории Эйнштейна, скорость течения времени на них другая, нежели на Земле, поэтому приходится вводить соответствующие поправки (20–30 наносекунд), что позволяет с точностью до нескольких метров определять координаты объекта на Земле – например, движущегося автомобиля. Без введения таких поправок точность определения координат резко снижается.
Не все всегда справедливо
Судьба не всегда делит славу строго по справедливости. Ранее было рассказано, что работы Бойля и Мариотта разделяет 15 лет, и тем не менее их имена стоят рядом, но есть иные примеры. Через три года после того, как А. Авогадро опубликовал свой знаменитый закон (см. раздел «Фундаментальный закон, открытый с помощью рассуждений»), в 1814 г. появилась статья французского физика А. Ампера, где он сформулировал положения, очень близкие к закону Авогадро. Позже Ампер признавал, что с работами Авогадро ознакомился после опубликования своей статьи, и на своем приоритете не настаивал. Справедливости ради следует отметить, что в редких научных изданиях можно встретить словосочетание «закон Авогадро – Ампера».
Голландский химик Я. Вант-Гофф, работая в Париже, познакомился с французским химиком Ж. Ле Белем, и вместе они иногда обсуждали вопросы стереохимии. Ле Бель независимо от Вант-Гоффа и почти в то же самое время предложил ввести понятие асимметрического атома, объясняющего оптическую активность. По воспоминаниям современников, между Вант-Гоффом и Ле Белем никогда не возникало споров о приоритете: они всегда относились друг к другу с взаимным уважением. Тем не менее Я. Вант-Гофф вошел в историю науки как основатель стереохимии, а имя Ле Беля известно лишь историкам. Не следует думать, что Вант-Гофф энергично добивался признания своих заслуг, – есть примеры того, как он уступал право приоритета, хотя имел все основания считать себя первооткрывателем. Известный принцип смещения равновесия при изменении внешних условий носит имя А. Ле Шателье, который в простой форме объясняет, как можно сдвинуть равновесие: при воздействии на химическую систему температуры или давления равновесие сдвигается в ту сторону, которая позволяет снизить внешнее воздействие (то есть система старается "убежать" от постороннего влияния). Впервые этот принцип сформулировал именно Вант-Гофф (см. раздел "Химическая реакция – живое существо").
Фундаментальное уравнение кинетики, связывающее скорость реакции и температуру, носит имя С. Аррениуса, в то время как впервые его предложил и применил к некоторым экспериментальным результатам все тот же Вант-Гофф, который, будучи человеком достаточно скромным, никогда не настаивал на своем приоритете. Он отдал все лавры открытия товарищу по борьбе за становление новой науки – физической химии.
Одно из самых заметных событий, изменившее мировоззрение химиков ХХ столетия, – создание теории химической связи. В 1916 г. Льюис опубликовал работу, в которой впервые было сказано то, что в наше время вошло в школьный курс химии: связь между атомами в молекуле осуществляют электроны. Современники не смогли оценить по достоинству работу Льюиса, но спустя три года на нее обратил внимание известный физик И. Ленгмюр, который дополнил представления Льюиса о ковалентной и ионной связи. Авторитет Ленгмюра (позже ставшего лауреатом Нобелевской премии) в то время был столь высок, что молва невольно приписала ему создание теории химической связи. В наше время справедливость частично восстановлена: имя Г. Льюиса стоит в первом ряду крупнейших химиков минувшего столетия, а термин "льюисовы кислоты и основания" постоянно встречается в современных работах.
Назад: Рискуя здоровьем и жизнью
Дальше: Досуг и увлечения

