Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Глава 9 Озарения, открытия, превратности судьбы
Дальше: Рискуя здоровьем и жизнью
Открытия не могло не быть
Есть много примеров того, когда постепенное накопление знаний делает открытие неизбежным. Оно буквально висит в воздухе – и посчастливится тому, кто первым «сорвет созревший плод».
Разделить славу поровну
Вплоть до начала XVIII в. ученые воспринимали воздух как некое однородное вещество. Исследования физических свойств воздуха, проводимые различными учеными, неизбежно приводили к похожим результатам. В 1661 г. физик-любитель Ричард Таунли (1627–1791) из Ланкастера, работая в лаборатории Оксфорда под руководством английского естествоиспытателя Роберта Бойля, проводил опыты с барометрической U-образной трубкой и высказал предположение, что воздух обладает упругостью. Р. Бойль, не желая преуменьшать заслуги своего помощника, в 1662 г. опубликовал эти результаты, назвав их теорией Таунли. Однако он не только отметил упругость воздуха, но и сформулировал результаты в виде закона, в котором указал на существование обратной зависимости объема от давления.
Пятнадцатью годами позже французский ученый Эдм Мариотт (1620–1684), незнакомый с работами Р. Бойля, пришел к тому же выводу. Это был знаменитый закон Бойля – Мариотта: pV = const (p – давление, V – объем), заложивший основы физической химии. Уменьшение объема газа при его сжатии внешним давлением обратно пропорционально величине давления.
История поставила рядом эти имена, что вполне справедливо. Бойль был первооткрывателем, а Мариотт сформулировал закон, введя в него очень важное дополнение: зависимость pV = const справедлива при постоянной температуре. Впрочем, некоторые историки любят отмечать, что первооткрывателем закона был помощник Бойля Ричард Таунли. Но кто же является первооткрывателем – тот, кто наблюдал явление, или тот, кто сумел его понять и сформулировал закономерность? Этот спор вечен.
В дальнейшем интересы Р. Бойля и Э. Мариотта не пересекались. Мариотт изучал чисто физические явления – причины возникновения ветров, объемы дождевых осадков, цвет колец Сатурна.
Бойль, более тяготевший к химическим обобщениям и осмыслению наблюдений, обработал громадный экспериментальный материал опытов с металлами, оксидами и солями и систематизировал многочисленные цветные реакции и реакции осаждения. Кстати, именно он обнаружил, что настой лакмусового лишайника меняет окраску при переходе от кислой среды к щелочной, то есть ввел в практику лакмусовый индикатор. Фактически Бойль выделил химию в самостоятельную науку и сформулировал ее основные задачи.
Мы уже знаем, что Р. Бойль открыто подчеркивал приоритет своего помощника Таунли, что достаточно точно отражает характер ученого. Он не искал славы и признания, в разное время отказывался от директорских постов в различных государственных компаниях.
Несмотря на различие интересов, научные судьбы Бойля и Мариотта оказались схожи в одном. Мариотт был основателем и первым членом Парижской академии наук (1666), а четырьмя годами раньше Бойль основал Лондонское королевское общество (по существу это тоже академия наук). Девизом общества стали слова римского поэта Горация, близкие каждому современному ученому: "Я не буду следовать рабски словам своего учителя". В период с 1603 по 1666 г. в разных странах Европы возникло пять академий – так наука заявила о себе как о вполне самостоятельной области человеческой деятельности. Нет ничего удивительного в том, что две национальные академии возглавили двое крупнейших ученых того времени, имена которых навсегда объединил открытый ими закон.
Газовый закон Бойля – Мариотта, сформулированный позже в более общей форме, объединил два других имени – Клапейрона (1799–1864) и Менделеева (1834–1907). Для одного моля газа уравнение имеет вид pV = RT (p – давление, V – объем, R – газовая постоянная, Т – абсолютная температура). Физик Б. П. Э. Клапейрон получил уравнение опытным путем, а химик Д. И. Менделеев вывел его, объединив законы Бойля – Мариотта, Гей-Люссака и Авогадро. По-видимому, это тот самый случай, когда открытие не могло не состояться.
От нового элемента к фундаментальному закону
К середине XVIII в. химики, изучавшие процессы горения и окисления, уже понимали, что окружающий воздух не однороден и представляет собой смесь веществ. Оставался один шаг до открытия того самого компонента – «огненного воздуха», который делает возможным процесс горения. Открытие кислорода связано с именами трех крупнейших химиков того времени – К. Шееле, Дж. Пристли и А. Лавуазье.
Шведский химик Карл Шееле (1742–1786) уже в 1772 г. умел получать кислород различными путями: нагреванием селитры, взаимодействием диоксида марганца с серной кислотой, разложением оксидов серебра и золота. Книга Шееле "Химический трактат о воздухе и огне" была сдана в печать в 1775 г., но по вине издателя вышла в свет только в 1777 г. За это время уже были опубликованы работы Пристли о кислороде, и в результате приоритет в открытии кислорода приписывают Дж. Пристли.
Вклад троих ученых в открытие кислорода различался, и судьбы их тоже не были похожи.
Для шведского химика Карла Шееле кислород, который он назвал "райским воздухом", был лишь этапом в длинной веренице сделанных открытий. Он выделил и описал громадное количество новых соединений: аммиак NH3, хлороводород HCl, фтороводород HF, арсин AsH3, сероводород H2S, глицерин, акролеин; щавелевую, мочевую, лимонную и винную кислоты, оксиды бария, молибдена и вольфрама, тетрафторид кремния SiF4, также он открыл хлор и марганец. Полученный им арсенат меди Cu3(AsO4) впоследствии стали использовать в качестве зеленой краски, названной «шееловой зеленью». Минерал CaWO4, из которого Шееле выделил оксид вольфрама, назван в его честь шеелитом, а сам вольфрам, впервые полученный в 1781 г., называли некоторое время шеелием.
Шееле всегда был равнодушен к славе и почестям. Он отклонил предложение занять профессорский пост в Уппсальском университете в Швеции и отказался от переезда в Берлин, где ему предлагали высокооплачиваемую должность.
Путь английского естествоиспытателя Джозефа Пристли в науку был совсем иным. Вначале он был религиозным проповедником, затем профессором лингвистики – и лишь в возрасте 34 лет занялся наукой. К открытию кислорода его привело исследование жизни растений, которые могут существовать без "живого" воздуха – некой составной части воздуха обычного. Более того, оказалось, что растения выделяют "живой" воздух на свету, что позволяет жить мышам, помещенным под стеклянный колпак вместе с растением. Пытаясь получить "живой" воздух искусственно, он проделал множество опытов – и в итоге достиг цели нагреванием красного оксида ртути HgO, а вслед за этим – нагреванием сурика Pb3O4. Может быть, самый важный этап в истории открытия кислорода – это встреча Пристли с Лавуазье, которому ученый рассказал о своих опытах.
Англичанин Пристли горячо приветствовал Французскую революцию 1789 г., что вызвало ненависть религиозных фанатиков. Пристли с большим трудом удалось спастись от расправы и эмигрировать в Северную Америку. В последние годы жизни Пристли погрузился в написание научных трудов, из-за чего отказался от должности ректора в открывшемся Пенсильванском университете. Одним из его последних трудов было сочинение "Опыты и наблюдения над различными видами воздуха".
Лавуазье (1743–1794) вошел в химию как ученый, сочетавший в себе исключительное мастерство экспериментатора с талантом истинного теоретика, способного правильно объяснить полученные результаты и сделать масштабные выводы. Совместно с известным математиком и астрономом П. Лапласом он создает новый прибор – калориметр – и проводит первые в истории измерения тепловых эффектов реакций. В результате был установлен основной принцип: количество поглощенного и выделяемого тепла при прямой и обратной реакциях одинаковы. Эти работы стали основой новой научной дисциплины – термохимии. Изучая горение водорода, Лавуазье сумел правильно истолковать результаты и тем самым установить состав воды, который до того момента не был известен (почти в то же время состав воды установил британский ученый Г. Кавендиш. И это снова служит примером того, что открытие не могло не состояться).
Проводя сжигание различных органических соединений, Лавуазье определил, что образуются вода и углекислый газ. Так было установлено, что эти соединения состоят из углерода, водорода и кислорода. Притом ученый разработал основы анализа органических соединений, проводя их сжигание в определенном объеме кислорода и измеряя объем образующегося углекислого газа. Важным достижением Лавуазье было введение в практику химической работы коромысловых весов.
Совместно с Лапласом Лавуазье исследовал дыхание животных и установил, что это процесс "медленного горения" полученных с пищей соединений, за счет чего в организме всегда поддерживается постоянный запас тепла. Это, по существу, заложило основы биохимии.
Разработанная Лавуазье номенклатура химических соединений внесла ясность в химический язык, очистив его от сложных и запутанных терминов, часто лишенных всякого смысла и сохранявшихся со времен алхимии. Например, он предложил называть элементом вещество, которое не может быть разложено на более простые вещества в результате химической реакции. Такое определение справедливо и в наши дни. Радиохимия исследует процессы перестройки атомных ядер, но это не химические реакции. Кроме того, Лавуазье ввел деление элементов на металлы и неметаллы.
Лавуазье вывел химию на новый уровень, внес в нее метод четкого, критического анализа явлений, который ранее показал свою результативность в других областях точного знания: в механике, физике, астрономии.
Помимо химии, Лавуазье также занимался общественно-полезной деятельностью, участвовал в составлении минералогической карты Франции, создал рациональную систему мер и весов, разработал методы очистки селитры для производства пороха и некоторое время управлял этим производством.
А. Лавуазье не считают первооткрывателем кислорода. Он вплотную подошел к этому открытию, поскольку интенсивно изучал горение фосфора, серы, углерода, процессы окисления и восстановления металлов. В результате Лавуазье пришел к выводу, что воздух состоит из двух частей: одна пятая часть поддерживает горение, а четыре пятых являются инертными. В 1774 г. он получил кислород нагреванием оксида ртути, но не сделал сообщения о своем открытии, оставив лишь записи в лабораторном журнале. Примечательно, что оксид ртути HgO оказался очень удобным объектом при изучении реакций с кислородом: при нагревании металлической ртути до 300 оС в присутствии воздуха происходит образование оксида, который затем можно разложить при 500 оС на ртуть и кислород.
Встреча с Пристли, во время которой тот рассказал о своих опытах, помогла Лавуазье окончательно во всем разобраться. Не уменьшая заслуг Пристли, он писал: "…этот воздух, который г. Пристли открыл… даже, я думаю, раньше меня…"
Важно, что именно благодаря Лавуазье из факта, означавшего просто открытие нового элемента, открытие кислорода превратилось в крупнейшее событие в истории химии. Лавуазье разработал химическую теорию горения и окисления, разгромил теорию флогистона. Поясним: флогистон (от греч. Φλογιστός – "горючий") – некая огненная невесомая субстанция, которая была придумана для объяснения процессов горения. Полагали, что он улетучивается при сгорании вещества. Существование флогистона было опровергнуто А. Лавуазье. В 1789 г. он издал "Начальный учебник химии", который был переведен на иностранные языки, и в результате ученые постепенно начали отказываться от теории флогистона. Вершиной его творчества стала формулировка фундаментального закона сохранения вещества. Справедливости ради отметим, что семнадцатью годами ранее этот закон сформулировал М. В. Ломоносов, но его работы в Европе не были известны.
Французская революция, изменившая судьбу Пристли, сыграла роковую роль и в жизни Лавуазье. Его опыты требовали внушительных средств. Стараясь обеспечить свою работу, Лавуазье стал членом акционерного общества "Генеральный откуп". Деятельность общества, законную с точки зрения буржуазного государства, революция сочла незаконной. Лавуазье вместе с другими членами "Генерального откупа" был отдан под суд революционного трибунала, созданного во время Французской революции для расправы с "политическими преступниками". Приговоренные обвинялись в заговоре против французского народа, в помощи врагам нации, в том, что добавляли вредные примеси к жизненно важным запасам, и т. п. Лавуазье даже не пытался скрываться или бежать, уверенный в том, что сумеет полностью отчитаться в финансовой деятельности общества. Кроме того, он полагал, что будут учтены его научные заслуги. Революционный трибунал отверг все оправдательные доводы, а председатель трибунала заявил: "Республике нужны не химики, а патриоты". 8 мая 1794 г. Лавуазье погиб под ножом гильотины. Эпитафией стали слова известного математика Жозефа Луи Лагранжа: "Всего мгновение потребовалось им, чтобы отрубить эту голову, но, может, и за сто лет Франция не сможет произвести еще такую же".
Завершая беседу об открытии кислорода, отметим, что предположения о существовании некой составной части воздуха, поддерживающей горение, встречаются в рукописях китайского ученого Мао Хоа (VIII в.) и в работах Леонардо да Винчи (XV в.).
Что интересно, сведения об открытии кислорода появились задолго до Шееле. Еще в XVI в. голландский инженер К. Дреббел нагреванием калиевой селитры получал газ, поддерживающий дыхание. Этот газ он намеревался использовать в изобретенной им подводной лодке. Открытие держалось в секрете, не было известно ученым и не оказало никакого влияния на развитие науки.
Кого же в итоге считать первооткрывателем кислорода? По существующим правилам приоритет принадлежит тому, кто первым опубликовал сведения о сделанном открытии. Книга Шееле на два года задержалась в типографии, Лавуазье оставил только запись в лабораторном журнале, поэтому официально открытие закрепилось за Пристли. При решении таких вопросов в расчет не принимаются запоздалые клятвы других претендентов и свидетельства очевидцев. Чтобы подобная ситуация не повторялась, в примечаниях к каждой опубликованной работе указывают точную дату поступления рукописи в редакцию.
Удача ходит случайными тропами
История открытия брома напоминает забег, где к финишу пришел не самый подготовленный, а самый удачливый участник. В 1825 г. студент Гейдельбергского университета в Германии К. Лёвиг при действии хлора на минеральную воду получил красно-бурую пахучую жидкость. Руководивший работами Лёвига опытный химик Л. Гмелин посоветовал получить новое вещество в достаточных количествах, чтобы подробнее его исследовать, но это так и не было сделано.
Год спустя никому не известный двадцатичетырехлетний лаборант А. Балар, обработав хлором рассолы некоторых соленых болот Франции, получил то же самое вещество и, полагая, что открыл новый элемент, сразу сообщил о своем открытии в Парижскую академию наук. Открытие нового элемента признавалось только после независимой проверки, которую в данном случае провели Ж. Гей-Люссак и Л. Тенар. Оба подтвердили открытие. Немного ранее, в том же 1826 г., крупнейший немецкий химик Ю. Либих, проводя опыты, получил темно-бурую жидкость, но решил, что это соединение хлора с йодом. Спустя несколько месяцев Либих узнал об открытии Баларом брома и с грустью осознал, что тоже держал в руках бром, но не понял этого вовремя.
Открытие брома резко изменило судьбу Балара. Безвестному лаборанту предложили должность заведующего кафедрой химии в одном из самых престижных учебных заведений Франции – Коллеже де Франс, столь высоко совет колледжа оценил сделанное открытие. Этим был ужасно раздосадован известный французский химик Ш. Жерар, который прочил на должность своего друга, ученого-химика О. Лорана. Узнав о принятом решении, Жерар в сердцах воскликнул: "Это не Балар открыл бром, а бром открыл Балара!"
Коварный элемент
Чем труднее задача, тем больший азарт вызывает она у исследователей. Фтор – самый активный неметалл, обладающий исключительной реакционной способностью, и экспериментальные трудности, связанные с его получением, долгое время казались непреодолимыми. Большинство известных материалов реагируют с ним, многие элементы при соприкосновении с фтором воспламеняются, он может даже вступать в реакцию с благородными металлами и инертными газами.
Выделение фтора в чистом виде напоминало стремление алхимиков получить алкагест – вещество, растворяющее все вещества. Из простых рассуждений следует, что задача неразрешима. Поскольку алкагест растворяет абсолютно все, его нельзя ни в чем получить и ни в чем хранить.
Получение фтора осложнялась тем, что сам фтор и фтористый водород, из которого многие пытались его выделить, очень ядовиты. Тем не менее многие химики называли его торжественно и поэтично: неприступным, разрушительным, неукротимым элементом и даже королем агрессивности. Не случайно Ампер и Дэви предложили сменить название предполагаемого элемента "флюор" (от флюорита) на "фтор" (греч. Φθόρος – "разрушитель").
Шееле (первооткрыватель кислорода), впервые получивший плавиковую кислоту (водный раствор фтористого водорода), предположил, что она содержит новый элемент. Более всех приблизился к получению фтора Г. Дэви, который по совету Ампера начал проводить электролиз плавиковой кислоты (по аналогии с электролитическим получением хлора). Исследования были приостановлены, так как плавиковая кислота разрушала любые материалы, из которых были изготовлены приборы. Кроме того, Дэви сильно отравился, надышавшись небольшим количеством паров.
Ученик Дэви Майкл Фарадей пытался получить фтор электролизом расплавленных фторидов олова и кальция. Если фтор и возникал в незначительных количествах, то мгновенно реагировал со стенками прибора, и обнаружить его не удавалось.
Выделить фтор удалось лишь спустя 70 лет после первых опытов Дэви. Это сделал Анри Муассан (1852–1907). Он использовал весь накопленный к тому времени опыт и учел высокую реакционную способность фтора. Вся аппаратура была изготовлена из платины, а электроды – из иридиево-платинового сплава; опыты проводились при –23 оС. Соединением, которое было «вынуждено отдать» элементарный фтор при электролизе, стал безводный фтороводород HF, сжиженный сильным охлаждением. В 1886 г. Муассан смог сообщить Парижской академии наук, что ему удалось получить фтор в чистом виде.
Получение фтора современники сравнивали с покорением высочайшей вершины, но слава и признание не могли отвлечь Муассана от исследований. Он вписал свое имя в историю науки дважды, создав электродуговую печь. Печи Муассана произвели настоящий переворот в технике: стало возможным проводить выплавку тугоплавких металлов (молибдена, вольфрама и др.) в промышленных масштабах.
В 1906 г. А. Муассан был удостоен Нобелевской премии за совокупность работ. Это произошло в тот год, когда друзья, ученики и коллеги Муассана торжественно отмечали двадцатилетие со дня получения фтора.
Периодическая система и ее «соавторы»
Литература, посвященная периодической системе, необычайно велика, а учение о ней представляет собой крупную главу в истории химической науки. Тем не менее некоторые вопросы обсуждаются редко. Всевозможные подходы к созданию периодической системы, индивидуальная трактовка проблемы разными исследователями и бесконечные интерпретации событий историками науки привели к тому, что на некоторые вопросы долгое время не находили однозначного ответа.
Внешний вид периодической системы знаком каждому: имя, а часто и портрет Менделеева всегда ставят в самое начало таблицы (рис. 9.1).
Отечественные химики настолько к этому привыкли, что при посещении лабораторий в других странах очень удивляются, увидев на стене или на рабочем столе таблицу без имени ее создателя.
Так выглядит верхняя часть таблицы, используемой обычно в физических лабораториях США (на рис. 9.2).

Во многих странах пользуются похожим вариантом таблицы, утвержденным ИЮПАК (IUPAC, Международный союз теоретической и прикладной химии). И здесь отсутствует знакомое нам имя (рис. 9.3).
Неужели авторство Менделеева не является общепризнанным? События, которые привели к описанной ситуации, по-своему драматичны. В науке существуют два пути, ведущие к появлению обобщающих законов. Первый – тщательное накопление фактов и дальнейшая систематизация с помощью логических рассуждений и формулировки нового закона. Во втором случае имеющихся данных недостаточно, остается много белых пятен, но интуиция исследователя помогает восстановить общую картину. История создания периодической системы – яркий пример того, как исследователи приступают к поискам обобщающих закономерностей задолго до того, как накопится исчерпывающее количество экспериментальных данных.
Первые попытки систематизации химических элементов относятся к концу XVIII в., когда Лавуазье, основываясь на отчетливо выраженных химических свойствах, предложил деление на металлы и неметаллы. Более детальную систематизацию удалось провести И. Дёберейнеру в 1817 г. Он сумел объединить некоторые элементы по близким химическим свойствам в триады: Li-Na-K, Ca-Sr-Ba, S-Se-Te и Cl-Br-I. Кроме того, он заметил, что атомная масса среднего элемента в триаде равна полусумме двух крайних. Можно сказать, что начиная с этого момента появление некой системы, объединяющей все элементы, стало ожидаемой реальностью. Поиски в указанном направлении привели к тому, что до Менделеева двое ученых очень близко подошли к ее созданию.
Лотар Майер (1830–1895), немецкий физикохимик, занимаясь систематизацией химических элементов, расположил их по группам, однако основным свойством он считал степень окисления, а не атомную массу. Составленную таблицу он опубликовал в 1864 г. Триады Дёберейнера, дополненные до четырех или пяти элементов, расположены в вертикальных столбцах (рис. 9.4).
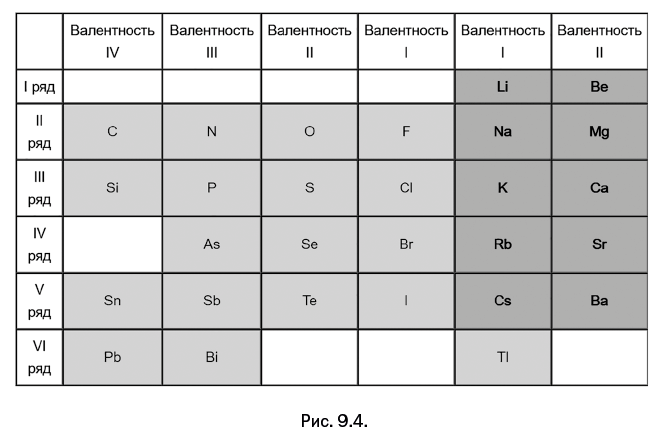
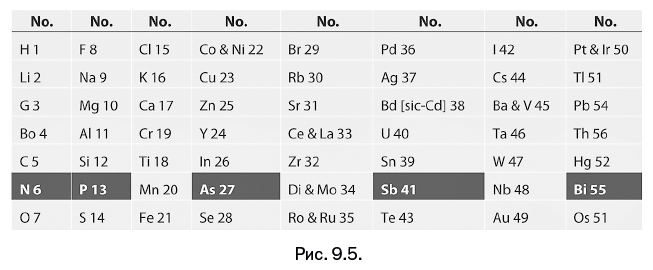
В 1866 г. британский химик Дж. Ньюлендс (1837–1898) представил таблицу, включающую 62 известных на тот момент элемента, состоящую из наборов по 8 элементов, расположенных в горизонтальных рядах (рис. 9.5). Ньюлендс, унаследовавший от матери-итальянки любовь к музыке, романтически назвал найденную закономерность «правилом октав» и доложил о ней на заседании Лондонского королевского общества. Доклад не вызвал интереса, а профессор Г. Фостер из Глазго с явной иронией спросил автора, не пробовал ли он расположить элементы по алфавиту и не возникла ли при этом новая закономерность.
Д. И. Менделеев создал свой вариант системы независимо от работ предшественников. В качестве основной характеристики он выбрал атомную массу, но не строго формально, а с учетом химических свойств. В результате ему удалось объединить в стройную систему все известные к тому времени элементы. В 1869 г. он опубликовал первый вариант таблицы (рис. 9.6).

В 1871 г. Менделеев представил детальный вариант, где были указаны атомные массы и варианты степеней окисления элементов. Горизонтальные черточки указывают места не полученных пока элементов (рис. 9.7).

При сравнении двух вариантов таблицы, показанных выше, мы сразу понимаем, что вертикальные столбцы в первом варианте превратились в горизонтальные ряды во втором варианте – то есть Менделеев повернул таблицу на 90 градусов. И такое изображение сохранилось до наших дней.
Важно то, что выведенный закон обладал предсказательной силой, что вскоре блестяще подтвердилось. Это был троекратный триумф – открытие предсказанных галлия, скандия и германия. В сравнении тем, что создал Менделеев, работа, которую проделали Майер и Ньюлендс, была по существу формальной классификацией элементов – авторы не нашли объединяющего закона и ничего не могли предсказать.
Итак, в интервале 1864–1869 гг. трое ученых независимо друг от друга предложили три варианта систематизации химических элементов. По-видимому, необходимость таблицы "висела в воздухе".
Вследствие широкого признания, которое получила работа Менделеева, в 1880 г. Майер опубликовал статью, где писал, что именно ему принадлежит приоритет в открытии закона. В итоге вопрос об истинном авторстве долгое время оставался открытым. Ситуация осложнялась тем, что в 1884 г. с претензиями на приоритетность выступил и Ньюлендс. В результате Лондонское королевское общество, чувствуя вину за прошлое свое ироничное отношение к его работе (предложение расположить элементы по алфавиту), присудило ему в 1887 г. золотую медаль им. Дэви – точно такую же, какую за пять лет до этого получили Менделеев и Мейер.
Периодическая система по-разному повлияла на судьбу участников этой драмы. Майер потратил много сил, доказывая свое авторство, и в результате не оставил заметных научных трудов. То же самое можно было бы сказать и о Ньюлендсе, если бы не одна деталь. Именно он приписал химическим элементам порядковые номера. Эта простая процедура, как оказалось, имела очень важные последствия. В 1914 г. благодаря работам физиков А. ван ден Брука и Г. Мозли было установлено, что порядковый номер элемента в периодической системе точно соответствует заряду ядра и, соответственно, числу окружающих ядро электронов (поскольку атом электронейтрален). Началась новая жизнь периодической системы, связавшей строение атома и химические свойства элементов.
Научная судьба Менделеева сложилась иначе, нежели у двух его предшественников. Заботы, связанные с доказательством своего авторства, не могли отвлечь столь крупного ученого от дальнейшей работы. Предсказав свойства не открытых еще элементов, он решил, что этим основная информация о периодической системе исчерпывается и просто надо набраться терпения и ждать, когда прогнозы подтвердятся. Он продолжает заниматься преподавательской и научной работой, а кроме того, выводит знаменитое уравнение состояния газов (уравнение Клапейрона – Менделеева, см. раздел "Разделить славу поровну"), вслед за тем работает над совершенствованием нефтеперерабатывающей и угледобывающей отраслей в России, формулирует принцип подземной газификации угля, возглавляет созданную Палату мер и весов, разрабатывает технологию производства бездымного пороха. Согласно легенде, Менделеев сумел разгадать состав пороха, производство которого было начато в Англии и Франции: он проанализировал сведения о том, какие продукты и в каких количествах завозятся по железной дороге на пороховые заводы.
Всемирная слава, которая пришла к ученому после открытия трех предсказанных элементов, не отвлекла его от интенсивной работы. Любимое детище – учебник "Основы химии", который Менделеев многократно перерабатывал, – при его жизни издавался 8 раз. Этот классический труд и в наши дни привлекает читателей большим количеством неустаревших сведений, своеобразным нестандартным языком и явной любовью к излагаемому предмету.
Лишь казус, о котором мы упомянули в начале рассказа, напоминает нам о давно ушедших в прошлое спорах об авторстве периодической системы. Скорее всего, по инерции западные издания таблицы копируют внешнее оформление, утвердившееся ранее. Тем не менее при изучении химии в школах большинства стран ученики узнают, кто истинный автор таблицы. На обратной стороне американского варианта, который показан на рис. 9.2, написано, что это "…модернизация периодической таблицы Менделеева". Существует также более весомое и убедительное признание заслуг Менделеева: в современной таблице элемент № 101 назван его именем – это единственный химик, упомянутый в ряду трансурановых элементов! И до, и после элемента 101 встречаются только имена физиков. Имена двух других ученых, претендовавших на право считаться первооткрывателями периодической системы, в этом ряду отсутствуют и, вероятнее всего, уже никогда не появятся.
Химическая реакция – живое существо
Если на живое существо оказывать внешнее неблагоприятное воздействие, оно отреагирует попыткой снизить влияние этого воздействия. Когда приходит холодное время года, птицы улетают в теплые края. Многие животные во время дождя прячутся под деревьями, в расщелинах скал или забираются в нору, чтобы не намокнуть. Антилопа, увидев подкрадывающегося тигра, старается убежать как можно быстрее. Если в помещении заметно похолодало, то мы постараемся надеть теплую одежду. Все это привычно и естественно. Необычно то, что подобным образом ведут себя многие химические реакции. Речь идет об очень крупной группе реакций, называемых равновесными. В них исходные продукты превращаются в конечные, а те, в свою очередь, могут превращаться в исходные: А + Б ⇄ C + D. В тот момент, когда скорости прямого и обратного процесса оказываются равны, возникает равновесие, и содержание всех веществ не изменяется. Подобное состояние возникает во многих реакциях, протекающих в газовой фазе и в растворе. Однако зачастую химиков это не устраивает – если нужно получить как можно больше конечных продуктов C и D, то равновесие необходимо сдвинуть. В решении проблемы помогает принцип Ле Шателье: если на реагирующую систему воздействовать определенным образом, то она сдвинется в том направлении, которое позволит снизить влияние этого воздействия (очень похоже на ответную реакцию живого существа). В химии существует три основных способа воздействия на реагирующую систему: а) понижение или повышение температуры; б) повышение или понижение давления; в) изменение концентрации одного из участников реакции. Третий способ самый очевидный и удобный. Если один из продуктов реакции, проходящей в растворе, выпадает в осадок, то его концентрация в реагирующей среде падает, и система старается восполнить его отсутствие. Соответственно, равновесие сдвигается в сторону образования уходящего из реакции (выпадающего в осадок) вещества. Приблизительно так же каждый из нас, замечая, что у него кончаются денежные средства, старается заработать еще. Вот пример равновесной реакции: смешаем растворы нитрата натрия (натриевая селитра) и хлорида калия:
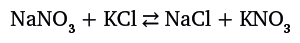
Все четыре вещества растворимы в воде, и никакого взаимодействия мы не увидим. Тем не менее сдвинуть равновесие вправо, то есть в сторону образования получающихся продуктов, все же возможно. Дело в том, что растворимость NaCl в воде почти не зависит от температуры, а растворимость KNO3 заметно зависит – при переходе от комнатной температуры к 100 оС она возрастает в 18 раз. Если мы смешаем горячие насыщенные растворы NaNO3 и KCl и охладим смесь, то начнут выпадать кристаллы калиевой селитры KNO3, которая очень плохо растворяется в холодной воде. В растворе концентрация KNO3 понизится, и равновесие сдвинется в сторону образования исчезающего из раствора вещества, то есть система постарается компенсировать возникшее нарушение равновесия. В конечном итоге в растворе останется почти чистый NaCl. Рассмотренная реакция в свое время сыграла заметную роль в развитии важного технологического процесса. До середины XIX в. черный (дымный) порох изготавливали смешением угля, серы и калиевой селитры, которую добывали из редкого и дорогого минерала – «индийской селитры». Запасы этого минерала быстро исчерпались. На смену пришли громадные запасы чилийской селитры – продукта тысячелетнего разложения птичьего помета, называемого гуано. Проблема состояла в том, что чилийская селитра содержала нитрат натрия NaNO3, который при хранении впитывает влагу воздуха, – зато этот недостаток отсутствует у KNO3. Рассмотренная выше реакция позволила решить проблему. И это согласуется с известной поговоркой «Держи порох сухим!».
Наиболее привлекательны реакции, в которых равновесие сдвигается само, без всякого внешнего воздействия, – например, когда продукт реакции выделяется в виде газа (фактически это необратимая реакция). Взаимодействие карбоната натрия (соды) и кислоты сопровождается удалением газообразного СО2:
Na2СО3 + 2HCl → 2NaCl+ H2O + CO2↑
Итак, возможны случаи, когда для того, чтобы сдвинуть равновесие, не требуется прикладывать никаких специальных усилий, но такое происходит далеко не всегда. Рассмотрим синтез аммиака из азота и водорода – один из самых важных процессов промышленной химии:
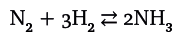
Из уравнения реакции следует, что из четырех молекул получаются две. Следовательно, из одного литра азота и трех литров водорода образуется два литра аммиака, то есть объем уменьшается. Напомним, что стехиометрические коэффициенты в уравнении реакции указывают соотношение объемов газов (об этом также рассказано в разделе «Фундаментальный закон, открытый с помощью рассуждений»). Исходные газы реагируют крайне неохотно и только в присутствии катализатора, поэтому, чтобы сдвинуть реакцию в нужную сторону, следует повысить давление. Система отреагирует соответствующим образом, стараясь «убежать» от воздействия, – она сдвинется так, что это приведет к снижению давления, то есть к уменьшению объема системы. Поэтому промышленный процесс синтеза аммиака проводят при 400 атм.
Рассмотренный принцип Ле Шателье имеет общий характер и применим к широкому кругу реакций. Его предложил в 1884 г. французский физикохимик Анри Луи Ле Шателье (1850–1936). В том же самом 1884 г. такой же принцип подвижного равновесия опубликовал голландский химик Я. Х. Вант-Гофф, ставший позже, в 1901 г., первым в истории Нобелевских премий лауреатом по химии благодаря открытию законов химической динамики и осмотического давления в растворах. Интересно, что именно он предложил обозначать обратимость реакции двумя стрелками, направленными в противоположные стороны ⇄. Этим символом мы пользуемся и в наши дни. То же самое, независимо от Ле Шателье и Вант-Гоффа, в 1887 г. сформулировал немецкий физик Карл Фердинанд Браун, получивший в 1909 г. Нобелевскую премию по физике совместно с Г. Маркони за создание беспроводного телеграфа.
Как видим, нобелевские лауреаты были весьма проницательны и сумели заметить и другие важные закономерности – помимо тех, за которые они получили премию.
Со временем обсуждаемый нами принцип получил математическое описание, но и в своей первоначальной формулировке он достаточно нагляден, понятен каждому химику и входит в школьный курс химии. Принцип, получивший имя Ле Шателье, вероятно, не мог не появиться – ведь трое наблюдательных ученых в течение трех лет независимо друг от друга высказывали одну и ту же идею.

