Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Между жидкостью и твердым телом
Дальше: Глава 9 Озарения, открытия, превратности судьбы
Молекулярные контейнеры
Многообещающими современными материалами на сегодня являются вещества, позволяющие организовать компактное хранение и транспортировку водорода. Водород – один из перспективных и экологически благоприятных источников энергии, конкурент углеводородного топлива. Химики изучают различные способы решения этой актуальной проблемы. Одно из направлений – использование веществ, которые химически связывают водород (например, гидриды металлов) и способны быстро его отдавать в мягких условиях. Другие способы аккумулирования водорода – использование пористых материалов, эффективно адсорбирующих (впитывающих) водород. Такими свойствами обладают некоторые углеродные материалы, цеолиты (пористые силикаты), органические сетчатые структуры. Естественно, была изучена перспективность использования ферроцена именно в этой области.
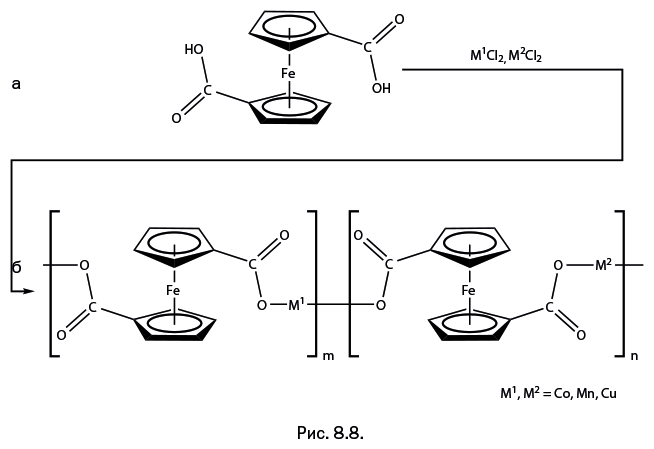
В предыдущем разделе было показано, каким образом ферроцен включается в организованную жидкокристаллическую фазу. Однако пространственная структура молекулы ферроцена и ее размеры позволяют также решать принципиально иные задачи. Поскольку ферроцен представляет собой объемную конструкцию, можно располагать замещающие группы разнообразными способами. В качестве исходного соединения была использована ферроцендикарбоновая кислота, в которой две карбоксильные группы -COOH присоединены к разным циклам. Эти группы, помимо прочего, расположены не на одной вертикали (друг под другом), а скорее диагонально (рис. 8.8а). На основе такой заготовки можно построить линейные полимерные конструкции. При взаимодействии этой дикислоты с галогенидами металлов образуются металлсодержащие полимерные цепочки (рис. 8.8б). При синтезе использовались различные парные сочетания металлов М1-М2: Co-Mn, Co-Cu, Mn-Cu.
Полученные полимеры были исследованы с помощью сканирующего электронного микроскопа; на полученных снимках помещены врезки с более высоким разрешением (рис. 8.9). Снимки показывают образование микросфер, причем неожиданно оказалось, что Mn,Cu-содержащие соединения формируют сферы с внутренней полостью (рис. 8.9в, Mn,Cu). Изменяя условия реакции (температуру и длительность синтеза), можно получать микросферы различного размера и плотности.

Затем следовало оценить пористость этих соединений, для чего их тщательно высушивали в вакууме и затем насыщали азотом. Это позволило определить удельную поверхность, которая дает оценку пористости, и она оказалась весьма значительной – в диапазоне 120–227 м2/г. Высокая пористость – следствие того, что объемные фрагменты ферроцена не позволяют полимерным молекулам плотно упаковываться (в отличие от большинства органических полимеров). Таким образом, в этом разделе работы роль ферроцена противоположна той, о которой было рассказано ранее: ферроцен не объединяет молекулы в новую фазу, а, наоборот, приводит к неплотной упаковке, что показано на трехмерных моделях (рис. 8.10).

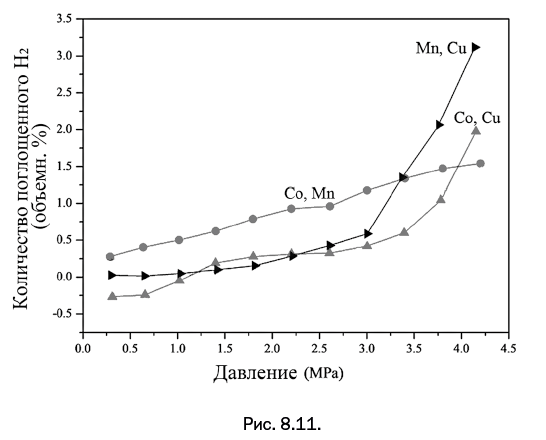
После получения высокопористых веществ решено было проверить, способны ли они поглощать и удерживать молекулярный водород. На рис. 8.11 показано, как изменяется количество молекулярного водорода, которое способны удерживать полученные металлорганические полимеры при повышении давления.
Заранее можно было предположить, что пустотелые сферы (Mn, Cu-содержащие полимеры) поглощают большее количество водорода. Подводя итог, отметим, что найденные новые области применения ферроценсодержащих веществ – жидкие кристаллы и молекулярные контейнеры для хранения водорода – не исчерпывают возможности этого класса соединений, поскольку ферроцен обладает еще одним важным достоинством. Он склонен к легким окислительно-восстановительным переходам. Это позволяет в перспективе планировать создание светочувствительных и электропроводящих материалов на его основе.

