Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Первое подтверждение расчетов
Дальше: Глава 5 От колбы к компьютеру
Упрощение бывает полезно
До сих пор мы обсуждали только атомы, а теперь перейдем к молекулам. Вернемся к молекуле метана CH4, изображенной на обложках учебников (рис. 4.3).
У атома углерода на втором электронном уровне находятся четыре орбитали (одна s и три р). На них расположены четыре валентных электрона: два – на s-орбитали и еще по одному электрону – на двух р-орбиталях, третья р-орбиталь углерода не занята.
В тот момент, когда атом углерода образует четыре химических связи с четырьмя атомами водорода, все четыре орбитали сливаются, образуя орбитали-гибриды (рис. 4.19, справа внизу), которые по форме напоминают несимметричные объемные восьмерки (крупная капля и маленький хвостик). Обычно их обозначают как sp3-гибридные орбитали, то есть полученные из одной s- и трех р-орбиталей (орбиталей-гибридов получится столько же, сколько орбиталей участвует в слиянии). Своими утолщенными частями гибридные орбитали направлены к вершинам мысленного тетраэдра (рис. 4.19, справа внизу).
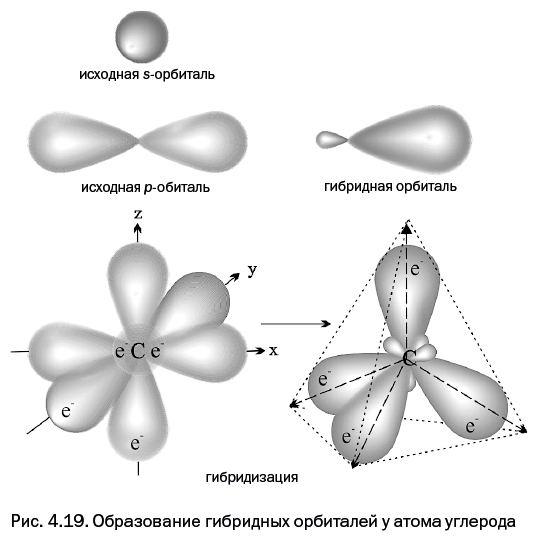
Такие картинки можно увидеть во всех учебниках органической химии, а истинный внешний вид гибридов показан на рис. 4.20. Для того чтобы нагляднее показать их форму, гибриды изобразили на некотором удалении друг от друга (рис. 4.20, слева), но чтобы увидеть всю картину в реальности, эти орбитали необходимо совместить в пространстве – при этом четыре белые точки должны совпасть (именно в этом месте находится ядро углерода). Результат показан на рис. 4.20, справа.

Далее эти четыре орбитали, направленные к вершинам мысленного тетраэдра, перекрываются со сферическими орбиталями четырех атомов водорода, что соответствует образованию четырех химических связей (как показано на обложках учебников). Именно здесь возникают сложности с графическим изображением: если к фигуре, состоящей из «слипшихся» шарообразных объемов (рис. 4.20, справа), вплотную приблизить четыре сферы, то разобрать на рисунке ничего не удастся. Все выглядит намного понятнее, если гибридные орбитали намеренно растянуты (рис. 4.19). Поэтому истинный вид орбиталей постоянно искажают в угоду наглядности, и на это трудно что-либо возразить. Впрочем, рис. 4.20 поможет любителям точности представить, как все выглядит на самом деле.
Рисунки на обложках учебников изображают перекрывание орбиталей атомов углерода и водорода в молекуле метана, но это промежуточная стадия, наиболее часто изображаемая и обсуждаемая. Когда связи уже образовались, появляются молекулярные орбитали, очерчивающие области возможного перемещения электронов вокруг молекулы. Число молекулярных орбиталей равно сумме исходных атомных орбиталей. На рис. 4.21а показана одна из молекулярных орбиталей метана.
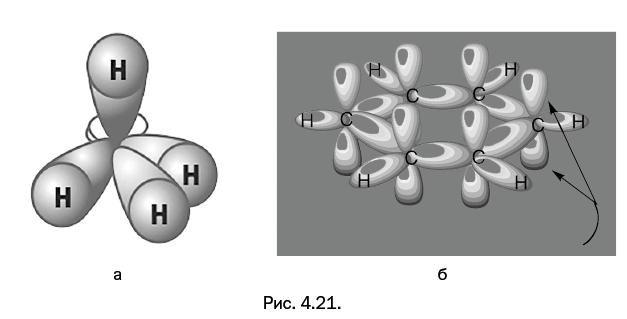
Во многих случаях химиков интересуют именно молекулярные орбитали, которые так же, как атомные орбитали, получают расчетом. На первый взгляд показанные объемные конструкции не имеют отношения к экспериментальной химии, однако это не так. Перекрывание атомных р-орбиталей в бензоле приводит к образованию единого кольцевого облака (рис. 4.21б – орбитали, охватывающие атомы водорода, не показаны). Это кольцевое облако и является основным признаком ароматических свойств. Кроме того, взаимоперекрывание орбиталей в пределах одной молекулы часто определяет электропроводящие или магнитные свойства вещества. Возможность протекания некоторых реакций определяется взаиморасположением молекулярных орбиталей в реагирующих молекулах – сформулированы соответствующие правила, и химики-синтетики их учитывают. И то, что все это хорошо согласуется, подтверждает близость результатов квантово-химических расчетов к реальности.
Назад: Первое подтверждение расчетов
Дальше: Глава 5 От колбы к компьютеру

