Книга: Лаборатория химических историй. От электрона до молекулярных машин
Назад: Щедрый этилен и его потомки
Дальше: Три шага творчества одной простой молекулы
Лучший изолятор
Название исходного мономера стирола (франц. styréne) было предложено его первооткрывателем – французским химиком М. Бонастром, который в 1831 г. получил стирол при сухой перегонке стиракса – смолы восточного эвкалипта.
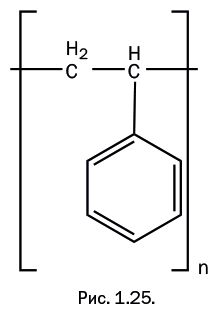
Полистирол – стеклообразный прозрачный материал, весьма хрупкий, зато обладающий исключительно высокими электроизоляционными свойствами. Материаловеды называют его стопроцентным диэлектриком. Для повышения его ударопрочности вводят бутадиен CH2=CH-CH=CH2, который при сополимеризации встраивается в полимерную цепь. Полистирол широко используют в виде окрашенного листового материала для изготовления вывесок, рекламных щитов и для отделки интерьеров. Очень популярен вспененный полистирол как теплоизолирующий материал, а также он часто применяется в качестве упаковки при перевозке хрупких предметов (рис. 1.25).
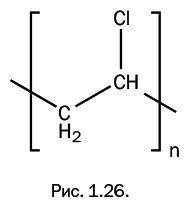
Материал для оконных рам – поливинилхлорид – плотный, прочный и химически устойчивый. При формовании он дает малую усадку, что позволяет сохранять заданные размеры. Поливинилхлорид широко используется в производстве устойчивых к коррозии труб, патрубков и покрытий для пола. Он легко пластифицируется, образуя гибкий материал, из которого делают искусственную кожу. С 1950-х гг. из поливинилхлорида стали изготавливать оконные рамы, и в практику вошел термин «профиль ПВХ» (рис. 1.26).
Оргстекло – полиметилметакрилат
Далее химики сами стали искать группы, присоединение которых к этилену облегчает полимеризацию, и, естественно, такие группы были найдены. Производное этилена, в котором атом водорода замещен карбоксильной группой СН2=СН-С(О)ОН, называют акриловой кислотой. Если далее заместить второй атом водорода метильной группой, то образуется метил-акриловая кислота СН2=С(Me) – С(О)ОН, которую называют метакриловой. Затем карбоксильная группа под действием метанола превращается в сложноэфирную, образуется метиловый эфир метакриловой кислоты СН2=С(Me) – С(О)ОMe, кратко называемый метилметакрилат (ММА). Все вышесказанное объясняет, откуда взялось название, в котором никак не упоминается этилен, хотя исходное соединение является его прямым производным.
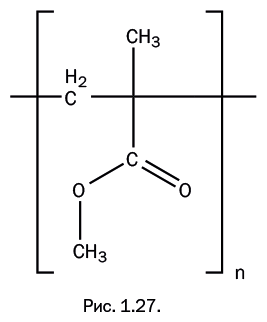
Полиметилметакрилат (ПММА) (рис. 1.27) – прозрачный пластик, получивший два распространенных названия – «плексиглас» и «оргстекло». Интенсивное производство началось в период между двумя мировыми войнами, причиной этого было бурное развитие авиации: появились самолеты, в которых кабину пилота нужно было закрывать прозрачным фонарем. Оргстекло удачно сочетало все необходимые свойства: оно было оптически прозрачно, не образовывало осколки, что обеспечивало безопасность летчика. В настоящее время полеты происходят на гиперзвуковых скоростях, и возникающие высокие температуры и давление исключили использование этого полимера в авиации. Его заменили многослойные композиции на основе органических и силикатных стекол.
Современное применение оргстекла – внутренняя и наружная реклама, небьющиеся стекла очков, различные бытовые предметы и сувениры. Полиметилметакрилат не смог вытеснить обычное силикатное стекло в быту, так как под действием погодных условий со временем он желтеет и мутнеет.
Синтетическая шерсть – полиакрилонитрил
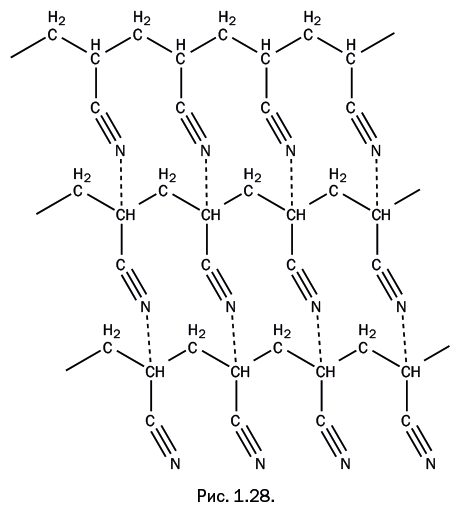
При замене атома водорода в этилене нитрильной группой образуется акрилонитрил CH2=CH-C≡N, то есть нитрил акриловой кислоты. И снова мы видим, что название вещества не говорит о его прямой связи с этиленом. Полиакрилонитрил образуется при полимеризации акрилонитрила, и по некоторым косвенным признакам он был очень привлекателен как волокнообразующий полимер, но при нагревании не размягчался, а начинал разлагаться. Таким образом, для переработки полимера в волокно необходимо было его растворить, но на это не был способен ни один из известных растворителей. Ситуация напоминала ту, которая в свое время сложилась с целлюлозой – она не размягчалась и не растворялась (описано в разделе «Лидер среди природных полимеров»). К этому моменту химики уже представляли себе и сам процесс полимеризации, и строение образующейся полимерной молекулы. Было понятно, что в полимере нет поперечных химических связей, его молекулы линейны, и, следовательно, полимер должен растворяться. Именно эти рассуждения позволили начать поиски растворителя, но найти его не удавалось в течение долгого времени. Причина отсутствия растворимости та же, что и в случае с целлюлозой, – сильное взаимодействие между полимерными цепями за счет водородных связей. Они возникают между атомами водорода C-H, находящимися в одной полимерной молекуле, и нитрильными группами соседней полимерной цепи (рис. 1.28). Обратите внимание, что обычно в образовании водородных связей участвуют атомы водорода O-H или N-H-групп, однако в этом случае связь C-H химически связана с нитрильной группой, что приводит к увеличению полярности группы C-H. Этого оказывается достаточно для ее участия в образовании водородной связи с атомом азота нитрильной группы, находящейся в соседней молекуле.
При поисках высокополярного растворителя, который мог бы разрушить эти водородные связи, было испытано несколько тысяч различных органических соединений. Почему же потребовалось исследовать такое большое количество растворителей? Дело в том, что поиск подходящего растворителя ведется в определенной области «подозреваемых» соединений. Опытные химики могут весьма точно очертить такую область. Имеются даже некоторые теоретические предпосылки, которые помогают выбрать класс подходящих веществ. Но невозможно указать заранее формулу конкретного соединения. И поиск правильного решения с помощью рассуждений не гарантирует успешный результат: необходим накопленный опыт, экспериментальное чутье и часто просто бесконечное экспериментирование.
В конечном итоге проблему удалось решить. История науки показывает, что широкий и интенсивный поиск решения задачи часто приводит к успеху – особенно если известно, что она в принципе разрешима. Было найдено сразу несколько растворителей, и оптимальным оказался диметилформамид (CH3)2NC(O)H.
Лишь по одной детали можно судить, насколько трудной была задача по поиску растворителя. На растворяющую способность веществ заметно влияют даже незначительные различия в структуре. Например, очень близкие по строению к диметилформамиду (CH3)2NC(O)H соединения – формамид H2NC(O)H и диэтилформамид (C2H5)2NC(O)H – не растворяют полиакрилонитрил. Можно представить, как легко было «проскочить» мимо нужного соединения, проверив лишь растворяющую способность двух из трех очень похожих соединений. Диметилформамид положил начало использованию полиакрилонитрильного волокна, которое стали получать, продавливая раствор через фильеры в воду (диметилформамид смешивается с водой). Волокно по внешнему виду напоминает шерсть, окрашивается в различные цвета, обладает заметной прочностью, светостойкостью и термостойкостью (длительно выдерживает 120–130 ℃, практически не изменяя своих свойств). Недостаток этого волокна – низкая гигроскопичность (влагопоглощаемость). Его торговое название в отечественной промышленности – «нитрон», а в зарубежной – «орлон» (рис. 1.29).
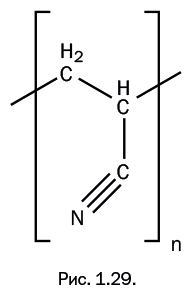
Орлон, в свою очередь, помог начать широко использовать диметилформамид. Ранее это было довольно редкое соединение, имевшееся далеко не в каждой лаборатории, но после того, как была обнаружена уникальная растворяющая способность, его стали производить в промышленном масштабе. Диметилформамид оказался почти универсальным растворителем и в настоящее время широко применяется в производстве пленок, лаков, красок, искусственной кожи, а также служит реакционной средой, обладающей каталитическими свойствами. В научной литературе для него даже есть специальное сокращение – ДМФА (в англоязычной литературе – DMF).
Необычное превращение происходит с полиакрилонитрилом при 300 оС: нитрильные группы взаимодействуют, замыкая циклы, затем происходит дегидрирование (отщепление водорода), и образуется имеющий лестничное строение полимер, состоящий из конденсированных циклов (рис. 1.30).
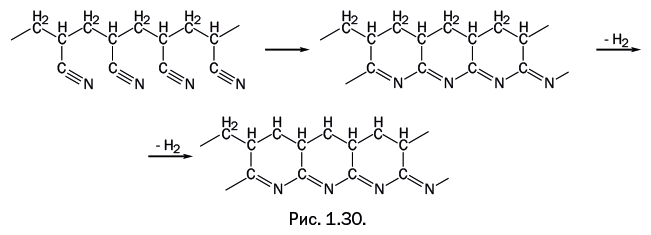
В результате нагрева соединение приобретает черный цвет (его называют «черным орлоном»), оно выдерживает нагревание в открытом пламени до температуры красного каления без видимого разрушения. Так как это соединение ни в чем не растворяется, то для получения определенного изделия его формируют из полиакрилонитрила, а затем оно подвергается термообработке. При дальнейшем нагревании черного орлона при 1500–2000 оC в среде инертного газа образуется углеволокно.
Углеродные волокна (иногда их называют графитовыми волокнами) обладают редким сочетанием свойств. Они имеют большую прочность на растяжение и потому используются для армирования полимерных композиций для авиации и автомобилестроения. Высокая термостойкость волокон придает этим композициям огнестойкость, кроме того, компактный слой углеродных волокон эффективно отражает тепло, что затрудняет терморазложение связующего полимера.
Благодаря высокой химической стойкости этих волокон, изготовленные из них ткани применяют для фильтрации агрессивных жидкостей, очистки газов и при изготовлении защитных костюмов для работы с едкими веществами.
Углеродные волокна электропроводны, что позволяет их использовать в качестве добавки при изготовлении электропроводящего асфальтобетона для нагреваемого дорожного покрытия аэропортов. Это помогает в зимний период легко устранять обледенение взлетных полос.
При введении таких волокон в структуру ткани образуется нагревающийся материал, используемый в быту, например при изготовлении термоодежды и термоодеял. В отличие от металлических нитей и спиралей углеродные волокна устойчивы к многократным изгибам, что обеспечивает долговечность и безопасное использование таких изделий.
Из полимерных композиций с углеволокном изготавливают легкий и прочный спортивный инвентарь: хоккейные клюшки, лыжи, лыжные палки, вёсла, велосипедные рамы.
Клей мгновенного действия – цианоакрилат
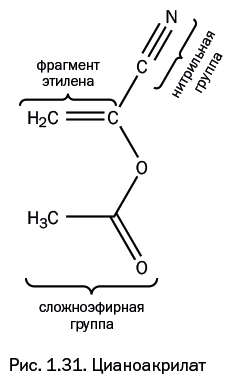
Если в молекуле этилена нитрильную группу -C≡N (как в предыдущем примере) и сложноэфирную группу -С(=О)ОMe (как в полиметилметакрилате, рассмотренном выше) присоединить к одному и тому же атому углерода, то образуется цианоакрилат (рис. 1.31) СH2=С(СN)(СООR). Его склонность к полимеризации исключительно высока из-за того, что электронная плотность сильно оттянута от двойной связи добавленными группами. Он применяется в виде мономера, а полимер получается сам в процессе использования. Это широко известный суперклей «циакрин». Он был создан американским химиком Гарри Кувером и мгновенно стал сверхпопулярным веществом. В 2010 г. американский президент Барак Обама наградил Кувера за эту разработку Национальной медалью технологий и инноваций. Циакрин склеивает большинство известных материалов и отвердевает почти мгновенно под действием влаги, присутствующей в незначительных количествах на большинстве поверхностей. Еще эффективнее, чем влага, действуют амидные группы, присутствующие в белках, поэтому его с успехом стали применять для обработки ран, ожогов, а также для склеивания треснувших ногтей. Свойства циакрина можно варьировать, изменяя группу R в сложноэфирной группе -OC(=O)R. Наиболее распространен циакрин, у которого R = CH3, однако у него низкая водостойкость. Она повышается, когда R = C2H5 и C3H7, но такие соединения заметно дороже. Когда R = C8H17 (октил-цианоакрилат), клей наименее токсичен, его применяют для остановки сильных кровотечений и для склеивания кровеносных сосудов при хирургических операциях.
Поливинилацетат и его «потомки»
С заменой атома водорода в этилене ацетатной группой – OC(=O)CH3 образуется винилацетат CH2=CH – OC(=O)CH3, а при его полимеризации получается поливинилацетат – [CH=CH(OC(O)CH3)]n – (ПВА), необычайно распространенный полимер: твердое, прозрачное и нетоксичное вещество. Его применяют в качестве клея для древесины, картона, керамической плитки и других материалов, а также как компонент лаков и красок.
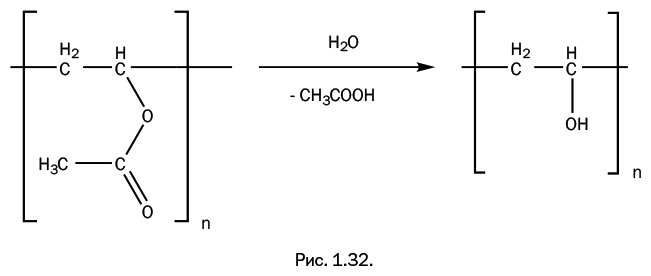
В отличие от всех рассмотренных выше полимеров, поливинилацетат стал "родоначальником" двух весьма распространенных полимерных соединений, продолжая развивать "генеалогическое дерево" этилена. При гидролизе поливинилацетата ацетатные группы заменяются гидроксильными – ОН, и образуется поливиниловый спирт (рис. 1.32).
Поливиниловый спирт применяют в качестве загустителя в пищевой промышленности, при изготовлении косметических средств и шампуней и для производства растворимой упаковки лекарств. Интересно, что исходный мономер – виниловый спирт CH2=CH-OH – не существует в чистом виде: OH-группа при атоме углерода с двойной связью неустойчива, поэтому происходит перескок атома водорода и изомеризация в ацетальдегид. Поэтому получение полимера возможно только гидролизом поливинилацетата.
Взаимодействие спиртов с альдегидами приводит к ацеталям – это соединения, содержащие две группы OR у одного атома С. При взаимодействии поливинилового спирта с альдегидами образуются, соответственно, полиацетали. Таким образом, альдегид соединяет две группы ОН, стоящие почти рядом (рис. 1.33).
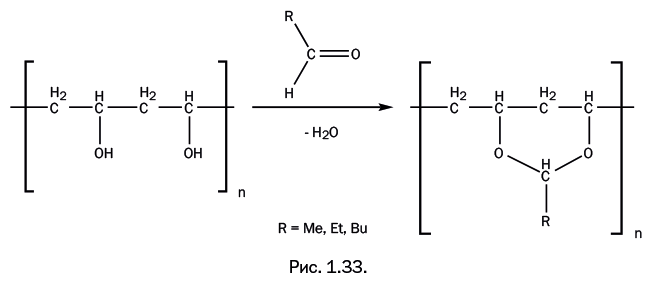
Если R = H, то это поливинилформаль, который используют для изготовления электроизоляционных лаков, стойких к действию масел, а до недавнего времени он применялся в качестве связующего при изготовлении магнитофонных лент для звуко– и видеозаписи. Если R = C3H7, то получаемый полимер – поливинилбутираль – применяют как соединительную пленку в производстве безосколочного стекла (триплекса), а при газопламенном напылении на металлические изделия образуются антикоррозионные покрытия. Если его смешать с фенольными смолами, то мы получим известный клей марки БФ (бутираль-фенол).
Общий признак строения всех рассмотренных материалов – линейное строение цепи, образующейся при полимеризации в результате раскрытия двойных связей. Этот способ получения полимеров не имеет аналогов в природе и является исключительно результатом творчества химиков. Полимерная цепь показанных полимеров состоит только из атомов углерода – их называют карбоцепными. При нагревании они размягчаются (исключая полиакрилонитрил), и это свойство обусловило выбор термина "термопласты". Все эти "потомки" этилена представляют собой полимеры, которые по свойствам заметно отличаются от полиэтилена, образуя класс материалов с самыми разнообразными свойствами. Диапазон свойств еще больше расширяется, когда перечисленные мономеры объединяют сополимеризацией. Например, известны сополимеры винилацетата с упомянутыми ранее метилметакрилатом или с акрилонитрилом.
В последнее время особенно популярным стал давно известный сополимер винилацетата с винилхлоридом, поскольку ожило производство "виниловых" грампластинок. Некоторые любители музыки предпочитают "теплую" аналоговую запись звука цифровой, да и сам внешний вид черной грампластинки вызывает ностальгическое удовольствие.
Отвлечемся ненадолго от основной темы. Безусловно, у некоторых людей восприятие произведений искусства более тонкое и обостренное, чем у большинства. Например, некоторые кинематографисты считают, что фильмы на кинопленке (которую они по традиции называют "целлулоид") эстетически более привлекательны, нежели на цифровых носителях. Часто можно услышать, что взять в руки бумажную книгу, пошелестеть страницами, почувствовать запах типографской краски несравненно приятнее, чем читать текст на экране планшета или смартфона. Таким образом, наш выбор часто определяется не практическими соображениями, а эмоциями, и здесь трудно что-либо возразить. Все это не мешает нам немного поиронизировать и предположить, что вернутся пишущие машинки с их незабываемым стрекотом, а голубиная почта потеснит электронную почту.
Вернемся к основной теме. В этом рассказе были перечислены полимеры, занявшие лидирующее положение с середины ХХ в. Вполне естественно, что с интенсивным развитием полимерной химии появились современные материалы-"конкуренты". Для изготовления монолитных изделий используют полиоксиметилен (другое название – "полиформальдегид", см. далее раздел "Создать новую науку"). Для клеевых композиций применяют эпоксидные смолы, в качестве прозрачного заменителя оргстекла – поликарбонат. Упомянута только малая часть новых материалов, которые были созданы и продолжают создаваться химиками-полимерщиками.
Несмотря на прогресс в химии полимеров, "родоначальник" рассмотренного класса соединений – полиэтилен – устоял и не потерял лидирующих позиций. Дело в том, что в 1950-х гг. были созданы металлоорганические катализаторы, которые позволили получать этот полимер, обладающий к тому же повышенной плотностью и прочностью, при низких температуре и давлении. Вслед за этим были созданы новые (металлоценовые) катализаторы, которые позволили получать сверхвысокомолекулярный полимер с молекулярной массой 3–5 млн. Он представляет собой высокопрочный термостойкий материал, а его волокна не уступают по прочности кевлару, из которого делают пуленепробиваемые жилеты (см. рассказ "Самый прочный полиамид").

