Приложение 2
Как Клаузиус примирил закон сохранения энергии с идеями Сади Карно
Рудольф Клаузиус полагал, что теплота и работа преобразуются друг в друга, а для производства работы теплота должна перемещаться из горячей зоны в холодную. Он сделал первый верный анализ взаимосвязи работы и теплоты. Его идеи живут в каждом газовом, дизельном и реактивном двигателе, а также в паровых турбинах и ракетах.
Клаузиус начал с переосмысления идеального двигателя и четырехступенчатого цикла Карно, но держал в уме мысль о взаимопревращаемости работы и энергии. В ходе этого исследования Клаузиус выявил форму энергии, которая скрыта от глаз, и обозначил ее буквой U. Сегодня эту величину обычно называют внутренней энергией.
Представьте надутый воздушный шарик. Заключенный внутри него воздух, оказывая давление на оболочку шарика, представляет собой хранилище энергии, напоминающее аккумулятор, который хранит в себе электрическую энергию. Заряд аккумулятора можно расходовать и восполнять, и точно так же можно расходовать и восполнять внутреннюю энергию газа.
Если вы сожмете шарик руками, он окажет сопротивление и станет горячее. Это показывает, что усилие, которое вы прикладываете при сжатии, то есть выполняемая вами работа, еще сильнее повышает внутреннюю энергию заключенного внутри воздуха.
Теперь возьмите шарик в руки так, чтобы он не мог расшириться, и нагрейте его. Вы почувствуете, как давление и температура внутри шарика растут, а значит, добавляемая вами теплота превращается во внутреннюю энергию газа, повышая ее уровень.
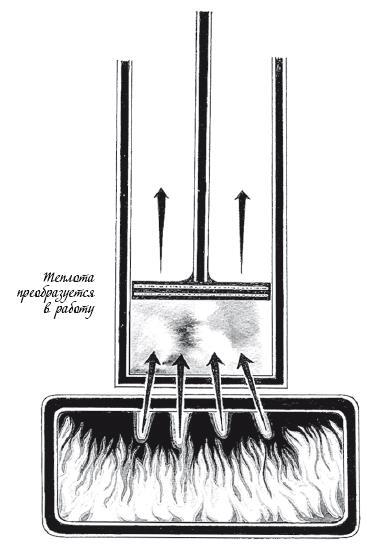
Стадия 1. Изотермическое расширение
Внутреннюю энергию можно высвободить в форме теплоты. Если поместить надутый шарик в прохладное место, например в холодильник, он начнет отдавать свою внутреннюю энергию в форме теплоты, выпуская ее в окружающую среду, и по мере этого сжиматься и становиться холоднее.
Внутреннюю энергию можно также преобразовать обратно в работу. Пусть шарик лопнет. Часть его внутренней энергии проявит себя в хлопке, а часть – в полете клочков резины по комнате и смещении окружающего воздуха.
Клаузиус считал, что в тепловом двигателе внутренняя энергия газа должна производить работу как можно эффективнее. Вот как это происходит в четырехступенчатом цикле Карно.

Стадия 2. Адиабатическое расширение
СТАДИЯ 1. ИЗОТЕРМИЧЕСКОЕ РАСШИРЕНИЕ
Некоторое количество горячего газа сжато в малом пространстве между поршнем и дном цилиндра. Когда газ расширяется, он толкает поршень и производит работу, отдавая в процессе часть своей внутренней энергии. Однако, поскольку цилиндр находится рядом с нагревателем, в газ из него поступает теплота, которая восполняет эту внутреннюю энергию. В результате температура газа поддерживается на одном уровне.
Таким образом, на этой изотермической стадии некоторое количество теплоты Н(1) преобразуется в некоторое количество работы W(1).
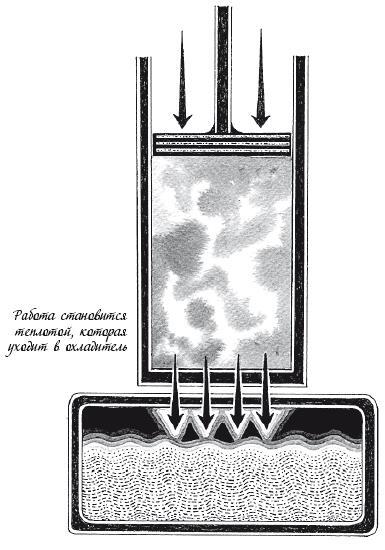
Стадия 3. Изотермическое сжатие
СТАДИЯ 2. АДИАБАТИЧЕСКОЕ РАСШИРЕНИЕ
Цилиндр герметично закрыт. Газ внутри него продолжает толкать поршень, производя работу, и теряет внутреннюю энергию, однако, благодаря герметичности цилиндра, теплота не поступает внутрь и не восполняет ее. По окончании стадии адиабатического расширения газ становится холоднее, выполнив работу W(2).
СТАДИЯ 3. ИЗОТЕРМИЧЕСКОЕ СЖАТИЕ
Цилиндр находится рядом с охладителем, и газ сжимают. Усилие прилагают к газу. Если бы цилиндр был по-прежнему герметично закрыт, это повышало бы внутреннюю энергию газа, делая его горячее.
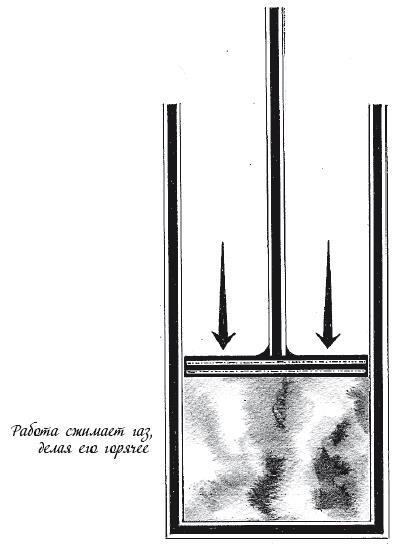
Стадия 4. Адиабатическое сжатие
Однако, поскольку цилиндр находится рядом с охладителем, охладитель поглощает всю производимую теплоту Поэтому температура газа не изменяется. Некоторое количество работы W(3) преобразуется в теплоту Н(3).
СТАДИЯ 4. АДИАБАТИЧЕСКОЕ СЖАТИЕ
Цилиндр герметично закрыт, и поршень опускают вниз до тех пор, пока газ не займет тот же объем, который занимал в начале первой стадии. Над газом производят еще некоторое количество работы, что повышает его внутреннюю энергию и температуру до уровня, соответствующего началу первой стадии. Работа W(4), производимая над газом на этой стадии, точно компенсируется работой W(2), произведенной самим газом на второй стадии.
Чтобы нарисовать общую картину, Клаузиус подсчитал количество теплоты, поступающей в двигатель и выходящей из него, и количество работы, производимой им и над ним. Результаты представлены в таблице ниже. (В соответствии с традицией теплота, поступающая в двигатель, и работа, производимая двигателем, представлены положительными величинами. Их противоположности – отрицательными.)
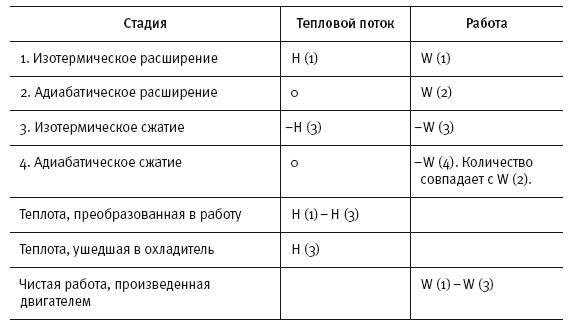
Анализируя тепловой поток в идеальном двигателе и производимую этим двигателем работу, Клаузиус примирил, казалось бы, противоречащие друг другу идеи Карно и Джоуля. Он пришел к следующему выводу о происходящем с идеальным двигателем:
Часть теплоты преобразуется в работу, как полагал Джоуль.
Остальная теплота уходит в охладитель, как считал Карно.
Чему это нас учит? Невозможно преобразовать всю теплоту в работу: часть теплоты неизбежно теряется и безвозвратно уходит в охладитель.
Приложение 3
Четыре начала термодинамики
В этой книге основное внимание уделяется открытию и следствиям первого и второго начал термодинамики. Стремясь к завершенности, в XX веке ученые добавили к ним еще два начала. Первое из них, теперь называемое нулевым началом термодинамики, в XIX веке считалось истинным, однако не имело статуса закона. Второе из дополнительных начал, теперь называемое третьим, относится к веществам при сверхнизких температурах, очень близких к абсолютному нулю.
НУЛЕВОЕ НАЧАЛО
Если каждая из двух термодинамических систем пребывает в тепловом равновесии с третьей системой, то они также пребывают в тепловом равновесии друг с другом.
(Осмыслите это начало с помощью термометров. Если термометр показывает, что два разных объекта имеют одинаковую температуру, то теплота не станет переходить от одного из них к другому, даже если они соприкоснутся.)
ПЕРВОЕ НАЧАЛО
Энергия Вселенной неизменна.
ВТОРОЕ НАЧАЛО
Энтропия Вселенной стремится к максимуму.
ТРЕТЬЕ НАЧАЛО
Энтропия системы достигает постоянного значения, когда ее температура достигает абсолютного нуля.
(Это начало позволяет выразить энтропию абсолютной величиной, а не только изменением ее значения.)

